miR-208a 在兔快速心房起搏模型中抑制心房电重构和结构重构的作用研究
2023-09-21徐孟骅王忠华王静朱晓锋李雯李勇
徐孟骅 王忠华 王静 朱晓锋 李雯 李勇
房颤是临床上最常见的心律失常类型,也是栓塞性卒中的最重要原因,已成为世界范围内的公共卫生问题[1-2]。由于导管消融治疗房颤复发率较高[3],而药物治疗可能发生心律失常或出血等并发症[4],故迄今为止仍缺乏令人满意的方法。上游治疗是近年来提出的一种新方法,这种方法基于房颤发生和发展的机制,其应用涵盖了所有类型的房颤,并显示了良好的疗效前景[5]。心房结构重构和电重构是房颤的两个重要特征,可导致房颤的发生和维持[6]。近年来,许多研究表明,一些miRNA 与房颤心房肌的电重构和结构重构有关,且是发生房颤的关键因素[7-8],心脏组织中富含的miR-208a 是许多疾病潜在的生物标志物和治疗靶标[9-11]。β-catenin 信号传导途径是可调节细胞存活、死亡和增殖的细胞信号传导系统[12]。许多研究报道,β-catenin 在房颤的发生和发展中起着重要作用[13-14]。还有研究发现,miR-208a 可以通过调节β-catenin 在肿瘤等疾病中发挥作用[15]。本研究通过建立快速起搏兔心房模型,探讨miR-208a 在心房肌电重构和结构重构中的作用,现将结果报道如下。
1 材料和方法
1.1 实验动物和试剂 健康新西兰大耳白兔40 只购自徐州医科大学动物实验中心,体重2.7~3.1(2.9±0.2)kg,不分性别。活性氧(reactive oxygen species,ROS)检测试剂盒购自上海碧云天生物技术有限公司,丙二醛(malondialdehyde MDA)检测试剂盒和超氧化物歧化酶(superoxide dismutase,SOD)活性测定试剂盒购自南京建成生物工程研究所,agomiR-208a 和antagomiR-208a 试剂购自上海源叶生物技术有限公司,聚合酶链反应试剂盒和抗体购自北京博奥森生物。
1.2 方法
1.2.1 实验动物分组和预处理 采用随机区组分组法将40 只兔分为假手术组(SHAM 组)、快速起搏组(RAP组)、快速起搏+ agomiR-208a 组(miR-208a 组)和快速起搏+ antagomiR-208a 组(antmiR-208a 组),每组各10只。实验前,将所有兔子放入实验动物中心适应性喂养7 d。建模前3 天,每天向miR-208a 组和antmiR-208a 组兔子静脉注射agomiR-208a 和antagomiR-208a,30 mg/kg,其余两组兔子静脉注射等量的0.9%氯化钠注射液。本研究经过杭州市余杭区第一人民医院医学伦理委员会审查通过(批准文号:yhqy221210)。
1.2.2 心房快速起搏模型的构建 通过兔耳静脉缓慢注入1%的戊巴比妥钠2 ml/kg。麻醉诱导成功后通过留置针维持麻醉。切开并分离气管,进行气管插管,动物呼吸机辅助通气。经右颈内静脉将10 极冠状窦电极送到右心房,并将胸腔导联V1连接到冠状窦的远端臀部线。连接BL-420s 生物功能实验系统,并以比窦性心律高10%~20%的频率释放连续刺激。当腔内导联和体表导联心电图同时观察到心房心室1∶1 传导时,提示心房完全起搏。维持冠状窦电极的位置,并且以2 倍于舒张期阈值的电压、600 次/min 的起搏频率进行12 h 连续心房刺激。
1.2.3 心房有效不应期(atrial effective refractory period,AERP)及频率适应性测定 将2 倍于舒张起搏阈值作为输出电压,并将脉冲宽度设置为0.5 ms,测定基本条件下AERP。程序性过早刺激(S1S2)采用的刺激频率为8∶1。以10 ms 的步长和30 s 的间隔执行递减扫描。不应期定义为在S1S2 刺激时S2 后不诱导心房激动的最长间期;重复测定3 次取其均值作为AERP 基线值。分别测量S1S1 为200、150 ms 时的AERP200、AERP150,频率适应性表示为AERP200-AERP150。
1.2.4 心房心肌组织病理学检查 起搏后,通过静脉注射100 mg/kg 戊巴比妥钠处死白兔。无菌开胸取出心脏,切开后立即用缓冲盐水(pH 7.4)洗涤,去除红细胞和血块后称重。心房心肌组织样本立即用0.9%氯化钠溶液洗涤,并在10%磷酸盐缓冲的甲醛溶液中固定24 h。脱水后石蜡包埋、切片,HE染色下观察心肌组织。
1.2.5 miR-208a 表达水平、SOD 活性、MDA 及ROS 水平检测 采用RT-PCR 法。根据说明书使用Trizol 试剂从心房心肌组织中提取总RNA,采用逆转录试剂盒操作步骤合成互补脱氧核糖核酸(complementary DNA,cDNA)。对miR-208a 表达水平进行检测,反应条件:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火40 s,共40 个循环。以U6 作为miRNA 内参,引物序列见表1。以2-ΔΔCt法计算miR-208a 的相对表达水平;使用相应的检测试剂盒检测心房心肌组织中SOD 活性、MDA 及ROS 水平。

表1 引物序列
1.2.6 β-catenin 蛋白表达检测 采用Western blot 法。使用补充了蛋白酶抑制剂的组织蛋白提取试剂盒(美国Roche 公司)获得心房心肌组织样本的全细胞裂解物。按BCA 蛋白测定试剂盒说明书测定总蛋白浓度,定量后变性制成样本。在10%十二烷基硫酸钠聚丙烯酰胺凝胶中通过电泳分离等量的蛋白质,然后将其转移到硝酸纤维素膜上,在5%的脱脂牛奶中室温封闭1 h,用1×TBST 洗膜后在4 ℃孵育一抗过夜,1×TBST 洗膜后室温孵育相应的二抗1 h,洗涤后进行化学发光显影检测,以β-actin 为内参校正,用图像灰度分析软件进行灰度分析。
1.3 统计学处理 采用SPSS 19.0 统计软件。计量资料以表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验;连续型重复计量资料间比较使用重复测量数据的方差分析,两两比较采用Dunnett-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组miR-208a 表达水平比较 RAP 组miR-208a表达水平均低于SHAM 组和miR-208a 组(均P<0.05),而高于antmiR-208a 组(P<0.05),见图1。

图1 各组miR-208a 表达水平比较
2.2 各组在200ms 和150ms 时AERP 比较 在SHAM组中,随着起搏时间的延长,在200 ms 和150 ms 时AERP 无明显变化(均P>0.05);其余组中,随着起搏时间的延长,AERP 逐渐缩短(均P<0.05)。与SHAM组相比,RAP 组在200 ms 和150 ms 时AERP 缩短(均P<0.05)。与RAP 组相比,miR-208a 组在200 ms 和150 ms 时的4、8、12 h 各时间点AERP 增加(均P<0.05),而antmiR-208a 组的AERP 缩短(P<0.05)。见表2~3。

表2 各组在200 ms 时AERP 比较(ms)

表3 各组在150 ms 时AERP 比较(ms)
2.3 各组AERP 频率适应性比较 SHAM 组随着起搏时间的延长,AERP 频率适应性在12 h 内无明显变化(P>0.05),而其余组均减低(均P<0.01)。与SHAM组相比,RAP 组的AERP 频率适应性在8、12 h 时间点时均减低(均P<0.01);与RAP 组相比,miR-208a 组在8、12 h 时间点时的AERP 频率适应性均增加(均P<0.01),而antmiR-208a 组均减低(均P<0.05)。见表4。
表4 各组AERP 频率适应性比较(ms)
2.4 各组心肌组织病理检查结果 SHAM 组兔心肌纤维结构完整,排列整齐、有序,见图2A;RAP 组可见心肌细胞肥大,细胞核大小不规则,许多细胞核显示凝结,心肌纤维紊乱、在某些区域破裂和溶解,见图2B。与RAP 组比较,miR-208a 组的心肌组织病理变化明显减轻,大多数核呈正常状态,多数的心肌纤维未显示破裂,其排列有序,见图2C;相反,antmiR-208a 组的心肌组织纤维排列紊乱、破裂和溶解等病理变化更为严重,见图2D。
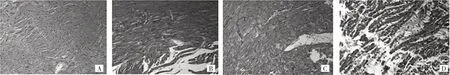
图2 各组心肌组织病理图片(A:SHAM 组;B:RAP 组;C:miR-208a 组;D:antmiR-208a 组;HE 染色,×200)
2.5 各组心肌组织氧化应激指标比较 与RAP 组相比,miR-208a 组MDA、ROS 水平降低,SOD 活性升高(均P<0.05),而antmiR-208a 组MDA、ROS 水平升高,SOD 活性降低(均P<0.05),见表5。

表5 各组心肌组织氧化应激指标比较
2.6 各组β-catenin 蛋白表达比较 与SHAM 组相比,RAP 组β-catenin 表达水平增加(P<0.01);与RAP 组相比,antmiR-208a 组β-catenin 表达水平升高,而miR-208a 组降低(均P<0.01)。见图3。

图3 各组β-catenin 表达的电泳图及表达水平比较
3 讨论
房颤的发病机制相当复杂,目前研究表明,房颤主要涉及结构重构和电重构[16-17]。心房肌电重构可能导致离子通道功能部分丧失,离子通道异常电流变化与Ca2+和K+的细胞内转运有关,这种变化可能会促进房颤的维持。心房结构重构也是房颤发生、发展的关键因素,心房胶原蛋白的异常合成、降解和沉积促进心房纤维化和结构重塑[18-19]。miRNA 是内源的非编码性小核糖核酸,含有21~24 个核苷酸,与它们的靶基因的3'非翻译区结合,导致靶基因降解或翻译抑制[20]。
在过去的10 年中,miRNA 已被证明可以调节心血管系统,并可用作多种心脏疾病的临床生物标志物,包括急性心肌梗死、心脏肥大和病毒性心肌炎[21-23]。研究表明,miR-208a 与多种心脏疾病有关,包括心脏纤维化、心脏肥大、扩张型心肌病和心力衰竭[13-15]。miRNA 表达的变化已在许多心血管疾病中得到了证实,包括房颤[24-26];然而,miR-208a 具体作用机制仍然需要更多的研究来阐明,特别是其在房颤中的作用机制,目前少有报道。本研究证实了RAP 组miR-208a 表达水平降低,提示miR-208a 参与了房颤的发生、发展。有研究发现,miR-208a 的高表达可以显着延缓快速起搏引起的AERP 缩短,频率适应性丧失。抑制miR-208a 的表达后,心房电重构更为严重。本研究显示,通过HE 染色,与RAP 组相比,miR-208a 组心肌纤维排列和溶解明显改善,antmiR-208a 组心肌病理变化更为严重。这些发现与之前的研究结果一致[27]。miR-208a 参与房颤的发生、发展,miR-208a 可显著改善快速起搏兔模型中的心房电重构和结构重构。
近年来,关于β-catenin 信号通路的研究越来越多。大量研究发现,微核糖核酸通过调节β-catenin 信号通路参与多种心血管疾病。例如,miR-708-5p 和miR-499-5p 对β-catenin 信号通路的调控可能是心律失常性心肌病的潜在病理生理机制[28];也有研究证明其对房颤的作用[17-18]。本研究发现,与SHAM 组相比,RAP 组β-catenin 的表达上调,而miR-208a 的高表达可下调β-catenin 的表达。相比之下,与RAP 组相比,抑制miR-208a 后β-catenin 的表达显著上调,说明miR-208a 在快速起搏兔心房模型中可能通过抑制βcatenin 的表达从而发挥改善电重构和结构重构的作用。此外,许多研究发现,miR-208a 在心脏应激反应中起重要作用[29-32]。而房颤的发生、发展还包括与氧化应激密切相关的应激反应[33-35]。本研究显示,与RAP 组 相 比,miR-208a 组MDA 和ROS 水 平 均 降 低,SOD 活性升高;而antmiR-208a 组MDA 和ROS 水平均升高,SOD 活性降低。这些结果表明,miR-208a 对快速起搏兔心房模型中电重构和结构重构的改善作用可能与抑制氧化应激有关。
综上所述,miR-208a 可以改善兔心房快速起搏模型中的电重构和结构重构,这可能与减少氧化应激和抑制β-catenin 信号通路有关。
