低氧和IL-1β联合刺激对类风湿关节炎成纤维样滑膜细胞基质金属蛋白酶表达的影响及机制研究
2023-09-21蒋琼姚瑞峰伍启阳王国芬王俊松罗心静
蒋琼 姚瑞峰 伍启阳 王国芬 王俊松 罗心静
关节滑膜组织中成纤维样滑膜细胞(fibroblastlike synoviocyte,FLS)的活化及其产生的炎症介质在类风湿关节炎(rheumatoid arthritis,RA)的病理机制中起关键作用[1-2]。RA 关节滑膜组织中FLS 受关节局部各种有害因子刺激时被激活,其不仅产生多种促炎细胞因子介导滑膜炎症反应,还产生多种基质金属蛋白酶(matrix metalloproteinase,MMP),如MMP-1、MMP-3、MMP-9 等,介导关节软骨及骨的细胞外基质降解,参与RA 关节滑膜组织中FLS 的迁移、侵袭及关节破坏[1,3]。已有研究表明,关节炎性缺氧微环境是RA 重要特征之一,滑膜炎症会导致关节局部的缺氧,而关节缺氧微环境又会促进滑膜细胞合成和分泌炎症细胞因子和MMP,加重滑膜炎症,促进血管新生、软骨及骨的破坏[4-5]。以往的研究多集中在单独缺氧或促炎因子对滑膜细胞炎症介质生成影响[6],缺氧和促炎因子联合刺激作用报道很少,其机制也尚未阐明。
低氧诱导因子(hypoxia-inducible factor,HIF)-1α通路和NF-κB 通路都是缺氧和炎症反应中的重要信号通路。HIF-1α和NF-κB均在RA患者关节滑膜组织中表达上调,并且参与滑膜炎症、滑膜增生、软骨及骨侵蚀破坏等病理过程[7-9]。但缺氧和炎症因子联合刺激对MMP生成的影响及机制尚不明确。本研究采用组织块法从RA患者滑膜组织分离原代FLS,探讨低氧和IL-1β 联合刺激对MMP-1、MMP-3、MMP-9表达的影响,并分析HIF-1α和NF-κB在其中的调控作用,现将结果报道如下。
1 材料和方法
1.1 材料 DMEM 培养基、FBS 购自美国Gibco 公司;Trizol 试剂、RevertAid 第一链cDNA 合成试剂盒、SYBR Green Master Mix 试剂 盒 购自美国Applied Biosystems 公司;磷酸化的NF-κB p65(p-p65)兔多克隆抗体、HIF-1α 兔多克隆抗体购自美国CST 公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体、辣根酶标记山羊抗兔IgG 购自中国Biosharp 公司;MMP-1、MMP-3 ELISA 试剂盒购自中国博士德公司;MMP-9 ELISA 试剂盒购自中国碧云天公司;WesternBright ECL 购自中国环亚生物科技;重组人IL-1β 购自中国近岸蛋白公司;HIF-1α 抑制剂YC-1、NF-κB 抑制剂BAY-117082 购自美国MCE 公司。
1.2 方法
1.2.1 RA 关节滑膜组织中FLS 分离、传代和鉴定 本研究通过台州学院附属台州市中心医院医学伦理委员会审查通过(批准文号:2020-sc-032)。滑膜标本来源于2 例RA 患者关节腔手术和关节置换术切取的滑膜组织。FLS 分离采用组织块法,具体操作如下:将手术切取的RA 滑膜标本去除脂肪和肌肉,修剪成5~8 mm2组织块,置于25 cm2培养瓶(每个培养瓶约7~8个组织块)中贴壁培养,1 h 后加入2 mL 含10% FBS 的DMEM 培养基,24 h 后再加入3 mL,3~5 d 细胞长出,去除组织块,更换培养基,1 次/3 d。当细胞生长融合时,用胰酶消化,并按照1∶3 传代。传至3 代后细胞用Vimentin 染色(免疫荧光法)鉴定,贴壁细胞基本上为均一的FLS。
1.2.2 实验分组 本实验采用的是4~9 代细胞。将细胞传代贴壁24 h 后置于三气培养箱低氧培养(1% O2、5% CO2、94% N2)。将细胞传代贴壁24 h 后置于普通CO2培养箱常氧培养(21% O2、5% CO2、94% N2)。一阶段实验中细胞分为4 组,分别为常氧组(细胞常氧培养)、低氧组(细胞低氧培养)、IL-1β 组(细胞加入终浓度10 ng/mL 的IL-1β 后常氧培养)、IL-1β+低氧组(细胞加入终浓度10 ng/mL 的IL-1β 后低氧培养);二阶段实验中细胞分为4 组,分别为IL-1β+低氧组(细胞在10 ng/mL 的IL-1β 和低氧环境培养)、YC 组(细胞先经5 μmol/L YC-1 预处理2 h 后,再在10 ng/mL 的IL-1β和低氧环境培养)、BAY 组(细胞先经10 μmol/L BAY11-7082 预处理2 h 后,再在10 ng/mL 的IL-1β 和低氧环境培养)、YC+BAY 组(细胞先经10 μmol/L YC-1 和5 μmol/L BAY11-7082 共 处 理2 h 后,再 在10 ng/mL 的IL-1β 和低氧环境培养)。
1.2.3 MMP-1、MMP-3、MMP-9 水平测定 经低氧和(或)IL-1β 处理24 h 后收集各组细胞培养上清液,采用ELISA 法(按试剂盒说明书进行),酶标仪测定各孔的吸光度(optical density,OD)值,对不同浓度的标准蛋白及对应的OD 值绘制标准曲线,根据公式计算MMP-1、MMP-3、MMP-9 水平。
1.2.4 MMP-1、MMP-3、MMP-9 mRNA 表 达水平测定 经低氧和(或)IL-1β 处理12 h 后收集各组细胞,采用Trizol 法提取总RNA,并将1 μg RNA 逆转录生成cDNA,逆转录操作按照RevertAid 第一链cDNA 合成试剂盒说明进行。将合成的cDNA(0.4 μmol/L)、相应引物(0.2 μmol/L)与10 μL SYBR green PCR master mix 混合,于定量PCR 仪进行Real-time PCR 法扩增反应,引物序列见表1。各组数据分析采用ΔCt 法,计算各组2-ΔΔCt值。

表1 定量PCR 引物
1.2.5 HIF-1α 和p-p65 蛋白表达水平测定 采用Western blot 法。经低氧和(或)IL-1β 处理6 h 后,收集各组细胞,用RIPA 缓冲液与蛋白酶抑制剂混合液裂解细胞30 min,离心收集上清液,用BCA 法测定蛋白表达水平。取各组裂解上清液蛋白20 μg 与蛋白上样缓冲液,1∶5 混合煮沸后上样,蛋白经8% SDS-聚丙烯酰胺凝胶电泳分离,然后经转印至甲醇预处理的聚偏二氟乙烯膜上,用含5%脱脂奶粉的TBST 缓冲液封闭4 h 后,加入HIF-1α、p-p65 或GAPDH 一抗4 ℃孵育过夜,第2 天经TBST 缓冲液漂洗后加入二抗室温孵育1 h,再经TBST 缓冲液漂洗后加入ECL 试剂室温孵育5 min,于化学发光荧光影像分析仪成像,检测HIF-1α和p-p65 蛋白表达水平。
1.2.6 HIF-1α 和p-p65 核移位测定 细胞接种于铺有爬片的6 孔板中(5×105个/孔),第2 天经低氧和(或)IL-1β处理2 h。然后细胞用5%多聚甲醛固定2 h,0.1% Triton X-100 通透(增加抗体对细胞膜的穿透性)20 min、封闭液封闭1 h;加入HIF-1α 或p-p65 抗体4 ℃孵育过夜;加入Cy3 标记的IgG 室温孵育1 h,加二脒基-2-苯基吲哚染核5 min,清洗后加入淬灭液,荧光显微镜观察,测定HIF-1α 和p-p65 核移位。
1.3 统计学处理 应用GraphPad Prism 7 统计软件。计量资料以表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 RA 关节滑膜组织中FLS 的观察及鉴定 倒置显微镜下观察显示,RA 滑膜组织块贴壁3 d 左右有细胞从组织块边缘长出,以长梭形细胞为主,也有少量卵圆形和不规则形细胞。14 d 左右培养瓶里可长满细胞,主要是贴壁的长梭形滑膜细胞。细胞免疫荧光结果显示,细胞传至3 代后90%以上细胞为Vimentin 染色阳性的FLS。见图1(插页)。

图1 RA 关节滑膜组织中FLS 的生长及鉴定图(A:倒置显微镜下的细胞生长,×10;B:免疫荧光法鉴定RA 关节滑膜组织中FLS,Vimentin 染色,×10)
2.2 一阶段实验各组细胞MMP-1、MMP-3、MMP-9 水平比较 常氧组与低氧组比较,MMP-1、MMP-3、MMP-9 水平差异均无统计学意义(均P>0.05),IL-1β组上述3 个指标水平均高于常氧组(均P<0.05),IL-1β+低氧组上述3 个指标水平均高于IL-1β 组(均P<0.05),见表2。
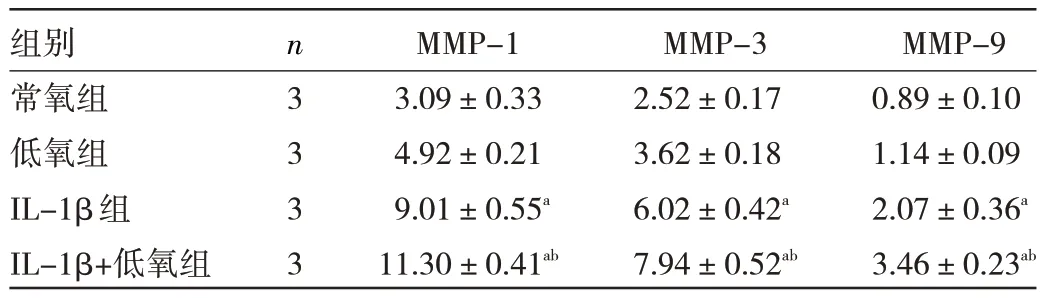
表2 各组细胞MMP-1、MMP-3、MMP-9 水平比较(ng/mL)
2.3 一阶段实验各组细胞MMP-1、MMP-3、MMP-9 mRNA 表达水平比较 与常氧组比较,低氧组和IL-1β 组MMP-1、MMP-3、MMP-9 mRNA 表达水平均升高(均P<0.05);与IL-1β 组比较,IL-1β+低氧组MMP-1、MMP-3、MMP-9 mRNA 表达水平均升高(均P<0.05)。见表3。

表3 各组细胞MMP-1、MMP-3、MMP-9 mRNA 表达水平比较
2.4 一阶段实验各组细胞HIF-1α 和p-p65 表达水平比较 与常氧组比较,低氧组和IL-1β 组HIF-1α 及pp65 表达水平明显升高,IL-1β+低氧组升高更为显著,见图2。

图2 各组细胞HIF-1α 和p-p65 蛋白表达的电泳图
2.5 一阶段实验各组细胞HIF-1α 和p-p65 核移位情况比较 与常氧组比较,低氧组HIF-1α 核移位较为明显,p-p65 核移位有所增加,IL-1β 组细胞p-p65 核移位较为明显,p-p65 核移位有所增加,而IL-1β+低氧组HIF-1α 和p-p65 核移位均更为显著,见图3(插页)。

图3 各组细胞HIF-1α 和p-p65 核移位的细胞免疫荧光图(cy3 染色,×200)
2.6 二阶段实验各组细胞MMP-1、MMP-3、MMP-9 水平比较 与IL-1β+低氧组相比,YC 组、BAY 组和YC+BAY组MMP-1、MMP-3、MMP-9水平均降低(均P<0.05),其中YC+BAY 组降低最明显,见表4。

表4 各组细胞MMP-1、MMP-3、MMP-9 水平比较(ng/mL)
2.7 二阶段实验各组细胞MMP-1、MMP-3、MMP-9 mRNA 表达水平比较 与IL-1β+低氧组相比,YC 组、BAY 组和YC+BAY 组MMP-1、MMP-3、MMP-9 mRNA表达水平均降低(均P<0.05),其中YC+BAY 组降低最明显(均P<0.01),见表5。
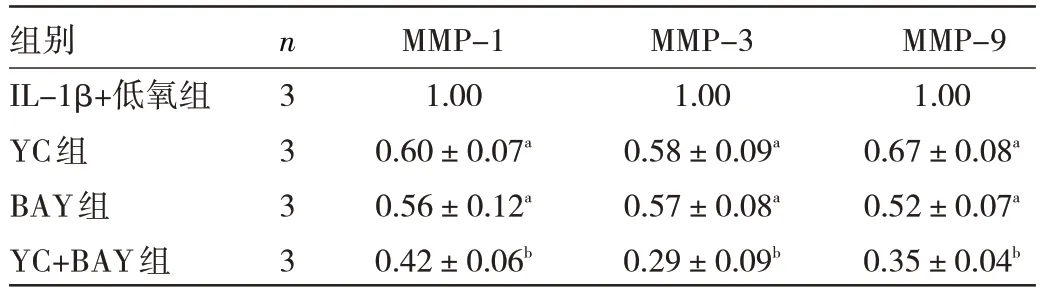
表5 各组细胞MMP-1、MMP-3、MMP-9 mRNA 表达水平比较
3 讨论
RA 关节滑膜组织中FLS 合成和分泌的MMP 在RA 软骨及骨破坏中发挥重要作用。目前已发现20 多种MMP 家族成员,其中MMP-1、MPP-3、MMP-9 是RA病变中主要作用的MMP,与正常人滑膜相比,它们在RA 患者滑膜组织和滑膜液中表达水平显著增高,其不仅介导RA 关节滑膜组织中FLS 的侵袭及软骨和骨质的降解,而且能促进新生血管生成,在RA 关节破坏中起重要作用[10]。因此,抑制MMP-1、MMP-3、MMP-9已经成为RA 治疗的有效靶点。
研究表明,RA 关节缺氧微环境也可能在炎症介质表达及其引发的关节破坏中起重要作用[5]。关节缺氧炎症是RA 的重要特征,关节局部炎症和缺氧是相互促进的[11]。虽然缺氧或促炎因子单独刺激对滑膜细胞炎症介质表达的影响已有报道,但缺氧和促炎因子联合刺激对MMPs 报道甚少。Lee 等[12]研究表明,缺氧和IL-1β 联合刺激RA 关节滑膜组织中FLS 后MMP-1表达升高,但MMP-13 表达下降。本研究显示,RA 关节滑膜组织中FLS 受单独的低氧刺激后MMP-1、MMP-3、MMP-9 水平均无显著改变,单独IL-1β 刺激后有明显升高,而低氧和IL-1β 联合刺激后升高更为显著。此外,单独低氧或IL-1β 刺激都能诱导细胞MMP-1、MMP-3、MMP-9 mRNA 表达水平升高,低氧和IL-1β 联合刺激后这些炎症介质mRNA 表达更为显著。以上研究提示,RA 关节滑膜炎症和缺氧微环境可能会协同促进RA 关节滑膜组织中FLS 表达和分泌MMP-1、MMP-3、MMP-9,从而加重软骨和骨质的降解及关节破坏。
HIF-1α 是缺氧诱导的主要转录因子。在常氧条件下,HIF-1α 被脯氨酰4-羟化酶(prolyl 4-hydroxylase,PHD)和缺氧诱导因子抑制因子(hypoxia inducible factor inhibitor,FIH)羟基化,导致HIF-1α 降解。在缺氧条件下,PHD 和FIH 活性降低,HIF-1α 积聚并迁移到细胞核,并与HIF-1β 和腺病毒E1A 相关的300 kD 蛋白(p300)/环磷酸腺苷反应元件结合蛋白(cAMP-response element binding protein,CBP)形成复合物,与低氧反应元件结合调节靶基因转录,调节细胞增殖,迁移、侵袭、凋亡和血管生成[13]。研究表明,HIF-1α 在RA 滑膜组织高表达,它通过调节促炎细胞因子、MMP 及血管生成因子(vascular endothelial growth factor,VEGF)生成介导RA 关节炎症和骨质破 坏[14]。本研究证实,单独低氧或IL-1 均能诱导HIF-1α 在FLS中的表达和核移位,低氧和IL-1β 联合作用更为显著。为了阐明HIF-1α 通路在低氧和IL-1β 联合刺激滑膜细胞MMP 表达中的作用,本研究采用HIF-1α 抑制剂YC-1 预处理FLS,结果显示HIF-1α 抑制剂能降低MMP-1、MMP-3 和MMP-9 在FLS 中 的 表 达 及 分泌。以上研究表明,HIF-1α 通路可能在低氧和IL-1β协同促进MMP 表达中起重要作用。
NF-κB 是炎症信号通路的重要转录因子,其常以RelA(p65)/ NF-κB1(p50)二聚体形式存在。在静息状态时,NF-κB 与抑制蛋白IκB 结合以无活性形式存在于胞浆;当受炎症因子刺激时,IκB 激酶被激活并降解IκB,NF-κB 被释放出来后进入细胞核,与靶基因启动子结合并调节其表达。NF-κB 与RA 促炎因子及MMP 生成调节密切相关,其高度活化导致关节滑膜炎症、软骨和骨破坏[15]。缺氧能诱导多种细胞(如前列腺癌细胞、血管内皮细胞)NF-κB 活化。本研究发现,低氧或IL-1β 均能诱导FLS 中NF-κB 活化,低氧和IL-1β 联合刺激后NF-κB 活化更为显著。本研究还发现,NF-κB 抑制剂BAY11-7082 能显著下调低氧和IL-1β 联合诱导的MMP-1、MMP-3、MMP-9 表达及分泌。这些研究表明NF-κB 通路在低氧和IL-1β 协同促进MMP 表达中也发挥重要作用。
虽然本研究证实HIF-1α 和NF-κB 在低氧和IL-1β 联合刺激诱导的MMP-1、MMP-3、MMP-9 的表达中起重要调节作用。然而,HIF-1α 和NF-κB 调控这些MMP 表达的机制尚不清楚。HIF-1α 和NF-κB 是否直接与这些MMP 启动子结合调节其表达,需进一步研究。有研究表明HIF-1α 和NF-κB 相互作用促进缺氧诱导的前列腺癌细胞CXCR1/2 的表达[16]。那么HIF-1α 是否与NF-κB 相互作用协调促进MMP-1、MMP-3、MMP-9 的表达,也需要进一步证实。
总之,低氧和IL-1β 能协同促进FLS 中MMP-1、MMP-3、MMP-9 的表达及分泌,而NF-κB 通路和HIF-1α 通路可能在这一调节过程中发挥关键作用。本研究初步揭示了关节缺氧微环境中的病变机制,可为RA 防治提供新策略和靶点。
