骨质疏松症环境下髌下脂肪垫源间充质干细胞成骨成脂分化及淫羊藿苷的干预机制
2023-09-20叶梓轩秦佳佳刘海全
叶梓轩, 秦佳佳, 刘海全
[1.广州中医药大学第三临床医学院,广东广州 510006;2.暨南大学中医学院,广东广州 510632;3.广州中医药大学惠州医院(惠州市中医医院),广东惠州 516001]
目前,随着老龄化的加剧,骨质疏松症(osteoporosis,OP)的治疗逐渐成为研究热点。唑来膦酸、特立帕肽、地舒单抗等药物[1]在治疗OP方面虽已取得了显著疗效,但其副作用及药物依赖性仍是OP 治疗过程中需要解决的问题。自从Zuk 等[2]发现脂肪源性干细胞(adipose-derived stem cells,ADSCs),诸多研究证明,其在伤口愈合[3-4]、促进周围神经生长[5]、治疗骨关节炎[6]等方面均可发挥巨大作用。研究者们随后对其获取部位、方式等[7-8]进行了不断的探索。另外,中医药因在提高骨质量方面具有疗效显著、副作用小的优势,被广泛应用于临床OP 的治疗[9]。淫羊藿为小檗科植物淫羊藿Epimedium brevicornuMaxim.、箭叶淫羊藿Epimedium sagittatum(Sieb.et Zucc.)Maxim.、柔毛淫羊藿Epimedium pubescensMaxim.或朝鲜淫羊藿Epimedium koreanumNakai 的干燥叶,具有补肾壮阳、祛风湿、强筋骨之功效,常被用于治疗肾阳虚衰、筋骨痿软、风湿痹痛等证[10]。而淫羊藿苷(icariin,ICA)作为淫羊藿的主要生物活性物质之一,具有调节内分泌、改善心脑血管功能、抗肿瘤等多重药理作用[11]。已有诸多研究证明,淫羊藿苷可有效促进骨髓干细胞向成骨细胞分化[12-14]。本实验拟通过取骨质疏松症患者脂肪组织,获得培养髌下脂肪垫-脂肪源性干细胞(infrapatellar fat pad adipose- derived stem cells,IPFP-ADSCs),探究OP 环境下ADSCs 的成骨成脂分化趋势及淫羊藿苷的干预机制,以期为淫羊藿苷协同ADSCs 临床治疗OP 提供相关理论支持,现将研究结果报道如下。
1 材料与方法
1.1 药物与试剂淫羊藿苷(分子式C33H40O15,分子量676.66,纯度99%,中国食品药品检定研究院,批号:110737-201516)。Ⅰ型胶原酶(美国Sigma-Aldrich 公司);DMEM 培养基(美国Hyclone公司);胎牛血清(美国Invitrogen 公司);人单克隆抗体CD34 PE(美国Biolegend 公司);人单克隆抗体CD90(Thy1)FITC(美国Biolegend公司);成脂分化试剂盒(美国Gibco 公司);成骨分化试剂盒(美国Gibco 公司);Taq 聚合酶(日本TaKaRa 公司);miScript 逆转录试剂盒(德国Qiagen 公司);碱性磷酸酶(ALP)抗体、Runt 相关转录因子2(Runx2)抗体、过氧化物酶体增殖物激活受体γ(PPARγ)抗体(美国Boster公司)。
1.2 仪器HERAcell150i 细胞恒温培养箱(美国Thermo Scientific 公司);CKX41 倒置光学显微镜(日本Olympus 株式会社);FACSDiva 流式细胞仪(美国BD 公司);Alpha 个人型凝胶成像系统red(美国ProteinSimple 公司);CFX96 荧光定量PCR仪、Bio-Rad Power PAC 200 电泳仪(美国Bio-Rad公司)。
1.3 IPFP-ADSCs的分离、培养和传代
1.3.1 脂肪组织来源 所有OP 患者均来自广州中医药大学第三附属医院关节中心,纳入标准[15-16]:①女性,年龄在45 岁以上,80 岁以下;②自上次月经停经以来至少36 个月;③患者腰椎双能X 线检查,骨密度低于正常值2.5个标准差以上(T 值<-2.5);④行人工全膝关节置换术的患者;⑤患者了解本次研究内容并签署知情同意书。本研究方案经广州中医药大学第三附属医院伦理委员会审核通过(批号:PJ-KY-20220523-008)。
1.3.2 髌下脂肪垫的获取 剔除髌下脂肪组织内的血管、滑膜及其他非脂肪组织,剪碎至约1 mm3大小。PBS 清洗后加入0.075%I 型胶原酶,振荡消化1 h。加入基础培养基(低糖DMEM 培养基,10%胎牛血清,100 U/mL 青霉素,100 U/mL 链霉素,pH7.2)中和消化液并稀释细胞,以140×g离心10 min,弃上清和残留脂肪,加基础培养液重悬后将细胞接种于培养皿内,于37 ℃、5%CO2的细胞培养箱中培养。2 ~3 d 视情况进行换液。待细胞汇集率达到约80%以上时,通过0.25%胰酶消化并进行传代培养,倒置显微镜下观察细胞形态。
1.3.3 流式鉴定 取第3 代ADSCs,经PBS 清洗后,取细胞浓度为1×107个/mL的细胞悬液100 μL,分别加入CD34 抗体、CD90 抗体,空白对照组不加抗体。室温下,避光孵育20 min。PBS 清洗,流式细胞仪检测细胞各表面标志物的表达情况。
1.3.4 成骨、成脂能力检测 将第3 代ADSCs 对数生长期的融合度达到60%~80%时分为2 组,吸弃培养基,加胰蛋白酶使细胞脱落,离心后接种于培养皿中,于37 ℃、5% CO2培养2 h 至4 d,分别换成成骨诱导培养基和成脂诱导培养基,每3 ~4 d 换液1 次。于诱导的第7、14、21 天观察干细胞分化情况。成骨分化组进行茜素红37 ℃染色30 min,成脂分化组进行油红O 37 ℃染色30 min,PBS 清洗3 次后进行显微镜下观察。
1.4 淫羊藿苷诱导ADSCs 将第3代ADSCs以1 ×104个/孔的密度接入6孔板,并分为3组,即对照组、成骨诱导培养基组、成骨诱导培养基+100 μmol/L淫羊藿苷组。培养21 d后,进行后续实验。
1.5 观察指标与方法
1.5.1 实时定量聚合酶链反应(RT-qPCR)法检测细胞ALP、Runx2 及PPARγ mRNA 的表达 采用TRIzol 法提取各组细胞总RNA,严格遵照反转录试剂盒的说明,将总RNA逆转录合成cDNA,设计碱性磷酸酶(ALP)、Runt 相关转录因子2(Runx2)、过氧化物酶体增殖体激动受体γ(PPARγ)以及内参甘油醛-3-磷酸脱氢酶(GAPDH)的引物序列(见表1)。扩增程序为:94 ℃、3 min,循环1 次;94 ℃、30 s,60 ℃、30 s,72 ℃、30 s,循环30次;72 ℃、10 min 循环1 次。扩增结束后,用2-△△CT法计算目的基因相对表达量,并进行分析。

表1 PCR引物序列Table 1 Primer sequences of PCR
1.5.2 Western Blot 法检测细胞Runx2、ALP 及PPARγ 蛋白表达 取各组的IPFP-ADSCs,用PBS清洗2次,加全蛋白裂解液进行裂解,提取总蛋白并定量。10%SDS-PAGE 电泳后,进行转膜、封闭,加入Runx2、ALP 及PPARγ一抗(1∶3 000)4 ℃摇床孵育过夜。次日,用TBST 洗膜,加二抗(1∶6 000),室温孵育2 h,洗膜后ECL 显色,拍摄蛋白条带,以ImageJ 软件进行灰度定量分析。以α微管蛋白(α-Tubulin)为内参。
1.6 统计方法采用SPSS 25.0 软件进行数据分析,以GraphPad Prism 8.0 软件绘制相关统计图。实验计量数据以均数±标准差(±s)表示,多组之间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 IPFP-ADSCs 形态观察与鉴定倒置显微镜下观察细胞,原代IPFP-ADSCs 培养至第5 天,细胞贴壁生长,并逐渐变成长梭形生长,清晰可见较大的细胞核,见图1-A。传至第3 代后,可见ADSCs 呈长梭型或多边形,增殖速度较快,密集生长,呈旋涡状排列,见图1-B。流式细胞技术检测第3 代ADSCs 的表面标志物CD34 和CD90 表达,结果显示,CD34 的表达率为0.23%,CD90 的表达率为91.73%,见图2。由此说明,成功从OP 患者的髌下脂肪垫中分离得到ADSCs。
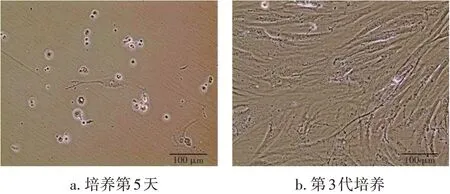
图1 镜下观察IPFP-ADSCs形态(10×20)Figure 1 Observation of morphological features of IPFP-ADSCs under microscope(10×20)
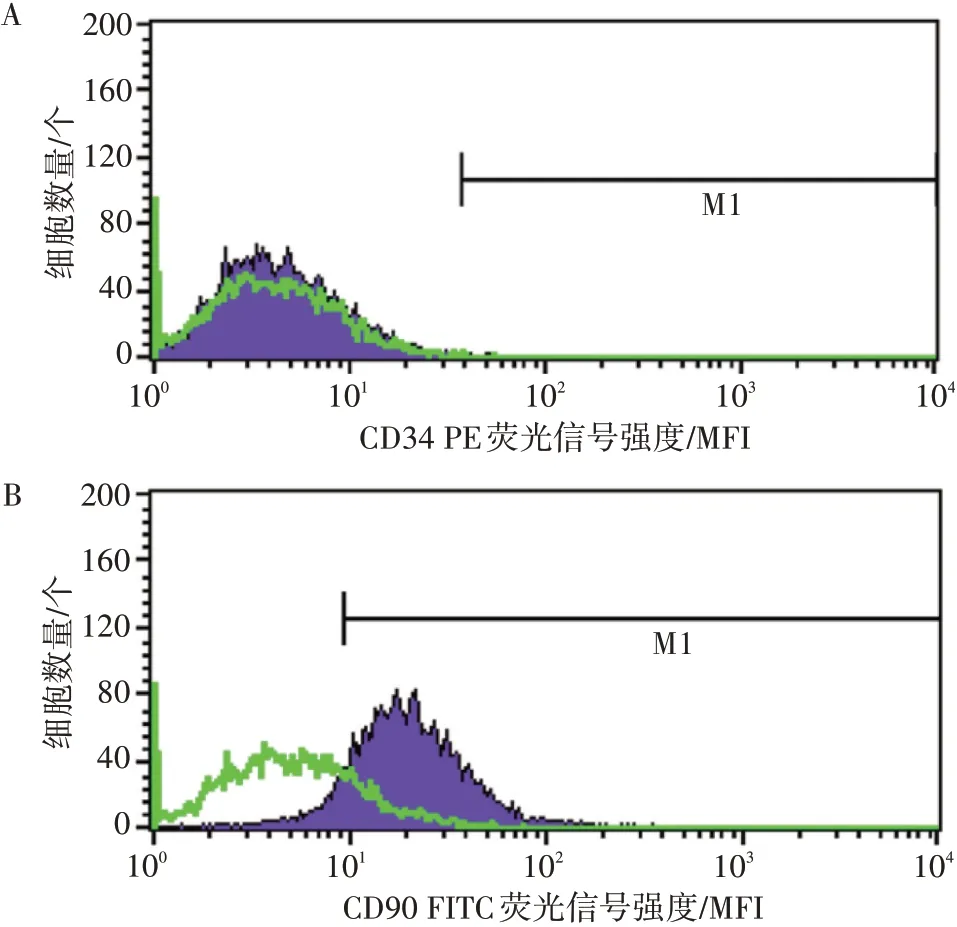
图2 流式细胞技术检测IPFP-ADSCs表面标志物CD34和CD90Figure 2 Detection of surface markers CD34 and CD90 on IPFP-ADSCs by flow cytometry
2.2 IPFP-ADSCs成骨分化能力鉴定第3 代IPFP-ADSCs 加入成骨诱导培养基后,分别在第7、14、21 天进行茜素红染色,光镜下观察。结果显示:在成骨诱导第7 天时仅可见少量钙化点出现,见图3-a;诱导第14天,钙化点较前增大,并有部分钙化点被染成鲜红色,见图3-b;诱导第21 天时,可见大面积鲜红色细钙化斑出现,见图3-c。由此可见,源自OP 患者的IPFP-ADSCs 可被诱导分化为成骨细胞。
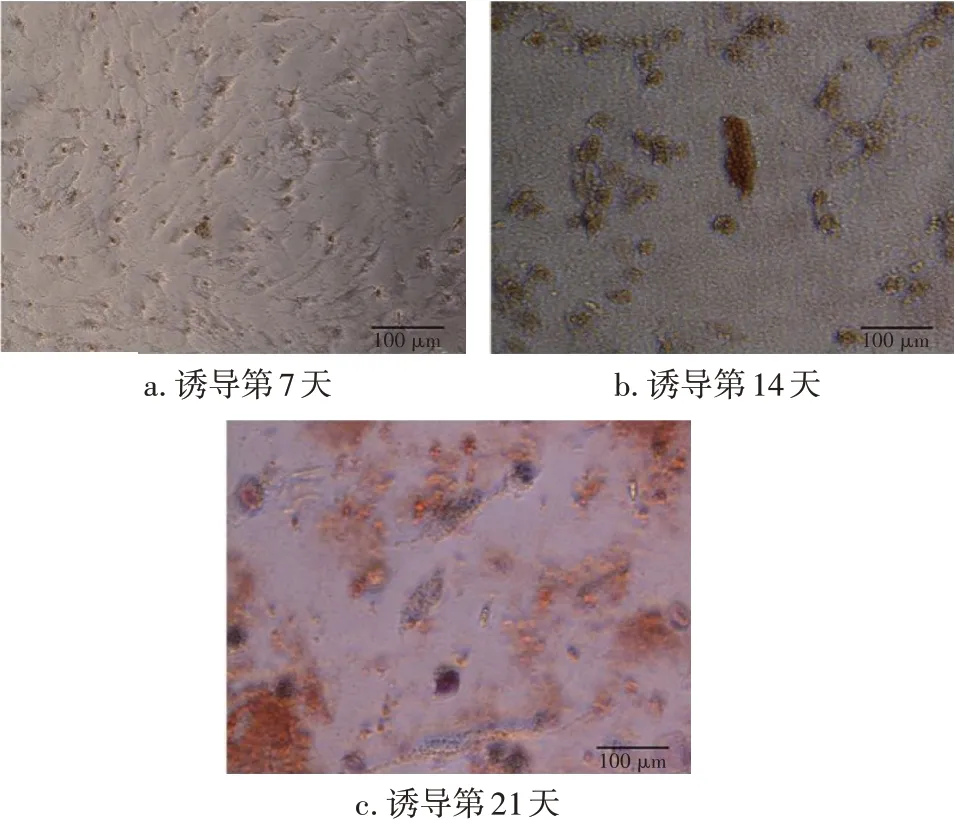
图3 成骨诱导培养后的IPFP-ADSCs(茜素红染色,10×20)Figure 3 IPFP-ADSCs after osteogenic induction(alizarin red staining,10×20)
2.3 IPFP-ADSCs 成脂分化能力鉴定第3 代IPFP-ADSCs 加入成脂诱导培养基后,分别在第7、14、21 天进行油红O 染色并镜下观察。结果显示:成脂诱导第7 天时可见有部分脂滴出现,见图4-a;诱导第14天,细胞团较前增大,并有部分细胞内呈现红色脂滴,见图4-b;诱导第21 天,可见细胞团内含有大量深红色脂滴,见图4-c。由此可见,源自OP 患者的IPFP-ADSCs 可被诱导分化为成脂细胞。
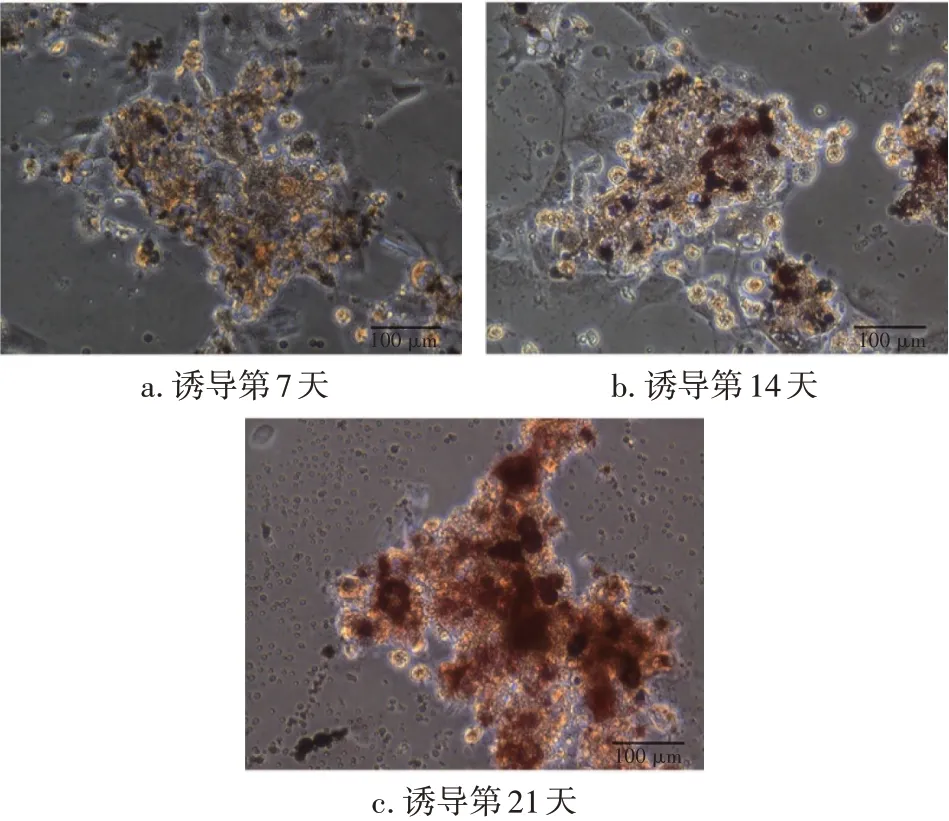
图4 成脂诱导培养后的IPFP-ADSCs(油红O染色,10×20)Figure 4 IPFP-ADSCs after adipogenic induction(oil red O staining,10×20)
2.4 各组细胞Runx2、ALP 和PPARγ 的mRNA表达比较表2 结果显示:与空白对照组比较,Runx2与ALP mRNA 在单纯成骨诱导培养基组和成骨诱导培养基+100 μmol/L 淫羊藿苷组内的表达均上升(P<0.01),且成骨诱导培养基+100 μmol/L 淫羊藿苷组内Runx2与ALP mRNA表达水平显著高于单纯成骨诱导培养基组(P<0.01)。而PPARγ mRNA在空白对照组内的表达显著高于其在单纯成骨诱导培养基组和成骨诱导培养基+100 μmol/L 淫羊藿苷组内的表达(P<0.01),且成骨诱导培养基+100 μmol/L 淫羊藿苷组内PPARγ mRNA 的表达显著低于成骨诱导培养基组(P<0.01)。
表2 各组细胞中Runx2、ALP及PPARγ 的mRNA相对表达量比较Table 2 Comparison of the relative mRNA expressions of Runx2,ALP and PPARγ among each group of cells(±s;n=3)

表2 各组细胞中Runx2、ALP及PPARγ 的mRNA相对表达量比较Table 2 Comparison of the relative mRNA expressions of Runx2,ALP and PPARγ among each group of cells(±s;n=3)
注:①P<0.01,与空白对照组比较;②P<0.01,与成骨诱导培养基组比较
?
2.5 各组细胞Runx2、ALP 和PPARγ 的蛋白表达比较表3、图5 结果显示:与空白对照组比较,成骨诱导培养基组和成骨诱导培养基+100 μmol/L淫羊藿苷组中Runx2 与ALP 蛋白表达水平升高(P<0.01),且成骨诱导培养基+100 μmol/L 淫羊藿苷组蛋白表达水平高于成骨诱导培养基组(P<0.01)。相反,与空白对照组比较,PPARγ 蛋白表达水平在该两组均降低(P<0.01),且成骨诱导培养基+100μmol/L 淫羊藿苷组PPARγ 蛋白表达水平低于成骨诱导培养基组(P<0.01)。
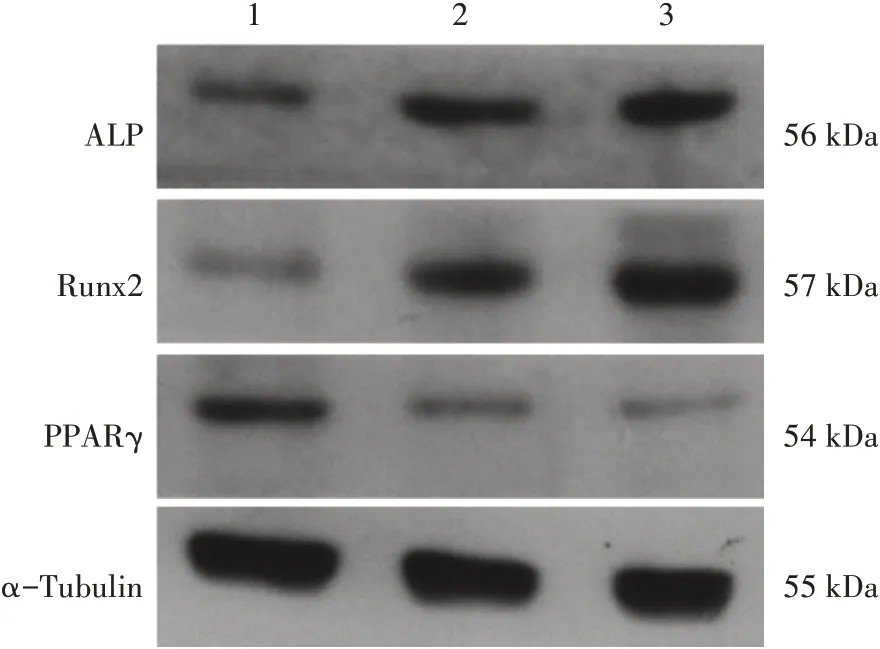
图5 Runx2、ALP及PPARγ蛋白的Western Blot结果Figure 5 Western Blot results of Runx2,ALP and PPARγ proteins
表3 各组细胞Runx2、ALP和PPARγ的蛋白相对表达量比较Table 3 Comparison of the relative protein expressions of Runx2,ALP and PPARγ among each group of cells(±s;n=3)

表3 各组细胞Runx2、ALP和PPARγ的蛋白相对表达量比较Table 3 Comparison of the relative protein expressions of Runx2,ALP and PPARγ among each group of cells(±s;n=3)
注:①P<0.01,与空白对照组比较;②P<0.01,与成骨诱导培养基组比较
?
3 讨论
作为人体主要干细胞之一的脂肪源性干细胞(ADSCs),在特定培养条件的诱导下,同其他来源的干细胞一样具有可以向成骨细胞、成软骨细胞、成脂细胞等方向分化的能力。与骨髓和脐带血等来源的间充质干细胞相比,ADSCs 不仅具有单位体积获取量大,且分离过程简单等诸多优点[17],还具有较强的增殖能力和较弱的免疫排斥反应,也是自体或者异体干细胞移植过程中良好的种子细胞[18]。本研究将ADSCs 作为研究对象。ADSCs 临床常用的获取部位包括腹部、大腿、上肢及腰部等,临床常用的脂肪组织采集有多种方式,如吸脂手术、直接切除、局部穿刺等技术直接获取[19-20]。在取材过程中供体的年龄、性别、部位、取材方式以及体质量指数(BMI)等均是影响所获取的ADSCs 数量、质量、增殖和分化的重要因素[21-23]。本研究采用直接切除髌下脂肪垫的方式,并尽量控制供体年龄、BMI 指数相近,性别相同,仅存在是否患有骨质疏松症这唯一变量来减少不利因素对本实验的影响。
髌下脂肪垫(IPFP)作为ADSCs 的重要储存区,可以在多种膝关节手术中较容易地获得,如全膝关节置换术、膝关节镜手术等。在此类手术中为充分暴露术野,均会去除部分髌下脂肪垫,但不会影响手术正常进程。虽然部分研究认为在人工全膝关节置换术中去除髌下脂肪垫可能会增加其术后的疼痛[24-25],但仍有研究认为在人工全膝关节置换术中去除髌下脂肪垫不会增加创伤和出血,甚至会有效改善髌骨高度[26-27]。有研究[28-30]表明,从髌下脂肪垫分离的ADSCs 可以通过多次传代纯化显示出稳定的分化潜能,且具有更强的向成骨细胞、成软骨细胞方向分化的能力。已有部分研究通过关节腔注射IPFP-ADSCs 的方式,改善了兔和大鼠膝关节的软骨损伤[7,31]。还有研究应用人IPFP-ADSCs 治疗大鼠骨关节炎也取得了较好的疗效[32]。
本研究从全膝关节置换术切除的髌下脂肪垫中成功地分离ADSCs,并进行传代培养。ADSCs经培养传代后,呈长梭形,良好的贴壁状态。就ADSCs 表型,国际脂肪应用技术协会认为经体外培养的ADSCs 表型为CD31-/CD34-/CD44+/CD45-/CD73+/CD90+/CD105+[33-35]。因此,本实验选择CD34和CD90 指标对ADSCs 进行细胞表型鉴定,流式分析显示,OP环境下的ADSCs高表达CD90,且不表达CD34,结果符合ADSCs 细胞表型特征。李聪聪等[15]研究对IPFP-ADSCs 细胞表面标志物CD44、CD45、CD105 进行检测,结果显示,从髌下脂肪垫分离的ADSCs 表面抗原与其他间充质干细胞具有相似性。
在已有的相关研究中关于OP 环境对ADSCs 的成骨分化能力是否有影响方面缺乏一致性。Park等[36]研究显示,OP 环境对ADSCs 的成骨能力无明显影响,但可能通过调节旁分泌作用降低ADSCs的活性,影响其免疫应答。而Wang 等[37]研究认为,OP 环境下小鼠ADSCs 增殖能力和成骨潜能受损。Zhang 和Peng 等[38-39]也认为,糖尿病骨质疏松症环境下ADSCs 成骨分化能力减弱。本研究对OP环境下ADSCs 进行成骨诱导和成脂诱导,观察ADSCs 分化趋势的变化,结果显示OP 环境下ADSCs 同样具有向成骨细胞和成脂细胞分化的能力。本实验虽未进一步探究ADSCs 在OP 环境下,其成骨分化能力是否会降低,但本实验结果说明ADSCs 在OP 环境下仍具有向成骨细胞和成脂细胞分化的能力。
淫羊藿苷对干细胞的影响已有诸多学者进行了探索。既往通过对不同浓度淫羊藿苷干预ADSCs成骨分化的研究[40],结果显示浓度为100 μmol/L 的淫羊藿苷可以更好地促进ADSCs 向成骨细胞方向分化。故本实验在此基础上对研究方法进行补充调整,直接选取浓度100 μmol/L 的淫羊藿苷加入成骨诱导培养基,对OP 环境下的ADSCs 进行干预,并设置对照组和单纯成骨诱导培养基组。在培养至第21 天,对干细胞成骨分化和成脂分化相关的基因蛋白进行检测。ALP是成骨细胞分化时分泌的一种糖蛋白酶,其主要作用是在碱性条件下被激活,可水解多种磷酸酯并转磷酸基,是成骨细胞分化特异性因子[41]。Runx2能通过Wnt和Notch等信号通路调节骨代谢,是重要的成骨转录因子,是早期成骨分化的标志物[42]。PPARγ对脂肪细胞分化和脂质代谢有重要的调节作用,是控制间充质干细胞向脂肪细胞分化的关键基因[43]。Wei等[13]通过淫羊藿苷对BMSCs 干预的研究证明,淫羊藿苷可上调成骨相关蛋白中的Runx2、ALP 表达;刘海全等[44]应用淫羊藿含药血清对绝经后骨质疏松症大鼠BMSCs 成脂分化进行干预,结果表明淫羊藿含药血清可抑制成脂相关蛋白中PPARγ 的mRNA 表达,抑制BMSCs 成脂分化。因此,本研究以Runx2、ALP及PPARγ作为检测细胞成骨和成脂分化的相关指标,观察淫羊藿苷对OP 环境下ADSCs成骨分化趋势的影响,结果显示,100 μmol/L的淫羊藿苷可显著提高细胞内Runx2和ALP基因及蛋白表达,可抑制PPARγ 基因及蛋白表达。表明淫羊藿苷可有效抑制OP 环境下ADSCs 向成脂细胞方向分化的趋势,并促进其向成骨细胞方向分化。
综上所述,ADSCs 具有易于获取、体内储量大及增殖能力强等优势,可为临床干细胞治疗疾病提供有利的基础。但由于ADSCs 多向分化能力使其被临床应用时不能达到稳定的趋向性分化,且OP 环境可能影响ADSCs 的分化能力,而本研究通过体外实验已证明,淫羊藿苷具备促进OP 环境下IPFP-ADSCs 向成骨细胞分化以及抑制其向成脂细胞分化的能力。
