复方骨肽注射液对髁突骨折后大鼠颌骨发育的影响
2023-09-20蒋骞陈毅飞陈雅秋朱志丹张嘉杰孙晓婧
蒋骞 陈毅飞 陈雅秋 朱志丹 张嘉杰 孙晓婧
1桂林医学院附属口腔医院,桂林 541000;2桂林医学院药学院,桂林 541000;3桂林市口腔医院正畸科,桂林 541000
髁突作为颞下颌关节的主要承力部位,其颈部骨折占比高达17.0%~37.1%[1-2]。此时颞下颌关节应力改变甚至中断,会影响髁突软骨超微结构变化,导致髁突异常发育[3]。由于骨折愈合需要的时间较长,在这个过程中会出现咬合紊乱、创伤和颜面部不对称等现象[4-5]。类胰岛素一号生长因子(insulin-like growth factor-1,IGF-1)、血小板衍生生长因子-BB(platelet derived growth factor-BB,PDGF-BB)作为参与髁突软骨力学信号传导,影响其细胞增殖代谢及骨折断端骨增殖分化的细胞因子,其网络调节在代谢转换过程中发挥着极其重要的作用[6-10]。目前,对于处在生长发育高峰期或之前的髁突骨折患者的治疗仍以保守治疗为主[11-13]。
注射用骨肽是含有多种骨代谢的活性肽类,具有调节骨代谢、刺激成骨细胞增殖,调节钙磷代谢,促进新骨形成,防治骨质疏松和促进骨折愈合等效果,临床上主要作为辅助治疗应用于四肢骨骨折,可以有效地改善骨折愈合情况,抑制炎性反应,增加骨代谢,达到缩短骨折愈合时间、减轻术后疼痛等效果[14-16]。为深入了解髁突骨折后使用复方骨肽注射液进行治疗,对颌骨发育及血清内IGF-1、PDGF-BB含量变化的影响,本研究拟建立生长发育高峰期SD大鼠右侧髁突颈部骨折动物模型,观察各组颞下颌关节的形态、影像学及血清学改变。
材料与方法
1.实验动物
SPF雄性SD大鼠72只,体质量为120 g,4周龄,由长沙市天勤生物技术有限公司提供,合格证号:SCXK(湘)2019-0014;使用许可证号:SYXK(桂)2020-0005。适应性饲养3 d,采用随机数字表法分为3大组,即空白对照组、手术组和手术给药组,随后每大组分为4小组,即1周龄组、3周龄组、5周龄组、9周龄组,每组6只。全部大鼠饲养在无病原体的环境中,喂养和建模过程得到了桂林医学院附属口腔医院医学伦理委员会的批准(编号为KQDW-20210003),并遵循了3R原则等所有有关动物伦理使用的适用机构和政府法规给予人道主义关怀。
2.主要试剂及仪器
主要试剂:复方骨肽注射液(吉林辉南长龙),规格2 ml/10 mg;PDGF酶联免疫吸附试验试剂盒(武汉博士德生物工程有限公司);IGF酶联免疫吸附试验试剂盒(武汉博士德生物工程有限公司);2%戊巴比妥钠(上海恩化化学技术有限公司);多聚甲醛溶液(北京兰杰柯科技有限公司)。
主要仪器:小动物活体成像仪(美国PerkinElmer,IVIS Lumina Ⅲ)、高速离心机(德国Eppendorf,5424R)、多功能酶标仪(美国BioTek,EL×800)、游标卡尺(0.02mm分辨率)、镊子、金冠剪等由桂林医学院提供。
3.实验方法
3.1.动物编号 每组按照实验动物颜料涂擦被毛编号法,用3%苦味酸溶液进行编号。
3.2.动物模型建立 实验于2019年10月25号开始,空白组不予以处理,手术组和手术给药组在适应性喂养3 d后,建立大鼠单侧髁突颈部骨折的动物模型。术前记录大鼠体质量,术前8 h禁食,2%戊巴比妥纳(0.2 ml/kg)行腹腔注射麻醉。待无角膜反射后即可开始手术。在实验过程中注意动物的反应,适时追加0.1 ml麻醉剂以维持麻醉效果。取左侧卧位固定大鼠,常规脱毛、消毒。待干燥后右耳前纵切口,切开皮肤、皮下组织。拉开腮腺,从颞肌、咬肌及外耳道之间的凹陷处入手。钝剥离暴露髁颈部,用眼科剪剪断髁颈造成骨折(图1)。手术过程中注意避让附近血管和神经,分层缝合创口。术后2 d内给予精细食物与常规饲料的混合喂养,之后恢复常规饲料饲养。
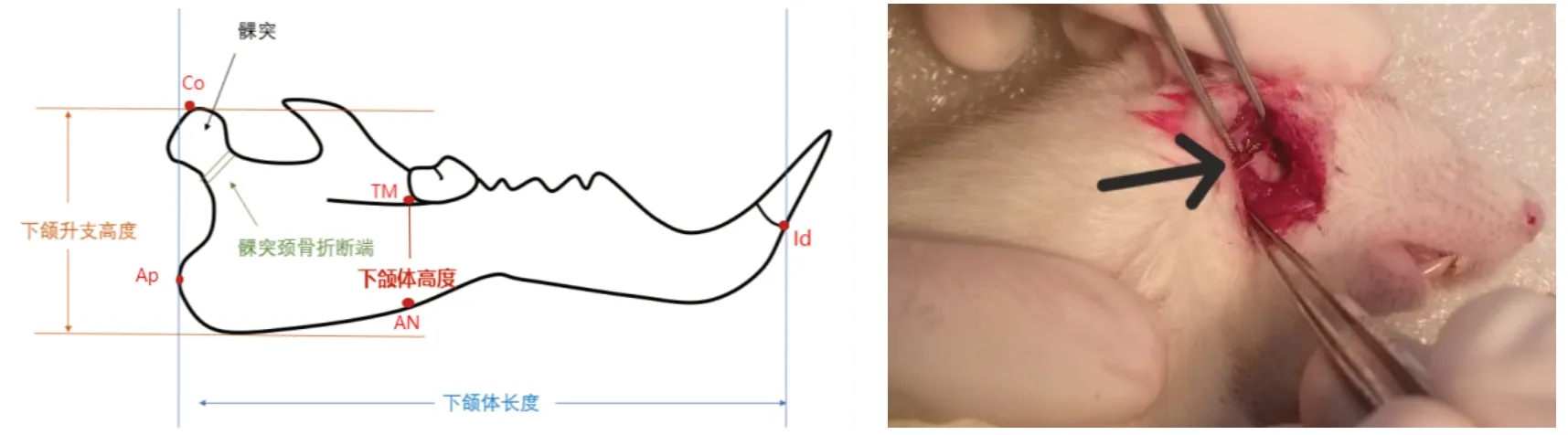
图1 大鼠髁突颈部骨折造模(箭头处为手术骨折端)
3.3.药物干预 手术给药组术后每天注射复方骨肽注射液。依据体表面积算法换算大鼠的等效剂量为每日用药量0.9 mg/kg,将复方骨肽注射液(2 ml/10 mg)溶于98 ml生理盐水中,按照大鼠体质量行腹腔注射。空白对照组和手术组给予等量生理盐水行腹腔注射。
3.4.血清样本的收集 将3组大鼠分别于术后1、3、5、9周各取6只,进行眼球取血。将大鼠头部朝斜下固定住,剪掉大鼠胡须及眼眶周围的鼠毛,待眼球充分充血后,用镊子快速夹掉大鼠眼球。用EP管收集全血,于试管架上做好标记后室温静置30 min后,以转速3 000 r/min离心15 min,离心半径9 cm,后取上方血清分装于冰箱-20 ℃保存以待检测。
3.5.解剖标本采集与保存 将3组大鼠分别于术后1、3、5、9周各取6只,进行眼球取血后,腹腔注射2%戊巴比妥纳(0.6 ml/kg)行大鼠安乐死。随后断头,去皮,手术结束后,统一将大鼠头部沿正中矢状面一分为二,取左右侧下颌骨作为检验标本,修整标本,按照组别分类标号后,4%甲醛浸泡。
3.6.观测与检验方案 (1)下颌骨的解剖学观测测量3组组织标本的下颌骨,使用分规卡尺和游标卡尺(0.02 mm分辨率)测量以下解剖结构标志。下颌体长度(Id-Ap):下颌角点至下齿槽缘点的距离;下颌体高度(TM-AN):角前切迹至下颌磨牙远中的距离;下颌升支高度(Co-Ap):下颌角点至髁顶点的距离,1个标本上每个解剖标志的距离测量3次,求平均值,由1人完成。观测下颌骨的生长发育情况。(2)颞下颌关节的影像学观察使用小动物活体成像仪,用X-ray摄片,观察3组的下颌骨形态和骨折线愈合情况。(3)检验血清内的IGF-1、PDGF-BB含量采用血清学夹心法酶联免疫吸附试验检测标本血清内IGF-1、PDGF-BB含量。利用酶标仪、恒温箱等实验仪器,分别按照IGF-1、PDGF-BB检测试剂盒检测各组SD大鼠血清中IGF-1、PDGF-BB的含量。检测流程:配制标准曲线、加样后反应、加抗体后反应、洗板、加ABC工作液后反应、洗板、加TMB显色液后避光反应、加终止液。
4.统计学方法
采用SPSS 26.0软件对数据进行统计分析,符合正态分布的计量资料以均数±标准差()表示,对结果数据进行方差分析,采用各组均数比较,两两比较用LSD检验。P<0.05表示差异有统计学意义。
结果
1.下颌骨生长观察结果(图2)
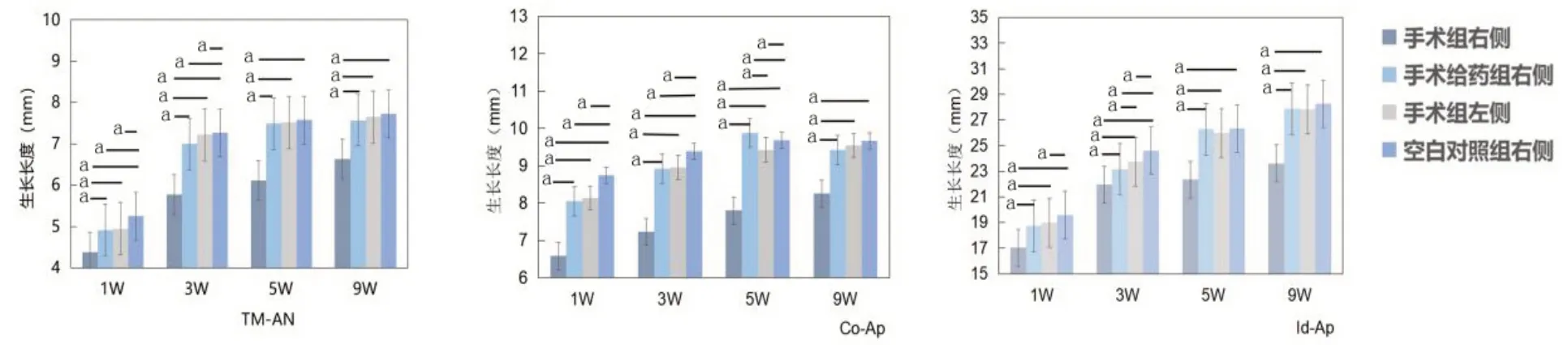
图2 各组大鼠生长长度比较(样本量=6)
通过对空白对照组右侧标本、手术组左侧标本、手术组右侧标本、手术给药组右侧标本进行测量,发现TM-AN、Co-Ap、Id-Ap在术后4个时间点各组比较,呈现出空白对照组大于手术组左侧,手术组左侧与手术给药组右侧相近,手术给药组右侧大于手术组右侧的结果。其中,对照组右侧、手术组左侧、手术组右侧的TM-AN、Co-Ap、Id-Ap在术后1、3周比较差异均有统计学意义(均P<0.05)。给药组的Id-Ap在每个时间点比较差异均有统计学意义(均P<0.05),但TM-AN和Co-Ap仅在术后1、3周差异均有统计学意义(均P<0.05)。绘制各组TM-AN、Co-Ap、Id-Ap的距离均数柱状图可见,各组下颌骨生长均表现为递增状态,但手术组右侧生长变化低于其他组,手术给药组右侧生长变化与手术组左侧相近。
2.下颌骨影像学观察结果(图3)

图3 各组髁突颈部骨折大鼠骨折下颌骨X片
在术后1周时,手术组左侧及空白对照组右侧下颌骨影像密度均匀连续,手术组及手术给药右侧骨折线均清晰可见骨折断端密度不均,骨折线内见高密度影像,边界模糊。术后3周时大鼠髁突颈部骨折线边界手术组较手术给药组模糊,手术给药组的骨折边界线逐渐消失。术后5周大鼠下颌骨形态逐渐恢复,手术组骨折边界逐渐消失,手术给药组未见骨折边界线。手术组大鼠在术后9周时下颌骨影像密度趋于均匀。
3.血清PDGF-BB水平(表1)
表1 各组大鼠术后不同时间血清血小板衍生生长因子-BB水平比较(ng/L,)

表1 各组大鼠术后不同时间血清血小板衍生生长因子-BB水平比较(ng/L,)
注:空白组不予以处理,手术组和手术给药组建立大鼠单侧髁突颈部骨折的动物模型,手术给药组术后每天注射复方骨肽注射液,空白对照组和手术组给予等量生理盐水行腹腔注射;表中同一列数值有相同肩标字母表示P<0.05
术后9周370.81±78.81ab 188.74±22.51a 202.79±51.77b组别手术组手术给药组空白对照组样本量6 6 6术后1周104.21±15.01a 241.69±22.49a 406.47±26.88a术后3周487.6±141.76a 337.37±51.28b 718.4±153.52ab术后5周432.61±33.03a 438.16±63.43b 348.65±68.24ab
分析各组大鼠生长过程中血清PDGF-BB水平的测定结果得出:3组PDGF-BB含量均呈先上升后下降趋势。相同周龄的3组大鼠血清内PDGF-BB的含量两两比较得出:术后1周时,空白对照组大鼠的血清PDGF-BB含量高于手术给药组、手术组,差异均有统计学意义(均P<0.001);术后3~5周时,手术组、手术给药组分别与空白对照组比较差异均有统计学意义(P3周=0.006、<0.001,P5周=0.022、0.016);术后9周时,手术组含量最高,手术给药组与空白对照组相近,此时手术组与其他两组比较差异均有统计学意义(均P<0.001)。
4.血清IGF-1水平(表2)
表2 各组大鼠术后不同时间血清类胰岛素一号生长因子水平比较(ng/L,)
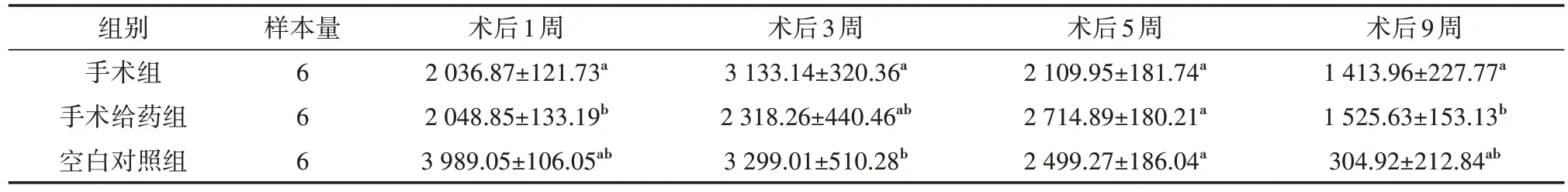
表2 各组大鼠术后不同时间血清类胰岛素一号生长因子水平比较(ng/L,)
注:空白组不予以处理,手术组和手术给药组建立大鼠单侧髁突颈部骨折的动物模型,手术给药组术后每天注射复方骨肽注射液,空白对照组和手术组给予等量生理盐水行腹腔注射;表中同一列数值有相同肩标字母表示P<0.05
术后9周1 413.96±227.77a 1 525.63±153.13b 304.92±212.84ab组别手术组手术给药组空白对照组样本量6 6 6术后1周2 036.87±121.73a 2 048.85±133.19b 3 989.05±106.05ab术后3周3 133.14±320.36a 2 318.26±440.46ab 3 299.01±510.28b术后5周2 109.95±181.74a 2 714.89±180.21a 2 499.27±186.04a
分析各组大鼠生长过程中血清IGF-水平的测定结果得出:空白对照组IGF-1的含量呈逐步下降趋势,但手术组与手术给药组均为先上升后下降趋势。术后1周时,空白对照组与其他两组比较差异均有统计学意义(均P<0.001);术后3周时,手术组血清IGF-1含量达到顶峰,与空白对照组相近,手术组、空白对照组分别与手术给药组比较差异均有统计学意义(P=0.005、0.001);术后5周时,手术给药组血清IGF-1的含量达到峰值,3组含量两两比较差异均有统计学意义(P=0.006、0.024);术后9周时,空白对照组含量低于其余两组(P<0.001),手术组与手术给药组差异无统计学意义(P=0.165)。
讨论
髁突颈部骨折是口腔颌面外科的高发骨折类型之一。在临床上,其治疗方式要考虑髁突骨折时所受到的作用力方向、大小以及个体年龄等差异[17-18]。若处于生长高峰期之前的儿童或正处于生长高峰期的青少年在下颌骨尚未发育完全的情况下出现髁突骨折,而髁突作为下颌骨主要生长发育中心之一,此时髁突所受到的应力刺激改变或中断将导致下颌骨发育暂停或缓慢[19]。复方骨肽注射液是用动物胎骨制成,具有多种促进骨生长、骨发育等活性物质。近年来,复方骨肽注射液在临床上常常作为辅助治疗药物用于促进四肢骨骨折的愈合。但骨折愈合是一个非常复杂的过程,会受到各种外界因素、个体差异、骨折区血供、软组织损伤程度等影响[20]。
本研究选择的是处于生长发育高峰期的雄性SD大鼠,实验结果分析表明。⑴空白对照组在术后4个时间节点内TM-AN、Co-Ap、Id-Ap均大于其他2组,表明单侧髁突骨折会对大鼠下颌骨的生长发育带来影响;手术组左侧(正常侧)大于右侧(骨折侧),这意味着手术组下颌骨因右侧髁突骨折造成双侧髁突受力不平衡,左侧受到咀嚼等应力刺激增加,使下颌骨左侧的生长发育快于右侧,下颌骨偏斜至患侧。手术给药组的生长距离与手术组左侧相近,大于手术组右侧,说明复方骨肽注射液能促进髁突骨折愈合,降低下颌骨的偏斜程度。⑵影像学结果发现,手术给药组在术后5周时就能使骨折断端基本愈合,这种现象在手术组术后9周时才出现,说明骨肽在一定程度上能促进骨折断端的愈合。⑶血清学检测结果显示,术后1周时,手术给药组血清PDGF-BB含量比手术组高,可能是骨肽注射液刺激了机体内PDGF-BB的表达,而空白组血清IGF-1含量与其他2组比较差异均有统计学意义,说明手术和药物处理对IGF-1的影响已经开始;术后5周时,手术给药组的血清PDGF-BB和IGF-1的含量比其他2组高且达到峰值,这可能是由于骨肽加速了骨折愈合过程中生长因子的表达,但具体作用机制还有待研究。
综上所述,本研究结果表明,手术和药物处理都会对大鼠血清IGF-1含量产生影响,并且这种影响是动态的,不同时间点的影响不同。这些数据为进一步研究髁突骨折和骨肽对大鼠生长和恢复的影响提供了重要的信息。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明蒋骞:酝酿和设计实验,实施研究,采集数据,分析/解释数据,文章撰写,工作支持;陈毅飞:酝酿和设计实验,实施研究,采集数据,分析/解释数据,文章撰写,统计分析,指导,支持性贡献;陈雅秋、朱志丹:实施研究,采集数据,分析/解释数据,起草文章,统计分析,行政、技术或材料支持;张嘉杰:实施研究,采集数据,起草文章,获取研究经费;孙晓婧:酝酿和设计实验,分析/解释数据,对文章的知识性内容作批评性审阅,获取研究经费,行政、技术或材料支持,指导
