先天性巨结肠家系EDNRB基因重复突变1例报道并文献复习
2023-09-20丁辉阳雷雯许露肖尚杰周佳亮原丽科黄蓉张亮朱小春
丁辉阳 雷雯 许露 肖尚杰 周佳亮 原丽科 黄蓉 张亮 朱小春
1广东省妇幼保健院新生儿外科,广州 511400;2广东省妇幼保健院妇幼研究所,广州 511400
先天性巨结肠(Hirschsprung's disease,HSCR,OMIM 142623)是一种先天性疾病,其特征是缺乏肠神经节细胞,导致胃肠动力障碍,是新生儿功能性肠梗阻的主要原因,其发病率为1/4 000~1/5 000,男女发病率比为4∶1。目前普遍认为,HSCR主要发病机制与肠神经嵴细胞的正常迁移、增殖、分化和存活异常有关,以及与肠祖细胞壁的相互作用受损,这个过程对于肠神经系统(enteric nervous system,ENS)的正常发育至关重要。ENS是一个十分复杂的过程,受其自身各种基因与环境中各种调控因子的影响和精确调节。许多报道已经研究了HSCR可能的遗传原因,据报道超过24个基因和7个染色体位点在HSCR的发展中起着重要作用,其中配体酪氨酸蛋白激酶受体(RET)和内皮素受体B(EDNRB)作为与HSCR疾病相关的主要基因在多个病例中被检测到[1-3]。RET基因突变占散发病例的20%和家族性病例的50%[2]。EDNRB基因突变占所有HSCR病例的5%~10%[3]。对东亚人群中的短段型HSCR(short-segment HSCR,S-HSCR)病例进行全外显子组测序(WES)分析,EDNRB基因突变总体风险高于RET[4]。当家族中出现HSCR复发时,子代患病的风险会增加200倍[5-6],即使在具有明显单基因遗传的家系中,家系内和家系间表现出不完全外显率和表型严重程度不一致的情况,这可能推论出其他一些因素参与到HSCR形成过程,例如基因修饰、随机表达、环境因素等[7]。
资料与方法
1.临床资料
患者1:母亲(Ⅱ2)被诊断为HSCR(具体病情不详)并在3岁时接受手术,术后未发生并发症,此后也未出现肠道相关问题。
患者2:患者1的女儿(Ⅲ1),通过辅助生殖技术孕2产1,在妊娠40周后于2021年4月14日出生,出生体质量为3 150 g。出生后当天患儿进食后出现腹胀,伴呕吐绿色胃液,未自行排胎便,无呕血、发热、发绀等异常,予灌肠后可见较多墨绿色胎粪,腹部平片提示肠管积气并明显扩张,灌肠造影显示直肠段及乙状结肠远端狭窄,直肠壶段呈“S”形,降横结肠明显扩张,回盲部结构未见异常。该患儿被诊断为HSCR常见型,并在出生84 d时接受了外科手术。
本研究经广东省妇幼保健院医学伦理委员会审批通过(202001101),已签署知情同意书。
2.WES和Sanger测序
2.1.样品和DNA提取 该患儿家属签订知情同意书后,收集了该家庭成员的外周血样本。获得母亲的兄弟和他女儿的口腔拭子用于测序验证。基因组DNA提取使用RelaxGene血液DNA试剂盒(中国北京天根生物科技有限公司)从300 µl外周血样本或口腔拭子中获得。提取的DNA于-20 ℃保存,为测序做准备。
2.2.WES检测 使用Agilent SureSelect Human All Exon Kit v6(Agilent Technologies, Inc., Santa Clara, CA, USA)进行基因组DNA杂交;使用Illumina HiSeq X Ten 平台(Illumina,Inc., San Diego,美国加利福尼亚州)测序及文库构建。
2.3.数据分析 数据分析结果进行分析和注释,生成的bam文件由SAMtools进行排序。基因组分析工具包(GATK;https://software.broadinstitute.org/gatk/)用于检测SNV和插入缺失(<50 bp),并应用CNVki(t17)检测拷贝数变异(CNV)。为了使用SNV数据计算纯合子比率,采用了以下规则:(1)去除了深度<20x的SNP;(2)只有变异等位基因频率在0.2和0.8之间的SNP被认为是杂合。
2.4.EDNRB基因外显子2测序 通过PCR扩增EDNRB基因的外显子2。正向(F)和反向(R)引物序列如下:EDNRB(F)5'-CAGAGATAATGACGCCACCC-3'和(R)5'-CGATCAAGATATTGGGACCG-3',扩增程序包括95 ℃变性步骤(10 min),95 ℃(30 s)、52 ℃(20 s)和72 ℃(40 s)40个循环。PCR产物用正向引物测序。
3.文献检索
检索万方、维普、中国知网、PubMed、Medline数据库,搜索关键词“:先天性巨结肠(Hirschsprung's disease)“”EDNRB基因(EDNRB gene)”,检索2022年10月前公开发表的文献。剔除标准:(1)剔除无法获得全文资料的文献;(2)对同一作者、医院、研究所、数据库重复报道突变予以剔除。检索到15篇相关文献(共报道26个可能致病的突变位点)。
结果
1.基因分析
WES和Sanger测序在4个家系成员中鉴定出1个新的EDNRB基因重复突变c.367delinsTT(p.L123Fter32),该突变会导致基因移码,32个核苷酸的变化(c.123_155ter),使155位的氨基酸过早产生终止密码子,从而生成功能区完全缺失的蛋白质(图1、2)。外婆和母亲的染色3inv(3)(p11.2p23)和染色体9inv(9)(p12q13)均出现倒置。该家系的RET基因未检测到突变。4名家系成员均是EDNRB杂合突变携带者,其中母亲和女儿患病通过手术治疗成功,外婆和舅舅并未表现出巨结肠的临床症状,见表1。该杂合突变在家系中的外显率为50%。

表1 4例EDNRB基因杂合突变携带者的临床资料

图1 三代家族系谱(Ⅰ~Ⅲ)
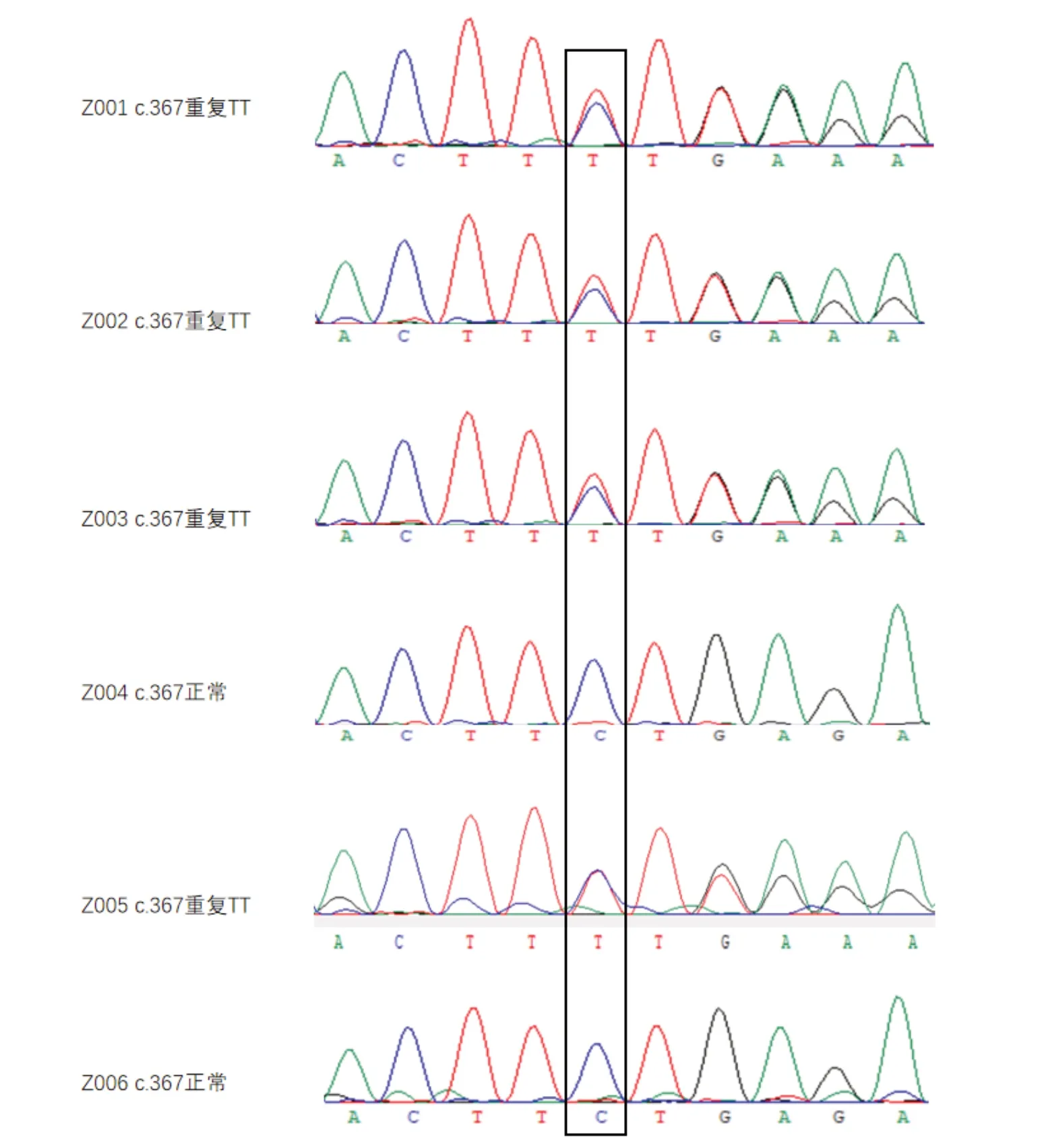
图2 经Sanger测序验证的二代测序结果。Z001:患者1(母亲),Z002:患者2(女儿),Z003:外婆,Z004:父亲,Z005:母亲的弟弟,Z006:弟弟的女儿
2.文献分析
以“EDNRB基因”“HSCR”中英文为关键词,检索万方、维普、中国知网、PubMed、Medline数据库。在HSCR患者中报道了EDNRB基因的多种突变,包括缺失/插入突变、无义突变、剪接突变和几种错义突变。EDNRB基因突变被发现存在于几种临床症状中,最常见的是在HSCR和Shah-Waardenburg综合征(WS4)[8],或者HSCR合并唐氏综合征[9],HSCR合并多发性硬化症(MS)[10],这些报道表明EDNRB基因位于多个基因调控网络中并影响早期胚胎发育。EDNRB遗传风险预测具有辅助诊断、提供遗传咨询、告知治疗方案的潜在临床应用价值。与HSCR致病相关的EDNRB变异位点,包括我们在研究中发现的位点,如表2所示。

表2 目前已报道的EDNRB基因变异位点
讨论
在此研究中,我们调查了1个患有HSCR疾病的家系,并发现了1个新的EDNRB突变。其中4个家系成员中携带1个新的 c.367delinsTT(p.L123Fter32) EDNRB杂合突变。该突变导致155位的氨基酸过早形成终止密码子,产生功能区完全缺失的蛋白质。我们得出结论,EDNRB基因c.367delinsTT(p.L123Fter32)突变可能对HSCR具有致病性。EDNRB(Chr 14位置103814625-103844173 bp)被确定为HSCR的潜在候选基因。人类基因组包含EDNRB基因的单个拷贝,该基因长度24 kb,包含7个外显子和6个内含子,编码442个氨基酸的蛋白质[25-26]。EDNRB是黑色素母细胞和肠神经母细胞迁移所必需的,通过EDNRB的信号传导对于ENS的发育至关重要,EDNRB基因的突变导致人类HSCR神经节细胞缺乏症。Shin等[27]确定EDNRB在胚胎第10天和第12.5天之间的神经嵴发育期内是必需的。Lee等[28]研究表明,EDNRB蛋白及其配体edn3在小鼠的肠神经嵴细胞系及人黑色素瘤细胞系的发育及分化过程中起至关重要的作用。EDNRB基因点突变的小鼠模型表现出HSCR表型。
患儿杂合突变基因遗传自她健康的外婆,这一事实表明其他未鉴定的基因区域(内含子和启动子)或其他因素可能导致该家系中HSCR疾病的发生。表观遗传变异在人类疾病的发展过程中起着重要作用。启动子甲基化引起的转录沉默已被认为是抑癌基因失活的一种常见机制[29]。EDNRB的5’端含有大量的CpG重复序列,这些CpG位点的甲基化可以调节基因表达[30]。启动子甲基化可引起基因表达的沉默,异常甲基化与mRNA转录减少有关[30]。Eberle等[30]检测到在HSCR中EDNRB基因低甲基化水平高于对照组,EDNRB表达的调节可能是由于在HSCR中检测到的异常甲基化引起的。本家系中HSCR疾病的外显率为50%,我们推测EDNRB基因启动子区域的不同甲基化方式使外婆和舅舅不患病,而母亲和女儿表现HSCR症状。
HSCR中EDNRB异常表达的可能有至少两种机制:基因突变和异常启动子甲基化[31]。该突变对剂量敏感,纯合子和杂合子发生HSCR的风险分别为74%和21%[22]。本研究中EDNRB基因杂合突变的风险为50%,高于常见的杂合突变。临床观察男性的巨结肠发生率显著高于女性,而该家系未出现男性患病情况。目前,对于HSCR的发病机制没有统一的定论,基因突变也只能解释70%左右的病例,说明HSCR是一种具有复杂遗传模式的多基因遗传病[32]。任何影响ENS发育过程的调控因子出现异常,这些调控基因均可能成为HSCR致病基因。
我们研究了患有HSCR家系中EDNRB突变的遗传原因,4名成员是EDNRB杂合子突变携带者,2名患病成员有明显HSCR症状,而其他人则表现健康。我们假设新的EDNRB(L123Fter32)突变只是致病因素之一。WES会忽略内含子区域和启动子区域甲基化程度。EDNRB基因的启动子区低甲基化可能在HSCR的发生发展中起作用。启动子甲基化对突变基因的致病外显率影响需要更多HSCR病例进行基因修饰分析来证实。外婆和母亲均有倒置染色体3inv(3)(p11.2p23)和染色体9inv(9)(p12q13),但与疾病无相关性。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明丁辉阳:酝酿和设计试验,实施研究,采集、分析/解释数据,起草文章,获取研究经费;雷雯:酝酿和设计试验,实施研究,采集、分析/解释数据,起草文章,统计分析;许露:酝酿和设计试验,对文章的知识性内容作批评性审阅,指导;肖尚杰、周佳亮、原丽科、黄蓉:对文章的知识性内容作批评性审阅,指导,支持性贡献;张亮:酝酿和设计试验,实施研究,分析/解释数据,对文章的知识性内容作批评性审阅,统计分析,行政、技术或材料支持,指导,支持性贡献;朱小春:酝酿和设计试验,实施研究,采集数据,对文章的知识性内容作批评性审阅,获取研究经费,行政、技术或材料支持,指导,支持性贡献
