盐驯化对提高青花菜耐盐性的研究
2023-09-19邬海艳闫瑾邹宜芯任玉欣李慧
邬海艳, 闫瑾, 邹宜芯, 任玉欣, 李慧
(天津农学院 园艺园林学院,天津 300392)
全球土壤盐碱化现象日益严重,一般认为由NaCl、Na2SO4等中性盐引起的胁迫称为盐胁迫,由Na2CO3、NaHCO3等碱性盐引起的胁迫称为碱胁迫[1]。相关研究数据显示,全球约20%的灌溉土壤受盐胁迫的影响,除自然原因外,环保意识的缺失、不良的灌溉方式与施肥方式等都是使土壤中盐分增加的原因[2-4]。土壤盐碱化使土壤肥力下降,影响植物新陈代谢,最终导致作物产量与质量下降,经济效益也受到一定影响[5-6]。
植物经历过生物或非生物胁迫后,再次面对胁迫时就会产生更高的抵御能力,这种逆境记忆已在多物种之中陆续发现,例如马铃薯、小麦、番茄等[7-8]。随着组织培养技术日益成熟,使用含盐的培养基筛选并鉴定植物的耐盐性成为常规手段。使用含NaCl培养基诱导小麦的幼胚和幼穗,获得耐盐性植株,对其进行连续重复选择,发现后代仍能保持耐盐性[9-10]。植物的逆境胁迫记忆可能是长期的也可能是短期的,并且植物的耐盐性在当代表现较为强烈,其后代也具有一定耐盐性。综上所述,植物的逆境适应性能使植物再次遭遇胁迫时,快速做出响应,产生一定耐盐性。
青花菜为十字花科芸薹属甘蓝种的一个变种,是我国大宗蔬菜之一。青花菜不仅含有丰富的营养价值和多种活性物质,例如硫代葡萄糖苷、萝卜硫素、类黄酮等,还具有抗癌、抗氧化等作用[11],因此其市场需求与受喜爱度日益增加。青花菜也是我国主栽的优质蔬菜之一,但我国其种质资源匮乏,因此,对于青花菜的研究也成为近年来的热点[12]。青花菜组培体系的建立,为盐驯化青花菜提供基础。本试验以青花菜组培苗为材料,设置不同NaCl驯化浓度,研究高盐胁迫下的驯化幼苗的生理指标变化,探讨盐驯化对其生理调节机制的影响,为提高植物耐盐性提供理论基础。
1 材料与方法
1.1 试验材料
青花菜(BrassicaoleraceaL. var.italica)为天津科润蔬菜研究所江汉民博士惠赠的KJ-18。
1.2 盐驯化组培体系建立
种子消毒:使用多菌灵冲洗种子30 min,75%酒精清洗种子2 min(期间摇晃),无菌水冲洗2遍(每次2 min),2%次氯酸钠消毒种子10 min,用无菌水冲洗至无残留为止,滤纸吸水至种子表面无水分,后接种至MS培养基中培养7 d(培养温度25 ℃)。生长7 d青花菜幼苗沿分生点切下,将分生点接种于分化培养基,分化7 d后接种于1/2 MS培养基生根,生根后的分生点即为无根苗。
1.3 组培苗盐驯化方案
青花菜组培无根苗分别接种至含有75、100、150、200 mmol/L NaCl的1/2 MS液体培养基中驯化7 d后,进行225 mmol/L NaCl高盐胁迫处理7 d。测定生理指标(表1)。
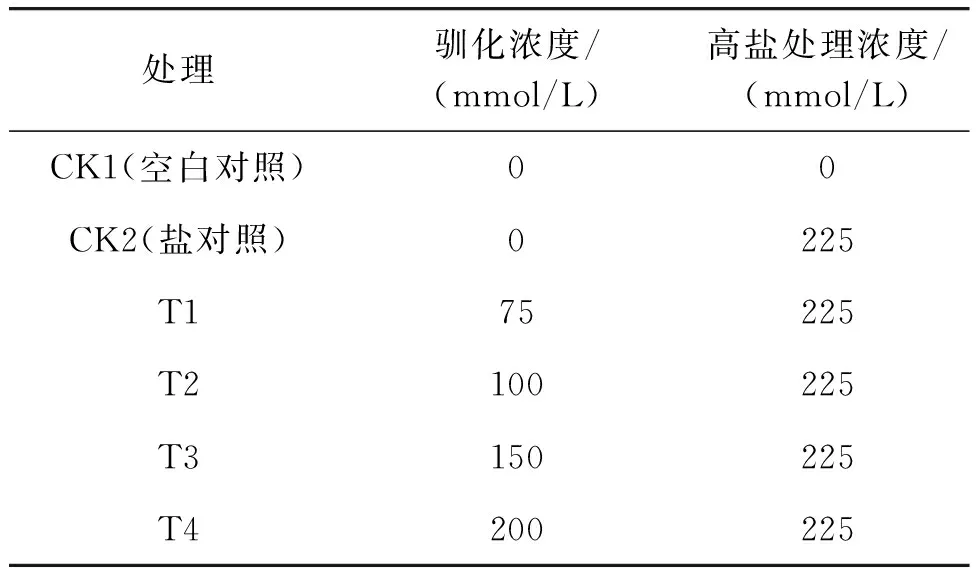
表1 盐驯化青花菜组培苗7 d的不同处理组合Table 1 Different treatment combinations for 7 d of salt-tamed broccoli tissue culture seedlings
1.4 试验方法
1.4.1 生理生化指标测定
叶绿素含量测定采用乙醇提取法,过氧化物酶(POD)活性测定采用愈创木酚显色法,超氧化物歧化酶(SOD)活性测定采用氮蓝四唑光化还原法,过氧化物酶活性(CAT)测定采用紫外吸收法,丙二醛(MDA)含量测定采用硫代巴比妥酸法,脯氨酸含量测定采用茚三酮显色法,可溶性蛋白含量测定采用考马斯亮蓝法,可溶性糖含量测定采用蒽酮法[13],总酚、类黄酮、花青素含量测定采用分光光度计法[14]。
1.4.2 硫代葡萄糖苷含量测定
取0.1 g样品研磨至粉碎,置于110 ℃烘箱1 h;加入8 mL热水(90 ℃),烘箱温度100 ℃烘50 min,期间混匀两次;结束后,静置冷却,用蒸馏水定容至10 mL,摇匀;用滤纸过滤,取1 mL于10 mL离心管中,加入0.15%羧甲基纤维素钠溶液2 mL和氯化钯溶液1 mL,摇匀后静置2~3 h。以氯化钯、羧甲基纤维素钠的空白溶液做参比,测定540 nm的吸光度值,代入标准曲线计算硫代葡萄糖苷含量。
1.5 数据分析
用Excel 2016进行数据的整理;使用Origin Pro 2022进行作图;应用SPSS 20软件进行数据分析,采用LSD和Duncan’s法进行显著性分析。采用隶属函数分析法进行数据综合分析。
隶属函数值计算公式:
反隶属函数值计算公式:
式中,Xi为生理指标测定值,Xmin、Xmax为所有处理的各指标的最小值与最大值。
2 结果与分析
2.1 盐驯化7 d对青花菜组培苗的抗氧化酶活性及MDA含量的影响
2.1.1 盐驯化7 d对青花菜组培苗的MDA含量的影响
由图1A可以看出,MDA含量从高到低依次为CK2、CK1、T1、T4、T3、T2,其中CK2的MDA含量最高,说明MDA含量与胁迫浓度呈正相关变化。CK2的MDA含量较CK1显著增加了42.34%。与CK2的MDA含量相比,驯化组分别显著降低54.95%、84.84%、76.19%、73.25%,说明盐驯化能有效降低高盐胁迫下的青花菜的MDA含量。
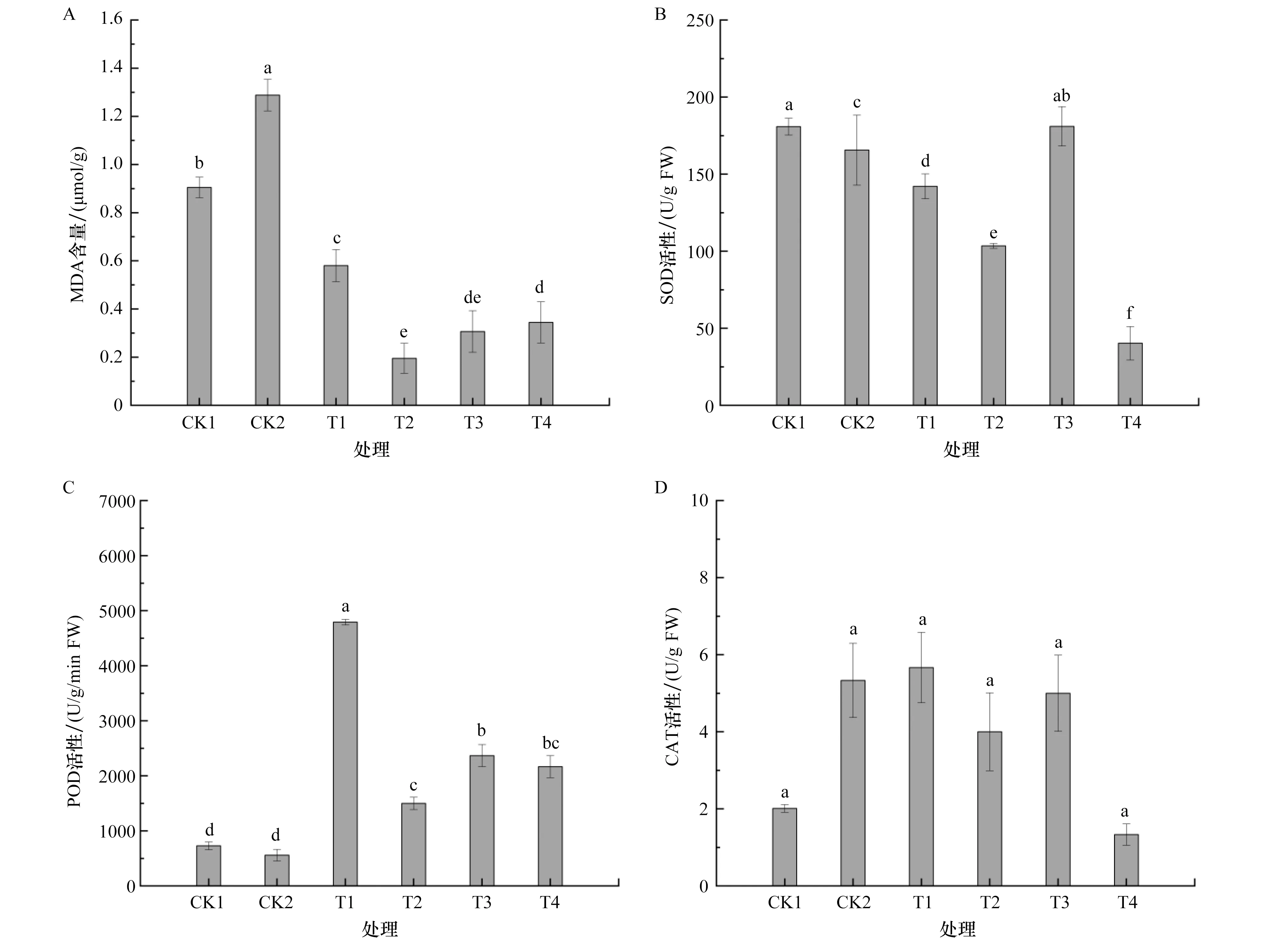
图1 盐驯化7 d对青花菜组培苗的抗氧化酶活性及MDA含量的影响A:盐驯化7 d对青花菜组培苗的MDA含量的影响;B:盐驯化7 d对青花菜组培苗的SOD活性的影响;C:盐驯化7 d对青花菜组培苗的POD活性的影响;D:盐驯化7 d对青花菜组培苗的CAT活性的影响。注:不同字母表示5%显著水平。下同。Figure 1 Effect of salt acclimation for 7 d on the antioxidant enzyme activity and MDA content of broccoli tissue culture seedlings
2.1.2 盐驯化7 d对青花菜组培苗的SOD活性的影响
由图1B可以看出,驯化组的SOD活性呈下降、上升、下降的变化趋势。CK1与CK2之间SOD活性存在显著差异(P<0.05),CK2较CK1显著降低。与CK1的SOD活性相比,T3组无显著差异,T1、T2、T4组显著降低。与CK2的SOD活性相比,T3组显著增加9.29%,T1、T2、T4组分别显著降低14.20%、37.53%、75.67%。T4组的SOD活性达到最低,同时也是降低幅度最大的驯化处理组。
2.1.3 盐驯化7 d对青花菜组培苗的POD活性的影响
由图1C可以看出,驯化组POD活性变化呈先升高后降低的趋势。CK1、CK2之间的POD活性无显著差异(P>0.05),驯化组的POD活性较CK1、CK2显著增加,T1组较CK1、CK2分别显著增加558.39%、758.21%。T1组为POD活性变化的拐点,此时POD活性最大,POD活性增幅也是最大的。
2.1.4 盐驯化7 d对青花菜组培苗的CAT活性的影响
由图1D可以看出,CAT活性水平从高到低排序依次为T1、CK2、T3、T2、CK1、T4。CK1、CK2与驯化组之间的CAT活性无显著差异(P>0.05),与CK1的CAT活性相比,T4组降低33.33%。与CK2的CAT活性相比,T1组增加6.25%,T2、T3、T4分别降低25.00%、6.25%、75.00%。由此表明,盐驯化调节青花菜植株地上部分活性氧稳态主要依靠POD和SOD。
2.2 盐驯化7 d对青花菜组培苗的渗透调节物质含量的影响
2.2.1 盐驯化7 d对青花菜组培苗脯氨酸含量的影响
由图2A可以看出,驯化组的脯氨酸含量呈先升高后降低的趋势。CK1与CK2之间的脯氨酸含量存在显著差异(P<0.05),与CK1的脯氨酸含量相比,CK2、T4组分别显著降低69.05%、65.8%,T3组显著增加了70.77%。与CK2的脯氨酸含量相比,T1、T2、T3组显著增加了240.96%、143.90%、451.83%。驯化组的脯氨酸水平高于或近似CK1水平,说明盐驯化能使青花菜组培苗积累脯氨酸含量,表现出良好的耐盐性。
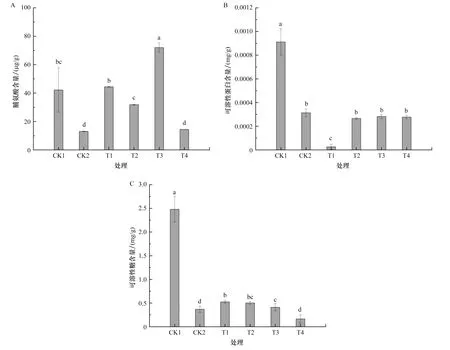
图2 盐驯化7 d对青花菜组培苗的渗透调节物质含量的影响A:盐驯化7 d对青花菜组培苗的脯氨酸含量的影响;B:盐驯化7 d对青花菜组培苗的可溶性蛋白含量的影响;C:盐驯化7 d对青花菜组培苗的可溶性糖含量的影响。Figure 2 Effect of salt acclimation for 7 d on the content of osmoregulatory substances in broccoli tissue culture seedlings
2.2.2 盐驯化7 d对青花菜组培苗可溶性蛋白含量的影响
由图2B可以看出,除T1外,驯化组的可溶性蛋白含量基本稳定。CK1与CK2之间的可溶性蛋白含量存在显著差异(P<0.05),CK2的可溶性蛋白含量较CK1显著降低。T1组的可溶性蛋白含量较CK1、CK2显著降低。
2.2.3 盐驯化7 d对青花菜组培苗可溶性糖含量的影响
由图2C可以看出,可溶性糖含量变化由高到低排序依次是CK1、T1、T2、T3、CK2、T4。驯化组与CK2可溶性糖含量较CK1显著降低。与CK2的可溶性糖含量相比,T1、T2、T3组分别显著增加42.76%、36.40%、11.66%。
2.3 盐驯化7 d对青花菜组培苗的总酚、类黄酮、花青素含量的影响
2.3.1 盐驯化7 d对青花菜组培苗总酚含量的影响
总酚含量由高到低依次为CK2、T3、T2、T1、CK1、T4(图3A)。CK1与CK2之间总酚含量存在显著差异(P<0.05),与CK1的总酚含量相比,CK2显著增加116.1%,T1、T2、T3组分别显著增加4.11%、5.82%、6.85%,T4组显著降低75.68%。驯化组的总酚含量较CK2显著降低,其中T4组降低幅度最大,显著降低88.75%。
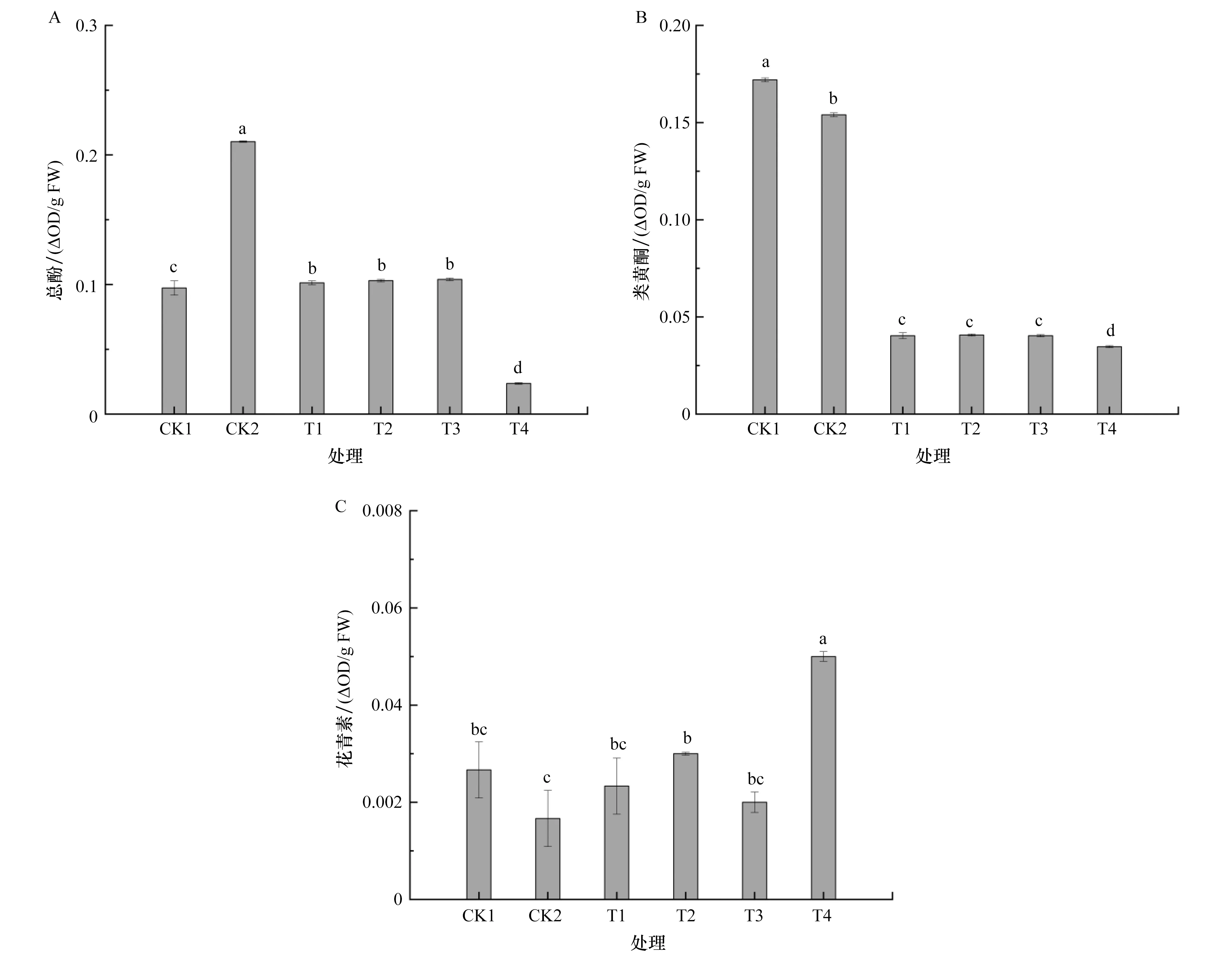
图3 盐驯化7 d对青花菜组培苗的总酚、类黄酮、花青素含量的影响A:盐驯化7 d对青花菜组培苗的总酚含量的影响;B:盐驯化7 d对青花菜组培苗的类黄酮含量的影响;C:盐驯化7 d对青花菜组培苗的花青素含量的影响。Figure 3 Effect of salt acclimation for 7 d on the total phenolic, flavonoid and anthocyanin contents of broccoli histoculture seedlings
2.3.2 盐驯化7 d对青花菜组培苗类黄酮含量的影响
驯化组的类黄酮含量呈下降趋势(图3B)。与CK1的类黄酮含量相比,驯化组与CK2显著降低。与CK2的类黄酮含量相比,驯化组分别显著降低73.81%、73.59%、73.80%、77.49%。T4组的类黄酮含量最低且降低幅度较CK1、CK2都是最大。
2.3.3 盐驯化7 d对青花菜组培苗花青素含量的影响
由图3C可以看出,CK1与CK2之间的花青素含量无显著差异(P>0.05)。与CK1的花青素含量相比,T4组显著增加87.50%。与CK2的花青素含量相比,T1、T3组差异不显著,T2、T4组分别显著增加80.00%、200.00%。
2.4 盐驯化7 d对青花菜组培苗的耐盐性分析
如表2所示,隶属函数值由高到低依次为CK1、T3、T1、CK2、T2、T4。除CK1外,T3组的隶属函数值的综合得分最高,即经150 mmol/L NaCl(T3)盐驯化的青花菜组培苗的抗氧化酶活性和渗透调节物质含量等指标在高盐下能恢复到近似正常CK1水平,说明盐驯化能在一定范围内提高幼苗的耐盐性。T4处理的各项生理指标最差,说明200 mmol/L NaCl的浓度过高,不适宜作为驯化浓度。
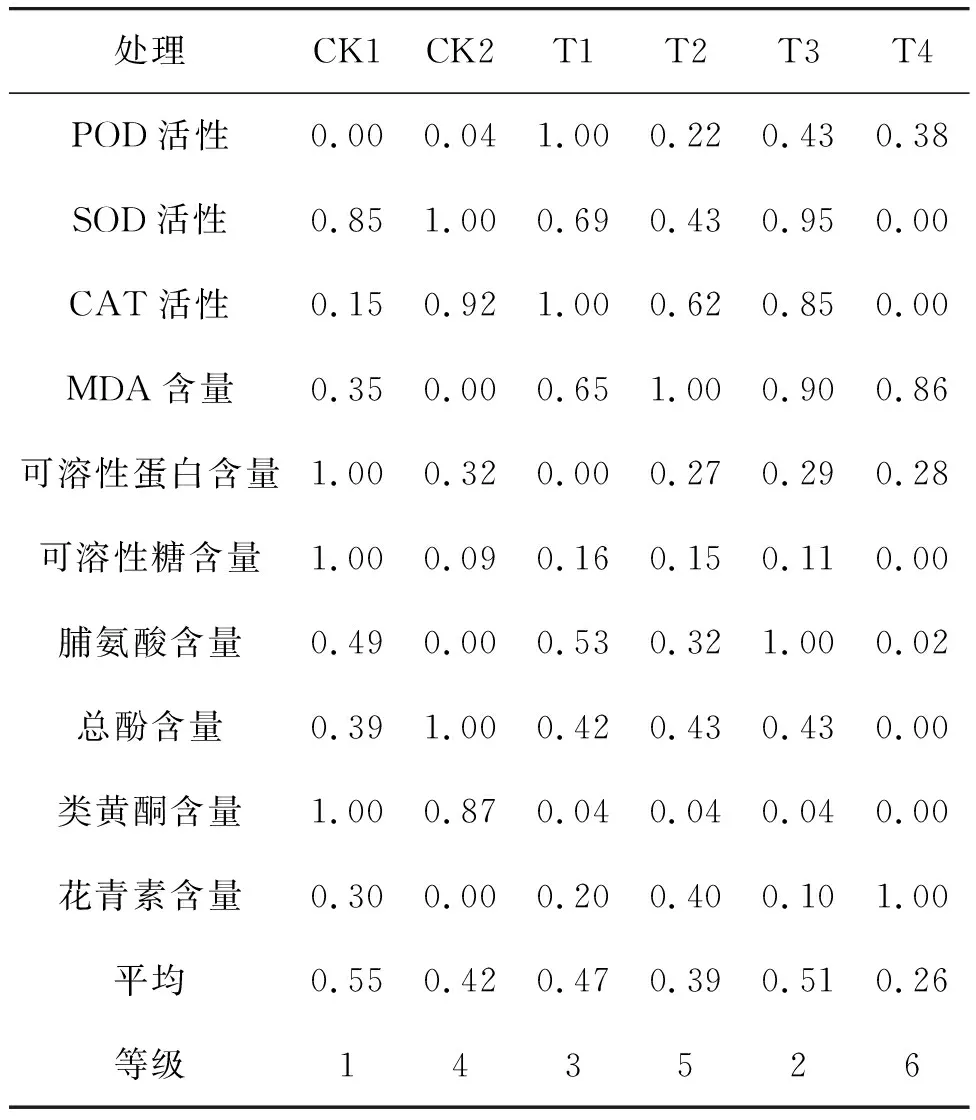
表2 盐驯化7 d的青花菜组培苗生理指标的隶属函数分析Table 2 Membership function analysis of physiological indicators of broccoli tissue culture seedlings acclimated to salt for 7 d
2.5 盐驯化7 d对青花菜组培苗的硫代葡萄糖苷含量的影响
由隶属函数分析可知,T3组的耐盐调节能力最强,所以挑选CK1、CK2与T3进行硫代葡萄糖苷含量的测定。
由图4可以看出,硫代葡萄糖苷含量由高到低排序依次为CK1、T3、CK2,各处理间的硫代葡萄糖苷含量存在显著差异。
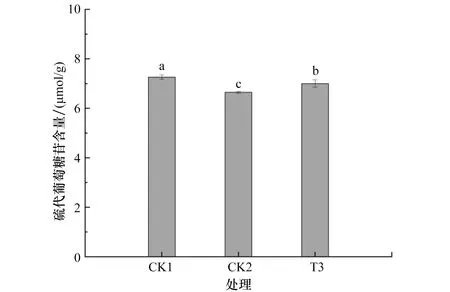
图4 盐驯化7 d对青花菜组培苗的硫代葡萄糖苷含量的影响Figure 4 Effect of salt acclimation for 7 d on glucosinolates content of broccoli tissue culture seedlings
3 讨 论
植物的胁迫适应(驯化)是一个较为复杂的过程,涉及植物的生理、分子及表观遗传水平上的变化。合适的驯化条件能增加植物的抗逆性。大量研究表明,逆境胁迫会使植物体内产生大量ROS并积累,影响植物细胞膜透性以及不饱和脂肪酸的氧化,从而影响植物的形态建成。抗氧化保护是植物胁迫适应的第一道防线,其酶活性水平可作为衡量植物抗性的重要指标之一[15]。盐胁迫下的甜菜耐盐品系中,抗氧化物酶活性显著升高,MDA含量减小[16]。本试验中,T1、T2组的POD活性较CK2显著增加,T3组的SOD、POD活性较CK2显著增加,T4组的SOD、CAT活性较CK2降低,POD活性较CK2显著增加。经盐驯化的幼苗(T1—T4)比未经盐驯化的幼苗(CK2)较CK1(空白对照)变化较小,因此证明盐驯化能活化青花菜的抗氧化酶,进而提高植物的抗逆能力,盐驯化使青花菜组培苗保持较高的SOD活性水平,这与低温驯化辣椒的研究结果一致[17]。盐驯化的CAT活性变化幅度小于SOD活性和POD活性,说明CAT活性对盐驯化的青花菜影响较小,调控能力较弱,与申世铭对玉米幼芽的耐盐性影响研究结果一致[18],SOD、POD活性水平能够更好地反映出植物耐盐性。MDA含量往往能体现植物细胞膜系统受氧化伤害的程度。驯化组的MDA含量较CK1、CK2显著降低,其中T2、T3组的MDA含量降低幅度最大,这与董爱玲低温驯化茄子幼苗研究结果一致[19],结合抗氧化物酶活性的变化,说明盐驯化能使植物的抗氧化物酶活性水平增加,可有效清除高盐胁迫产生的活性氧,调节植物的MDA含量变化,降低盐分对植物造成的氧化伤害。
植物遭受盐胁迫时,因吸水困难造成渗透压失衡,从而遭受渗透胁迫。植物体通过合成及积累无机、有机渗透保护物质,降低细胞水势,维持光合作用、气体交换和酶活性等生理过程的正常进行[20]。研究表明,盐胁迫下,烟草的脯氨酸含量积累不仅与渗透调节有关,还与抗氧防御基因的表达有关[21]。苦苣菜在低盐胁迫下(66~200 mmol/L NaCl),可溶性蛋白含量显著增加,高盐胁迫下(200~300 mmol/L NaCl),脯氨酸与可溶性糖含量显著增加[22]。本试验结果显示,驯化组的脯氨酸变化趋势为先升高后降低。其中T1、T2组的脯氨酸含量与CK1水平一致,T3组的脯氨酸含量达到最大,说明中低盐驯化能使植物在高盐胁迫下通过增加脯氨酸含量增强青花菜组培苗的耐盐性,这与甘草愈伤组织的盐适应研究结果一致[23]。T4组青花菜组培苗的脯氨酸和可溶性蛋白含量下降后趋于稳定,说明青花菜在NaCl浓度超过200 mmol/L后渗透调节能力降低,这与贾鹏燕的研究结果一致[22]。驯化组的可溶性蛋白含量较CK2无显著差异,较CK1显著降低,与薄杉、秦丽凤等人的研究结果一致[24-25],说明盐驯化的青花菜可溶性蛋白含量在高盐胁迫下的合成受阻或分解速度加快,可溶性蛋白不是主要有机渗透调节物质。T1、T2、T3组的可溶性糖含量显著高于CK2,T4组与CK2无显著差异。芸豆在50 mmol/L NaCl和100 mmol/L NaCl盐胁迫下可溶性糖含量与胁迫浓度呈正相关,但当浓度为175 mmol/L NaCl时,可溶性糖含量较CK(空白对照)显著降低,与本试验结果一致[26]。
酚类物质、类黄酮类和花青素等是植物的次生代谢产物,其含量与植物的风味品质、抗逆性及抗氧化等作用有着密切的联系[27]。研究表明,酚类含量与抗氧化能力呈极显著正相关[28],类黄酮与酶促氧化剂的表达有关,因此类黄酮也能通过清除自由基恢复植物的氧化平衡[29]。研究表明,耐盐性强的甘蔗品种中,多酚类物质、类黄酮和花青素含量均升高[30]。本试验中,驯化组的总酚和类黄酮含量较CK2显著降低,说明不经盐驯化的青花菜幼苗(CK2),通过积累酚类和类黄酮类物质含量来增加自身抗氧化能力,清除产生的过量ROS,这与银杏盐胁迫的研究结果一致[29],表明高盐胁迫下,植物可通过积累多酚、类黄酮等活性物质减少盐害损伤。驯化组的花青素含量变化幅度不明显,T4组的花青素含量较CK1、CK2显著增加。硫代葡萄糖苷是十字花科蔬菜中一种重要的活性物质,具有多种生物学功能,例如抗癌、抗氧化、抗菌等[31]。本试验中,硫代葡萄糖苷含量与植物的耐盐性有一定的关系,还待进一步验证。
4 结 论
盐驯化青花菜组培苗在高盐胁迫下,通过提高抗氧化物酶(SOD、POD)活性水平和积累脯氨酸来提高其耐盐能力。隶属函数分析表明,T3组的驯化效果最好,耐盐调节能力最佳。
