基于RNA-seq的HBSS诱导细胞自噬的组学分析及实验验证
2023-09-19曹敬博王来友贾永鹏
阮 晨,曹敬博,吴 冉,王来友,贾永鹏
(1.南阳理工学院 河南省工业微生物资源与发酵技术重点实验室,河南 南阳 473004;2.南阳理工学院 生物与化学工程学院,河南 南阳 473004;3.辽宁大学 数学与统计学院,辽宁 沈阳 110036;4.南阳理工学院 信息工程学院,河南 南阳 473004)
自噬是细胞维持自身稳态的一种高度保守的生命过程,它可以平衡细胞内部的能量来源,有效应对周围环境造成的胁迫作用从而保证细胞的生存[1].自噬过程还可以降解错误折叠的冗余蛋白质,清除老化受损的细胞器(如线粒体、内质网和过氧化物酶体等),消灭侵入细胞内的病原体并促进细胞表面抗原呈递,在预防癌症、神经退行性病变和自身免疫性疾病等方面发挥重要作用[2].细胞自噬的相关研究倍受关注,到目前为止已经鉴定出了41个核心自噬相关ATG基因,其中大部分在真核生物中表现出了高度的保守性[3-5].相关自噬调控基因和蛋白也逐渐被发现,它们对医学及相关学科的发展具有推动作用.经典自噬诱导剂雷帕霉素抑制mTOR促进细胞自噬的同时可以减少脊髓损伤后的运动功能障碍[6];此外它还可以诱导细胞自噬清除突变的亨廷顿蛋白,防止神经退行性病变[7].毒胡罗卜素会引发内质网应激诱导的自噬现象,研究人员发现基因Park2在毒胡罗卜素诱导的内质网应激对短暂缺血性脑损伤起到了保护功能[8].从药用植物中提取的白藜芦醇可上调心肌细胞自噬活性,增加关键基因Sirt1的表达进而增强梗死心肌的心脏功能,这一研究对防治心血管疾病具有指导意义[9].由以上可以看出,自噬机制及调控蛋白的发现都离不开种类繁多功能各异的自噬诱导剂的帮助.
HBSS是细胞培养及清洗中常用的磷酸盐缓冲液,同时也是经典的细胞自噬诱导剂[2].它可以为细胞提供无糖、无血清、无氨基酸的饥饿环境,科学家通常将其用于自噬模型的对照处理中[10].在生物信息学飞速发展和组学数据大流行的今天,自噬领域的相关研究绝大多数还停留在经典的分子生物学阶段,各类自噬现象的相关组学数据的挖掘和分析研究较少.HBSS作为最早使用的经典的自噬诱导剂,其相关组学数据分析报道较小.
在本研究中,以HBSS诱导NRK细胞自噬为研究对象,探究饥饿自噬的最佳处理条件.随后结合转录组测序技术系统鉴定和分析HBSS处理前后的转录组数据并筛选差异基因,最后以自噬Marker蛋白为指标,结合RNA干扰技术和免疫印迹实验验证潜在调控基因的功能.基于RNA-seq的HBSS诱导细胞自噬的组学分析及新的相关调控基因的发现,可以为自噬调控机制的深入阐明提供依据和参考.
1 材料与方法
1.1 试剂及仪器
DMEM高糖培养基、PBS磷酸盐缓冲液、HBSS缓冲液、青霉素-链霉素双抗,美国Hyclone公司.胎牛血清,杭州四季青生物工程材料有限公司.BCA蛋白检测试剂盒、RIPA裂解液、RNA转染试剂,碧云天生物技术有限公司.甘氨酸、三羟甲基氨基甲烷、盐酸、十二烷基硫酸钠、过硫酸铵、TEMED、蛋白酶抑制剂、NC膜等,上海麦克林生化科技有限公司.Anti-LC3抗体、Anti-ACTB抗体,艾伯泰克生物科技有限公司.VAHTS Stranded mRNA-seq Library Prep Kit,南京诺唯赞生物科技有限公司
细胞培养箱,日本SANYO公司.液氮罐,新乡新亚低温有限公司.超低温冰箱,青岛海尔集团.Western blot电泳套装,美国Bio rad公司.360度混匀摇床,杭州米欧仪器有限公司.全波长酶标仪,Thermo Fisher Scientific公司.双色红外成像系统,美国Odyssey公司.
1.2 细胞培养与自噬诱导检测
用细胞计数板进行细胞计数后,取适量细胞悬浮液放入细胞培养瓶中,并补充5~10 mL新鲜细胞培养基,置于恒温细胞培养箱中,培养条件为37 ℃,5% CO2.培养细胞至汇合度为80%时,去除细胞培养基后用PBS清洗3次,加入HBSS缓冲液处理细胞不同时间段诱导细胞自噬.处理完毕后用RIPA裂解液裂解细胞样本提取总蛋白,使用BCA蛋白定量试剂盒对蛋白定量.取适量蛋白质进行SDS-PAGE凝胶电泳,电泳完毕后用湿转法把目标蛋白转移至NC膜上,用5%脱脂奶粉封闭过夜,封闭温度为4 ℃.封闭完毕清洗,分别用含有LC3B-Ⅱ和ACTB抗体的PBS溶液封闭过夜,其中封闭温度为4 ℃.第二天用含有二抗的PBS溶液室温孵育2 h,再次洗涤后至于凝胶成像系统成像.
1.3 总RNA提取与转录组测序
用HBSS缓冲液分别处理NRK细胞0 h和3 h.每个时间点约取3×106个细胞,迅速置于液氮冻存备用.取样完毕后,每个细胞样品分别加入Trizol充分混匀离心取上清.使用氯仿、异丙醇和乙醇,用多次离心取上清的方法获取RNA沉淀.DEPC水溶解分装后,置于-80 ℃超低温冰箱保存.使用Nanodrop 2000 spectrophotometer检测RNA样品纯度,Qubit 3.0检测RNA样品浓度,Labchip GX检测样品RNA的ROS(RNA quality score)值.用VAHTS Stranded mRNA-seq Library Prep Kit进行文库构建,建库完成将样品送至武汉百迈克生物科技有限公司进行测序,得到经过质控过滤后的高质量测序数据(Clean data).
1.4 组学数据注释及分析
用Tophat程序将bowtie2数据中的reads回帖至大鼠参考基因组,根据经典剪切位点标记寻找可能剪切组合.Tophat进一步在没有剪切位点注释信息下建立比对索引[11].用Cufflinks程序拼接前一步中获得的转录本,并计算表达量.用Cuffmerge程序将获得的转录本数据整合成一个数据集,从而使所有转录本数据基于一个标准进行展示和计算.最后用Cuffdiff程序设定阈值,根据FPKM(Fragments Per Kilobase of exon model per Million mapped fragments)值过滤筛选差异表达基因.GO(Gene Ontology)富集分析及KEGG(Kyoto Encyclopedia of Genes and Genomes)富集分析均采用R语言进行超几何分布计算和展示[12-13].
1.5 RNA干扰实验
培养细胞至汇合度80%时,去除细胞培养基后用PBS溶液洗涤3次,用RNA转染试剂转染每个基因相应的siRNA 48 h.用PBS溶液清洗3次后,加入HBSS缓冲液处理细胞3 h.收集细胞样品,用免疫印迹实验检测LC3B-Ⅱ蛋白的表达量.siRNA由广州睿铂生物科技有限公司提供.
1.6 荧光定量PCR实验
取细胞RNA反转录合成cDNA,然后在荧光定量PCR上进行扩增实验.引物由武汉奥科鼎盛有限公司设计合成.
1.7 数据分析与绘图
使用R语言的t.test()函数对实验数据的差异显著性进行分析,*表示p<0.05.用R语言进行绘图.
2 结果与分析
2.1 自噬诱导时间的确定
培养细胞至汇合度为80%时,加入HBSS缓冲液处理细胞0,2,2.5,3,3.5和4 h.用CCK-8 kit检测各时间点细胞存活率,如图1a所示,细胞存活率在3.5 h出现显著下降.提取各时间点样品的总蛋白,用免疫印迹实验检测细胞内自噬Marker LC3B-Ⅱ蛋白的表达量[14].由图1b可知,处理时间为3 h时,细胞内LC3B-Ⅱ蛋白的表达量达到最大,此后出现明显下降.结合图1a,b,可知HBSS诱导细胞自噬的较优诱导时间为3 h,3 h后细胞因饥饿处理时间过长,出现自噬性死亡.

图1 自噬诱导时间的选择
2.2 总mRNA提取及质量检测
样品总mRNA的提取纯度对转录组后续的建库和数据分析有直接的影响,总mRNA提取完毕后进行质量检测,样品各项指标均符合建库质量要求,结果见表1.两个处理的6个待建库样本总mRNA浓度均在500 ng·μL-1以上,提取总量达到50 μg以上.6个样本OD260/280的值均在标准区间1.9~2.0内,总mRNA纯度较高,基本无杂质或污染.反映RNA完整性的质量评估参数RQS值均在9以上,满足建库要求.

表1 总mRNA质量检测
2.3 转录组数据的基本统计与质控
转录组测序数据的质量直接影响了数据分析的结果.因此利用 Illumina 测序平台完成6个样品的转录组测序,每个样品产生不低于10 G clean data,基本数据信息见表2.由统计结果可知,样品的低质量碱基(Q<30)比例较低,说明测序质量较好.6个样品的测序碱基质量值Clean Q30均在85%以上,表明样本转录组测序结果干净可靠,可用于后续的计算和分析.

表2 数据信息
2.4 基因表达情况及差异基因的过滤
经Tophat-Bowtie2-Cufflink转录组分析计算完毕后,用Cuffdiff程序设定阈值计算过滤筛选差异表达基因.差异表达基因的过滤条件为|log2(Fold change)|>1和p<0.05.差异基因的结果展示见图2,根据筛选阈值共过滤出477个差异基因,其中共有249个上调基因和228个下调基因.在上调基因中log2(Fold change)>2的基因有117个,占差异表达基因总数的24.53%;log2(Fold change)的值位于1~2之间的基因共有132个,占差异表达基因总数的24.67%.而在下调基因中,log2(Fold change)<-2的基因有107个,占差异表达基因总数的22.43%;log2(Fold change)的值位于-1和-2之间的基因共有121个,占差异表达基因总数的25.36%.由上可知,差异基因中各区间内发生上调的基因数量均高于发生下调的基因数量,因而在差异表达的上调基因中可能更容易筛选出具有影响饥饿诱导自噬的潜在调控基因.

图2 差异基因分布
2.5 差异基因的GO富集分析
为了更加清晰的了解差异基因可能发挥的生物学功能以及参与的信号通路及生命过程,对上一步过滤出的差异表达基因进行GO富集分析[15].GO富集分析的结果主要从三个方面进行描述,分别为:描述基因参与的生物学过程(BP),描述基因存在的细胞组分(CC)位置,描述基因发挥的生物学功能(MF).分析结果见图3,差异基因在BP过程中主要富集在蛋白质及基因层面的磷酸化和去磷酸化相关调节(GO:0045936;GO:0010563;GO:0042326)、对错误折叠或未折叠蛋白质的响应(GO:0006986;GO:0035966)、内源性凋亡信号调节(GO:0097193)和应激性调节过程(GO:0032922)等.差异基因在CC描述中主要富集在核糖体前体(GO:0030688)、染色质间颗粒团簇(GO:0016607)、吞噬泡(GO:0000407)和液泡膜(GO:0005774)等.差异基因在MF信息描述中主要富集在氨基酸的转运活性(GO:0015171;GO:0015175;GO:0015179;GO:0022858)、有机酸的转运活性(GO:0046943;GO:0005342)以及泛素蛋白连接酶的相关功能(GO:0044389;GO:0031625)等.由以上可以看出,GO分析三个层面的主要富集结果都与细胞自噬的发生存在联系[4].这从一个侧面说明过滤出的差异表达基因可能在HBSS诱导自噬的过程中发挥调控功能.

图3 GO富集分析
2.6 差异基因的KEGG富集分析
除了对差异表达基因进行GO富集之外,进一步对差异基因进行KEGG富集分析[16].结果见图4,该图的横坐标为Gene ratio值,表示富集到相应信号通路的基因占总差异基因数的比值;纵坐标为富集后基因所处的信号通路名称;每个信号通路上圆点的大小代表了富集于该信号通路的基因数目;圆点的颜色代表了每条信号通路的显著性.由KEGG富集分析可以看出,差异表达基因主要富集于mTOR信号通路(hsa04150)、MAPK信号通路(hsa04010)和cAMP信号通路(hsa04024)等,这些信号通路的调控都与细胞自噬的发生密不可分[17].由KEGG富集分析可以看出,过滤出的差异表达基因有可能在HBSS诱导自噬的过程中发挥调控功能.
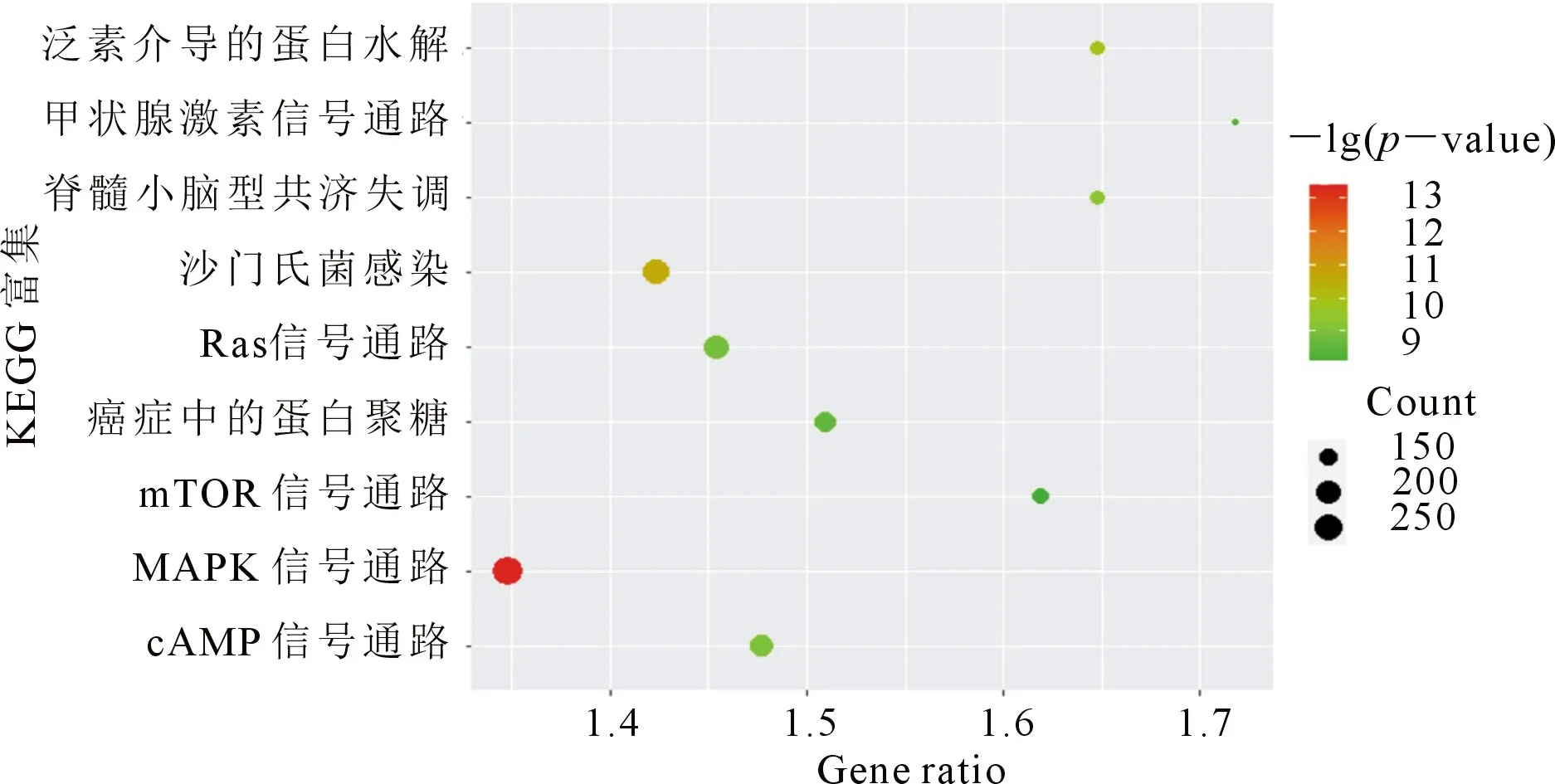
图4 KEGG富集分析
2.7 差异表达基因的相关实验验证
过滤出的差异表达基因在富集结果分析中表现出与细胞自噬的紧密联系.根据2.3分析的结果,选取差异表达基因的前18个上调基因进行后续调控功能的验证,这些基因在转录组两个处理组中的相对表达量见图5.

图5 基因表达情况
选取相对表达量差异大(log2(Fold change)>2)的基因设计siRNA,转染细胞后敲降48 h.用PBS缓冲液洗3次后,加入HBSS溶液诱导细胞自噬3 h.收取细胞样品,提取细胞蛋白,利用免疫印迹实验检测自噬蛋白Marker LC3B-Ⅱ的表达量,其中NC为阴性对照.在实验结果中,发现干扰Sat1基因表达,可以降低细胞内LC3B-Ⅱ蛋白的表达量,影响细胞自噬的正常进行,如图6a所示.此外,本研究同时通过实验发现了三个已经具有自噬调控功能的蛋白质Sqstm1、Nbr1和Hmox1,干扰其基因表达,细胞内LC3B-Ⅱ蛋白的表达水平明显降低,如图6b所示.

图6 实验验证
用荧光定量PCR对HBSS溶液诱导细胞自噬3 h后Sat1的基因表达情况进行辅助验证,上下游引物分别为:CACAGCATTGTTGGTTTTGC和CAAAAGAAGAGGTGCTTCGG.在荧光定量PCR的实验结果中,HBSS处理3 h后Sat1的表达量出现上升(图6c,6d),这与转录组分析结果图5中Sat1基因的表达上调的结论一致.
3 讨论
自噬是细胞维持自身稳态的一种高度保守的生命过程,自噬过程可以降解错误折叠的冗余蛋白质,清除老化受损的细胞器,这一生命过程在预防癌症、神经退行性病变和自身免疫性疾病等方面发挥重要作用.HBSS溶液目前主要为细胞自噬模型营造饥饿环境,从而提供饥饿诱导自噬的对照.在HBSS实验处理的帮助下,科学家们发现了许多调控机制.已有报道确定了HMGB1蛋白在HBSS诱导的自噬中探索甲状腺癌细胞通过自噬溶酶体途径中降解钠碘转运体的分子机制[18].研究人员还发现通过HBSS实验处理比较线粒体膜电位、凋亡蛋白水平和活性氧水平的变化,证明自噬可以抑制去甲斑蝥素诱导的细胞凋亡,抑制自噬可以提高华蟾蜍精诱导的细胞凋亡现象[19-20].用HBSS进行间歇性氨基酸饥饿实验,证明自噬是骨骼肌细胞衰老的重要作用因素[21].由以上分析可以看出,HBSS作为经典的细胞自噬诱导剂,它在相关研究领域中担当着重要的角色.
在各种组学数据爆发式增长的今天,自噬研究领域中HBSS诱导细胞饥饿自噬的对照模型实验应用广泛,然而围绕HBSS诱导细胞自噬的相关组学数据的产出和分析报道较少,相关研究亟需探索和挖掘.本研究中,以HBSS诱导NRK细胞饥饿自噬为研究模型,结合转录组测序技术分析其组学数据,寻找潜在的新的调控蛋白,最后实验验证其功能.
在本研究中,通过不同时间段饥饿处理后的蛋白表达量的检测以及对细胞存活率的测定,最后确定在NRK细胞中HBSS诱导细胞自噬的最佳诱导时间为3 h.这一结论和相关研究一致,已有科学家发现HBSS在3 h时同样可以诱导甲状腺癌细胞自噬水平达到最大[21].在HCT116细胞中HBSS的自噬诱导时间需要6 h,在人胃癌细胞中自噬诱导时间仅0.5 h[18,22].HBSS的细胞自噬诱导时间的不同,可能与细胞的具体种类有密切联系.在确定最佳诱导时间后,以此时间点作为最佳条件,结合转录组测序技术系统鉴定和分析HBSS处理0和3 h的转录组数据.组学数据质控完毕后分析整体基因的表达情况,通过过滤阈值共过滤出249个上调基因和228个下调基因.在该分析中,差异基因中各区间内发生上调的基因数量均高于发生下调的基因数量,因而在上调基因中可能更容易筛选出具有影响饥饿诱导自噬的潜在调控基因.为了更加清晰的了解和挖掘477个差异基因可能的信号通路和细胞位置上发挥的功能,接着对这些差异基因进行GO和KEGG富集分析.在GO富集分析中,蛋白质及基因层面的磷酸化和去磷酸化相关调节和对错误折叠或未折叠蛋白质响应的富集系数较高;在KEGG富集分析中,MAPK信号通路的富集系数最大.结合俩者的富集结果,数据分析筛选出的差异基因可能在蛋白质降解及能量供给上发挥作用,具体的机制在未来仍需继续探索.
为了在这些差异基因中找到具有调控细胞自噬功能的基因,选取差异表达基因的前18个上调基因进行后续实验验证.假设基因在转录组层面发生变化,那么在蛋白质层面才可能发生改变;又由于蛋白质是生命活动的主要承担者,所以采用基因敲降和免疫印迹实验联合手段筛选具有调控功能的蛋白质.以自噬蛋白Marker LC3B-Ⅱ的表达量为检测指标进行筛选,最后发现干扰基因Sat1的表达,可以降低HBSS诱导的细胞内LC3B-Ⅱ的表达量.而已有研究结果中也发现了相似的结论,在白藜芦醇诱导的细胞自噬研究中,基因Sat1的表达量存在显著上调现象[23].综合已有的研究结果和本研究的实验结论,基因Sat1可能在细胞自噬的生命过程中担当着一定的角色.
除此之外,通过实验发现了三个具有自噬调控功能的蛋白质Sqstm1,Nbr1和Hmox1.SQSTM1作为一种多功能蛋白可与溶酶体降解底物结合从而进一步被水解酶酶解,本身依赖自噬降解过程又参与到多个信号通路中.其中,SQSTM1是泛素化自噬底物形成的主要驱动者之一,NBR1通过使SQSTM1-NBR1聚合物具备高亲和性的UBA(Ubiquitin-associated )结构域来促进底物形成;不仅如此,NBR1还可以通过调控HSP90.1和 ROF1来调控自噬发生[24,25].已有研究证明HMOX1参与HIF1A-BNIP3-ATG7调控的自噬信号通路中,干扰HMOX1表达可以影响AT 101诱导的细胞自噬[26,27].在本实验体系中,三个基因在HBSS实验处理3 h时均发生了显著变化,干扰基因表达均会影响LC3B-Ⅱ的表达量.
综上,本研究围绕HBSS诱导细胞自噬进行组学测序分析和实验验证,发现了新的潜在功能调控基因Sat1,新的调控基因的发现可为细胞自噬相关机制的深入挖掘和理解提供帮助.但是在本研究中仍存在不足,研究仅从转录组层面分析过滤潜在的功能调控基因并进行实验验证,这一方法可能漏掉了很多信息点从而导致重要的调控蛋白被滤掉.在未来研究中,我们将继续深入挖掘Sat1影响的信号通路,阐明其自噬调控的具体机制;同时将其他组学方法加入其中,多层次、多角度看待问题和分析问题,找到被滤掉的重要调控蛋白.最后,希望本研究的这些发现可为细胞自噬相关机制的阐明和理解提供参考.
