磁性荧光免疫纳米探针的制备及检测应用
2023-09-19刘一丹左显维韩根亮宋玉哲
刘一丹,左显维,韩根亮,宋玉哲,王 焱
(甘肃省科学院 传感技术研究所,甘肃省传感器与传感技术重点实验室,甘肃 兰州 730000)
免疫球蛋白G(IgG)是人体血清中含量最高的抗体,它由免疫反应部分的B淋巴细胞产生,占血清中免疫球蛋白的70%~80%,具有抗菌、抗病毒、抗毒素的特征,在机体免疫防护中起重要作用[1-4].鉴于IgG是诊断慢性感染、慢性肝病、免疫性疾病的一个特异性临床指标,因此测定人血清中IgG的含量可对许多疾病的早期诊断提供依据.
目前,检测 IgG 的主要方法为酶联免疫分析技术(ELISA),然而标记酶需要特别的保存,且传统的ELISA采用比色法检测,灵敏度和准确性有待进一步提高[5].利用特定生物分子之间的特殊亲和力和特异性,包括抗体-抗原、受体-配体DNA-蛋白质等的相互作用,已经开发出了一系列敏感和高选择性的生物检测探针[6].而荧光免疫探针基于抗原抗体结合的免疫反应,将物质的荧光作为输出信号实现定量检测,体系兼具免疫反应的特异性和荧光响应的高灵敏度.在众多荧光检测体系中,荧光共振能量转移(FRET)体系备受关注,它对供体和受体之间的分离距离极其敏感,其中发光供体通过非辐射偶极子-偶极子相互作用将能量转移到荧光或非荧光受体,当生物亲和反应使其接近时,就会在两个荧光团之间发生FRET[7-8].因而在单分子光谱[9]、蛋白质折叠[10]、细胞成像[11]和免疫分析[12]中有广泛的应用.
纳米材料具有独特的结构和性能,其与生物分子偶联构建的新型纳米探针,可极大地提高生物探针的性能.将生物分子偶联在具有生物相容性的纳米磁性材料表面,可以通过磁场将其从复杂基质中分离,从而减小背景信号,为生物分子的检测提供了简便的方法.磁性纳米材料已广泛应用于免疫分析[13-14]、酶固定化[15]等生化领域,如蛋白质的检测[16]、核酸杂交[17]和端粒酶活性检测[18].然而磁性材料与IgG结合时普遍会面临一个问题,即磁性材料与IgG进行非特异性结合,使固定的抗体分子取向不一致,影响抗体的靶向效率.蛋白G是G型链球菌分离而得到的细胞壁蛋白,可以与IgG的补体端(Fc端)以高亲和力特异性结合,特别对人、兔和鼠的IgG表现出很高的亲和力[19-20].由于蛋白G能够特异性识别IgG的Fc端,因此,通过蛋白G的连接,可以将抗体分子定向固定在磁性材料上,使抗原结合部位(Fab)充分暴露,有利于分析物的结合,因此提高检测灵敏度,降低检出限.
鉴于此,在聚丙烯酸(PAA)修饰的Fe3O4磁性纳米团簇上连接蛋白G,从而在其表面定向固定抗体,并利用荧光团/淬灭剂对距离依赖性光学特性,设计分别标记荧光团和淬灭剂的抗原-抗体偶联复合物,制备出基于FRET原理的磁性荧光纳米免疫探针,并利用此探针与目标物IgG的竞争性免疫反应,建立了灵敏、快速检测IgG的新方法.PAA中的羧基可与蛋白G的氨基连接,提高连接效率和强度.将这种羧基化磁性纳米团簇与蛋白G的复合材料用于抗体的定向固定,抗体活性Fab部分充分暴露在外侧,极大地提高了抗体的结合效率.而小尺寸的纳米团簇可以起到信号放大作用,从而提高检测灵敏度.
1 实验部分
1.1 实验试剂
1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)、2-吗啉乙磺酸(MES)均为分析纯,购自美国 sigma-aldrich公司;重组蛋白G(protein G)、牛血清蛋白(BSA),纯度>98%,购自美国 sigma-aldrich公司;人免疫球蛋白G(IgG)、4-[4-(二甲基氨基)苯偶氮]苯甲酸标记羊抗人免疫球蛋白G(DABCYL-anti-IgG)、荧光素二乙酸酯标记人免疫球蛋白G(FAM-IgG)购自北京博奥森生物技术有限公司;灭菌去离子水.纳米团簇的洗涤和活化缓冲液为0.05 mol·L-1MES溶液(pH=6.0),培养免疫复合物的缓冲液为含0.1 mol·L-1NaCl 的 0.01 mol·L-1磷酸盐(PBS, pH=7.4).
1.2 磁性荧光免疫纳米复合探针的制备
利用Discover SP型单模微波合成仪(美国CEM公司),通过微波辅助多元醇法制备得到聚丙烯酸修饰的磁性纳米团簇(PAA-Fe3O4NCs)[21].取500 μL 10 mg·mL-1磁性纳米团簇分散液到离心管中进行磁分离,用0.05 mol·L-1MES(pH=6.0)缓冲液洗涤3次后,加入500 μL 10 mg·mL-1EDC,室温孵育50 min,以活化羧基.在活化后的磁性纳米团簇中加入200 μL 1 mg·mL-1蛋白G,室温孵育3 h,磁分离弃去未连接的蛋白G,用MES缓冲液洗涤后,重新分散在含1.0 % BSA的PBS中,然后在室温下孵育2 h,以消除非特异性结合,磁分离除去多余的BSA.洗涤后加入500 μL 0.16 mg·mL-1荧光淬灭剂标记的羊抗人免疫球蛋白G (DABCYL-anti-IgG),室温下孵育24 h,得到Fe3O4NCs-protein G-DABCYL-anti-IgG.洗涤后再次分散在含1.0 % BSA的PBS中,在室温下孵育2 h,以消除非特异性结合,并进行磁分离.最后用0.01 mol·L-1PBS(pH=7.4)缓冲液洗涤3次,在4 ℃下储存待用.吸取12 μL 2.5 mg·mL-1FAM-IgG和488 μL PBS,加入到Fe3O4NCs-protein G-DABCYL-anti-IgG的PBS溶液,混合均匀后,在37 ℃下孵育1 h,得到磁性荧光免疫纳米复合探针(Fe3O4NCs-protein G-DABCYL-anti-IgG-IgG-FAM).
1.3 血清样品的制备
随机留取门诊患者的血液样本,利用H1650型台式高速离心机(湖南湘仪)离心15 min(4000 r·min-1)获得血清,然后在-20 ℃保存,进行分析前用0.01 mol·L-1PBS(pH=7.4)缓冲液稀释.
1.4 人免疫球蛋白G的检测
采用FS5型一体化稳态瞬态荧光光谱仪(英国爱丁堡公司)测定荧光强度,激发和发射波长分别为490和517 nm.用荧光光谱仪检测磁性荧光免疫纳米复合探针的初始荧光强度.将过量的免疫复合探针分为8等份,分别加入不同浓度梯度(0.06,12.00,45.60,70.70,110.00,146.00,180.00,210.00 nmol·L-1)的IgG标准液或样品液,在37 ℃下孵育3 h,进行免疫竞争反应.随后将磁性荧光免疫纳米复合探针通过磁分离,测定上清液的荧光光谱.
2 结果与讨论
2.1 竞争性免疫反应的检测原理
竞争性免疫反应的检测原理见图1.在羧基化的磁性纳米团簇(Fe3O4NCs)表面修饰蛋白G,用于定向连接荧光淬灭剂标记的羊抗人免疫球蛋白G(DABCYL-anti-IgG),制得荧光淬灭剂标记的羊抗人免疫球蛋白G修饰的Fe3O4磁性纳米团簇;将它与FAM荧光素染料标记的人IgG(FAM-IgG)混合后,磁性纳米团簇上的抗体与IgG特异性结合,FAM荧光团与荧光淬灭基团DABCYL靠近,发生荧光共振能量转移,FAM的荧光淬灭;当加入目标检测物IgG时,IgG与FAM-IgG竞争结合磁性纳米团簇上的抗体[22],因此磁性纳米团簇上的FAM-IgG减少,发生FRET的荧光强度减少,而磁分离后上清液荧光信号增强;随着IgG加入量的增多,竞争免疫反应持续发生,上清液中荧光信号不断增强,IgG与荧光信号响应成正比,从而定量检测IgG.

图1 磁性荧光免疫纳米探针的制备及检测原理
2.2 磁性荧光免疫纳米复合探针的表征
2.2.1 羧基化Fe3O4磁性纳米团簇(Fe3O4NCs)的表征 采用透射电镜、X射线衍射和红外光谱表征合成的羧基化Fe3O4磁性纳米团簇的微观形貌和结构组成,结果见图2.从透射电镜(图2a)中看出,纳米团簇是由许多很小的Fe3O4纳米颗粒组装而成,平均粒径约30 nm,背景干净清晰,团簇分布均一.材料的XRD见图2b所示,其与反尖晶石型 Fe3O4(JCPDS.19-0629)标准衍射谱吻合,表明团簇由Fe3O4纳米颗粒组成.另外,在衍射角为20.0°左右的位置出现了无定形的聚合物包峰,说明在Fe3O4纳米团簇表面有聚合物的包覆.图2c为羧基化磁性纳米团簇的傅立叶变换红外(FT-IR)光谱,602 cm-1处出现的峰归属于Fe-O键的伸缩振动峰,此为Fe3O4的特征峰.3 400 cm-1处的宽峰为—OH的伸缩振动峰,1 663 cm-1处的峰为C=O的伸缩振动峰,这2个峰的出现说明样品中存在羧基,且羧基上的2个氧原子与Fe结合后发生红移.2 948 cm-1处的峰为聚丙烯酸主链上—CH2—的反对称伸缩振动峰,进一步证实聚丙烯酸(PAA)的存在,说明PAA成功修饰在Fe3O4纳米团簇表面,它们极易与蛋白之间发生化学偶联、静电吸附、氢键等相互作用.

图2 羧基化Fe3O4磁性纳米团簇(Fe3O4NCs)的透射 电镜(a),X射线衍射(b)和红外光谱(c)
2.2.2 蛋白G修饰的Fe3O4磁性纳米团簇(Fe3O4NCs-protein G)的表征 图3A为Fe3O4NCs与Fe3O4NCs-protein G的Zeta电位对比图,可以看出Fe3O4纳米团簇表面由于存在羧基,Zeta电位呈负性(a曲线);而包覆蛋白G后Zeta电位向更负方向移动(b曲线),这是由于蛋白G分子中含有很多活性基团.图3B为Fe3O4纳米团簇与蛋白G包覆Fe3O4纳米团簇的磁滞回线对比,从图中可以看出,Fe3O4纳米团簇包覆蛋白G后饱和磁化强度减弱(b曲线),这是由于随着蛋白G的引入,导致Fe3O4磁性粒子的含量降低,从而造成饱和磁化强度下降,从侧面证明蛋白G已成功包覆.
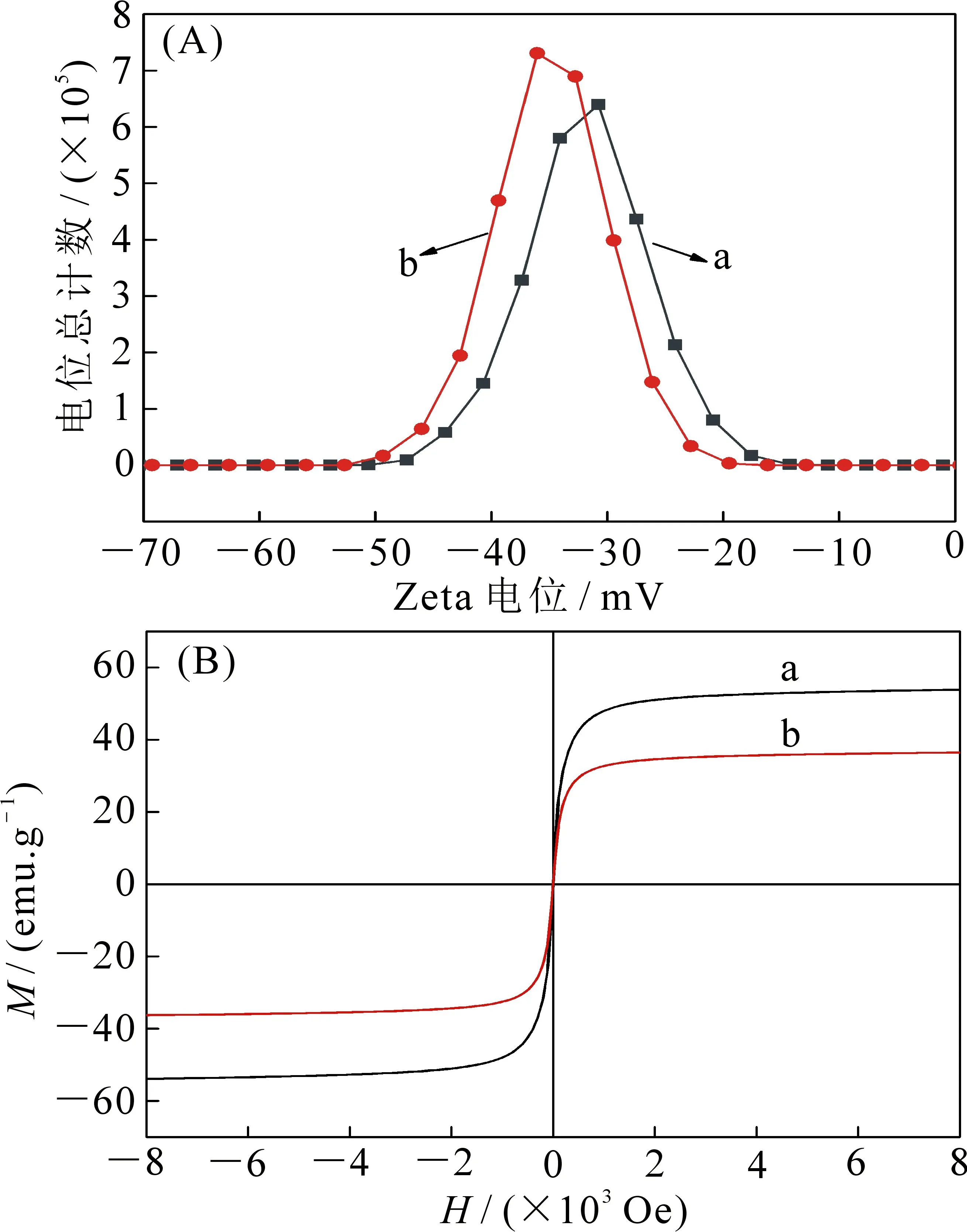
图3 Zeta电位(A)(a为Fe3O4NCs,b为 Fe3O4NCs-protein G)和磁滞回线(B) (a为Fe3O4NCs, b为Fe3O4NCs-protein G)
2.2.3 荧光淬灭剂标记的羊抗人免疫球蛋白G修饰的Fe3O4磁性纳米团簇(Fe3O4NCs-protein G-DABCYL-anti-IgG)的表征 图4为探针制备过程中在Fe3O4磁性纳米团簇表面修饰蛋白G和抗体的Zeta电位.由图可见,随着磁珠表面蛋白G和DABCYL-anti-IgG的连接,Zeta电位逐渐向负方向移动,说明带负电的活性基团越来越多,这与实验过程一致,证明Fe3O4NCs-protein G-DABCYL-anti-IgG成功制备.
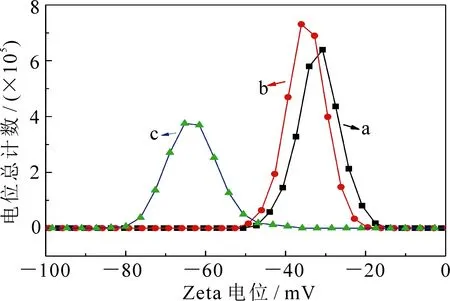
图4 磁性纳米团簇表面修饰蛋白G和抗体的Zeta电位(a Fe3O4NCs,b Fe3O4NCs-protein G,c Fe3O4NCs-protein G-DABCYL-anti-IgG)
2.2.4 磁性荧光免疫纳米复合探针(Fe3O4NCs-protein G-DABCYL-anti-IgG-IgG-FAM)的表征 图5为FAM荧光素标记的人免疫球蛋白G修饰的Fe3O4磁性纳米团簇(Fe3O4NCs-protein G-IgG-FAM)与磁性荧光免疫纳米复合探针(Fe3O4NCs-protein G-DABCYL-anti-IgG-IgG-FAM)的荧光显微镜图.如图5a所示,Fe3O4NCs-protein G-IgG-FAM有荧光出现,说明标记有FAM荧光素染料的IgG成功连接在蛋白G上,实现了蛋白G对抗体的连接;但当FAM-IgG与Fe3O4NCs-protein G-DABCYL-anti-IgG发生免疫反应形成磁性荧光免疫纳米复合探针Fe3O4NCs-protein G-DABCYL-anti-IgG-IgG-FAM后,由于荧光淬灭剂DABCYL与荧光供体之间发生荧光共振能量转移,磁性荧光免疫纳米复合探针的荧光明显被淬灭(图5b).说明磁性荧光免疫纳米复合探针Fe3O4NCs-protein G-DABCYL-anti-IgG-IgG-FAM已制备成功.

图5 荧光显微镜图(a Fe3O4NCs-protein G-IgG-FAM, b Fe3O4NCs-protein G-DABCYL-anti-IgG-IgG-FAM
2.3 磁性荧光免疫纳米复合探针检测IgG的原理验证
图6为磁性荧光免疫纳米复合探针检测IgG的荧光光谱.曲线a为Fe3O4NCs-protein G-DABCYL-anti-IgG与FAM-IgG混合后发生荧光共振能量转移后的荧光光谱曲线,荧光被淬灭,几乎没有荧光强度.当加入目标检测物IgG时,IgG与FAM-IgG竞争结合磁性纳米团簇上的抗体,因此磁性纳米团簇上的FAM-IgG减少,磁分离后上清液FAM-IgG荧光信号增强;随着IgG加入量的增多,竞争免疫反应持续发生,上清液中荧光信号不断增强.如图6b,c,d所示,随着IgG加入量的增多,上清液荧光信号不断增强.图6有效证明了磁性/荧光复合免疫探针检测IgG的设计原理.

图6 a Fe3O4NCs-protein G-DABCYL-anti-IgG-IgG- FAM溶液的荧光光谱,b,c和d加入不同浓度 IgG(42.0,58.0,67.0 nmol·L-1)后发生免疫竞争 反应的上清液荧光光谱
2.4 磁性荧光免疫纳米复合探针检测条件的优化
为了得到最佳的检测条件,对检测过程中Fe3O4NCs-protein G-DABCYL-anti-IgG用量、缓冲液pH值、免疫反应温度和免疫竞争反应时间进行了优化.选用250 μL荧光标记IgG(FAM-IgG)分别与50,100,150,200和250 μL Fe3O4NCs-protein G-DABCYL-anti-IgG偶联,以优化竞争免疫反应中Fe3O4NCs-proteinG-DABCYL-anti-IgG的用量(图7a).当Fe3O4NCs-protein G-DABCYL-anti-IgG用量为200 μL,荧光响应趋于稳定,表明其用量已达到饱和.因此,选用200 μL Fe3O4NCs-protein G-DABCYL-anti-IgG进行后续实验.

图7 反应条件优化(a Fe3O4NCs-protein G-DABCYL-anti-IgG用量,b 缓冲液pH值,c 免疫反应温度,d 免疫竞争反应时间)
抗原抗体免疫反应一般在PBS缓冲液中进行.由于PBS的pH值影响抗体和抗原的活性,免疫竞争反应在pH为5.5~8.5之间进行测试.结果表明(图7b)免疫竞争反应的最佳pH值为7.4.
通常过高或过低的温度都会干扰抗原和抗体的稳定性,而适当的免疫反应温度会促进免疫识别.如图7c所示,在10~45 ℃范围内的孵育温度会引起上清液荧光强度的变化,实验表明37 ℃时荧光信号最强.因此,竞争免疫反应的最佳孵育温度为37 ℃.
竞争免疫反应的孵育时间对上清液荧光强度的影响如图7d所示,当孵育时间小于3 h时,荧光强度随孵育时间的增加而增加,然后随着时间的推移趋于稳定.由图可发现免疫竞争反应时间也不是越长越好,反应时间太长反而会使荧光强度受损,3 h的孵育时间可以保证免疫反应的平衡,因此选择3 h作为最佳孵育时间.
2.5 磁性荧光免疫纳米复合探针检测IgG的性能
图8为加入不同浓度人免疫球蛋白G(IgG)后体系荧光光谱的变化(图8a)和IgG响应的线性曲线(图8b).在发射波长为517 nm时记录各样品的荧光信号,从图8a可以看到,当IgG的浓度逐渐增大时,检测体系的荧光强度也随之增强,这表明该探针对IgG的浓度变化具有很好的响应.从图8b可以看到,IgG的浓度变化与检测体系相对荧光强度变化值呈良好的线性关系,IgG检测的线性范围为0.06~146 nmol·L-1,检测限为0.02 nmol·L-1(S/N=3),相关系数为0.999 7.
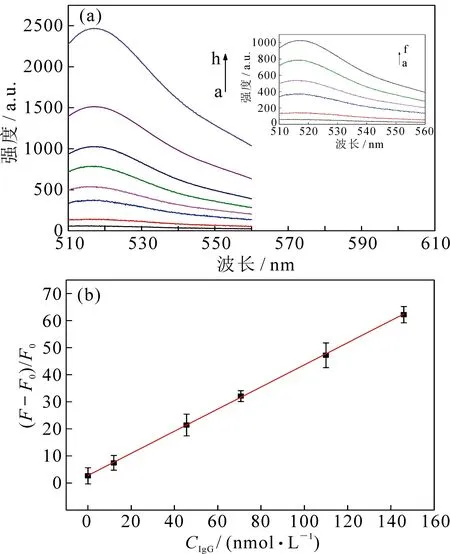
图8 (a)加入不同浓度IgG时荧光强度变化图(IgG浓度从曲线a到曲线f依次为0.06,12.00,45.60,70.70,110.00和146.00 nmol·L-1),(b)相对荧光强度变化值与IgG浓度线性关系
免疫球蛋白(Ig)是一组具有抗体活性的蛋白质,主要存在于生物体血液、组织液和外分泌液中,是检查机体体液免疫功能的一项重要指标.免疫球蛋白三项指血清免疫球蛋白G(IgG)、免疫球蛋白A(IgA)和免疫球蛋白M(IgM).用IgA和IgM来测试磁性荧光复合免疫探针的选择性,评估其抗干扰能力.如图9所示,只有IgG能明显地引起荧光变化,IgA和IgM没有明显的干扰.结果表明该方法对IgG检测具有良好的选择性,能够将复杂样品中的IgG与其类似物区分开,归因于抗原-抗体免疫反应的高特异性和磁性分离纯化.

图9 干扰物IgM(240.0 nmol·L-1)和 IgA(240.0 nmol·L-1)对IgG(240.0 nmol·L-1) 检测的影响
2.6 实际样品检测
正常人血清中免疫球蛋白G含量在53.33~106.67 μmol·L-1[23].将人血清离心处理(4 000 r·min-1),用0.01 mol·L-1的PBS缓冲溶液稀释1 000倍,与磁性荧光免疫纳米复合探针在37 ℃下振荡反应3 h,磁分离,分别收集上清液进行检测.用该探针测得3个血清样品中人IgG的浓度分别为50.30,84.23和 61.60 μmol·L-1.另外,采用标准加入法对该探针的可靠性进行评估,检测结果见表1,测得加标回收率为92.3%~95.6%.将各血清样品在1个工作日内重复分析3次,相对标准偏差为0.8%~2.2%.综上说明该磁性荧光复合免疫探针可以用于血清中IgG的检测.

表1 实际样品中人免疫球蛋白G(IgG)的测定
3 结论
1)利用一种对人免疫球蛋白G(IgG)具有高亲和力的天然肽链——蛋白G,解决了磁性材料与IgG的非特异性位点结合,影响抗体的靶向效率.
2)在磁性纳米团簇上定向连接抗体,制备了一种磁性荧光免疫纳米复合探针,并利用此探针与目标物IgG的竞争免疫反应建立简单、灵敏、快速检测IgG的新方法.探针制备方法简单,能够进行磁操控,不涉及复杂的化学过程,并且对目标物具有高特异性和敏感性,能够用于人血清中IgG的检测.
3)该复合免疫探针通过改变相应的抗原和抗体即可设计其他纳米复合免疫探针,具有一定的通用性.此探针的制备及检测方法为构建荧光免疫分析方法开辟了新路径,有望推进其在生物科学、药学和临床诊断等领域的应用.
