真实世界中利妥昔单抗生物类似药HLX-01治疗惰性B细胞淋巴瘤的有效性和安全性
2023-09-19张明智张旭东朱利楠冯晓燕丁梦杰武晓龙陈清江
董 萌,张明智,张旭东,朱利楠,冯晓燕,丁梦杰,武晓龙,陈清江
郑州大学第一附属医院肿瘤科 郑州 450052
B细胞非霍奇金淋巴瘤(B-cell non-Hodgkin′s lymphoma,B-NHL)约占非霍奇金淋巴瘤的85%[1],包括侵袭性B细胞淋巴瘤(aB-NHL)和惰性B细胞淋巴瘤(iB-NHL)。利妥昔单抗(rituximab)作为B-NHL的单克隆靶向药物,1997年、2006年分别被美国食品和药物管理局批准用于iB-NHL和 aB-NHL的治疗。然而,利妥昔单抗原研药昂贵的价格降低了其临床可及性。2019年利妥昔单抗生物类似药HLX-01被中国国家药品监督管理局批准上市,用于治疗滤泡淋巴瘤(follicular lymphoma,FL)和弥漫大B细胞淋巴瘤。Shi等[2]的研究表明 HLX-01与原研药在安全性、耐受性、药代动力学及药效学方面具有良好的一致性。另一项多中心前瞻性研究(HLX01NHL03)[3]表明HLX-01治疗弥漫大B细胞淋巴瘤时在安全性、有效性方面表现出与原研药一致的生物等效性。
根据我国《生物类似药临床应用专家共识》[4]中的“外推法”原则,来自HLX01NHL03研究的数据支持HLX-01外推至iB-NHL。“外推法”要求,外推适应证的有效性、安全性需要被评估。因此,本研究旨在探讨真实世界中HLX-01治疗iB-HNL的有效性和安全性。
1 对象与方法
1.1 研究对象收集2019年9月至2021年5月河南省淋巴瘤诊疗中心(郑州大学第一附属医院肿瘤科)收治的初治iB-NHL病例。纳入标准:①病理诊断明确、CD20阳性的iB-NHL患者,并且接受至少1个周期以利妥昔单抗为基础的治疗。②初次诊断,此前未接受过除手术外的其他抗肿瘤治疗。③未患有第二肿瘤。排除3b级滤泡淋巴瘤、转化淋巴瘤、除惰性套细胞淋巴瘤(indolent mantle cell lymphoma,iMCL)以外的其他套细胞淋巴瘤。最终纳入109例,其中1~3a级FL 42例、小淋巴细胞淋巴瘤/慢性淋巴细胞白血病(small lymphocytic lymphoma/chronic lymphocytic leukemia,SLL/CLL)3例、淋巴浆细胞淋巴瘤(lymphocytic lymphoma,LPL)5例、边缘区淋巴瘤(marginal zone lymphoma,MZL)52例、iMCL 7例。本研究征得患者知情同意,并得到该院伦理机构审查委员会的批准。
1.2 治疗方法109例中,接受利妥昔单抗治疗39例(R组),HLX-01治疗70例(H组)。治疗方案包括R/H、R/H-CHOP样方案、R/H+苯达莫司汀、R/H+来那度胺、R/H-GDP、R/H+BTK抑制剂±苯达莫司汀。治疗方案均按照标准剂量应用药物。治疗周期数根据疾病临床分期、治疗敏感性以及耐受性有所不同,诱导治疗有效的情况下常规进行4~6个周期的治疗。
1.3 临床资料从电子病历中收集资料,包括年龄、性别、B症状、临床分期、东部肿瘤协作组(Eastern Cooperative Oncology Group performance status,ECOG)评分,治疗前血清乳酸脱氢酶(lactate dehydrogenase,LDH)、β2微球蛋白水平。
1.4 疗效评价诱导治疗期每2个周期进行一次疗效评价,维持治疗期每2~3个月进行一次疗效评价,直至死亡或随访结束。按Lugano2014标准评价疗效,疗效分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)及疾病进展(progression disease,PD,包括任何复发或任何原因的死亡)。以(CR+PR)计算客观缓解率(objective response rate,ORR),以(CR+PR+SD)计算疾病控制率(disease control rate,DCR)。
1.5 安全性评价评估两组一线治疗4个周期中的不良反应,多次出现同一不良反应按最严重不良反应记录。根据美国国家癌症中心不良反应评价标准对3.0不良事件进行评估和记录,包括血液学毒性(白细胞减少、中性粒细胞减少、贫血和血小板减少)和非血液学毒性(转氨酶升高、呕吐、乏力、感染)不良事件。
1.6 随访所有病例从一线治疗开始随访,截止日期为2021年10月31日。无进展生存期(progression-free survival,PFS)指一线治疗开始到PD的时间。总生存期(overall survival,OS)指从一线治疗开始到因任何原因死亡的时间。缓解持续时间(duration of response,DOR)为从第一次判断为CR或PR进展到PD的时间。治疗持续时间(duration of therapy,DOT)为从治疗开始药物治疗持续的时间。
1.7 统计学处理采用GraphPad Prism 9.0和SPSS 25.0进行数据分析。采用χ2检验或精确概率法对不同分组患者的临床资料、ORR、DCR进行比较,使用Mann-WhitneyU检验对DOR、DOT、近期疗效进行比较。采用Kaplan-Meier法绘制生存曲线并进行Log-rank检验。检验水准α=0.05。
2 结果
2.1 R组和H组一般临床特征的比较见表1。
2.2 两组近期疗效的比较所有患者均完成2个周期的一线治疗。两组近期疗效差异无统计学意义,见表2。R、H组ORR分别为84.6%、80.0%,差异无统计学意义(χ2=0.356,P=0.551);DCR分别为97.4%、94.3%,差异亦无统计学意义(P=0.653)。

表2 两组近期疗效的比较 例

表1 R组和H组一般临床特征的比较 例(%)
2.3 两组DOR和DOT的比较7例(R组1例,H组6例)因疾病持续进展无法计算DOR,最终R组38例、H组64例进行了DOR分析。109例均进行了DOT分析。两组DOR和DOT的比较见表3。

表3 两组DOR和DOT的比较 月
2.4 安全性R组和H组输注前均给予常规预防措施,R组和H组各1例(2.6%和1.4%)在首次输注时发生输液不良反应,经应用糖皮质激素、抗组胺药物等对症处理后症状好转。
血液学不良事件:两组所有级别血液学不良事件及3级以上不良事件发生率差异无统计学意义(表4)。
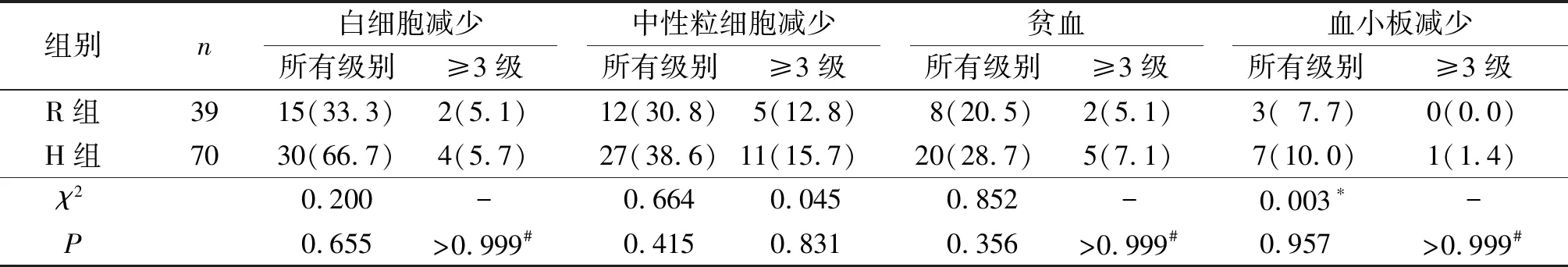
表4 两组治疗相关血液学不良事件发生情况 例(%)
非血液学不良事件:主要的非血液学不良事件为细菌感染、转氨酶升高、低蛋白血症、呕吐。两组非血液学不良事件发生率差异无统计学意义(表5)。R组和H组治疗前分别有6例和7例有慢性乙肝病史,HBV病毒复制量在正常范围,治疗期间常规抗病毒治疗;治疗后分别有3例和4例发生病毒复制量增加。
2.5 生存分析入组患者无失访,R组随访17.4(6.1~24.0)个月,H组11.8(2.4~24.0)个月。两组的Kaplan-Meier生存曲线见图1 。两组OS、PFS生存曲线差异无统计学意义(χ2=0.138,P=0.711;χ2=1.189,P=0.276)。

图1 两组生存曲线
3 讨论
2019年利妥昔单抗生物类似药HLX-01被批准用于治疗FL和弥漫大B细胞淋巴瘤,也被用于治疗iB-NHL[4]。然而,关于HLX-01治疗iB-NHL的真实世界数据仍鲜有报道。本研究表明: HLX01是iB-NHL靶向治疗选择之一,有效性和安全性良好,经济负担小,可及性强。
研究表明,利妥昔单抗原研药与生物类似药治疗弥漫大B细胞淋巴瘤的ORR分别为85%和84%[5],治疗FL的ORR分别在70.7%~92.6%和75.5%~97.0%之间[6-11],含有利妥昔单抗的方案治疗MZL的ORR在90%左右[10,12]。本研究中两组ORR相近,数据略低于上述报道,可能与评估时间短、部分病例仍在治疗过程中有关。有研究[9]报道,利妥昔单抗原研药与生物类似药一线治疗FL的DOR类似;真实世界中,即使在疾病进展后仍可继续使用利妥昔单抗。本研究中两组DOR、DOT也极其相近,进一步说明HLX-01和利妥昔单抗具有一致的有效性。
研究[6,13]表明利妥昔单抗原研药及其生物类似药治疗FL的2 a总生存率在89%~93%。本研究中2 a总生存概率分别为79%(R组)、78%(H组),低于报道,可能与多数患者复发难治、多线多周期治疗,预后差有关。生物类似药GP2013和利妥昔单抗治疗初治晚期FL的2 a无进展生存率分别为70%和76%[6]。本研究中2 a无进展生存概率分别为70%和82%,与上述研究结果相近。
本研究中R组和H组输液相关不良反应发生率分别为2.6%、1.4%,低于相关报道[7-9,14-15]。两组所有级别和3级以上血液学不良事件发生率和非血液学不良事件发生率差异无统计学意义,均在安全可控范围内,未发生新的不良事件及致死性事件。
综上所述,利妥昔单抗生物类似药HLX-01治疗iB-NHL在有效性和安全性方面与利妥昔单抗原研药效果一致。由于本研究为单中心回顾性研究,随访时间较短,因此今后将延长随访时间,进一步比较HLX-01与利妥昔单抗原研药在相关疾病治疗方面的效果。
