聚乙烯微塑料暴露对辣椒生长及产量的影响
2023-09-18杨国梅李娟龙健廖洪凯冉泰山赵雨鑫
杨国梅,李娟,龙健,廖洪凯,冉泰山,赵雨鑫
(1.贵州师范大学贵州省山地环境信息系统与生态环境保护重点实验室,贵阳550001;2.贵州师范大学地理与环境科学学院,贵阳550001)
微塑料是一种新兴有机污染物,其普遍存在于农田、河流、海洋甚至极地地区[1]。目前,针对微塑料的研究主要集中在海洋系统中,陆地系统中微塑料的研究相对较少。事实上,每年人类排放至陆地上的微塑料比海洋高4~23倍[2]。农田土壤中微塑料的来源,一方面是其他环境中的微塑料纤维、薄膜等以污水灌溉、污泥还田、有机肥等形式进入[3-5];另一方面是残留的大块农用地膜经过物理、化学和生物作用裂解、破碎形成[6]。土壤中的微塑料影响了土壤容重[7]、水力特征及电导率等理化性质[8],进而对植物的生长[9]、光合色素含量[10]及产量[11]等产生影响。
微塑料对植物的影响与其种类、形态特征、粒径和浓度有关,其通过影响植物种子空隙、水分和养分的吸收进而对作物生长产生影响[12]。研究表明,低密度聚乙烯能抑制小麦种子的发芽与幼苗生长[9];其他研究也指出高浓度(5%)的聚乙烯微塑料(PEMPs)降低了西红柿与辣椒种子的活性,并对其种子发芽、芽长与根长的生长均有抑制作用[13]。同时,微塑料对植物的光合色素含量也有一定的影响。如聚苯乙烯纳米塑料(PS-NPs)显著降低了大蒜叶片叶绿素含量,且较高浓度(100 mg·L-1)的PS-NPs 能影响大蒜叶片的营养品质[10]。此外,微塑料亦能影响作物的养分含量。研究发现大豆各器官中碳、氮、磷含量基本随聚乙烯农膜残片浓度的增加而增加[14]。微塑料也将通过影响作物的生长进而影响其产量,研究发现聚丙烯微塑料(PP-MPs)能显著降低樱桃萝卜(Raphanus sativusL. var.radculus pers)的产量[11]。综上,微塑料能够显著影响作物生长、光合色素含量等,其影响程度与微塑料种类和浓度密切相关。聚乙烯是农用地膜的主要成分[15],其在贵州等30 个省市的农田土壤微塑料中检出比高达80%[16]。但目前对于不同浓度的PE-MPs 对农作物不同生长时期的生长状况、光合色素、养分指标及产量的研究还较少,需进一步探究。
辣椒是我国种植面积最大的蔬菜和消费量最大的辛辣调味品[17],同时也是世界上最重要的蔬菜作物之一,其使用量在全球范围内逐年升高[18]。辣椒质量与人们的健康息息相关。鉴于此,本研究选择辣椒为供试植物,研究不同浓度的PE-MPs 对辣椒不同生长阶段的生长状况、光合色素含量、植株中养分含量以及辣椒产量的影响,旨在讨论PE-MPs 对蔬菜作物辣椒的生态毒性,为微塑料污染治理提供依据。
1 材料与方法
1.1 供试材料
土壤选择贵州省贵阳市花溪区田园路(26°21′56″N,106°39′44″E)郊区未使用过地膜覆盖和再生水灌溉(尽量避免多余塑料污染)的耕地进行采样,土壤类型为棕色石灰土。采集深度为0~20 cm,处理后过2 mm 筛网备用。辣椒(Capsicum annuumL.)品种为“贵辣21 号”购自贵研农业公司。实验使用的PEMPs 购自于中国丰泰塑化公司,其外观为规则球状。供试土壤基本理化性质:pH 为7.51,有机碳(SOC)为26.06 g·kg-1,全磷(TP)为0.83 g·kg-1,速效磷(AP)为14.16 mg·kg-1,硝态氮为4.48 mg·kg-1,铵态氮为2.88 mg·kg-1。
1.2 盆栽实验
第一步:将采集的土壤去除树枝、杂草与石子等杂质后进行自然风干,磨细过2 mm 筛;第二步:处理后的土壤每盆称取2 kg 备用(先称取400 g 土壤和有机肥与PE-MPs 混合均匀,再分两次分别加入800 g土壤,使其与先前处理的土壤充分混合均匀);第三步:提前一周将盆栽土壤浇水(超纯水),第一次浇水确保将土壤浇透,后期每日根据土壤湿度进行适当浇水;第四步:选取颗粒饱满均匀、没有损坏的辣椒种子,放于培养皿进行催芽,待种子发芽完全后,挑选发芽一致的辣椒幼苗移栽至已处理过的盆栽盆(内径19 cm,高15 cm),前期每盆种植6 株,定植后每盆留2~3 株,开花后每盆留1 株;第五步:定期观察并浇水施肥(采样一个月内不进行施肥),于幼苗期(移栽时)、开花期、结果期对辣椒植株进行破坏性采样,用于植物各指标的测定。
1.3 试验设计
试验在贵州师范大学贵州省山地环境重点实验室进行,PE-MPs 粒径选择蔬菜土壤中常见的0.2 mm,浓度参考我国西南地区微塑料含量情况[19]。外源添加的PE-MPs 浓度设置为0、50、500、2 500 mg·kg-1,标记为CK、M1、M2 与M3;每个浓度设置3 个重复,共12 个样。每日观测,根据土壤湿度与辣椒生长周期进行浇水并施肥(种植前每盆施用有机肥0.2 g,幼苗期时施用1‰的尿素,开花期后施用1‰磷酸二氢钾;每盆每日浇水15 mL;各处理施肥、浇水量一致,采样前一个月内不进行施肥),在幼苗期(定植时,约50 d)、开花期(约40 d)、结果期(约45 d)分别对辣椒植株进行破坏性采样并对相关指标进行测定。
1.4 测定方法
在辣椒生长的三个阶段对植株进行破坏性采样,先用自来水洗净附着于植株表面的微塑料和土壤,然后用蒸馏水冲洗干净,最后用吸水纸擦干植株表面的水分,用于辣椒植株各项指标的测定。
使用直尺(精确到0.1 cm)测量辣椒的株高、根长;使用天平(精确到0.000 1 g)称量鲜质量后,将其置于105 ℃的烘箱中杀青30 min,然后降温至70 ℃烘干至质量恒定,称其干质量。
将烘干的植物样磨碎,混匀,过0.25 mm 筛备用;其中植物中全碳、全氮使用Elementar 元素分析仪测定,植株中磷的含量采用H2SO4-H2O2消煮,钼锑抗吸光光度法测定。
取新鲜干净的辣椒叶片,去掉中脉,剪碎,混匀,称取剪碎的新鲜样品0.20 g,乙醇提取,用紫外分光光度计分别在波长665 nm(叶绿素a)、649 nm(叶绿素b)、470 nm(类胡萝卜素)下测定吸光度后进行计算[20];
辣椒植株第一次结果,果实使用天平(精确到0.000 1 g)称量其总鲜质量作为辣椒产量。
1.5 数据处理与分析
试验测定的指标均以平均值±标准偏差(Mean±SD)表示,数据的差异显著性通过软件SPSS 26.0用单因素方差分析(One-way ANOVA)中的Duncan 多重比较检验法,图通过Origin 2021软件制作。
2 结果与分析
2.1 PE-MPs对辣椒生长状况的影响
图1 为不同浓度的PE-MPs 处理下辣椒幼苗期、开花期与结果期的鲜质量、干质量、株高与根长的变化情况。幼苗期、开花期与结果期三个阶段辣椒植株干质量与空白相比均无显著性差异,即PE-MPs 对辣椒植株干质量无显著性影响(图1A)。辣椒幼苗期,3个浓度的PE-MPs 处理对其鲜质量均有促进作用,但其促进效果不显著(图1B);开花期,三个浓度的PEMPs 均抑制了辣椒鲜质量,2 500 mg·kg-1PE-MPs 处理下抑制作用最强,与空白相比减少15.99%;结果期,2 500 mg·kg-1PE-MPs 处理下对其鲜质量有促进作用,其余处理均呈现抑制作用。可见,PE-MPs 对辣椒鲜质量表现出显著影响(P<0.05),对干质量未见显著影响。
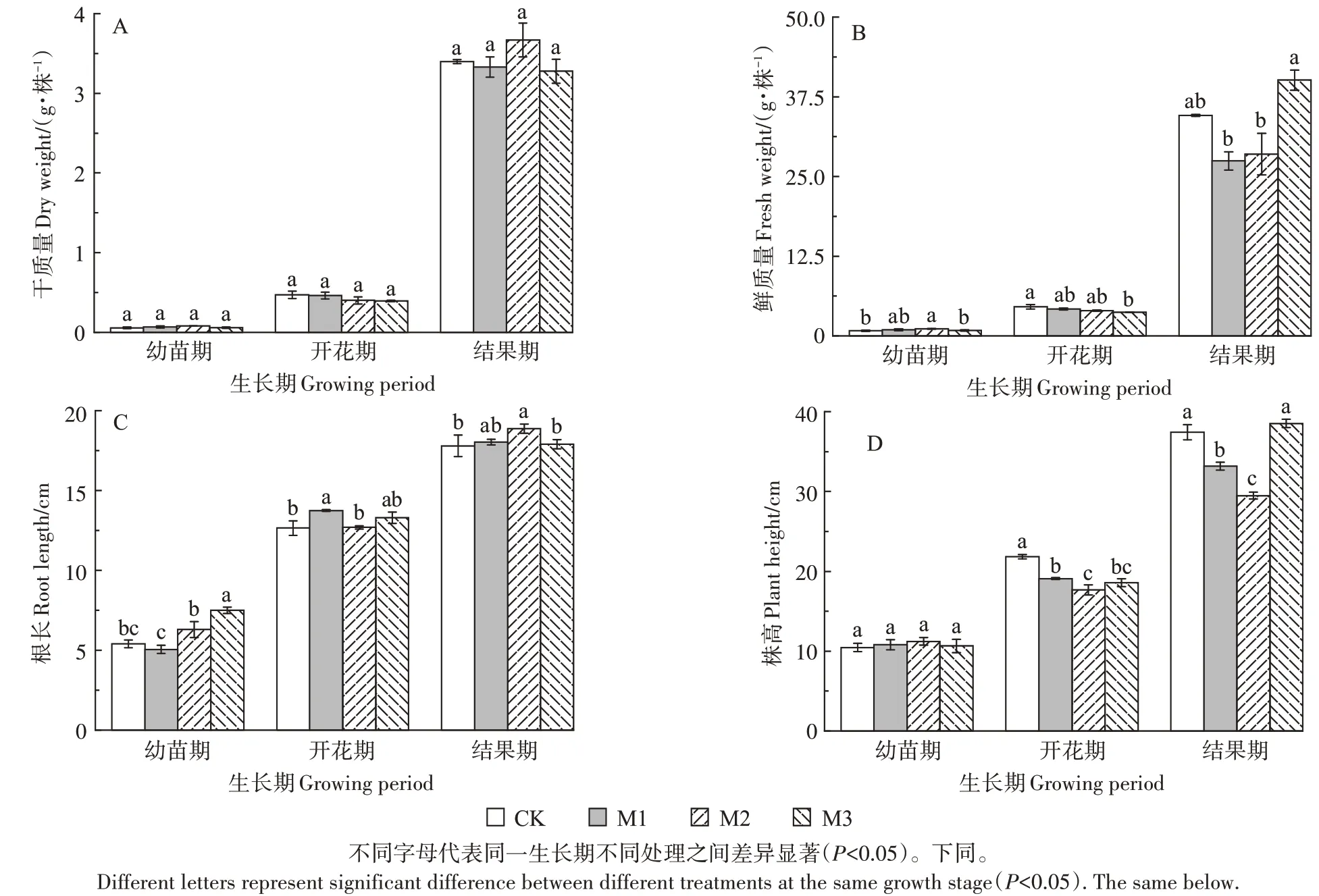
图1 PE-MPs添加对辣椒鲜质量、干质量、株高与根长的影响Figure 1 Effects of microplastics addition on fresh weight,dry weight,plant height and root length of pepper
幼苗期,PE-MPs 处理促进了辣椒根长,而对其株高则无显著性影响(图1C、图1D);开花期,3 个处理下其根长与空白相比均有增加,50 mg·kg-1的PEMPs 处理下其根长最长,与空白相比增加了8.7%;而株高在3 个处理下均比空白小,500 mg·kg-1的PEMPs 处理下其株高最小,与空白相比株高减少了19.07%;结果期,50、500 mg·kg-1PE-MPs 处理下都促进了根长的生长,2 500 mg·kg-1PE-MPs 处理下与空白处理相比未见显著性差异,但3 个浓度的PE-MPs处理均能抑制株高的生长;其中,500 mg·kg-1PE-MPs处理下其株高最小,抑制作用最强,与空白相比减少了21.19%。
2.2 PE-MPs对辣椒各生长阶段光合色素含量的影响
图2 为辣椒植株幼苗期、开花期与结果期叶片的光合色素含量变化情况。幼苗期,仅当PE-MPs 浓度为50 mg·kg-1时,抑制了光合色素的合成,其余处理均有促进作用,且PE-MPs 浓度越高对光合色素的促进作用越强;开花期,PE-MPs 浓度为2 500 mg·kg-1时,对叶绿素a、叶绿素b 与叶绿素总量有促进作用,其余处理下未见显著性影响,类胡萝卜素在3 个处理下均未见显著性影响;结果期,3 个处理下均抑制了叶绿素a、叶绿素b与叶绿素总量;类胡萝卜素含量与空白相比均体现出促进作用,PE-MPs 浓度为500 mg·kg-1时促进作用最强,与空白相比增加了37.19%。
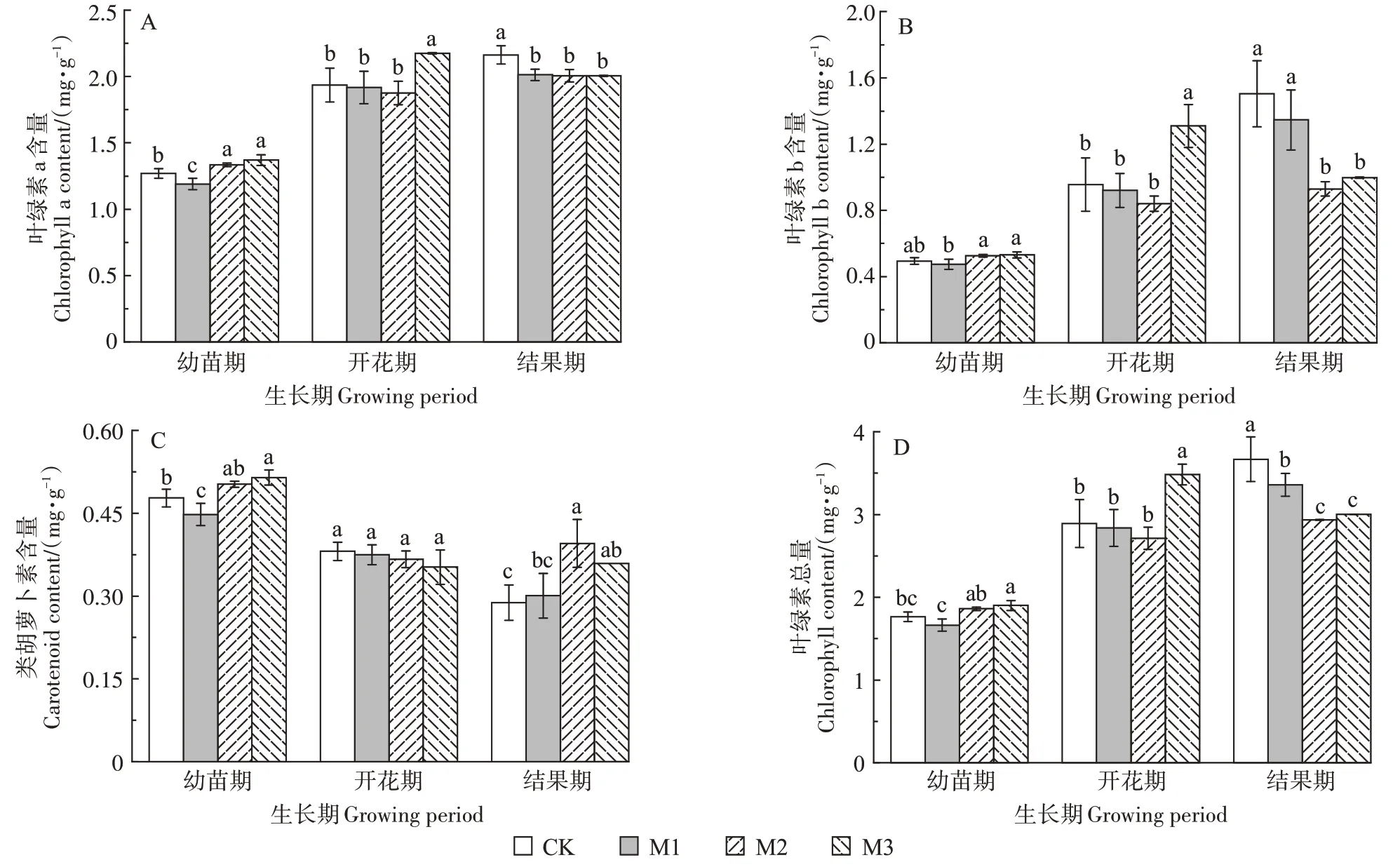
图2 PE-MPs添加对辣椒叶片光合色素的影响Figure 2 Effects of polyethylene microplastics on photosynthetic pigments in pepper leaves
2.3 PE-MPs对辣椒植株养分含量的影响
图3 为不同浓度的PE-MPs 对幼苗期、开花期与结果期辣椒植株养分含量(碳、氮、磷)影响的变化情况。幼苗期,500 mg·kg-1的PE-MPs 处理,辣椒植株碳含量与空白相比有所减少,但其余处理对植株碳含量有促进作用;2 500 mg·kg-1的PE-MPs处理,氮含量无显著性影响,其余处理则有促进作用;50 mg·kg-1的PE-MPs 处理,磷含量与空白相比有所增加,其余处理无显著性影响。开花期,3 个处理下均能促进其碳含量;只PE-MPs 浓度为50 mg·kg-1,氮含量比空白处理时降低,其余处理均表现出促进作用;磷含量与空白相比均表现出抑制作用,随PE-MPs 浓度的增加,抑制作用呈先增后减的趋势。结果期,浓度为50 mg·kg-1时抑制碳的形成,其余处理则促进碳的形成,其促进作用随PE-MPs 浓度的增加而增强,最多比空白增加4.15%;2 500 mg·kg-1的PE-MPs 处理能促进氮含量,其余处理则有抑制作用,50 mg·kg-1的PE-MPs处理其抑制作用最强,与空白相比减少了7.26%,磷含量与空白相比均体现出抑制作用,且随PE-MPs 浓度的增加抑制作用逐渐增强,最少比空白减少21.16%。
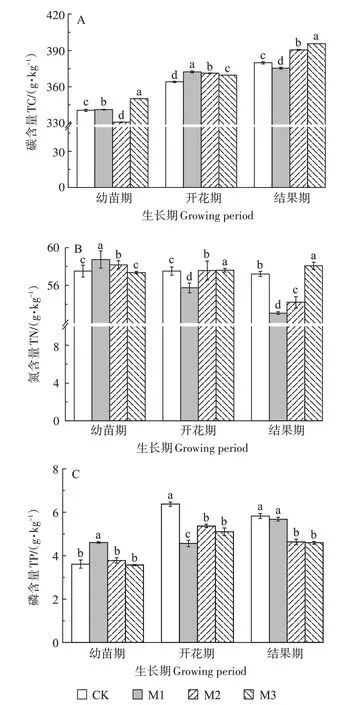
图3 PE-MPs添加对辣椒植株养分含量的影响Figure 3 Effects of polyethylene microplastics on nutrient content of pepper
2.4 PE-MPs对辣椒产量的影响
图4 为不同浓度的PE-MPs处理下辣椒初期果实鲜质量的变化情况。与空白相比,50、500 mg·kg-1浓度的PE-MPs 处理都显著降低了辣椒产量,平均每株辣椒的产量与空白相比最多减少了42.86%;浓度为2 500 mg·kg-1处理时亦有降低趋势,但其影响未达到显著。

图4 PE-MPs添加对辣椒产量的影响Figure 4 Effects of polyethylene microplastics on pepper yield
3 讨论
3.1 辣椒生长对PE-MPs的响应
植物的鲜质量、干质量、株高与根长是植物生长状况的直接体现,同时也是植物生长的重要指标。本研究中,不同浓度PE-MPs 对辣椒幼苗期的鲜质量(图1B)表现出促进作用,生长后期则为抑制作用。可能是作物生长前期主要依靠种子提供自身生长所需的营养物质,对外界环境不敏感[21];而作物生长后期则可能是PE-MPs 包裹在辣椒地下部的表面,阻塞作物的细胞壁空隙进而阻碍了其水分和养分的吸收和转运[22]。本实验PE-MPs 对辣椒植株的干质量(图1A)未见显著影响,PE-MPs 对辣椒鲜质量影响大于其干质量的影响;这可能与作物对水分的利用有一定的关系。Lozano等[8]通过土培试验也证实了微塑料能影响土壤环境,从而改变植物的根际环境,进而减少了植物对水分的吸收。本实验发现PE-MPs 能促进辣椒根长的生长(图1C),而对辣椒株高则呈现出抑制作用(图1D)。相关研究也发现了适量微塑料的存在可以促进根系的生长[23]。可能是因为微塑料的存在降低了土壤容重,导致土壤大孔隙和通气量增加,从而促进根系生长[24]。在另外的报道中,大块薄膜和塑料降解过程中产生的聚乙烯醇类物质,都能抑制辣椒根系的生长[25],这与本实验的结果不同。可能是本实验中的PE-MPs 粒径较小,并不会阻碍根系的延伸。但本实验中的结果与PE-MPs 降解的关系还需进一步探究。本研究发现微塑料对辣椒植株株高的生长有抑制作用。相关研究中,也发现PE-MPs 能抑制西红柿与辣椒幼苗的茎长[13],原因可能是微塑料进入到土壤中,降低土壤对水分的利用效率,进而影响了植物的生长[26]。本实验中辣椒生长后期中浓度比高浓度的PE-MPs 对株高的抑制作用更强。这可能是由于高浓度的PE-MPs 在土壤中不断团聚后,团聚体直径增大[27],降低了与辣椒根系的接触,相对来说减轻了对辣椒株高的抑制作用。
3.2 辣椒叶片光合色素对PE-MPs的响应
光合作用是植物生长重要的生理过程,其合成的有机物为植物生长提供能量,光合作用的强弱与光合色素的多少密切相关[28]。本研究中,随着辣椒植株的生长,叶片叶绿素a、叶绿素b与总量逐渐增加。可能是辣椒生长的过程中,叶片逐渐成熟导致叶绿素含量逐渐增加。同时,本实验发现:幼苗期,PE-MPs 对其叶片光合色素含量表现出低浓度抑制高浓度促进。可能是高浓度的PE-MPs 在土壤环境中不断团聚,而后直径增大[27],降低了与辣椒根系的接触,从而减轻了对光合色素含量的影响。相关研究发现随着微塑料胁迫提升,将产生浓度聚集效应,减少其吸附于根系表面的量[29]。然而本研究中开花期时,PE-MPs 对叶片光合色素含量无显著影响,只在浓度为2 500 mg·kg-1时对叶绿素a、叶绿素b 和总量有促进作用,结果期只对类胡萝卜素含量有促进作用,其余叶绿素含量均有抑制作用。相关研究指出微塑料在土壤中降低了植物对水分的利用效率,进而使植物的蒸腾作用减弱[24],从而降低光合色素含量;同时,微塑料对氮、磷与钾离子有吸附作用,导致植物体内的离子失衡[30],进而抑制了植物叶绿素的合成;此外,相关研究中指出PE-MPs能降低莴苣[31]的光合速率、气孔导度、瞬时蒸腾速率、荧光参数等,这也可能是植株叶绿素合成减少的原因[32]。也有研究指出微塑料通过堵塞植物的毛孔进而影响光合色素含量[33],但目前认为进入植物体内的微塑料颗粒为≤2 µm,此外,叶绿素的合成也是多种酶参与的复杂过程[34]。因此本实验PE-MPs对光合色素含量的影响机制需进一步探究。
3.3 辣椒植株养分含量对PE-MPs的响应
碳、氮、磷是植物体内的主要元素,其含量是植物养分的主要指标,能客观反映植物的生长状况[35]。Romera 等[36]发现PE-MPs 在30 d 内向环境释放溶解性有机碳达8.9 µg·m-2。本研究发现,PE-MPs 对辣椒植株碳含量总体表现为促进作用(图3A),这可能是PE-MPs 可作为土壤中“碳源”的重要来源,进而被植物吸收,使植物碳含量增加。此外,也有研究表明微米塑料能够被小麦吸收[37],本研究中碳含量增加也可能是由于土壤中的微塑料经破碎、风化后形成粒径更小的颗粒,被植物吸收和积累。PE-MPs 对辣椒植株氮含量(图3B)的影响在幼苗期表现为促进作用,开花期与结果期高浓度(2 500 mg·kg-1)有促进作用,低浓度时(<2 500 mg·kg-1)则有抑制作用。可能是微塑料在土壤中影响了氮循环相关酶的活性和微生物基因,从而影响土壤中氮素含量。Qian 等[38]的研究中发现积累微塑料地膜的农田土壤硝态氮和铵态氮含量比对照土壤显著降低50.53%和17.7%。由于微塑料对氮素的循环有影响[39],土壤中的氮素含量降低,从而使植株中氮含量有所变化,加之高浓度的微塑料有团聚效应[27],导致了本研究中植株氮含量的变化趋势。另外,本研究中PE-MPs对磷含量(图3C)的影响在幼苗期未见显著性影响,开花期与结果期均有抑制作用,可能是微塑料通过影响植物光合作用进而影响了植株中磷含量,与结果期光合色素含量的变化趋势一致。李瑞杰等[33]也发现微塑料通过根系进入到植物体内,并转移到茎和叶中,通过影响植物的光合作用进而影响植物体内碳、氮、磷的含量。本实验辣椒植株碳、氮、磷含量在辣椒生长的不同阶段受影响不同,这可能与微塑料的粒径、浓度、种类以及植物类型、生长阶段、器官等有关,目前所见报道的关于微塑料对植物体内养分含量影响方面的文章还较少,其影响机制也不够完善,需继续深入研究。
3.4 辣椒产量对PE-MPs的响应
在微塑料对作物产量影响的研究中发现,PPMPs 降低大豆、花生的百粒质量以及樱桃萝卜的产量[13,40]。本实验的结果表明,在各个浓度的PE-MPs处理下,辣椒产量均有下降(图4)。在类似的研究中发现,微塑料可通过影响作物的水分利用效率进而影响其生长[26]。并且,研究发现微塑料的存在会降低小麦对氮素的利用效率,进而使小麦减产[41]。同时,相关研究指出辣椒产量与水分利用效率和氮素含量呈正相关关系[42],这在某种程度上解释了本研究结果。本研究发现中低浓度比高浓度的PE-MPs 对辣椒产量的抑制作用更显著。这可能是由于辣椒结果期,高浓度的PE-MPs 不断团聚后团聚体直径增大[27],降低了与辣椒根系的接触,相对来说减轻了PE-MPs 对辣椒养分吸收的阻碍,进而对辣椒产量的影响有所减弱。而目前所见报道的关于微塑料对作物产量影响方面的文章略少,相关机制也不够完善,还需进一步探究。
4 结论
(1)聚乙烯微塑料(PE-MPs)的添加,能促进辣椒根的生长,但对辣椒株高则有抑制作用;在幼苗期抑制了辣椒的鲜质量,而随着辣椒的生长,则有一定的促进作用,但对其干质量则未见显著影响。
(2)幼苗期,低浓度(50 mg·kg-1)的PE-MPs 能抑制光合色素的合成,而浓度在500 mg·kg-1以上则促进光合色素的合成,开花期时无显著影响,结果期PE-MPs促进了类胡萝卜素的合成,而对其余光合色素含量则有抑制作用。
(3)PE-MPs的添加,对辣椒植株中的碳含量有促进作用;幼苗期时使植株氮含量增加,而开花期与结果期浓度为50 mg·kg-1时对植株中氮含量有抑制作用,浓度为500 mg·kg-1以上时有促进作用;PE-MPs 对其幼苗期植株磷含量无显著性影响。
(4)PE-MPs 的添加,降低了辣椒的产量,其浓度为50 mg·kg-1时抑制作用最强,可使辣椒减产42.86%。因此,农业生产等活动中应尽量避免微塑料进入土壤环境。
