镉胁迫下福美双对小麦幼苗镉积累及生理特征的影响
2023-09-18高志新米禄琪刘烨潼李泊岩秦旭孙约兵
高志新,米禄琪,刘烨潼,李泊岩,秦旭,孙约兵
(1.农业农村部环境保护科研监测所,天津300191;2.东北农业大学资源与环境学院,哈尔滨150030;3.天津市农业科学院,天津300381;4.天津市农业生态环境监测与农产品质量检测中心,天津300193)
镉(Cd)是植物非必需的重金属元素,极易污染土壤和水源,并通过生物富集作用在植物体内积累,对植物的生长发育表现出很高的毒性,形态上表现为植株矮小和产量下降,生理上则会引起作物的光合能力下降以及氧化胁迫[1-2]。而含有过量Cd的作物被食用后容易对人体造成危害,严重威胁身体健康[3]。
小麦(Triticum aestivumL.)是世界三大粮食作物之一。国家统计局2022 年粮食产量数据的公告显示,我国是世界上最大的小麦生产国和消费国,年产量达1.38亿t。然而由于麦田Cd污染,我国小麦中Cd超标现象时有出现。Liu 等[4]在甘肃白银抽样调查中发现,部分地区春小麦籽粒中Cd 的平均含量高达1.88 mg·kg-1,是我国食品安全国家标准限量的17.81倍。在河南新乡部分麦田监测点位中,有近100%的冬小麦籽粒Cd 含量超标[5]。所以麦田Cd 污染问题需要引起重视。
小麦的Cd吸收行为受多种因素影响,如土壤理化性质、金属螯合剂、有机质、耕作方式及小麦品种等,其中土壤pH 是最重要因素[6]。Cd 通过根系进入小麦体内后,根系分泌物会改变根际土壤pH值,影响Cd有效态含量,改变小麦可吸收Cd的比例,根系分泌物还可与Cd2+形成络合物,从而影响小麦对Cd的吸收。小麦茎秆中的Cd 积累取决于Cd 从根系向地上部的转运,籽粒中Cd的积累取决于根向茎的转移和茎中木质部到韧皮部的运输[7]。韧皮部中蒸腾作用和木质部运输的改变会导致Cd 累积的变化,所以Cd 可以通过韧皮部和蒸腾作用在小麦植株内进行再分配[8]。
种植小麦需要喷施多种农药来保障其顺利生长发育。福美双(又名二硫化四甲基秋兰姆,分子式C6H12N2S4)是麦田常用的广谱高效保护性杀菌剂,被广泛用于防治条锈病、赤霉病和纹枯病等各种小麦病害[9-10]。福美双主要作用于病菌呼吸系统中的乙酰辅酶A,使其失去活性,并抑制线粒体呼吸作用,最终影响能量代谢。也可以作用于其他辅酶,抑制丙酮酸脱氢酶等多种酶的活性,从而影响病菌的正常生理代谢从而起到防治病害的作用[11]。另外,福美双在一定温度下可以释放出活性硫或含硫自由基,而硫(S)是植物第四大必需营养元素,不仅在含硫氨基酸和蛋白质的合成、光合作用、呼吸作用、脂类合成、生物固氮和糖代谢等生理生化过程中发挥重要作用[12],还在植物的生长发育和逆境生存中发挥重要作用[13]。
有研究显示,福美双可以与重金属Cd 产生一定的毒性协同作用,比如二者共存时可诱导酵母细胞线粒体发生突变,而二者单独存在时则无此现象[14]。另外Adamczyk-Szabela 等[15]的研究显示,福美双还可以影响植物对Cd 的吸收和积累。导致Cd 的转移系数和富集系数显著下降。这既与施用福美双改变了土壤菌群结构从而导致Cd 有效态含量变化有关,也和福美双可以与土壤中的Cd形成螯合物从而阻碍了植物吸收有关。另外,他们还发现施用福美双促进了蒲公英的生长并阻碍蒲公英对Cd等重金属的吸收和转运[16]。但施用福美双对小麦等粮食作物Cd吸收和Cd耐性的影响还未见相关报道。
本研究以冬小麦幼苗为供试材料,采用水培方法,探讨Cd 胁迫下福美双对小麦生理特性以及对Cd分配和积累的影响及其可能的作用机制,为研究施用农药这种常规农艺措施对Cd污染麦田安全生产的影响提供有益探索和理论支持。
1 材料与方法
1.1 材料
小麦品种:百农AK58,为市场常见冬小麦品种,购自河南省新乡市某农资商店。福美双制剂:50%可湿性粉剂(有效成分福美双占比为50%,其余为农药助剂),购自山东百农思达生物科技有限公司。Cd 标准溶液(1 000 mg·L-1,基体为0.1%HNO3)。
1.2 试验方法
实验采用双因素完全组合设计。第一个因素为营养液中Cd 浓度,添加量为0、0.1、0.5 mg·L-1和1.0 mg·L-1,分别记作Cd0、Cd0.1、Cd0.5和Cd1;第二个因素为福美双施药量,分别为不施药(记作F0)、低推荐剂量(800倍稀释液,记作F1)和高推荐剂量(400倍稀释液,记作F2)。共12 个处理:Cd0F0、Cd0.1F0、Cd0.5F0、Cd1F0、Cd0F1、Cd0.1F1、Cd0.5F1、Cd1F1、Cd0F2、Cd0.1F2、Cd0.5F2和Cd1F2,每个处理3次重复。
选取饱满一致的小麦种子用自来水清洗,用H2O2消毒30 min 后用去离子水冲洗3 遍,均匀置于育种盘上,再加入适量去离子水避光催芽,待发芽后去掉避光装置,在育种盘上生长一周左右移至Hoagland营养液中,不间断曝气。3 周后转移至日光温室内的2.5 L 水培盆中,每盆4 株苗,在幼苗拔节初期换无S营养液并进行Cd 处理,3 d 和10 d 后对小麦叶部各喷施一次福美双,喷施时水培装置需遮盖严密,防止药液落入营养液中对根系造成污染。末次喷施两周后采集植株样品进行测定。
1.3 测定指标
1.3.1 小麦叶片叶绿素含量和光合作用参数
叶绿素含量采用乙醇提取法,称取鲜样0.10 g,加入乙醇研磨过滤后,分别在波长665、649 nm 和470 nm 下比色测定,计算叶绿素含量;采用便携式光合仪(3051D,浙江托普云农),在采样之前控制光照条件下测定供试小麦叶片的光合速率、蒸腾速率、叶片气孔导度及胞间CO2浓度,每个处理设5次重复[17]。
1.3.2 抗氧化酶活性以及脂质过氧化参数
抗氧化酶活性以及脂质过氧化参数采用紫外可见分光光度法测定(UV-VIS,TU-1810PC,北京普析)。操作步骤为:样品经液氮研磨后加入4 ℃预冷的提取液,涡旋混匀,静置提取20 min 后4 ℃下离心。取一定体积的上清液,加入相应酶促反应试剂,反应一段时间后在相应的波长下测定反应液的吸光度,最后计算酶的活性或物质含量。测定波长:超氧化物歧化酶(SOD)为560 nm,过氧化物酶(POD)为470 nm,抗坏血酸过氧化物酶(APX)为290 nm,过氧化氢酶(CAT)为240 nm,过氧化氢(H2O2)为508 nm,丙二醛(MDA)为600、532 nm和450 nm。
1.3.3 重金属Cd含量
将小麦植株样品分为地上部和根部,依次用自来水和去离子水洗净,称量鲜质量,液氮冷冻后-80 ℃冰箱保存。称取1.00 g 鲜样,加入8 mL 浓H3NO4(优级纯),加盖浸泡12 h 后置于电热板消解。消解顺序为80 ℃加热1.5 h,120 ℃加热1.5 h,150 ℃加热3 h,之后打开塞子,升温至175 ℃赶酸至管内剩1 mL 左右,冷却后加水定容至50 mL,加盖摇匀并用滤纸过滤,用电感耦合等离子体质谱仪(ICP-MS,ICAPQc,赛默飞科技)测定Cd含量。
1.3.4 Cd的亚细胞含量测定
称3.00 g 粉碎鲜样置于50 mL 离心管,加入30 mL提取液[0.25 mol·L-1蔗糖+50 mmol·L-1Tris-HCl缓冲液(pH 7.5)+1.0 mmol·L-1二硫赤鲜糖醇] ,2 000 r·min-1下涡旋5 min,然后用80 µm 孔径的尼龙网布垫在漏斗里进行过滤,滤液接到冷冻离心专用管中进行下一步操作。残渣用超纯水少量多次冲至玻璃消煮管中,为细胞壁组分;滤液用高速冷冻离心机以4 ℃、11 900 r·min-1离心45 min,所得上清液为细胞可溶组分;所得沉淀用超纯水少量多次冲至玻璃消煮管中,为细胞器组分。所有组分烘干,冷却后消煮,ICP-MS测定[18]。
1.3.5 Cd的化学形态分析
共六种形态,依次是:乙醇提取态(FE)、去离子水提取态(FW)、氯化钠提取态(FNaCl)、醋酸提取态(FHAc)、盐酸提取态(FHCl)和残渣态(Fr)。提取液依次为FE,80%乙醇,提取以硝酸盐/亚硝酸盐、氯化物、氨基酚类镉为主的无机镉;FW,蒸馏水(d-H2O),提取有机酸中的水溶性镉;FNaCl,1 mol·L-1NaCl,提取果胶和蛋白质结合的Cd;FHAc,2%醋酸,提取未溶解磷酸镉,包括CdHPO4和Cd3(PO4)2;FHCl,0.6 mol·L-1HCl,提取草酸镉[19]。
具体步骤:称2.00 g 粉碎鲜样置于专用冷冻离心管,加入25 mL 相应的提取液,25 ℃下振荡12 h,并于20 000 r·min-1离心10 min,提取液移至50 mL 玻璃消煮管。再加25 mL提取液,25 ℃下振荡12 h,并于20 000 r·min-1离心10 min,提取液移至50 mL 玻璃消煮管(提取液共50 mL)。将提取液80 ℃下蒸干,145 ℃消煮。定容后用ICP-MS测定。
1.4 数据分析
所有数据采用Excel 2019 和SPSS 20.0 软件进行处理和统计分析,处理间比较采用单因素方差分析,Origin 2021 作图。利用营养液中Cd 浓度与小麦植株各部位Cd 浓度之比计算生物富集因子(BCF)和转运因子(TF)。
2 结果与分析
2.1 Cd胁迫下福美双对小麦幼苗Cd累积的影响
2.1.1 福美双对小麦幼苗体内Cd含量的影响
随着Cd 浓度的增加,小麦根系和地上部Cd 含量均呈增加趋势(图1)。喷施福美双后,各处理间小麦幼苗根部Cd 含量以及Cd 从营养液到根部的富集系数均无显著变化规律;但小麦地上部Cd 含量普遍增加,与不施药F0 相比,施药后在Cd0.1、Cd0.5 和Cd1处理中Cd 含量最大增幅分别为8.5%、61.1% 和73.8%,从营养液到地上部的富集系数以及从根到地上部的转运系数也都有不同程度的提高(表1),说明喷施福美双促进了小麦地上部对Cd的积累。另外还可以看出,营养液中Cd含量越高,喷施福美双后小麦地上部Cd含量增幅就越大。

表1 福美双处理对小麦中Cd转移系数的影响Table 1 Effects of thiram on the transfer coefficient of Cd in wheat
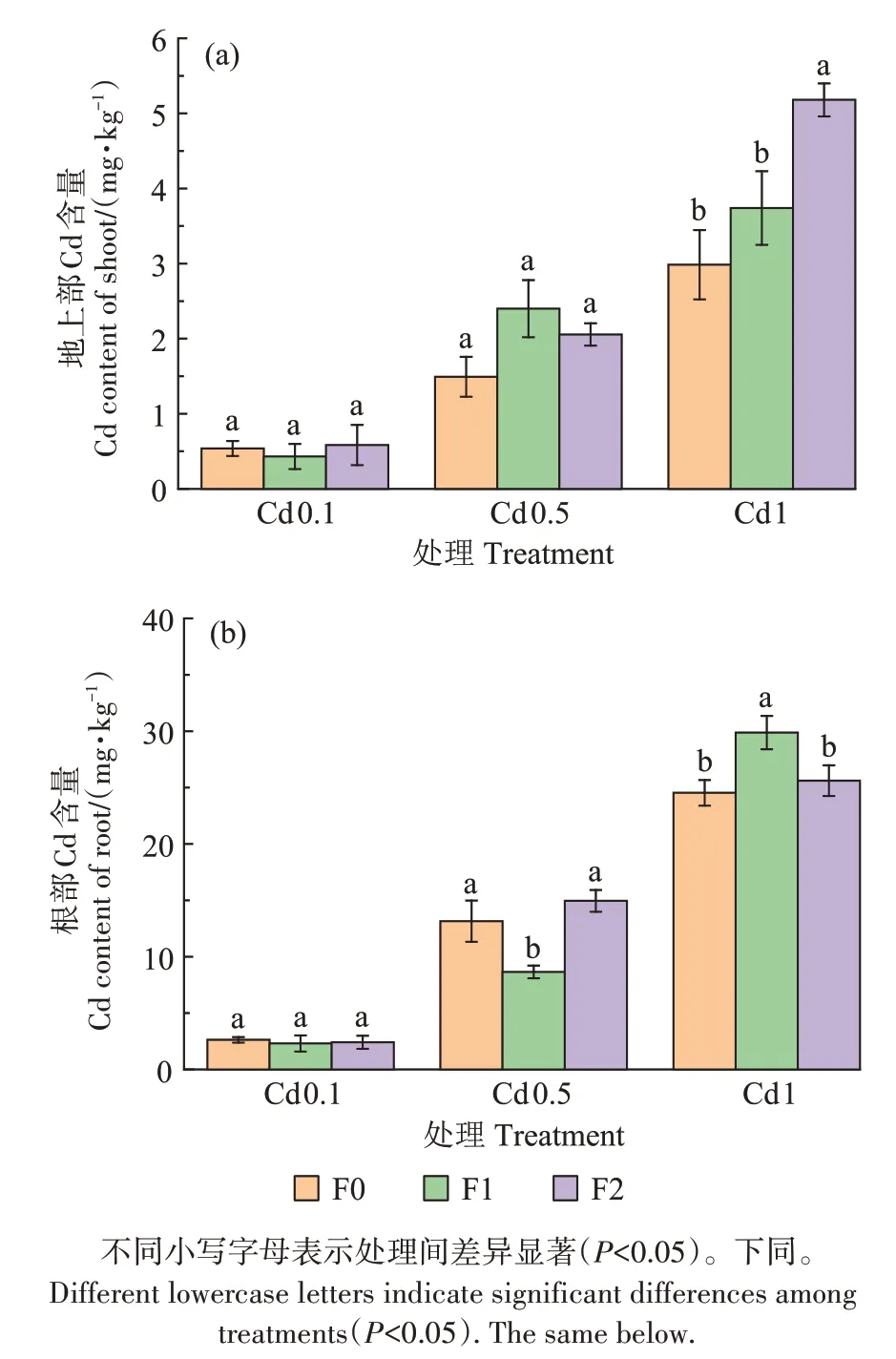
图1 福美双处理对Cd胁迫下小麦地上部和根部Cd含量的影响Figure 1 Effects of thiram on Cd content in shoot and root of wheat under Cd stress
研究结果显示喷施福美双后,小麦幼苗地上部S含量显著提高(图2),表明福美双为小麦补充了S 元素,小麦幼苗地上部S含量与福美双的施药剂量和Cd含量均呈正相关关系。Cd0、Cd0.1、Cd0.5 和Cd1 处理中S 含量最大增幅分别为151.2%、20.3%、23.4%和43.2%
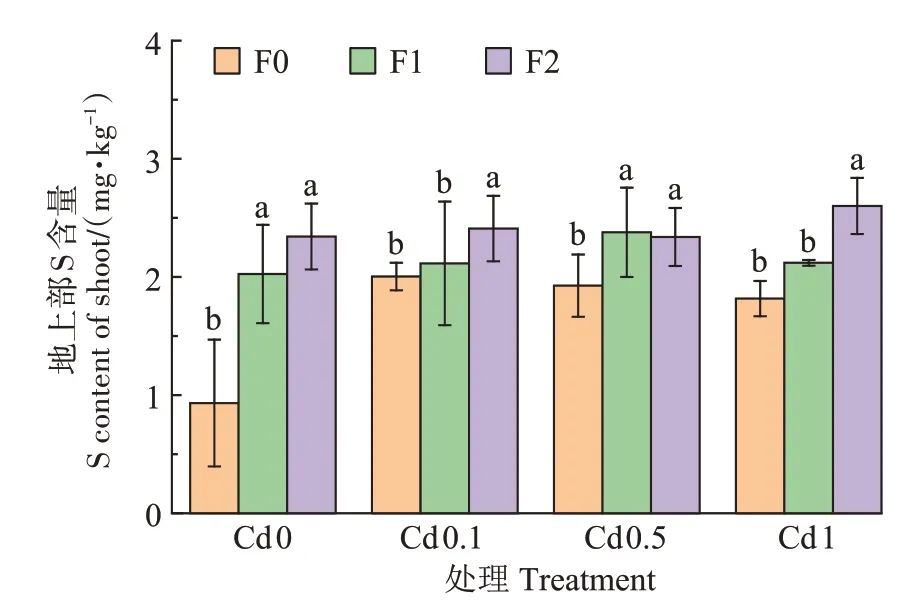
图2 福美双处理对Cd胁迫下小麦地上部S含量的影响Figure 2 Effects of thiram on S content in wheat shoot under Cd stress
2.1.2 福美双对Cd在小麦体内亚细胞分布的影响
与不施药相比,喷施福美双后,Cd0.1、Cd0.5 和Cd1 处理的小麦植株细胞器官中的Cd 含量均有所增加,细胞壁中分别提高了2.4%、83.2%和160.5%,细胞器中分别提高了72.2%、100.0%和160.2%。可见喷施福美双后,细胞各部分Cd 含量的增幅随着福美双喷施量增加而增加(图3)。其中Cd1 处理最为显著,与不施药相比细胞壁、细胞器和可溶性组分Cd含量由0.82、0.09 mg·kg-1和2.08 mg·kg-1分别提高至2.13、0.25 mg·kg-1和2.57 mg·kg-1。
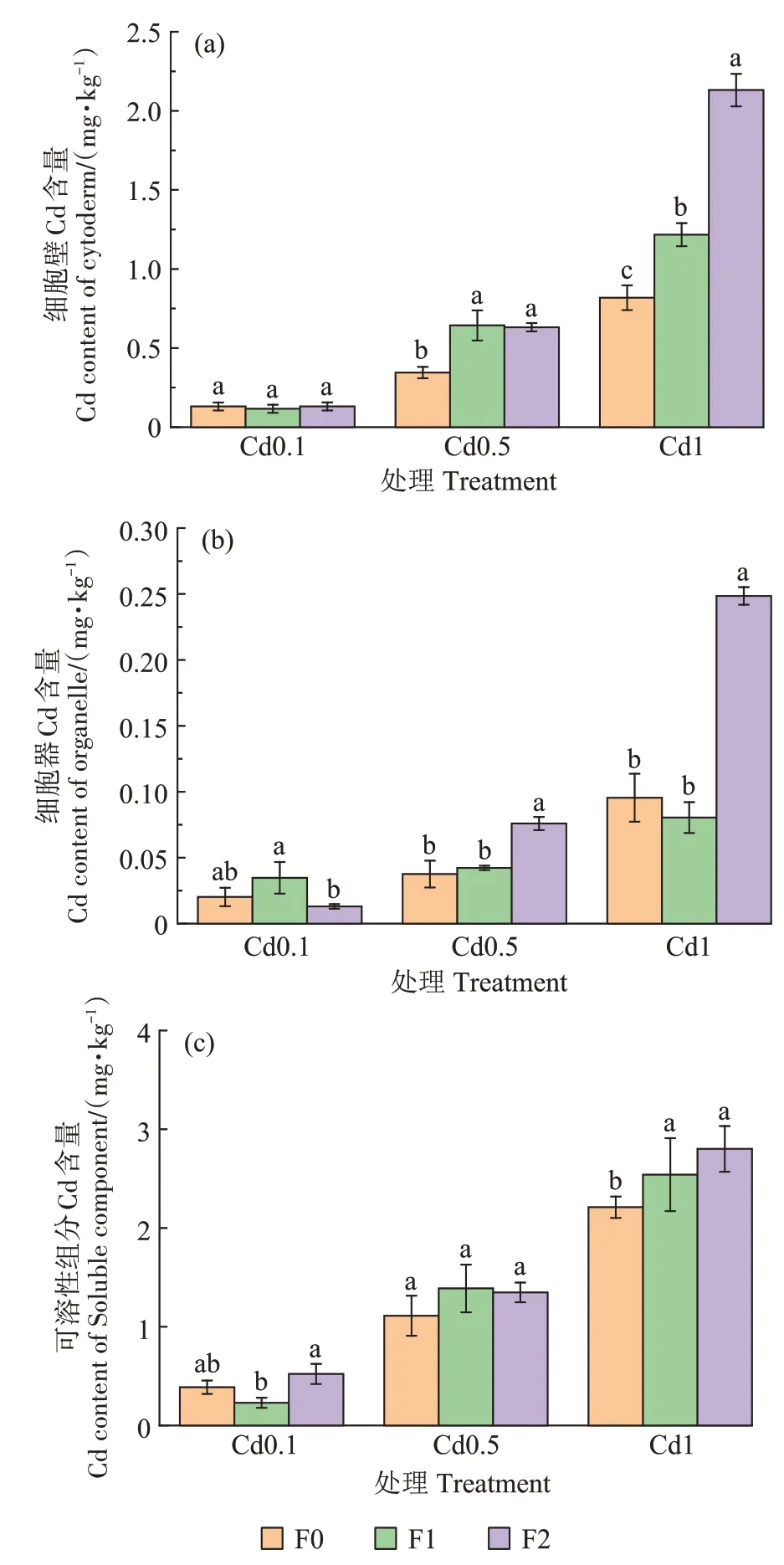
图3 福美双处理对小麦亚细胞Cd含量的影响Figure 3 Effects of thiram on subcellular distribution of Cd in wheat
由图4 可知,亚细胞组分Cd 含量数据表明各处理间Cd含量分布具有以下趋势:可溶性组分>细胞壁组分>细胞器组分。施用福美双后,与对照相比,Cd0.1、Cd0.5 和Cd1 处理下细胞壁Cd 含量占比分别由24.2%、23.2% 和27.5% 增 加 至26.9%、30.7% 和43.1%,增幅与福美双的施用剂量呈正相关;可溶性组分Cd 含量占比分别由72.1%、74.5%和69.7%降至66.7%、65.1%和51.9%,降幅与福美双的施用剂量呈正相关。

图4 福美双处理对小麦亚细胞Cd分布的影响Figure 4 Effects of thiram on the percentages of subcellular distribution of Cd in wheat
2.1.3 福美双对小麦中Cd化学形态的影响
由图5 可知,在小麦幼苗体内,FNaCl、FE、FW和FHAc在Cd 的六种化学形态中所占比例最高,四种形态共占据99%左右,为主要形态。其中FNaCl占比最高,超过50%。随着营养液中Cd添加量的增加,FNaCl所占比例随之升高,从60.1%增加到68.6%。施用了福美双之后,FNaCl所占比例下降,最高降幅达15.8 个百分点;FE占比上升,最高增加了8.5 个百分点;而FW在中、高Cd(Cd0.5 和Cd1)处理下占比升高,最高增幅为10 个百分点;而FHAc占比整体上不受Cd水平和福美双施用剂量影响。可以看出,相同Cd水平的处理中,施用福美双后Cd的化学形态整体上由FNaCl向FE和FW转移。

图5 福美双处理对小麦叶片中Cd化学形态的影响Figure 5 Effects of thiram on the different chemical forms of Cd in wheat leaves
2.2 Cd胁迫下福美双对小麦幼苗生长的影响
试验结果显示,Cd 和福美双单一及复合处理对小麦幼苗生长无显著影响,随着Cd 浓度以及福美双剂量的增加,幼苗地上部鲜质量和根系长度均没有显著性变化(图6、图7)。另外,同一Cd 浓度下不同福美双施药浓度对幼苗生长的影响也不显著。Cd 和福美双对小麦鲜质量和根系长度没有显著影响,可能是由于整个实验处理时间较短所致。

图6 福美双处理对Cd胁迫下小麦地上部鲜质量的影响Figure 6 Effects of thiram on fresh weight of wheat shoot under Cd stress

图7 福美双处理对Cd胁迫下小麦根系长度的影响Figure 7 Effects of thiram on length of wheat root under Cd stress
2.3 Cd胁迫下福美双对小麦幼苗光合作用的影响
Cd 和福美双对小麦叶片叶绿素的影响如图8 所示,可以看出Cd 胁迫降低了叶片叶绿素a、叶绿素b的含量以及光合速率。在喷施了福美双之后,叶绿素含量普遍上升。其中Cd0、Cd0.1、Cd0.5和Cd1处理中叶绿素a的增幅分别为20.2%、19.5%、36.0%和9.0%,叶 绿 素b 的 增 幅 分 别 为28.2%、49.2%、89.5% 和31.6%;光合速率整体上得到提高,最高增幅分别为37.2%、51.5%、62.7%和3.4%。

图8 福美双处理对Cd胁迫下小麦幼苗光合作用的影响Figure 8 Effects of thiram on photosynthesis of wheat seedlings under Cd stress
2.4 Cd胁迫下福美双对小麦幼苗抗氧化系统的影响
从图9a 可以看出,小麦幼苗MDA 含量随着营养液中Cd 含量的增加而提高,但增幅并不显著。喷施福美双后,各处理间小麦MDA 含量进一步提高,增幅最高为27.1%。图9b 显示,未喷施福美双,Cd 降低了小麦幼苗H2O2含量,最高降幅为36.7%(Cd0.1)。喷施福美双后,各处理间小麦H2O2含量显著提高,Cd0、Cd0.1、Cd0.5 和Cd1 处理中H2O2的最高增幅分别为17.5%、81.4%、123.6%和100.6%。另外,在低Cd浓度下(Cd0.1 和Cd0.5),添加福美双使小麦POD含量下降,最高降幅为23.9%;高Cd 浓度下(Cd1),添加福美双使小麦POD含量上升,最高增幅为42.4%(图9c)。从图9d 可以看出,营养液中的Cd 促进了小麦幼苗CAT 含量的增加,最高增幅为554.7%(Cd0.5)。喷施福美双后,各处理间小麦CAT 含量进一步提高,Cd0、Cd0.1 和Cd1 处理中CAT 的最高增幅分别为464.3%、23.8%和105.5%。Cd0.5 处理中CAT 含量下降,最高降幅为11.3%,降幅不显著。图9e 显示,添加福美双使各处理中小麦幼苗中的SOD含量下降,Cd0、Cd0.1、Cd0.5 和Cd1 处理中SOD的最高降幅分别为13.3%、20.1%、17.5%和13.5%。

图9 福美双处理对Cd胁迫下小麦幼苗抗氧化系统的影响Figure 9 Effects of thiram on antioxidant system of wheat seedlings under Cd stress
3 讨论
3.1 福美双对小麦幼苗体内Cd吸收和累积的影响
本研究中施用福美双后小麦幼苗地上部Cd含量增加,这可能与福美双提供了S元素有关(图2),因为S 可以促进小麦对Cd 的吸收和积累[20]。有很多研究得出过相同的结论,如在小麦盆栽试验中,施用Na2SO4(30~120 mg·kg-1)可导致土壤pH降低、Cd有效态含量增加,促进小麦根系吸收Cd[20-21]。李会合等[22-23]研究也表明施S 促进了东南景天对Cd 的吸收和积累,出现了“增S 诱导Cd 需求”现象。这是由于施S 可以促进作物体合成更多谷胱甘肽和螯合多肽等非蛋白巯基,而这些非蛋白巯基可与Cd 形成络合物,从而促进了Cd在植物体内的积累[24]。
细胞壁是Cd 进入植物细胞的第一道屏障,富含亲Cd 物质和阳离子交换位点,使Cd 得到有效固定,很难转移到其他部位[25-26]。在本实验中,Cd在可溶性组分含量最高,其次是细胞壁,表明Cd在小麦幼苗细胞中的移动性较强。可溶性组分中的液泡是代谢物和副产物累积的场所,重金属可与液泡中的各种蛋白质、有机酸和有机碱结合,使其被区隔在液泡中,这种区隔能够防止细胞质中过多的Cd对植物细胞器官造成损害[27]。在本研究中,施用福美双使Cd 在细胞壁中的占比升高,在可溶性组分中的占比下降,表明福美双可使Cd 更多地固定在细胞壁上,阻止其向细胞中的其他位置转移,但这种影响没有改变Cd 在可溶性组分中占据优势比例的状态。
Cd 各化学形态的毒性和移动能力随着提取剂的极性增加而降低,整体上呈现FE>FW>FNaCl>FHAc>FHCl的顺序[28],其中FE和FW的移动能力和毒性最强,也导致FE和FW含量同植物地上部Cd含量呈正相关[29]。本研究结果显示施用福美双后FE和FW占比增加、FNaCl占比下降,说明福美双可以增强Cd的移动性和毒性,这与文中福美双对小麦抗氧化系统影响的结论相同。另外,FNaCl形态占比最多,这与大部分Cd 都位于可溶性组分中有关,而分布于细胞壁中的则较少,导致Cd无法得到有效固定,保持了较强的移动能力[28]。
3.2 福美双对Cd胁迫下小麦幼苗光合作用的影响
许多研究都表明Cd可以抑制植物光合作用。刘大林等[30]研究显示,Cd 胁迫下狼尾草叶片的光合作用受到显著影响,叶绿素a、叶绿素b、净光合速率、蒸腾速率、细胞间CO2浓度等参数均显著下降。Xin等[31]在对水稻的研究中也得到了类似的结果,他认为这些现象有以下原因:首先是Cd2+进入植物后与酶相互作用,抑制叶绿体合成;其次是细胞内活性氧的增加导致更多的H2O2和O2扩散到叶绿体中,参与了叶绿素的降解;另外Cd2+胁迫直接导致叶肉细胞排列紊乱,破坏细胞内膜结构,从而降低了叶绿素含量。在我们的研究中,Cd 使小麦叶片叶绿素含量显著下降。而施用福美双后,叶绿素a 和叶绿素b 含量均有所升高,并恢复至无Cd 添加的水平。说明福美双可以有效缓解小麦叶片在Cd 胁迫下的非气孔限制,提高叶绿素含量和呼吸能力,恢复并保持叶片的光合作用。
3.3 福美双对Cd胁迫下小麦幼苗抗氧化系统的影响
植物在正常代谢过程中产生的活性氧总是与其清除能力保持平衡,然而在应激下,这种平衡会被破坏,导致细胞损伤[32]。Cd 胁迫可以刺激植物激活抗氧化酶和渗透调节系统,以减少不利环境造成的损害[33]。有研究表明Cd 可以在植物体内产生O-2·,过量的活性氧会引起膜脂过氧化。而高浓度Cd会导致小麦H2O2和·相互作用产生羟基自由基,将脂肪酸转化为有毒的过氧化物,破坏生物膜,导致MDA 积累[34-35]。在本实验中,Cd 胁迫下施用福美双后,小麦幼苗MDA 和H2O2含量整体上均有所升高,说明福美双增加了小麦的氧化胁迫。过量的自由基继续累积,引起膜蛋白和脂类的变化,改变细胞膜的通透性,增加细胞内膜的脂质过氧化物,对植物造成不可逆的损害[36]。本实验结果表明,添加福美双后SOD和POD的活性下降,说明小麦的自我保护能力还有待提高。而Cd胁迫下添加了福美双后植物体内活性氧呈进一步上升趋势,说明福美双加剧了Cd毒性[37]。
4 结论
(1)施用福美双对Cd胁迫下的小麦幼苗的鲜质量无显著影响,提高了光合速率,叶绿素、丙二醛、H2O2和过氧化氢酶含量,降低了超氧化物歧化酶含量。
(2)施用福美双提高了小麦中S 的含量,也促进了小麦对Cd的积累。施用福美双增加了小麦亚细胞各器官中Cd 的含量;提高了Cd 在细胞壁中的占比,降低了Cd 在细胞液中的占比;使小麦植株体内Cd 的化学形态由氯化钠提取态转变为乙醇提取态和去离子水提取态。
(3)福美双促进了小麦幼苗对Cd的积累,降低了植株抗氧化能力并加剧了Cd 胁迫,施药剂量和效应呈正相关。所以镉胁迫下施用福美双对小麦的安全优质生产和食品安全造成了进一步威胁,建议在Cd污染麦田选择其他杀菌剂防治病害,如无其他选择,则尽量以低剂量施用福美双。