不同微塑料对水稻土性质、镉有效性及其形态的影响
2023-09-18胡榆杰伍钧杨刚徐敏
胡榆杰,伍钧,杨刚,徐敏
(四川农业大学环境学院,成都611130)
微塑料(MPs)是指尺寸小于5 mm 的塑料,是环境中普遍存在的新型污染物,近年来受到国内外学者的广泛关注[1-2]。MPs 可通过多种途径进入农田生态系统,如农膜残留、废水灌溉、有机肥施用、大气沉降等[3]。当前,MPs已在农田土壤中大量累积。Ding等[4]对陕西省农田土壤研究发现MPs 丰度达到1 430~3 410 个·kg-1;武汉郊区某菜地中MPs 的丰度为320~12 560 个·kg-1[5];于庆鑫等[6]研究发现,哈尔滨某农田土壤中MPs 丰度范围为198.32~1 002.6 个·kg-1,且有农用膜覆盖的土壤中MPs 丰度是无农用膜覆盖的1.69 倍。聚乙烯(PE)是农膜的主要成分,而农膜在物理、化学等作用下破碎形成的MPs是农田MPs的主要来源之一[7]。
累积在土壤中的MPs可改变土壤理化性质,进而影响微生物群落和植物生长[8-11],对农田生态系统功能及农田产出造成不利影响。Ren 等[9]研究发现MPs可改变土壤微生物群落结构,对陆地生物地球化学循环有潜在影响。Wan 等[10]研究发现MPs 可通过加剧土壤水蒸发而增加水分流失;Zhang 等[11]报道塑料残膜会降低土壤的透水性,并影响土壤有机质和速效磷含量。Wang 等[12]研究发现MPs 可使土壤pH 和阳离子交换量显著降低,但可显著提高土壤溶解性有机碳(DOC)含量。
为了缓解环境中塑料累积的问题,可生物降解塑料(BPs)因其可通过微生物作用转化为CO2、CH4和微生物基质,被作为传统塑料的代替品[13],逐渐在生产生活中使用。聚己二酸-对苯二甲酸丁二酯(PBAT)是一种含有芳香环和脂肪链段的典型热塑性BPs,具有良好的延展性和断裂伸长率,常被用于替代PE 地膜[14]。然而,BPs 能否完全降解取决于其自身性质和环境条件[15]。事实上BPs 会因为在自然环境中不能完全降解而与传统塑料一样可产生MPs,并且由于BPs 对微生物更为敏感,在相同时间内BPs 会比传统塑料产生更多的MPs[16]。因此,PE-MPs与PBAT-MPs对土壤环境的影响值得进一步研究。
除了MPs污染以外,重金属也是农业土壤中常见的污染物。我国耕地正受到不同程度重金属污染,其中镉(Cd)污染最为严重,因其环境风险高且难以从土壤中去除一直受到国内外研究者的广泛关注[17-18]。重金属在土壤中的化学形态不同会表现出不同的环境行为与生物有效性[19],所以重金属的危害程度不仅受总量的影响还受到其化学形态的影响。重金属的形态与土壤理化性质密切相关[20]。如DOC 可降低土壤对重金属的吸附,当DOC 提高时可增加重金属的生物有效性[21-22]。也有研究发现pH 可影响碳酸盐的形成与溶解,当pH 升高时土壤中碳酸盐结合态的重金属含量会随之增加[23]。事实上,MPs与重金属Cd广泛存在于土壤环境中,二者在土壤环境中共同暴露已不可避免[24]。然而,关于MPs 进入土壤后如何影响土壤性质及Cd的有效性及其影响机制还不清楚。目前关于MPs与Cd等重金属相互作用的研究主要集中在溶液环境中,MPs 对土壤中Cd 影响的研究仍处于早期阶段[25-26],有待进一步研究。
因此,本研究以PE 与PBAT 两种MPs 为研究对象,分别设置不同剂量的MPs 处理,采用土壤培养试验,研究MPs 对Cd 污染土壤的有机质、DOC、铵态氮、硝态氮含量等理化性质,酶活性,Cd 有效性及其赋存形态的影响,以期为有效管理MPs与重金属复合污染土壤提供理论依据及数据支撑。
1 材料与方法
1.1 供试材料
供试土壤采自四川省成都市某稻田(30°41′41″N,103°47′02″E),采样深度为0~20 cm。采集土壤剔除石块与植物残体,风干、磨细,过20 目尼龙筛备用。土壤类型为水稻土,土壤基本理化性质:pH 7.68、有机质含量22.68 g·kg-1、全氮含量1.64 g·kg-1、总Cd 含量0.26 mg·kg-1。
供试地膜购自浙江某农膜生产公司,两种地膜主要成分分别是PBAT 和PE,厚度为0.01 mm。将两种塑料地膜剪切为1~3 mm 小块获得MPs,经稀硝酸溶液(5%)浸泡24 h 后用去离子水反复清洗至中性,避光风干后装入自封袋备用。
1.2 试验设置
Cd 污染土壤制备:将硝酸镉[Cd(NO3)2·4H2O,分析纯] 以溶液的形式加入供试土壤中,混合搅拌均匀,向土壤添加去离子水,以保持75%最大田间持水量。使用称量法每5 d补充一次去离子水。在室温下稳定60 d 后风干,磨细过20 目尼龙筛,备用。最终使土壤总Cd含量为1.45 mg·kg-1。
试验共设置7 个处理,分别是:CK(空白对照)、B1(0.5%PBAT - MPs)、B2(1%PBAT-MPs)、B3(2%PBAT-MPs)、N1(0.5%PE-MPs)、N2(1%PEMPs)、N3(2%PE-MPs),MPs 的添加剂量参照文献[27-28] 设置,每个处理3 次重复。具体操作步骤为:称取1 kg 上述Cd 污染土壤于烧杯中,将两种MPs 按照0.5%、1%、2%(m/m)的剂量添加至土壤,充分混合后,添加去离子水,以保持75%最大田间持水量。随后封上带孔滤纸,移入25±1℃恒温培养箱中避光培养。培养期间使用称重法每3 d 补充一次去离子水,培养55 d 后进行取样。分别将每个烧杯中的土壤样品倒出,充分混合后进行自然风干,分别过10 目和100目筛后装袋,备用。
1.3 样品测定
土壤基本理化性质参照《土壤农化分析》进行测定[29]。采用电位法测定土壤pH;采用硫酸-重铬酸钾氧化法测定有机碳含量;采用半微量凯氏定氮法测定全氮含量;采用靛酚蓝比色法测定铵态氮含量;采用双波长比色法测定硝态氮含量;采用碳酸氢钠浸提-钼锑抗比色法测定速效磷含量。脲酶活性采用苯酚钠-次氯酸钠比色法测定,过氧化氢酶采用KMnO4滴定法测定,土壤脱氢酶采用2,3,5-三苯基四氮唑氯化物还原法测定[30]。DOC 与总溶解性氮(TDN)采用水土比5∶1浸提[31],用总碳分析仪(vario TOC,Elementar,德国)测定。
采用0.1 mol·L-1CaCl2提取土壤有效Cd(CaCl2-Cd)[32]。采用改进的BCR 法连续提取土壤Cd 形态[33],Cd 形态分为酸溶态(可交换态和碳酸盐结合态)、可还原态(铁锰氧化物结合态)、可氧化态(有机物结合态)和残渣态。所有提取液中的Cd 用电感耦合等离子体质谱仪(ICP-MS,NexION300X,PerkinElmer,美国)进行测定。
1.4 数据处理
采用Excel 2016 及SPSS 26.0 进行数据处理及统计分析。单因素方差分析(One-way ANOVA)检测差异,处理间多重比较采用Duncan检验,当P值小于0.05时认为差异显著。使用Canoco5.0进行冗余分析(RDA)。
2 结果与分析
2.1 不同类型及剂量MPs对土壤理化性质的影响
不同MPs 处理下土壤理化性质如表1 所示。由表1 可知,不同类型MPs 对土壤理化性质的影响不同。与CK 相比,B1、B2、B3 处理下土壤pH 分别提高了0.01、0.20、0.30 个单位,而N1、N2、N3 处理对土壤pH 均无显著影响。与CK 相比,B1、B2、B3处理下,有机质含量分别提高了0.1%、4.7%、9.0%,DOC 含量分别提高了10.3%、54.2%、80.2%;而N1、N2、N3 处理下,有机质含量分别降低了2.5%、2.8%、2.9%,DOC含量分别降低了9.1%、9.2%、6.6%。与CK 相比,B1、B2、B3 处理下TDN 含量分别降低了0.2%、42.5%、67.1%,N1、N2、N3 处 理 下TDN 含 量 分 别 提 高 了9.9%、20.7%、32.6%。在不同MPs 处理下,土壤全氮含量与CK 均无显著差异。与CK 相比,B1、B2、B3 处理下铵态氮含量分别提高了2.2%、148.1%、457.0%,硝态氮含量分别降低了4.9%、55.8%、91.5%,速效磷含量分别降低了7.4%、10.8%、16.4%,且随PBATMPs 剂量的增加速效磷含量呈降低趋势;而N1、N2、N3处理对铵态氮、硝态氮和速效磷含量无显著影响。
2.2 不同类型及剂量MPs对土壤酶活性的影响
土壤脲酶、脱氢酶、过氧化氢酶活性变化如图1所示。由图1可知,与CK相比,B2、B3处理显著提高了土壤脲酶活性,分别提高了62.1%、130.2%(P<0.05),且脲酶活性随PBAT-MPs 剂量的增加而显著增加。与CK相比,B2、B3处理显著提高了脱氢酶活性,分别提高了88.9%、99.3%(P<0.05)。与CK相比,B1、B2、B3处理显著提高了过氧化氢酶活性,分别提高了12.8%、39.2%、44.2%(P<0.05)。而不同剂量PE-MPs 处理下土壤脲酶、脱氢酶和过氧化氢酶活性均无显著差异。
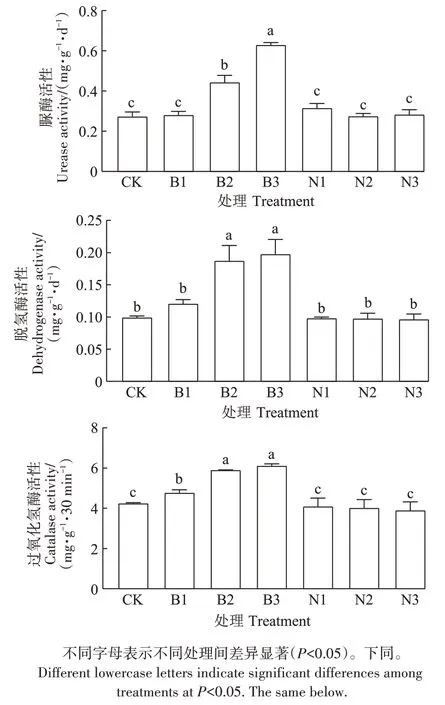
图1 不同处理对土壤酶活性的影响Figure 1 Effects of different treatments on soil enzymes activities
2.3 不同类型及剂量MPs 对土壤Cd 有效性及形态的影响
不同类型及剂量MPs对土壤Cd 有效性的影响如图2 所示。由图2 可知,MPs 处理均显著降低了土壤CaCl2-Cd的含量。与CK相比,B1、B2、B3处理下土壤CaCl2-Cd 分别降低了4.3%、15.4%、22.4%(P<0.05);N1、N2、N3 处理下土壤CaCl2-Cd 分别降低了4.6%、8.7%、7.2%(P<0.05)。此外,随着PBAT-MPs 剂量的增加,CaCl2-Cd 含量呈显著降低的趋势,而不同PEMPs剂量之间差异不显著。
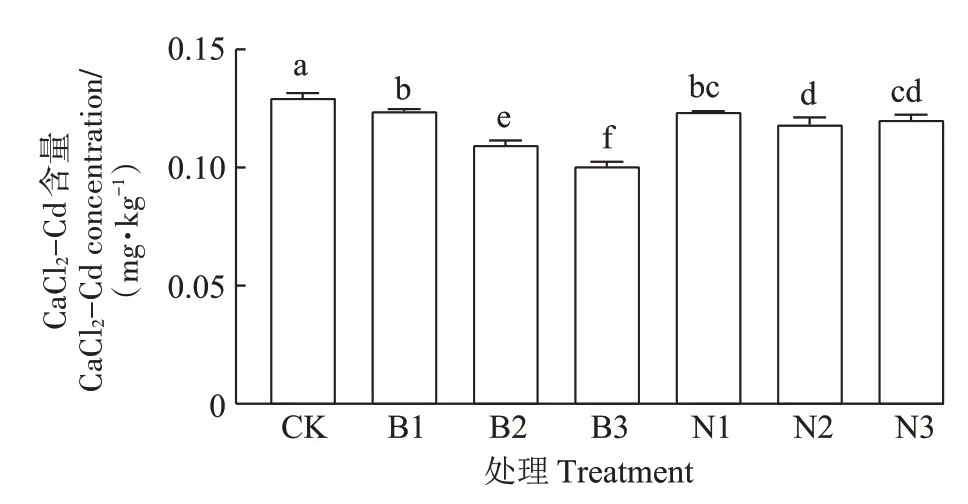
图2 不同处理对CaCl2-Cd含量的影响Figure 2 Effects of different treatments on soil CaCl2-Cd
不同类型及剂量MPs对土壤Cd 形态的影响如图3 所示。由图3 可知,不同处理下土壤各形态Cd 占比总体呈现为酸溶态Cd(53.8%~63.3%)>可还原态(30.1%~39.3%)>残渣态(3.0%~3.4%)>可氧化态(2.5%~4.1%)。与CK 相比,B2、B3 处理下酸溶态Cd占比分别显著增加了6.6%、9.5%,可还原态Cd 占比分别显著降低了6.6%、9.2%,可氧化态Cd 占比分别显著降低了0.1%、0.6%;N1、N2、N3 处理下酸溶态Cd占比分别显著增加了1.8%、1.0%、1.6%,可氧化态Cd占比分别显著降低了1.3%、1.0%、1.1%。

图3 不同处理对土壤Cd形态的影响Figure 3 Effects of different treatments on Cd fractions
2.4 土壤理化性质、酶活性与Cd形态之间的冗余分析
冗余分析结果如图4 所示。由图4 可知,第1 轴和第2 轴分别解释了85.92%和4.47%的土壤Cd 形态变化,即前两轴的累积方差解释度为90.39%,能够较好地反映土壤理化性质与Cd 形态的关系。酸溶态Cd 与TDN、硝态氮呈负相关,与铵态氮、DOC、pH、有机质、脲酶、脱氢酶呈正相关。可还原态Cd、CaCl2-Cd 与铵态氮、DOC、pH、脲酶、脱氢酶呈负相关,与TDN、硝态氮呈正相关。
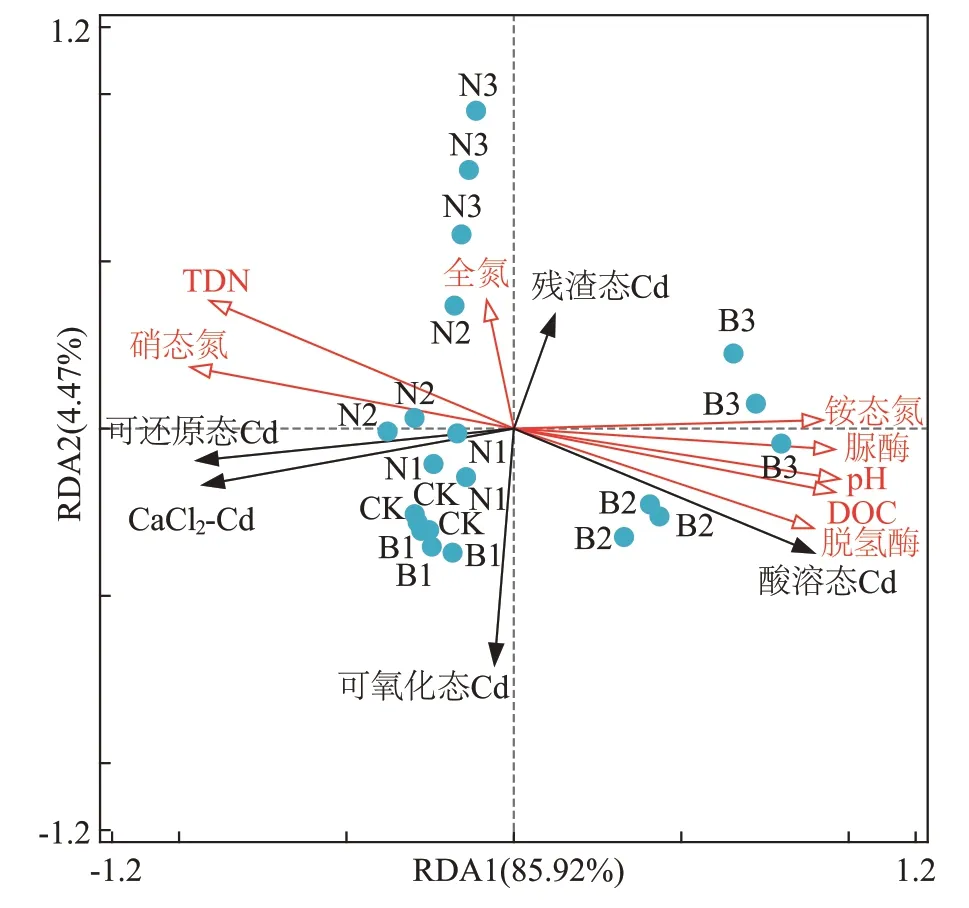
图4 土壤Cd形态与土壤理化性质、酶活性之间的冗余分析Figure 4 Redundancy analysis of Cd speciation,soil physicochemical properties and enzyme activities
3 讨论
MPs进入土壤后会影响土壤理化性质,改变土壤微环境,这在众多研究中已经得到证实[8-9]。目前,MPs 对土壤pH 的影响在不同研究中呈现不同结果,Zhao 等[34]和王春丽等[35]研究表明,PE-MPs、聚苯乙烯微塑料(PS-MPs)和PBAT-MPs 能显著提高土壤pH;而Palansooriya 等[36]研究则表明,PE-MPs 进入土壤后pH 显著降低。这些矛盾的结果可能是因为pH 的变化受到MPs 的种类及剂量的影响。在本研究中仅B2、B3 处理下,土壤pH 值分别提高了0.20 个和0.30个单位(P<0.05),B1、N1、N2、N3 均对土壤pH 无显著影响,可见不同MPs种类及剂量对土壤pH影响不同。PBAT-MPs 能显著提高土壤pH 可能是由铵态氮在土壤中累积所致[34]。
MPs 是富碳材料,在微生物作用下会逐步降解,释放可溶性有机物并在微生物的作用下形成土壤腐殖质等有机物质。本研究中,不同MPs对土壤有机质及DOC 含量影响不同。与CK 相比,PE-MPs 处理降低了土壤有机质和DOC 含量,其原因是难生物降解塑料(如PE)具有线性烃基结构且缺乏官能团,在短期内难以被微生物降解[37-38],主要通过改变微生物群落和活性,间接改变土壤有机物的分解与转化。同时,PE-MPs 具有较大比表面积和吸附性,能吸附土壤中的有机物,为微生物提供相对丰富的碳源,形成土壤有机质分解转化的热点区域[39],进而导致土壤有机质与DOC 的消耗。而PBAT-MPs 处理增加了土壤有机质和DOC 含量,且PBAT-MPs 剂量越大增幅越大,结果与Meng 等[40]研究结果相似。这可能是因为可生物降解型MPs(如PBAT-MPs)较PE-MPs具有更高的化学活性,容易被微生物分解并释放DOC 进入土壤环境中,最终形成土壤有机质[3,26]。有研究发现,DOC 可促进电子转移生成活性氧,进而加速MPs 老化[41]。然而MPs的老化又可为微生物分解MPs创造有利条件,进一步促进PBAT-MPs 向土壤中释放DOC。Ma 等[42]研究发现,吸附了DOC的纳米塑料(400 nm)与吸附在土壤矿物表面的DOC具有静电斥力,促进了纳米塑料在土壤中迁移。本研究中,PBAT-MPs 较PE-MPs 更容易老化分解形成纳米塑料,同时释放大量DOC,从而造成这些纳米塑料在土壤中的迁移扩散。
不同剂量的PE-MPs 与PBAT-MPs 对土壤全氮含量影响均不显著,可能是因为两种MPs均不含氮元素而不能直接向土壤中输入氮。TDN 被认为是土壤中的有效氮,主要由铵态氮、硝态氮和溶解性有机氮组成,是植物生长的重要限制因素[43]。与CK 相比,N1、N2、N3 处理下土壤TDN 含量增加了9.9%、20.7%和32.6%,B2、B3 处理下土壤TDN 含量分别降低了42.5%、67.1%,可见两种MPs 对土壤TDN 含量的影响不同。PE-MPs 降低了土壤生物可利用的碳(如DOC),降低了土壤碳氮比,进而抑制了土壤TDN 的消耗。对于PBAT-MPs,Chen 等[44]研究发现,5%和10% PBAT-MPs 进入土壤后经120 d 培养,土壤TDN含量显著下降了61.3%~84.3%,本研究结果与其一致。这可能是因为PBAT-MPs 向土壤中释放了大量DOC,促进了微生物的生长繁殖,加速了土壤氮素的矿化[40]。不同的研究中观察到MPs 对土壤无机氮(铵态氮、硝态氮)组成的影响不一致,这与MPs 的类型、添加量、土壤性质及环境条件有关。本研究中,3 种剂量的PE-MPs 对土壤铵态氮、硝态氮均无显著影响,与Liu 等[43]向土壤中添加1%和5%的PE-MPs 培养30 d 后发现土壤铵态氮与硝态氮含量均无显著变化的研究结果一致。而PBAT-MPs 处理下土壤铵态氮含量较CK 增加了2.2%~457.0%,土壤硝态氮含量较CK 降低了4.9%~91.5%,表明PBAT-MPs 可能改变了微生物群落结构,导致了土壤无机氮组分发生改变。Shi 等[45]研究发现,可生物降解型MPs 选择性改变了土壤中参与氮循环的特定菌群,增强了土壤反硝化作用。不同用量PBAT-MPs 处理下土壤速效磷含量较CK 分别降低了7.4%、10.4%、16.4%,这可能是因为pH 改变了土壤对磷的吸附作用。已有研究表明,碱性土壤中pH 升高时,钙对土壤磷的固定作用会显著增强[46]。本研究中PBAT-MPs 处理下pH 的增加可以印证此观点(表1)。此外,MPs 也可能通过改变微生物丰度和活性,降低土壤速效磷含量[47]。
土壤酶可参与土壤物质循环过程。土壤脲酶能够破坏C—N键,促进有机氮转化为铵态氮、二氧化碳和水,在土壤氮循环中起着重要作用。土壤过氧化氢酶可表征土壤肥料和微生物活性[30]。土壤脱氢酶是有机物最初分解的关键酶,被认为是土壤微生物活性的指标[48]。本研究中,不同剂量PE-MPs 对土壤酶活性的影响不显著,而PBAT-MPs 处理提高了土壤脲酶、脱氢酶、过氧化氢酶的活性,表明PBAT-MPs对土壤酶活性的影响更大,这可能是因为PBAT-MPs自身含碳丰富,且容易被微生物利用,促进了微生物生长和代谢,从而提高了土壤酶活性。Feng等[28]也发现可生物降解型MPs能大幅提高土壤酶活性,本研究结果与其一致。此外,本研究发现,PBAT-MPs 处理显著提高了土壤脲酶活性,这是该处理下土壤铵态氮含量增加的重要原因(表1)。
不同类型和剂量的MPs 进入土壤后均能降低土壤CaCl2-Cd 含量,与Meng 等[32]的研究结果一致。这可能是因为MPs 直接吸附了土壤中的Cd2+。此外,随着PBAT-MPs剂量的增加,CaCl2-Cd的含量呈逐渐下降的趋势,而在PE-MPs 处理下CaCl2-Cd 含量的变化与PE-MPs 剂量没有明显的关系,表明两种MPs 可能通过不同机制影响土壤中Cd的有效性。
土壤pH 与DOC 是影响土壤重金属形态的重要因素[20,49]。pH可通过改变重金属吸附位点、质子化反应及沉淀-溶解来影响土壤中重金属的形态[25,50-51]。冗余分析发现,pH与酸溶态Cd呈正相关(r=0.948,P<0.05),表明PBAT-MPs可通过增加土壤pH,进而增加土壤酸溶态Cd。BCR 法中将可交换态与碳酸盐结合态称为酸溶态[52],侯青叶等[53]研究发现,碳酸盐结合态Cd 对土壤pH 的变化最为敏感,可随pH 增加而增加。因此,土壤酸溶态Cd 升高,可能是因为土壤pH的升高促进了碳酸盐的形成,导致更多Cd 以碳酸盐的形式沉淀[23]。冗余分析发现,土壤DOC与可还原态Cd 呈负相关(r=-0.955,P<0.05),表明DOC 增加可降低土壤可还原态Cd 占比。这可能是因为DOC 中的亲水性小分子组分能更有效地与Cd形成可溶性络合物[54]或优先吸附在土壤铁锰矿物表面[21],抑制了Cd与土壤铁锰化合物结合,从而降低了土壤可还原态Cd。已有研究表明,DOC 与可氧化态Cd 具有较强相关性[25,49]。本研究发现,PE-MPs 与PBAT-MPs 处理均降低了可氧化态Cd的占比,且可氧化态Cd与DOC含量的相关性不显著,这可能是两种MPs 对可氧化态Cd 的影响是通过不同机制完成的。PE-MPs 处理下DOC 含量降低是因为土壤内源DOC 的消耗,PBATMPs处理下增加的DOC主要来自PBAT-MPs的释放。DOC 是一种复杂的聚合物,其表面含有复杂的官能团[55],因此不同DOC 对Cd形态可表现出不同的影响。PE-MPs 处理下,结合在土壤矿物表面的内源DOC 被消耗,释放了DOC 所吸附的Cd,从而导致可氧化态Cd 占比降低;而PBAT-MPs 处理下,PBAT-MPs 所释放的外源DOC 可作为有机配位体与Cd 结合,降低Cd与土壤稳定有机质的结合,进而降低了可氧化态Cd的占比。综上,MPs 对土壤中Cd 的影响与MPs 的种类和剂量密切相关,PBAT-MPs 对土壤中Cd 的活化作用更强,应减少PBAT地膜在Cd污染土壤上使用并加强塑料地膜的回收。
4 结论
(1)聚己二酸-对苯二甲酸丁二酯微塑料(PBATMPs)能提高土壤溶解性有机碳(DOC)含量、pH、铵态氮含量、脲酶活性、脱氢酶活性、过氧化氢酶活性,且降低总溶解性氮(TDN)、硝态氮和速效磷的含量;聚乙烯微塑料(PE-MPs)显著降低了土壤有机质和DOC含量。PBAT-MPs 对土壤理化性质及酶活性的影响比PE-MPs更显著。
(2)两种MPs 均能降低CaCl2-Cd 含量,其中,随PBAT-MPs剂量增加,CaCl2-Cd含量呈显著降低趋势。
(3)两种MPs对土壤中Cd 形态的影响机制不同。PE-MPs 主要通过降低土壤DOC 含量来降低可氧化态Cd;PBAT-MPs 通过增加DOC 含量来降低可还原态Cd,通过提高pH来促进酸溶态Cd的形成。