噻虫啉对表达多房棘球绦虫nAChR基因HEK293细胞内钙的影响
2023-09-18王宇琦达哇卓玛张雨薇刘川川樊海宁
王宇琦,达哇卓玛,张雨薇,刘川川,樊海宁
泡型包虫病(alveolar echinococcosis, AE)是由多房棘球绦虫幼虫感染引起的致死性人兽共患寄生虫病,主要流行于北半球区域[1]。啮齿类动物和人等中间宿主通过食入含有寄生虫虫卵而感染[2-3]。虫卵在寄生宿主肠道内孵化后可穿透肠壁,通过门静脉进入肝脏,在肝脏中向后绦幼虫阶段转变[4]。多房棘球绦虫囊肿由许多小泡组成,这些小泡呈浸润性生长,像恶性肿瘤一样,与正常肝组织分界不清[2-4]。由于AE病灶不受限制的生长,导致中间宿主肝组织内血管和胆管阻塞,最终导致器官衰竭发生[2]。AE的另一个特征是广泛的肝纤维化发生,可导致肝实质完全消失,这很可能与慢性感染时肝星状细胞的激活有关[5-6]。手术切除AE病灶组织是唯一可靠、有效的治疗方法,但对大多数患者来说并不可行,多数患者基于苯并咪唑的化学药物治疗是唯一的治疗选择。然而,苯并咪唑只能起到寄生虫抑制作用,而且必须长期服用(通常是终身服用),这就强调了针对AE新治疗方案的必要性[2]。
噻虫啉(thiacloprid, Thia)是一种新型氯代烟碱类杀虫剂。我们先前研究已经确定,噻虫啉在体内和体外均能发挥抗AE作用[7-8]。噻虫啉已知作用于昆虫神经接合后膜,通过与烟碱乙酰胆碱受体(nicotinic acetylcholine receptor, nAChR)结合,干扰昆虫神经系统正常传导,引起神经通道阻塞,造成乙酰胆碱的大量积累,从而使昆虫异常兴奋,全身痉挛、麻痹而死。随着多房棘球绦虫基因组测序的完成,多种乙酰胆碱受体被鉴定出来[9]。而多房棘球绦虫的发育和幼虫的生长完全是由一群体壁干细胞驱动的,这些干细胞是多房棘球绦虫中唯一存在有丝分裂活性的细胞,并产生所有分化的细胞类型[10]。利用体外培养系统也证实可以培养后绦幼虫囊泡和生发层细胞[11-14]。但迄今为止,还没有关于多房棘球绦虫乙酰胆碱受体以及受体与小分子药物相互作用的研究。
本文通过对多房棘球绦虫已鉴定出的乙酰胆碱受体结构分析,对其中的一种乙酰胆碱受体进行生物信息学分析和异源表达,结果表明该受体存在与噻虫啉结合的空间构象。进一步的实验也初步证明噻虫啉能引发乙酰胆碱受体离子通道的开放。
1 材料与方法
1.1 细胞和试剂 HEK293细胞由武汉普诺赛公司提供,经STR鉴定正确。RNA提取试剂盒购自北京天根公司;噻虫啉、人乙酰胆碱(acetychiline,ACh)购自美国Sigma公司;0.2 μm聚偏二氟乙烯膜(PVDF膜)购自美国Millipore公司;GFP抗体、Cy3标记羊抗小鼠二抗、HRP标记羊抗小鼠二抗购至Abclonal公司;超敏化学发光试剂盒、BCA蛋白定量试剂盒购自美国Thermo Scientific公司;青链霉素混合液(PS, 100×)、0.25%胰蛋白酶、MEM培养基购自武汉普诺赛公司;胎牛血清(FBS)购至美国Gibco公司;Rhod-2 AM钙离子荧光探针购至上海懋康生物。pCMV-N-EGFP质粒、EcoR I内切酶、SpeI内切酶、PstI内切酶、卡那霉素购于上海碧云天公司。cDNA第一链合成试剂盒、质粒提取试剂盒、T4 DNA连接酶、FastKing gDNA Dispelling RT SuperMix试剂盒、qPCR试剂盒购于北京天根公司。
1.2 实验材料来源
1.2.1 多房棘球绦虫原头节分离 多房棘球绦虫原头节最初是从中国青海玉树自然感染的高原鼠兔中分离出来,经扩增nad1、nad5、Cox1基因鉴定为多房棘球绦虫来源[7]。通过腹膜内注射在蒙古长爪沙鼠体内长期保种。蒙古长爪沙鼠经异氟烷吸入麻醉后颈椎脱臼安乐死,经75%乙醇浸泡消毒 5 min,后置于生物安全柜内分离腹腔内病灶。将病灶置于磷酸盐缓冲液(PBS)中并剪碎,并将剪碎后病灶通过四层无菌纱布过滤至无菌50 mL离心管中。通过100 μm细胞筛过滤去除钙质颗粒后,吸取部分原头节于EP管中,经12 000 r/min离心2 min收集沉淀用于后续RNA提取实验。部分原头节用PBS调整浓度约为6 000个/mL,用于后续构建继发性小鼠AE感染模型。
1.2.2 继发性小鼠感染模型构建 6只SPF级雌性C57BL/c小鼠购于北京华阜康生物科技有限公司(合格证号:110322210101187827),动物饲养于本实验室IVC笼具中(3只/笼)。取上述分离原头节0.3 mL(浓度约为6 000个/mL)通过腹腔注射感染C57BL/c小鼠3只,另取3只小鼠注射等量PBS。小鼠饲养6周后,经2%戊巴比妥钠麻醉后经眼球取血分离包虫病小鼠血清和正常小鼠血清,用于后续实验研究。
1.3 生物信息学分析 从Uniprot数据库获取nAchR蛋白序列(蛋白ID:A0A068YBH0),利用ExPASy系统中的ProtParam tool在线分析软件分析nAchR蛋白的相对分子质量、等电点、稳定性及平均亲水系数,并使用ProtScale在线工具分析亲/疏水性氨基酸比重;SignalP 5.0分析信号肽序列和剪切位置;TMHMM Server v. 2.0分析蛋白跨膜区域位置;SOPMA预测蛋白二级结构;Swiss-Model预测蛋白三级结构。
1.4 分子对接 以nAChR氨基酸序列(蛋白ID:A0A068YBH0)为模板,使用Swiss-Model同源建模软件进行同源性建模[15],获得蛋白质的三维结构。使用Ramachandran图建模结果进行质量评估[16]。当模型的相似度大于30%时,可以得到合理的构象[17]。进一步的分析是基于Swiss-Model同源建模软件构建的可比蛋白质的结构信息。将nAChR建模结构上传到POCASA以预测其潜在的结合位点[18]。根据其可能的结合位点设置Grid box坐标和box size,使用Autodock Vina. 1.1.2进行分子对接[19]。从PubChem获取噻虫啉的三维结构。
1.5 目的基因引物设计 通过GeneDB数据库获取nAchR基因(EmuJ_000984000)CDS序列,使用金斯瑞在线引物设计软件设计引物为:F: 5′-cgGAATTCATGCTCTCACCTGCCGTGGA-3′(下划线部分为EcoR I酶切位点),R:5′-ggACTAGTTCAGTGTCTGGGGAGAATAATA-TG-3′(下划线部分为SpeI酶切位点),理论产物长度为1 633 bp。引物由上海生工生物公司合成。
1.6 nAChR重组质粒构建 根据天根RNA提取试剂盒说明书提取多房棘球蚴原头节总RNA。取2 μg总RNA按cDNA第一链合成试剂盒说明书合成cDNA,置于-80 ℃保存。以合成的cDNA为模板进行PCR扩增,反应体系为:2×Taq PCR MasterMix Ⅱ 10 μL,Primer F(10 μmol/L) 0.5 μL,Primer R(10 μmol/L) 0.5 μL,cDNA模板 1 μL,双蒸水 8 μL。反应条件为:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s, 72 ℃ 2 min, 30个循环;72 ℃ 5min。PCR产物使用1.5%琼脂糖凝胶电泳鉴定。PCR产物经回收纯化后,使用限制性内切酶EcoR I和SpeI进行双酶切。将双酶切后的基因片段和双酶切后的pCMV-N-EGFP质粒(pCMV-EGFP)用T4 DNA连接酶16 ℃连接过夜,重组后质粒命名为pCMV-EGFP-nAChR。连接产物转化感受态细胞E.coliDH5α后涂布于含有卡那霉素(50 μg/mL)LB固体平板,37 ℃倒置培养48 h。挑取单克隆使用LB液体培养基扩增,用特异性引物进行PCR鉴定及单酶切鉴定。阳性克隆送上海生工测序鉴定,使用在线Multiple Sequence Alignment比对软件对所得序列与Wormbase Parasite数据库nAChR序列比对。
1.7 重组质粒转染HEK293细胞 HEK293细胞在含10%灭活胎牛血清和1% PS的MEM培养基中培养,将HEK293细胞以6×105/孔接种于6孔细胞培养板。待细胞密度达到60%~70%后,用PBS洗涤细胞后进行转染。按照Lipofectamine 3000试剂盒说明书分别将pCMV-EGFP质粒和pCMV-EGFP-nAChR质粒转染HEK293细胞,以未转染细胞作为对照组(Control)。转染48 h后,在Zeiss倒置荧光显微镜下观察细胞内荧光表达情况,并用ACEA NovoCyte流式细胞仪检测转染效率。
1.8 Real-time PCR检测nAChRmRNA的表达 使用Trizol试剂提取转染pCMV-EGFP质粒和pCMV-EGFP-nAChR质粒后细胞总RNA。琼脂糖凝胶电泳观察28S和18S核糖体RNA条带用于评估RNA完整性。用NanoDrop 2000分光光度计测定总RNA纯度和浓度。使用FastKing gDNA Dispelling RT SuperMix根据说明将2 μg总RNA逆转录为cDNA。cDNA产物分装保存于-80 ℃备用。特异性引物由上海生工生物公司合成,引物序列为:nAchR-F:5′-TGTACAACAACGTGGACGGCAA-3′;nAchR-R:5′-AAGTACTCCATGTCGATTCTGCAGGC-3′;β-actin-F:5′-CCACGGCTGCTTCCAGCTCC-3′,β-actin-R:5′-GGG-CAGCGGAACCGCTCATT-3′。使用天根qPCR试剂盒根据说明配制反应液。qPCR反应使用ABI Q5检测系统,反应程序设置为:95 ℃预变性15 min,然后进行40个循环(95 ℃ 10 s,60 ℃ 34 s)。
1.9 Western blot检测nAChR蛋白的表达 HEK293细胞于转染48 h后,收集细胞沉淀,以RIPA蛋白裂解液提取细胞总蛋白。经BCA法定量后,以30 μg蛋白上样进行SDS-PAGE电泳。电泳结束后,将蛋白转移至PVDF膜上,5%脱脂奶粉室温封闭1 h。加入GFP抗体(1∶1 000)、泡型包虫病小鼠血清(1∶300)和正常小鼠血清(1∶300)4 ℃孵育过夜。TBST洗膜后,加入辣根过氧化物酶标记山羊抗兔IgG(1∶5 000)或辣根过氧化物酶标记山羊抗小鼠IgG(1∶5 000)室温孵育1 h。TBST洗膜后,使用ECL超敏化学发光液于GE Amersham Imager 600化学发光仪中显像蛋白条带。以β-actin为内参对照。
1.10 免疫荧光染色 HEK293细胞接种于6孔细胞培养板中,24 h后转染pCMV-EGFP质粒和pCMV-EGFP-nAChR质粒。转染后细胞继续培养48 h。HEK293细胞经PBS轻柔洗涤后,加入4%多聚甲醛室温固定20 min。经含有1%BSA-PBS洗涤后加入正常小鼠血清(1∶50)和泡型包虫病小鼠血清(1∶50)于4 ℃孵育过夜。第2 d,细胞经PBS洗涤后,加入Cy3标记羊抗小鼠二抗室温避光孵育1 h。随后,经PBS洗涤后,于Zeiss LSM 880激光共聚焦显微镜下观察并采集图像。
1.11 全细胞膜电流分析 转染pCMV-EGFP质粒和pCMV-EGFP-nAChR细胞接种于含有盖玻片的细胞培养皿中,培养24 h后进行全细胞膜电流检测。将铺有细胞的盖玻片置于倒置显微镜中的记录浴槽中,工作液以及不含化合物的外液利用重力灌流的方法流经记录浴槽从而作用于细胞,在记录中利用真空泵进行液体交换。细胞外液:140 mmol/L NaCl,3.5 mmol/L KCl,2 mmol/L CaCl2·2H2O,1 mmol/L MgCl2·6H2O,10 mmol/L HEPES,10 mmol/L D-Glucose,1.25 mmol/L NaH2PO4,NaOH调节pH=7.4;细胞内液:50 mmol/L CsCl,10 mmol/L NaCl,20 mmol/L EGTA,60 mmol/L CsF,10 mmol/L HEPES,CsOH调节pH=7.2。所有电生理试验在室温下进行。
用微电极拉制仪将毛细玻璃管拉制成记录电极。在倒置显微镜下操纵微电极操纵仪将记录电极接触到细胞上,给予负压抽吸,形成GΩ封接。形成GΩ封接后进行快速电容补偿(pF),然后继续给予负压,吸破细胞膜,形成全细胞记录模式。然后进行慢速电容的补偿并记录膜电容(pF)及串联电阻。全细胞膜片钳记录刺激方案如下:当形成全细胞封接后细胞膜电压钳制于-70 mV。在Gap-free模式下进行记录,先给予细胞外液,后细胞外液+15 μmol/L Thia或细胞外液+100 μmol/L人乙酰胆碱灌流给药10 min后,观察并记录电流,以细胞外液下记录的电流值作为对照。试验数据由EPC-10放大器(HEKA)进行采集并储存于PatchMaster(HEKA)软件中。
1.12 细胞内Ca2+浓度分析 稳定转染nAChR-HEK293细胞接种于24孔细胞培养板24 h后,细胞分别与5 μg/mL、10 μg/mL、20 μg/mL噻虫啉共同作用6 h、12 h和24 h。干预后细胞与2 μmol/L Rhod-2 AM在37 ℃避光孵育25 min进行钙离子荧光探针加载。细胞经PBS缓冲液洗涤两次后,在37 ℃再次避光孵育30 min。使用蔡司Vert.A1荧光显微镜拍摄图像,用image J软件分析图像荧光强度。
1.13 钙流分析 将稳定转染的nAChR-HEK293细胞消化,将细胞密度调整为1×106/mL,然后用PBS洗涤细胞,用4 μm Rhod-2AM在37 ℃避光孵育20 min进行钙离子荧光探针加载,细胞经PBS洗涤2次后在37 ℃条件下避光孵育30 min。将细胞重悬浮于HEPES缓冲溶液中(含1 mmol/L CaCl2、0.5 mmol/L MgCl2、0.1% BSA、10 mmol/L HEPES、pH 7.2)中,加入终浓度为15 μg/mL噻虫啉在37 ℃孵育15 min后,在静息状态下测量2 min的基线钙水平(样品体积25 μL,样品速度14 μL/min),然后立即用流式细胞仪继续监测5 min(样品体积75 μL,样品速度14 μL/min)。使用FlowJo 10软件计算曲线下区域相对面积。
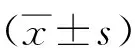
2 结 果
2.1 nAChR蛋白理化性质分析 Protparam tool工具分析显示,nAChR蛋白含有538个氨基酸,相对分子质量约为62.08 kD;理论等电点为8.46;不稳定系数为54.27,为不稳定蛋白;平均亲水性系数为-0.029,为亲水性蛋白。ProtScale工具分析显示,nAChR蛋白亲水性氨基酸占53.96%,疏水性氨基酸占46.04%(图1)。
注:正值代表疏水区;负值代表亲水区图1 多房棘球绦虫nAChR蛋白亲/疏水性分析Fig.1 Hydrophilic/hydrophobic analysis of the Echinococcus multilocularis nAChR protein
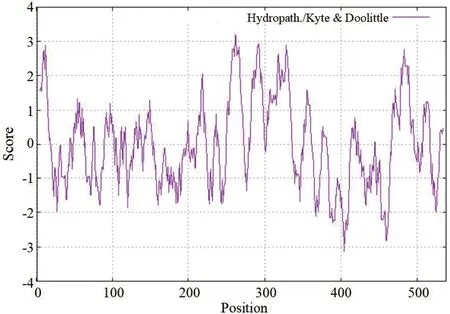
2.2 nAChR信号肽及跨膜区分析 信号肽为新合成多肽链中用于指导蛋白质的跨膜转移的N-末端的氨基酸序列。SignalP工具分析显示,依据平均SP值大于0.5为信号肽的判断标准,nAChR蛋白N-端1~20个氨基酸序列的平均SP值为0.567,为信号肽序列,信号肽剪切位点在甘氨酸(G20)和甘氨酸(G21)之间(图2)。TMHMM工具分析显示,nAChR蛋白的跨膜区域位于250~497氨基酸之间,其中,250~272、279~301、314~336和475~497为与膜脂结合的多肽序列(图3),表明nAChR蛋白为信号肽介导的细胞质膜定位的4次跨膜蛋白。
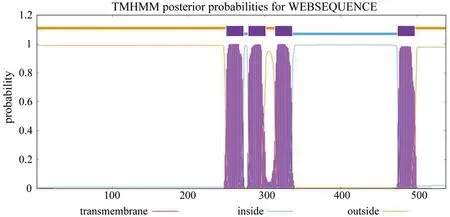
图3 nAChR跨膜区分析Fig.3 nAChR transmembrane region analysis
2.3 nAChR蛋白二级结构预测 SOPMA软件分析显示,nAChR蛋白可能含有4种二级结构:α螺旋占27.14%,β转角占4.83%,无规则卷曲占44.42%,延伸链组成占23.61%,可见α螺旋和无规则卷曲是该蛋白的主要组成部分(图4)。
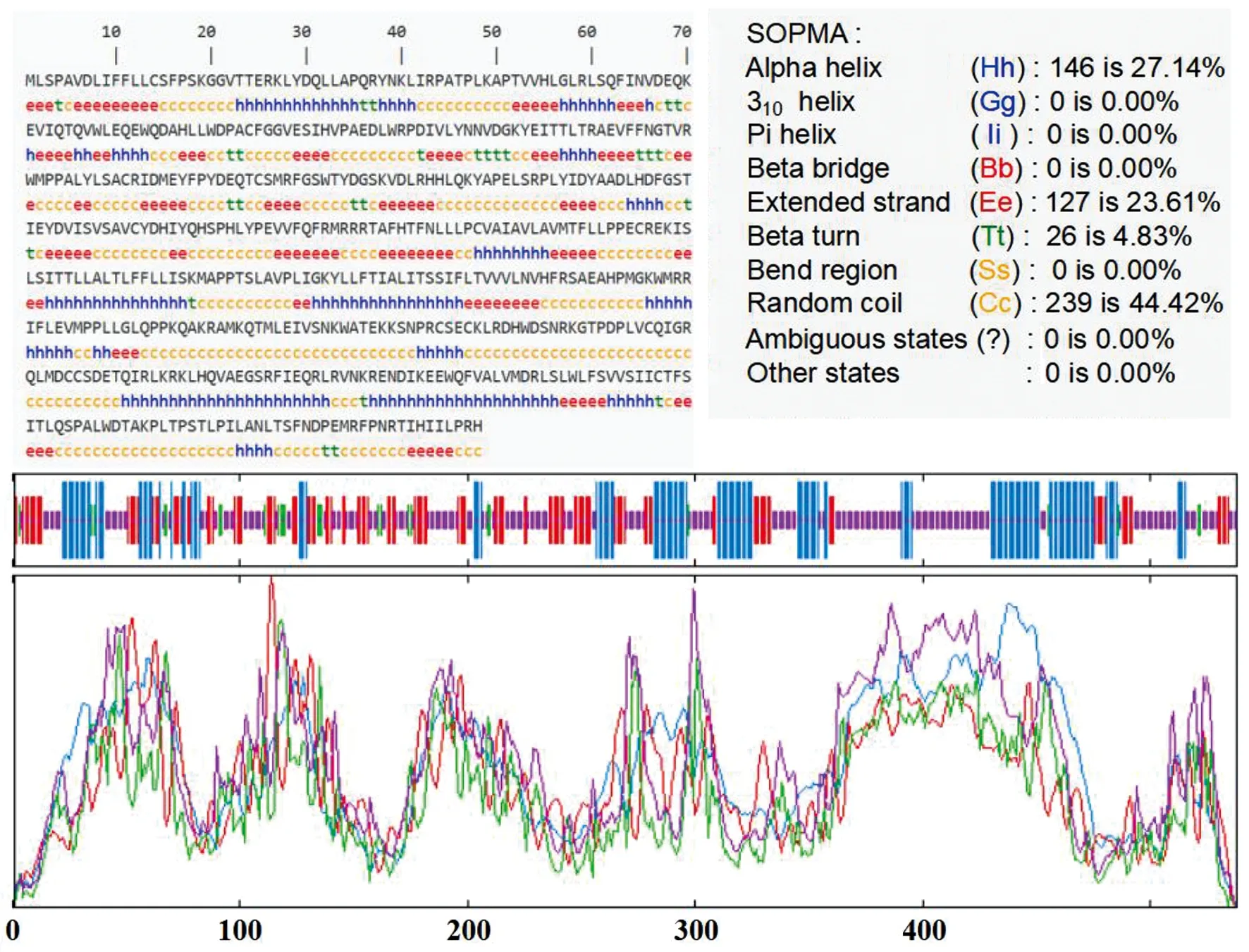
图4 nAChR蛋白二级结构分析Fig.4 Secondary structure analysis of nAChR protein
2.4 nAChR蛋白三级结构和结构域预测 Swiss-Model分析显示,该蛋白胞外结构域主要由无规则卷曲组成,胞内结构域主要由α螺旋和无规则卷曲组成,与二级结构预测结果一致,见图5A。SMART分析表明,nAChR蛋白存在两个受体结构域,其中一个为细胞外配体门控离子通道活性部位,表明nAChR蛋白存在与配体结合的能力,从而激活下游信号功能。应用Swiss-Model数据库对nAChR蛋白进行同源建模,参考模板为neuronal acetylcholine receptor subunit alpha-4(PDB ID: 6usf.1.D),两者相似度为40.40%,得到nAChR蛋白的3D结构(图5B)。利用拉氏图(Ramachandran Plot)检测nAChR蛋白的立体化学构象是否合理。由预测结果可知,nAChR蛋白结构的G-factor计分总平均值为0.62。所有的氨基酸残基的二面角都落在了最适宜区域(图5C)。由此可见nAChR蛋白3D模型的立体构象和二面角分布较为合理,符合立体化学ψ、φ二面角分布的要求。
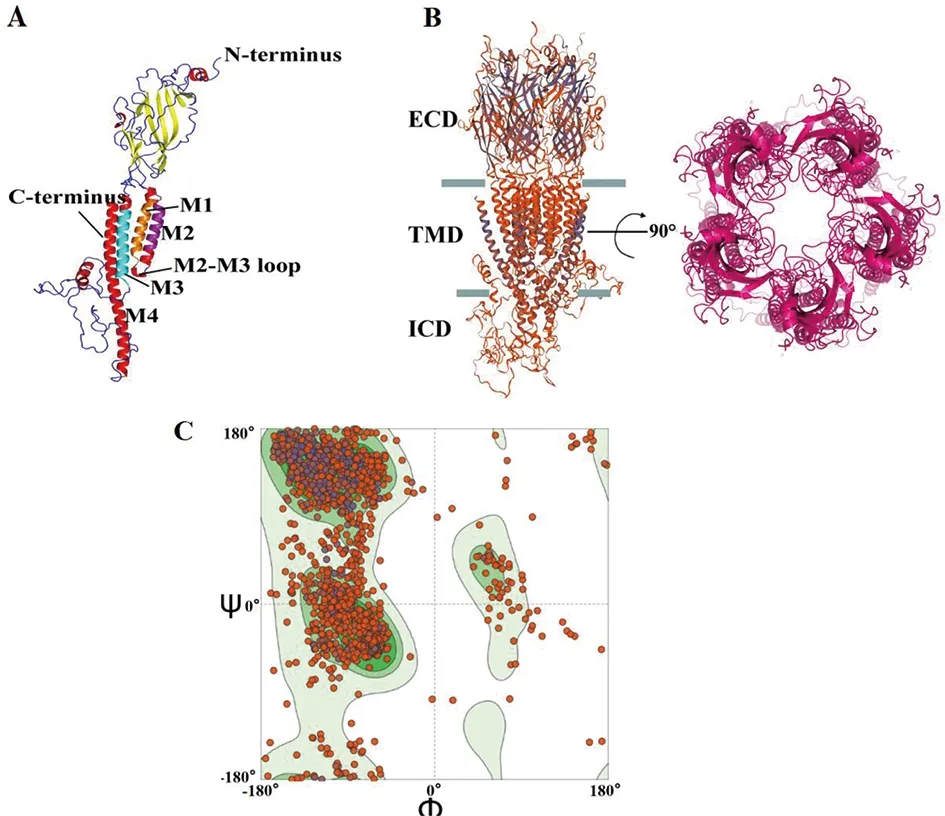
注:A:nAChR同源建模结果;B:nAChR同源五聚体结构预测,ECD:细胞外结构域;TMD:跨膜结构域;ICD:细胞内结构域;C:拉氏图。图5 nAChR三级结构预测Fig.5 Tertiary structure prediction of nAChR protein
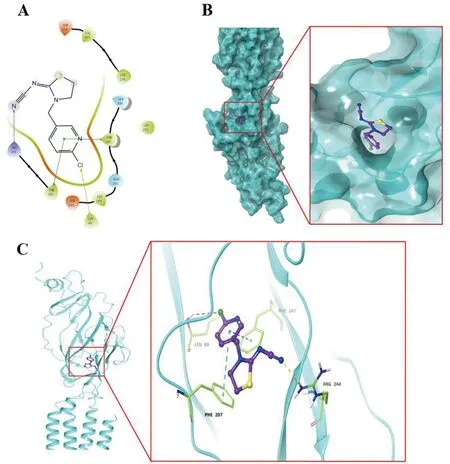
注:A:噻虫啉与nAChR分子对接表面图;B:噻虫啉与nAChR分子对接二维结构;C:噻虫啉与nAChR分子对接三维结构。图6 噻虫啉与nAChR分子对接Fig.6 Molecular docking of thiacloprid and nAChR
2.5 噻虫啉与nAChR分子对接 用Autodock vina 1.1.2软件计算nAChR蛋白与噻虫啉的结合能量为-6.4 kcal/mol。对接完成后,由表面图可以看出,噻虫啉和nAChR蛋白表面结合较为紧密,两者之间具有较好的匹配性,为噻虫啉结合到此处提供了可能。由噻虫啉和nAChR蛋白的相互作用图可以看出,噻虫啉与活性位点附近的PHE 207、PHE 241两个氨基酸形成Pi-Pi相互作用,与LEU 60之间形成一个盐桥,此外与ARG 244之间形成一个Pi-Pi相互作用。这些氢键相互作用促使噻虫啉稳定结合到nAChR蛋白活性位点,进而发挥杀虫活性。
2.6nAChR基因扩增及重组质粒构建 经PCR扩增后产物琼脂糖凝胶电泳显示单一的扩增条带(图7A),与研究的nAChR基因预期大小符合。将nAChR基因连接到pCMV-N-EGFP质粒,pCMV-EGFP-nAChR重组质粒经PstI酶切后得到2个条带,大小分别在1 500 bp和5 000 bp附近,与理论大小相符合(图7B)。pCMV-EGFP-nAChR重组质粒经测序鉴定证实序列与Wormbase Parasite数据库nAChR序列一致(图7C)。这些结果表明pCMV-EGFP-nAChR重组质粒构建成功。
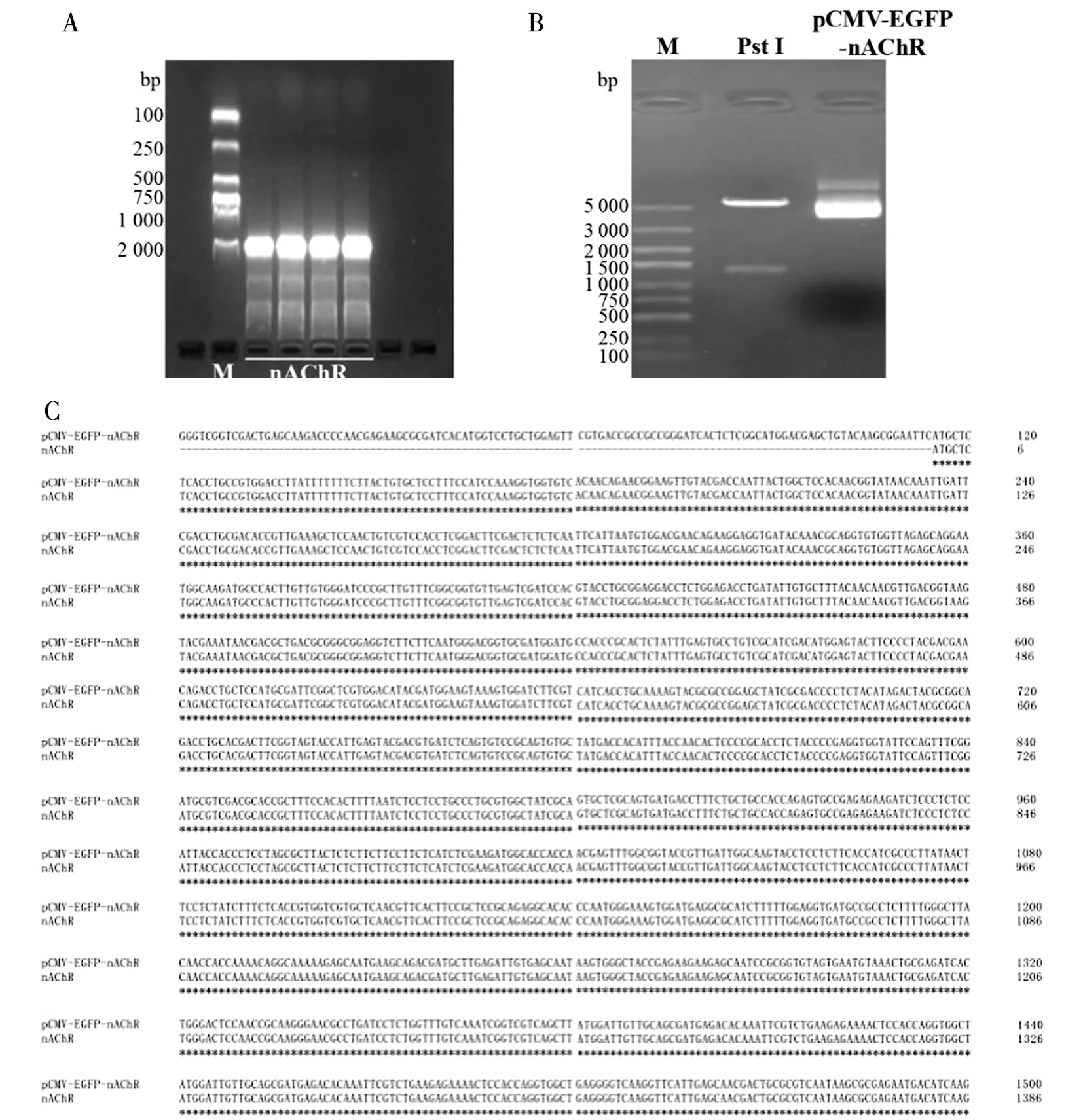
注:A为nAChR基因PCR产物电泳结果;B为pCMV-EGFP-nAChR重组质粒酶切鉴定电泳图;C为重组质粒测序结果与Wormbase Parasite数据库nAChR序列比对。图7 nAChR基因PCR产物和重组质粒鉴定Fig.7 Identification of nAChR gene PCR products and recombinant plasmids
2.7 nAChR重组质粒转染HEK293细胞检测 pCMV-EGFP-nAChR重组质粒或pCMV-EGFP质粒分别转染HEK293细胞,经过嘌呤霉素筛选后,荧光显微镜下观察到分别转染两种质粒组细胞中明显表达绿色荧光蛋白(图8A)。流式细胞术检测转染后表达EGFP荧光细胞比例,pCMV-EGFP组和pCMV-EGFP-nAChR组转染成功比例均达到95%以上(图8B)。
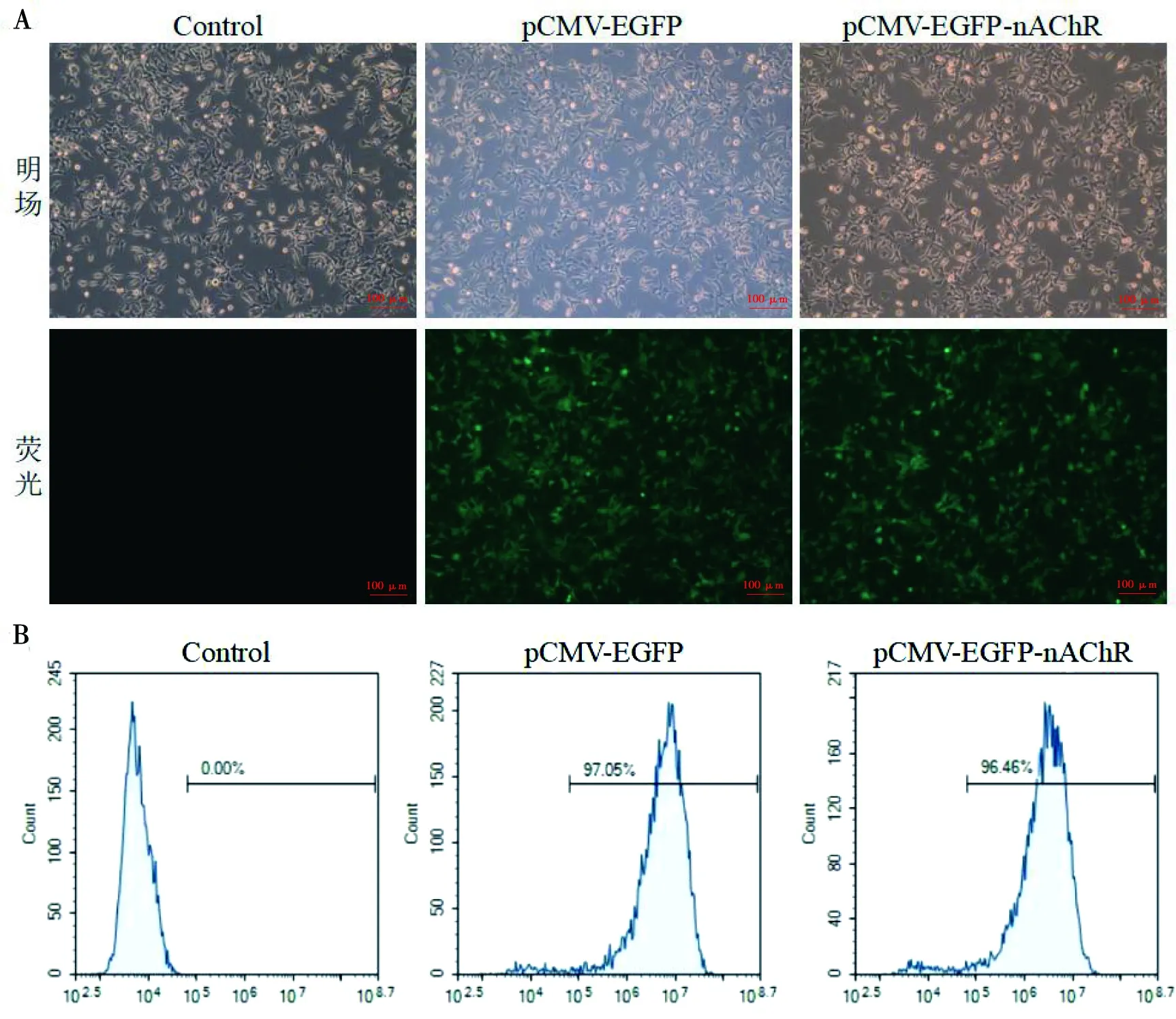
A:EGFP荧光观察(100×);B:流式细胞术检测转染效率。图8 重组nAChR质粒转染HEK293细胞Fig.8 Recombinant nAChR plasmid transfected into HEK293 cells
2.8 nAChR在HEK293细胞中稳定表达 在之前研究的基础上,进一步明确多房棘球绦虫nAChR基因在HEK293细胞中的表达。qPCR结果显示,转染pCMV-EGFP-nAChR质粒后能检测到明显的nAChR基因表达(图9A)Western blot结果显示,在27 kDa和70~100 kDa之间可见GFP阳性反应;在70~100 kDa之间的蛋白条带能与泡型包虫病小鼠血清发生免疫反应,而正常小鼠血清孵育后在70~100 kDa之间未见阳性反应条带(图9B)。使用泡型包虫病小鼠血清对转染后HEK293中nAChR进行免疫荧光鉴定。免疫荧光结果显示,经泡型包虫病小鼠血清孵育后,在HEK293细胞膜上观察到阳性表达,而正常小鼠血清未见阳性反应(图9C)。这些结果表明,nAChR在HEK293细胞膜上稳定表达。
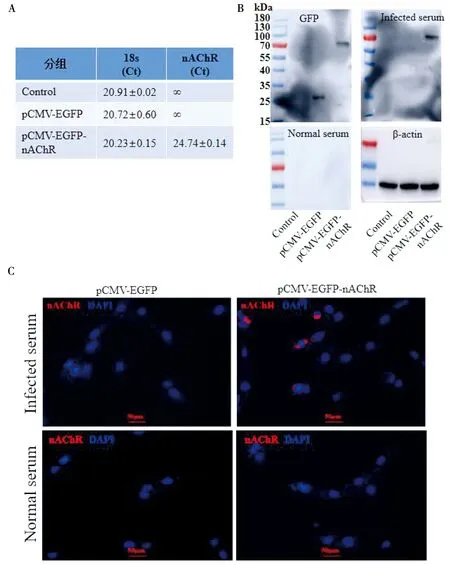
A:qPCR检测nAChR基因表达;B:Western blot检测nAChR蛋白表达;C:免疫荧光检测nAChR蛋白表达。图9 nAChR在HEK293细胞中表达鉴定Fig.9 Identification of nAChR expression in HEK293 cells
2.9 噻虫啉对nAChR-HEK293细胞全细胞膜电流的影响 为了检测噻虫啉对nAChR-HEK293细胞全细胞膜电流的影响,通过细胞旁灌流给药检测10 μg/mL噻虫啉作用后全细胞膜电流的改变。通过在荧光显微镜下观察pEGFP-N-nAChR重组质粒转染HEK293细胞后呈现明显的绿色荧光,并能清楚的观察到微电极钳制nAChR-HEK293细胞(图10A)。给予细胞外液终浓度为10 μg/mL噻虫啉细胞旁灌流给药,灌流速度为0.3 mL/min。10 μg/mL噻虫啉干预pEGFP-N-nAChR重组质粒转染HEK293细胞诱发出内向型膜电流,而转染LV-EGFP并未诱发出电流(图10B)。此外,100 μmol/L人乙酰胆碱作用于pEGFP-N-nAChR重组质粒转染HEK293未诱发出膜电流(图10B)。
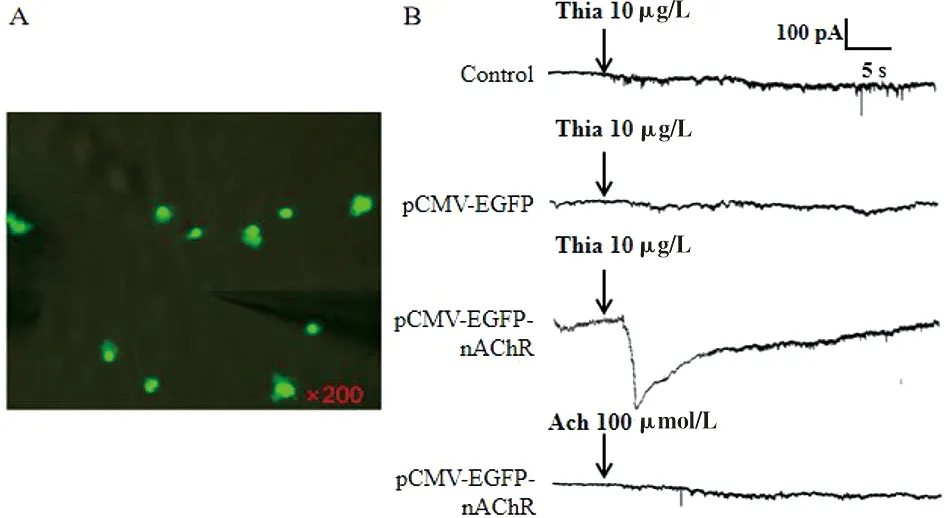
A:电极钳制细胞代表性图像;B:噻虫啉对转染后HEK293细胞全细胞膜电流的影响。图10 pEGFP-N-nAChR重组质粒转染HEK293后全细胞膜电流记录Fig.10 Recording of whole cell membrane currents after transfection of HEK293 with pEGFP-N-nAChR
2.10 噻虫啉对细胞内Ca2+浓度影响 为了初步探讨噻虫啉能与多房棘球绦虫nAChR结合引起离子通道开放,我们用钙离子探针检测稳定转染的nAChR-HEK293细胞中钙离子浓度的变化。5 μg/mL、10 μg/mL、20 μg/mL噻虫啉分别与nAChR-HEK293细胞孵育6 h(F=30.04,P<0.000 1)、12 h(F=177.10,P<0.000 1)和24 h(F=48.64,P<0.000 1),细胞内钙离子荧光强度逐渐增强(图11A)。结果表明,噻虫啉可能激活多房棘球绦虫的nAChR离子通道。进一步使用流式细胞术分析钙离子流变化如图11B所示。经噻虫啉处理20 min后流式检测可见,静止的nAChR-HEK293细胞显示稳定的钙离子基线。经不同浓度噻虫啉处理后,钙离子浓度增加,并在接下来的5 min内保持稳定。
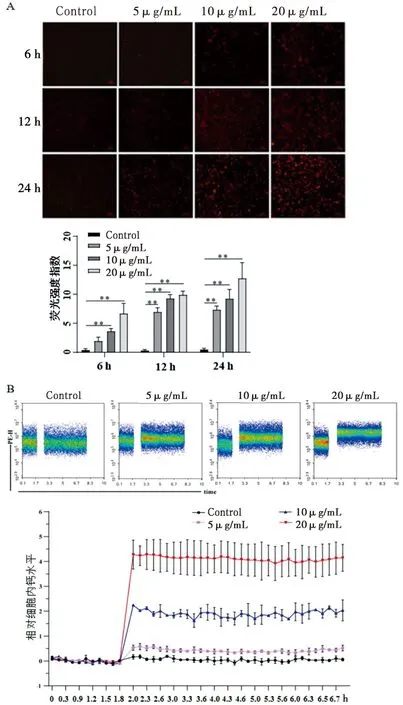
A:Rhod-2 AM定量检测细胞浆内游离Ca2+水平(200×);B:流式细胞术检测细胞内钙动员。**P<0.01 。图11 噻虫啉增加nAChR-HEK293细胞内钙离子水平Fig.11 Thiacloprid increases calcium levels in nAChR-HEK293 cells
3 讨 论
泡型包虫病是由多房棘球绦虫的后绦幼虫期感染宿主引起的一种人兽共患寄生虫病[20]。多房棘球绦虫的自然生命周期通常包括犬科类动物(通常是狐狸)作为终宿主和田鼠作为中间宿主[21]。然而,许多哺乳动物(包括人类)通过摄入寄生虫虫卵而感染成为中间宿主。甲苯达唑和阿苯达唑是目前获准用于人类的少数几种抗蠕虫药物[22]。然而,这些药物已被证明对泡型包虫病具有寄生虫抑制作用而非杀寄生虫作用[23]。同时,中断治疗后的高复发率和副作用限制了它们的应用[24]。因此,抗包虫病新药物或新靶点的发现显得尤为迫切。
靶向人类nAChRs的药物在临床上有重要的作用,它们为尼古丁成瘾、阿尔茨海默病和精神分裂症提供治疗方法,以及用于治疗一些由nAChR突变引起的神经疾病[25-27]。此外,通过靶向无脊椎动物nAChRs已经实现了对害虫和蠕虫寄生虫的有效控制[28-30]。一般来说,化合物需要适当的亲脂性才能显示出高杀虫作用,因为它们只能在穿过角质层和包裹神经系统的细胞后才能接触nAChR发挥杀虫效应。我们通过设计引物扩增出原头节nAChR基因,其扩增序列与Wormbase Parasite数据库序列一致,进一步明确了多房棘球绦虫原头节中nAChR基因的存在。研究表明,HEK293细胞膜上缺乏相应的受体,因而能够表达多种异源性基因,同时能为蛋白质的加工提供基础[31]。我们通过将nAChR基因克隆到荧光真核表达载体上,并在HEK293细胞上表达nAChR蛋白。
nAChRs作为胆碱能驱虫药的靶位,可由五个相同亚基或不同亚基组成五聚体膜蛋白,围绕一个中央阳离子可渗透孔[32-33]。不同nAChR亚基的组合导致在肌肉细胞上形成异聚受体,从而产生多种受体亚型,每种亚型具有不同的药理学和驱虫敏感性[34-35]。在本研究中,我们成功在HEK293细胞膜上表达多房棘球绦虫nAChR蛋白。在15 μmol/L噻虫啉作用于转染后的nAChR-HEK293细胞,随着时间的延长,细胞内钙离子荧光强度逐渐增强。全细胞膜电流检测显示噻虫啉干预后诱导内向型电流形成,这表明噻虫啉可能作用于转染后nAChR蛋白导致细胞内游离钙离子浓度增加。但nAChR在HEK293细胞膜上是否形成同源五聚体仍有待进一步研究证实。
总之,本研究在HEK293细胞上异源表达了其中一种nAChR,并分析nAChR与噻虫啉的分子对接构象。噻虫啉作用后证实能引起细胞内游离钙离子增加。
利益冲突:无
引用本文格式:王宇琦,达哇卓玛,张雨薇,等.噻虫啉对表达多房棘球绦虫nAChR基因HEK293细胞内钙的影响[J].中国人兽共患病学报,2023,39(8):739-749. DOI:10.3969/j.issn.1002-2694.2023.00.080
