羊口疮病毒SYBR Green I qPCR方法建立及VIR基因的遗传演化分析
2023-09-18卢昌杨邓亚飞吴佳颖苑君君贺绍君辛洪雷刘德义张留君
冯 星,卢昌杨,邓亚飞,吴佳颖,苑君君,贺绍君,辛洪雷,刘德义,张留君
羊口疮(orf)又称羊传染性脓疱病,是由羊口疮病毒(orf virus,ORFV)感染主要引起山羊和绵羊的一种急性、高度接触性、嗜上皮性传染病,人类以及多种野生动物如骆驼、驯鹿等也能够被ORFV感染[1]。orf在绝大多数养羊国家均有分布和流行,如中国、美国、印度、新西兰、澳大利亚等,给世界养羊业带来重大经济损失,同时也对公共卫生安全构成严重威胁[2-3]。本病主要是侵害6月龄以下的羔羊,患病羔羊在舌面、齿龈、口唇、鼻镜等部位常出现丘疹、脓疱、溃烂、结痂等临床症状,导致其吸吮乳汁及采食困难,营养摄入不足而免疫力低下,常继发多种病原微生物混合感染,因此羔羊病死率可高达20%-50%。另外,ORFV对外界环境有较强的抵抗力,并能逃避宿主免疫应答而引发持续性感染,一旦进入羊群将很难被彻底清除掉,这也是其造成更加严重危害的重要原因[4-5]。
ORFV是痘病毒科(Poxviridae)副痘病毒属(Parapoxvirus)的重要成员,具有包膜,基因组为一条双股线状DNA分子,全长140 kb左右。F1L基因处于ORFV基因组的中段区域,所编码的F1L囊膜蛋白在病毒入侵宿主细胞、基因组DNA复制及病毒粒子成熟等过程中均发挥着关键作用[6]。此外,F1L蛋白还可介导宿主机体细胞免疫应答和诱导机体病毒中和抗体生成,是研发ORFV亚单位疫苗的优良候选靶标抗原分子,同时,由于F1L基因位于ORFV基因组的高度保守区,其不同毒株间F1L基因的一致性超过95%,因此成为病原检测与诊断中的理想目标基因[7]。干扰素抗性基因(Interferon resistance gene,VIR)位于ORFV基因组的左端,是病毒的主要毒力基因,其编码产物为一种可抑制干扰素抗病毒活性的双链RNA(ds RNA)结合蛋白。该蛋白是ORFV的非结构蛋白,在病毒跨种感染和免疫逃逸等方面均发挥着重要功能,同时也不断遭受着来自宿主的免疫压力,在对orf进行流行病学调查和遗传演化分析时,VIR基因常常被选为靶基因[8-9]。
在我国,几乎所有养羊省份均有orf发生与流行情况的报道。近年来,随着大规模集约化养殖的兴起,我国各地羊场orf的发生频度不断上升,羊群经常呈暴发性流行,给养殖业造成严重的的经济损失,同时也威胁着人类的生命健康[10]。虽然针对orf进行了较多的研究,但国内目前仍缺乏可供利用的能防治该病的商品化疫苗,也尚无有效的抗ORFV药物和疗法[11]。因此,适时开展orf流行病学调查研究,尤其是病毒早期感染阶段的检测与诊断及病毒遗传变异分析,对防控orf具有重要的意义。安徽省肉羊养殖业体积庞大,且主要集中在皖北地区。并且,其养羊业近年来仍在迅速发展,规模化羊场的数量持续增加,orf现已成为安徽养羊业的主要传染病之一。然而,当前安徽省orf流行状况及病原变异情况并不十分清楚。因此,本研究基于ORFVF1L基因建立了一种快速、特异、灵敏的SYBR Green I嵌合荧光染料实时荧光定量PCR方法,对从皖北地区羊场采集的疑似orf羊临床样本进行检测,并比较、分析阳性病料中ORFVVIR基因的遗传变异情况,揭示病毒的分子遗传演化规律,为生产实践中orf的防控和治疗奠定理论基础。
1 材料与方法
1.1 毒株、菌株和病料 山羊痘活疫苗、鸡痘活疫苗均购自哈药集团。感受态细胞DH5-购自上海唯地生物。168份疑似orf羊临床样本(唇部痂皮、口拭子、血清等)于2021-2022年采集自安徽省皖北地区的20个规模化羊场,并保存在动物疫病监测与防控安徽省重点实验室超低温冰箱(-80 ℃)中备用。
1.2 主要试剂和仪器 病毒基因组DNA提取试剂盒购自OMEGA公司;质粒小量抽提试剂盒、DNA胶回收试剂盒和Taq Master Mix购自上海生工公司;DNA Marker、pMD19-T载体及SYBR Green I Premix Taq购自Takara公司。组织病料研磨仪购自QIAGEN公司;超微量紫外分光光度计购自Thermo Scientific公司;荧光定量PCR仪购自ABI公司。
1.3 引物设计与合成 下载GenBank中发布的ORFV基因组序列,同源比对后使用Primer 5.0软件在序列高度保守区设计3对特异性引物,分别用于SYBR Green I qPCR(qF1L-F/R)、标准质粒构建(F1L-F/R)和全长VIR基因扩增(VIR-F/R),引物信息见表1。

表1 引物信息Tab.1 Primer sequences
1.4 标准质粒的构建和制备 提取ORFV阳性样本中的病毒基因组DNA,并作为模板使用F1L-F/R引物PCR扩增全长F1L基因,反应程序为:94 ℃ 4 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 90 s,35个循环;72 ℃ 10 min。产物回收后连接至pMD19-T 载体,转化入DH5-感受态细胞中,涂板过夜培养后挑取单克隆并继续扩大培养。将PCR鉴定阳性的菌液提取质粒进行双酶切验证,并同时送检测序。对构建正确的重组质粒作为标准质粒保存,并根据测量浓度换算其拷贝数。
1.5 SYBR Green I qPCR检测方法的建立
1.5.1 反应条件优化 本实验采用SYBR Green I嵌合荧光法,以标准质粒为模板用实时荧光定量PCR仪进行扩增和数据分析。以能得到较小的阈值循环数(Ct值)、较高的荧光值、溶解曲线单一且特异为标准,分别对SYBR Green I Premix Taq酶浓度、引物浓度、退火温度、扩增体系等进行摸索和优化。
1.5.2 标准曲线建立 分别以不同拷贝数(1.0×102~1.0×109copies/μL)的标准质粒为模板,用优化好的反应条件进行实时荧光定量PCR,以质粒拷贝数为X轴,Ct值为Y轴绘制标准曲线。
1.5.3 特异性、敏感性和重复性试验 特异性试验:用已建立的ORFV SYBR Green I qPCR方法检测山羊痘和鸡痘疫苗毒株的核酸,并设立阴性对照,以验证其特异性。
敏感性试验:将已知拷贝数的标准质粒进行10倍梯度稀释,然后作为模板进行实时荧光定量PCR和普通PCR扩增,计算两种方法所能检出的最低模板拷贝数,并同时对其敏感性进行比较。
重复性试验:用已建立的实时荧光定量PCR方法,以相同拷贝数标准质粒为模板进行组内重复试验;选取3个不同浓度(104~106copies/μL)的标准质粒为模板,分别在同等条件下进行扩增,每个浓度重复检测3次,进行组间重复试验;通过计算变异系数对荧光定量PCR方法的组内及组间重复性进行分析。
1.6 临床样本的检测 将采集的168份临床样本处理后提取DNA作为模板,用建立的ORFV SYBR Green I qPCR和普通PCR法分别检测,比较、分析阳性检出结果。
1.7 阳性临床样本中ORFVVIR全长基因的扩增、测序和遗传演化分析 使用表1中的VIR-F/R引物,PCR扩增阳性临床样本中ORFV的VIR全长基因,反应程序为:94 ℃ 4 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 60 s,35个循环;72 ℃ 10 min。扩增产物直接送上海生工公司测序。基于已测序样本毒株VIR基因及GenBank中已收录参考ORFV毒株(见表2)VIR基因的全长核苷酸序列,用MEGA 7.0软件构建ORFV毒株间的遗传进化树(Neighbor-Joining树,1 000 bootstrap),并用DNA Star 7.0软件进行氨基酸序列同源性比较和分析。
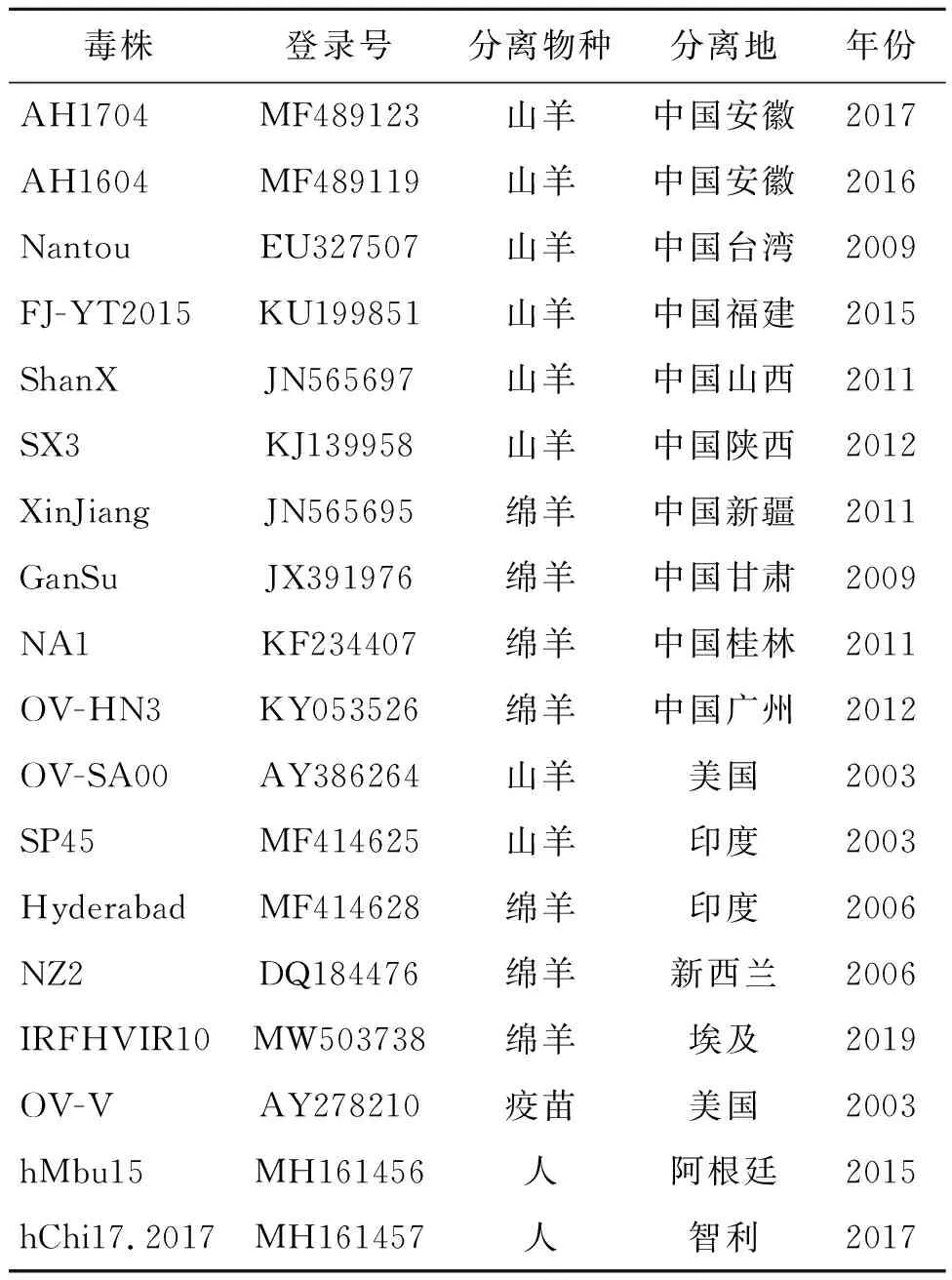
表2 参考毒株信息Tab.2 Information on reference strains
2 结 果
2.1 重组标准质粒pMD19T-F1L的制备结果 重组标准质粒经PCR鉴定、双酶切鉴定及测序验证,证实重组标准质粒构建成功。
2.2 实时荧光定量PCR反应条件的优化结果 经筛选优化,确定实时荧光定量PCR 最佳反应体系为10 μL:SYBR Green I Premix Taq酶4 μL,上、下游引物qF1L-F/R(20 μmol/L)各0.5 μL,去离子水4 μL,模板DNA 1 μL。最佳反应程序为:95 ℃ 60 s;95 ℃ 5 s,61 ℃ 15 s,共计循环40次;反应结束后PCR仪自动生成融解曲线和扩增动力学曲线。
2.3 实时荧光定量PCR标准曲线的建立结果 使用已优化的实时荧光定量PCR反应条件,以8个连续梯度浓度(102~109copies/μL)的标准质粒为模板进行扩增,并以标准质粒拷贝数的对数值为横坐标(X轴),Ct值为纵坐标(Y轴)绘制标准曲线。结果显示,不同浓度质粒模板PCR扩增曲线间距均匀,拷贝数与Ct值保持良好线性关系:y=-3.393x+40.698,相关系数(R2)=0.994,扩增效率(E%)=95.62%(图1)。熔解曲线结果显示,不同浓度标准质粒模板扩增均为单一波峰,无引物二聚体产生,融解温度88.5 °C左右,且所有波峰基本重合,阴性对照无波峰(图2),表明PCR扩增中未被污染,试验数据可信度高。

图2 ORFV荧光定量PCR熔解曲线Fig.2 Melting curve for qPCR of ORFV
2.4 实时荧光定量PCR的特异性、敏感性和重复性检测结果
2.4.1 特异性检测结果 采用已建立的实时荧光定量PCR方法对山羊痘、鸡痘疫苗毒提取的DNA进行检测,均未出现特异性扩增,且阴性对照也无扩增曲线,而质粒标准品及ORFV阳性样本均有良好扩增(图3),表明本试验方法特异性较强。
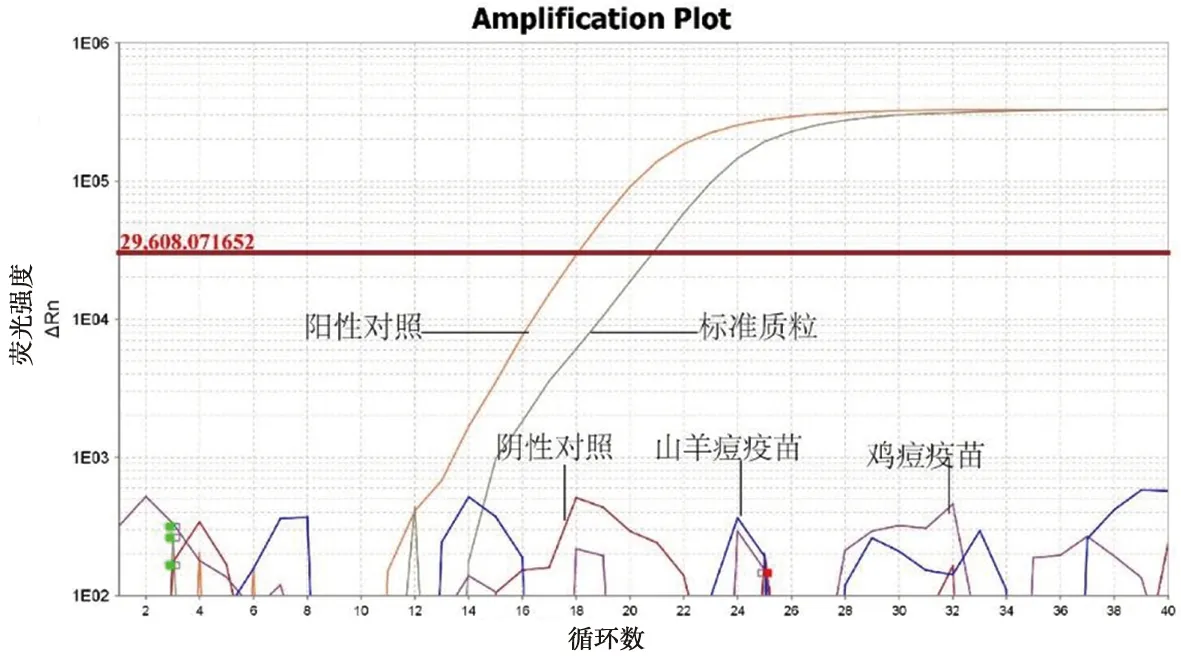
图3 ORFV荧光定量PCR特异性扩增曲线Fig.3 ORFV PCR-specific amplification curve
2.4.2 敏感性检测结果 以7个梯度浓度标准质粒(100~106copies/μL)为模板进行敏感性检测。结果显示,实时荧光定量PCR法检测下限为101copies/μL,而常规PCR法检测下限为103copies/μL,本次建立的实时荧光定量PCR方法敏感性优于常规PCR,检测结果可信度更高。
2.4.3 重复性检测结果 使用实时荧光定量PCR对3个不同浓度梯度标准质粒(104~106copies/μL)的检测结果显示,不同浓度标准质粒模板的批内扩增变异系数为0.44%~1.14%,批间扩增变异系数为2.82%~3.16%(表3),表明试验重复性良好。
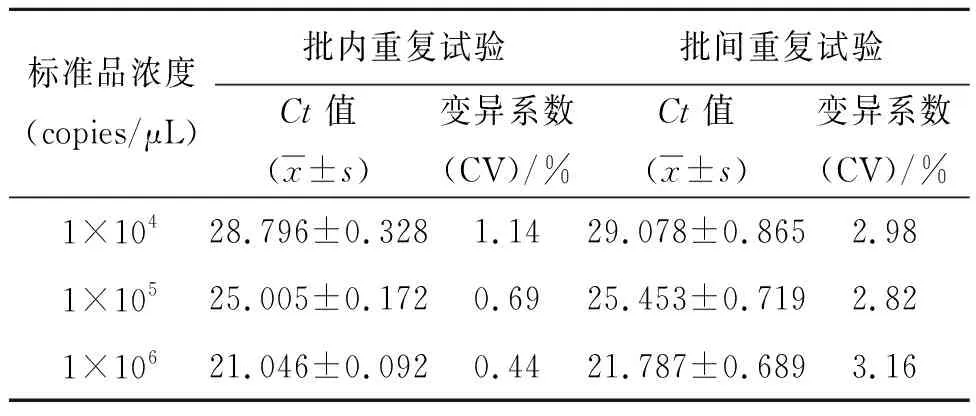
表3 实时荧光定量PCR的Ct值Tab.3 Ct value of SYBR Green Ⅰ real-time fluorescence qPCR
2.5 临床样本的检测结果 使用所建立的ORFV SYBR Green I qPCR方法对168份采集自安徽省皖北地区不同羊场的疑似orf临床样本进行检测,其ORFV总体阳性率为37.5%(63/168),其中山羊为28%(28 /100),绵羊为51.5%(35/68)。
2.6 ORFVVIR基因的进化树分析结果 经PCR扩增和测序,共得到52条阳性样本中ORFV的全长VIR基因序列,其中山羊源和绵羊源分别为21条和31条。将其与GenBank收录的15株国内外ORFV参考毒株的完整VIR基因一起作遗传演化分析。进化树分析显示,已构建的NJ进化树可分为两个主要分支,其中本次试验的21株山羊源毒株与8株国内外山羊源参考毒株(AH1704、AH1604、Nantou、FJ-YT2015、ShanX、SX3、OV-SA00、SP45)和1株人源参考毒株(hChi17.2017)位于一个大分支,而本次试验的31株绵羊源毒株与7株国内外绵羊源参考毒株(XinJiang、GanSu、NA1、OV-HN3、Hyderabad、NZ2、IRFHVIR10)、1株人源参考毒株(hMbu15)和1株疫苗毒株(OV-V)位于另一个遗传距离较远的独立分支上(图4)。

●:2021-2022年阳性样品分离株图4 基于ORFV-VIR基因序列以邻近法所构建的系统发育树(NJ树)Fig.4 Phylogenetic tree (NJ tree) constructed with the proximity method based on the ORFV-VIR gene sequence
2.7 ORFVVIR基因的核苷酸及氨基酸序列比对分析结果 核苷酸和氨基酸序列多重比对分析显示,本次试验的52株阳性样本毒株的VIR基因编码183个氨基酸,均未出现碱基对的增添和缺失,其相互间核苷酸和所推导氨基酸序列的同源性分别为95.8%~100.0%和93.5%~100.0%,与参考毒株VIR基因核苷酸序列和氨基酸序列的同源性分别为95.1%~100.0%和91.3%~100.0%(表4)。此外,本次测得的21株山羊源阳性样本毒株VIR基因间核苷酸和所推导氨基酸序列的同源性分别为98.6%~100.0%和98.4%~100.0%,与参考毒株VIR基因核苷酸序列和氨基酸序列的同源性分别为95.3%~100.0%和92.9%~100.0%,其中与国内山羊源AH1704、Nantou、SX3毒株同源性最高,氨基酸同源性均为98.9%~100.0%,而本次测得的31株绵羊源阳性样本毒株VIR基因间核苷酸和所推导氨基酸序列的同源性分别为99.5%~100.0%和99.5%~100.0%,与参考毒株VIR基因核苷酸序列和氨基酸序列的同源性分别为95.1%~100.0%和91.8%~100.0%,其中与国内绵羊源Xinjiang、Gansu、Na1、OV-HN3同源性最高,核苷酸序列和氨基酸序列均为99.5%~100.0%,疫苗株与绵羊源阳性样本分离株同源性更高,氨基酸序列同源性为95.1%~95.7%(表4)。对VIR基因进一步分析显示,所有山羊源毒株VIR基因的氨基酸序列与绵羊源毒株存在较多突变,其位点主要分布在第14、17、24、47、97、101、103、122、124、135、140、154和169位氨基酸处。另外,人源毒株VIR基因氨基酸突变位点与所有山羊源和绵羊源毒株均存在较大差异(图5)。

图5 VIR基因推导的氨基酸序列分析Fig.5 Analysis of amino acid sequences derived from the VIR gene

表4 52株ORFV分离株和国内外参考分离株VIR核苷酸和氨基酸序列同源性分析(%)Tab.4 Analysis of VIR nucleotide and amino acid sequence identities (%) of the 52 Anhui ORFV isolates and the reference ORFV isolates from China and abroad
3 讨 论
orf是一种广泛分布于世界上各个养羊国家和地区的人兽共患传染病。本病在成年羊群中发生较少且多呈隐性经过,但在羔羊群中具有较高的发病率和死亡率,并可引发多种病原混合感染或继发感染,同时造成持续性感染,不仅降低羊场经济效益,而且威胁从业人员身体健康[12-13]。orf现已成为严重影响世界养羊生产的主要病毒性传染病之一,也是阻碍我国养羊业健康可持续发展的重要不利因素。目前,国内外尚无针对orf的有效药物和治疗方法,疫苗免疫接种是预防和控制该病的重要措施,但是灭活疫苗因诱导中和抗体能力低、持续时间短而保护效果较差,弱毒疫苗又因容易出现毒力反强而存在散毒风险。我国至今还没有可供利用的商品化orf疫苗,疫苗的研制仍停留在实验室评估阶段,并且不同地区流行的毒株还存在一定的遗传差异,这大大增加了orf的防控难度[14]。因此,及时地对该病做出准确诊断,确定感染毒株的类型,对受感染羊进行隔离与对症治疗,是控制该病的有效途径。
目前,病毒分离、电子显微镜观察、血清学方法、普通PCR、环介导等温扩增技术(LAMP)、TaqMan探针法实时荧光定量PCR、染料法 qPCR等已相继被用于orf的临床诊断[15]。但以上方法均存在一定的不足之处,如:操作复杂且耗时较长,只适合检测小量样本;易发生交叉反应,导致特异性降低;敏感性较低,易出现假阴性;易污染而造成假阳性;检测成本较高,难以满足规模化羊场的全面筛查等[6,15-17]。在本次研究中,我们根据ORFVF1L基因高度保守区片段设计了1对特异性引物,并以构建的pMD19T-F1L重组质粒作为阳性标准品,建立了用于检测ORFV DNA的SYBR Green I qPCR方法。所建立的qPCR方法检测时间短;特异性强,只能扩增出ORFV核酸DNA,与痘病毒科的其它成员如山羊痘和鸡痘疫苗毒均无交叉反应;灵敏度高,最低有效检测量为10 copies/μL,是普通PCR的100倍;花费少,包括样品前处理在内,单个样本的检测费用不足10元,从而实现了在感染早期阶段对ORFV的快速、特异、灵敏和低成本的批量检测与诊断。使用该qPCR方法对从安徽省皖北地区采集的168份疑似orf临床样本进行检测,病毒总阳性率为37.5%(63/168),其中山羊为28%(28/100),绵羊为51.5%(35 /68)。这些结果表明,皖北地区羊群存在ORFV普遍感染现象,应进一步加强对该地区orf的监测与防控。建议针对病毒阳性羊群除了严格隔离与对症治疗外,必要时应及时进行淘汰处理,同时也应避免养殖场工作人员的感染。
VIR基因是ORFV的主要毒力基因,编码一种可抑制宿主干扰素抗病毒活性的ds RNA结合蛋白,参与病毒早期感染,并与病毒跨种感染及免疫逃逸密切相关[9]。在对orf进行流行病学调查及抗原性分析时,VIR基因常被作为研究对象。为了进一步明确安徽省皖北地区ORFV流行毒株的分子遗传特征。本研究对阳性样本中ORFV全长VIR基因进行PCR扩增和测序,得到了52株病毒的完整VIR基因序列,其中山羊源21株,绵羊源31株。进化树分析显示,21株山羊源毒株与8株国内外山羊源参考毒株和1株人源参考毒株位于同一大分支,而31株绵羊源毒株与7株国内外绵羊源参考毒株、1株人源参考毒株及1株疫苗毒株位于另一独立分支,表明不同宿主来源毒株间其遗传距离较远。序列多重比对分析显示,52株病毒分离株VIR基因间DNA及氨基酸序列的同源性分别为95.8%~100.0% 和93.5%~100.0%,明显低于之前的报道[18],表明皖北地区ORFV存在较大程度的遗传变异。21株山羊源毒株与安徽参考毒株(AH1704)、台湾株(Nantou)、山西株(SX3)同源性较高,氨基酸同源性均在98.9%以上。31株绵羊源毒株与国内新疆株(Xinjiang)、甘肃株(GanSu)、桂林株(Na1)、广东株(OV-HN3)同源性较高,氨基酸同源性为99.5%~100%。此外,31株绵羊源毒株与美国疫苗株OV-V处于同一分支,并且其氨基酸同源性也较高(95.1%~95.7%),而该疫苗株并未在我国注册和批准使用。根据以上结果,推测安徽皖北地区orf流行可能与羊群相互频繁调运或引种不当有关,同时也再次提示弱毒疫苗可能存在返毒、散度等安全风险,应加强调运和引种过程中的检疫。进一步氨基酸序列分析显示,所有山羊源、绵羊源和人源毒株的VIR基因氨基酸序列间存在较大差异,主要突变位点位于第14、17、24、47、97、101、103、122、124、135、140、154和169位等氨基酸处,推测这些氨基酸位点可能与宿主适应性相关,这些变化可能是病毒在跨种感染过程中为了适应不同宿主或遭受不同选择压力而引起的,这些位点的功能有待于进一步的研究验证[19-20]。值得注意的是,人类宿主来源的两株ORFV分离株亲缘关系较远,与绵羊、山羊宿主来源的分离株氨基酸同源性较低,表明人类宿主的毒株变异情况可能更为复杂。
总之,orf作为严重危害养羊业可持续发展及人类健康的重要疫病之一,其病原致病机制不明、病毒变异情况复杂、缺乏有效疫苗与治疗方法,快速诊断和确定病原类型是控制该病的有力措施。本研究基于ORFVF1L基因建立了一种快捷、特异、灵敏、低成本的SYBR Green I实时荧光定量PCR方法,不仅适用于对ORFV的检测和诊断,还能对临床检测样本中病毒含量进行精准定量,在为ORFV早期监测及流行病学调查提供有效手段的同时,也为未来开展ORFV实验室研究等奠定了良好基础。对安徽省皖北地区羊场ORFV流行毒株VIR基因的遗传变异分析,有助于揭示病毒的分子遗传演化规律,明确感染毒株的类型,以便采取针对性防治措施,也可为病毒致病机制研究及有效疫苗设计开发提供理论参考。
利益冲突:无
引用本文格式:冯星,卢昌杨,邓亚飞,等.羊口疮病毒SYBR Green I qPCR方法建立及VIR基因的遗传演化分析[J].中国人兽共患病学报,2023,39(8):772-779. DOI:10.3969/j.issn.1002-2694.2023.00.084
