抗结核抗菌肽及其纳米药物递送系统的研究进展
2023-09-18袁廷勋何欣雨王佳齐
袁廷勋,何欣雨,王佳齐,李 倩
结核病是由结核分枝杆菌(Mycobacteriumtuberculosis, MTB)复合群菌株感染导致的单因致死率顺位第二传染性疾病。尽管已有高效抗结核药物和结核病推荐治疗方案,但结核病仍在世界各地广泛传播。根据世界卫生组织的统计,2021年全球约有1 060万人患有结核病[1],超过140万人死于结核病;由于新冠肺炎大流行减少了结核病诊断和治疗的机会,结核病发病率在2020年至2021年间上升了3.6%,而过去20年大部分时间中该数据每年约下降2%。目前的结核病治疗方案治疗周期长,必须在治疗的前2个月同时服用4种口服药物(异烟肼、乙胺丁醇、吡嗪酰胺和利福平),然后在继续治疗阶段连续4个月服用异烟肼和利福平[2]。这种模式虽然具有较高的有效治疗率,但存在药物价格昂贵、毒副作用大和患者耐受性差等问题[3]。并且,由于抗生素的过度或不合理使用,结核耐药菌株的问题也随之而来[4]。耐药结核病患者则需要增加贝达喹啉、普托马尼、利奈唑胺或莫西沙星等药物加强治疗[5],但这些药物更加昂贵、毒副作用更大,且需要的疗程比治疗药物敏感结核病更长。而据世界卫生组织的数据,2021年约有45万例耐多药或耐利福平结核病患者,比2020年增长3.1%[1],结核病防治形势依旧严峻且面临着重大挑战。对新的抗菌药物资源的需求变得非常迫切。
抗菌肽(Antimicrobial peptides, AMPs)被认为是“天然抗生素”,广泛存在于动物、植物、细菌和真菌中[6]。截止到2023年4月,AMPs数据库共报告了3 569种AMPs,其中380种来自细菌,5种来自古细菌,8种来自原生动物,25种来自真菌,371种来自植物,2 600种来自动物,及一些合成肽。AMPs具有广谱、快速的杀菌活性,且病原体获得抗性的概率很低。除抗菌活性外,AMPs还具有多种生物学功能,如抗癌,免疫调节,促血管生成,促伤口愈合等[7-9]。由于AMPs对包括MTB在内的各种病原菌表现出显著的抑菌性和其他优势,因此引起了微生物学家和医学科研人员的广泛关注。本篇综述了抗结核AMPs的特征、作用机制和靶点,及抗结核抗菌肽的与化疗药物联用、生产、修饰和优化等方面的研究现状,并分析了纳米材料作为抗结核药物和抗菌肽递送载体的研究与应用。
1 抗结核AMPs的特征、作用机制和靶点
1.1 抗结核AMPs的特征 抗结核AMPs通常含20-60个氨基酸残基,具有疏水区和亲水区,使它们具有两亲性,有利于它们与MTB富含脂质的生物膜相互作用,同时保持它们在水环境中的溶解度[10-11]。绝大多数抗结核AMPs表面带正电荷。由于MTB菌体表面带负电荷,同时菌体内部存在较高的负跨膜电位,这些都增强了MTB与抗结核AMPs之间的静电吸引;而真核细胞的细胞膜总体呈中性,因此电荷属性也是抗结核AMPs具有高效杀菌率和体内安全性的因素之一。抗结核AMPs根据其二级结构可分为4种:α-螺旋、β-折叠、环状和延伸结构,其中α-螺旋和β-折叠是所有AMPs中最常见的二级结构。在α-螺旋AMPs中,疏水氨基酸残基与亲水残基分离,并聚集在螺旋的一侧,导致螺旋疏水侧的形成[12-14]。β-折叠AMPs是由二硫键稳定的两亲分子,这些肽比它们的α-螺旋对应物具有更高的构象刚性[15]。
1.2 抗结核AMPs的作用机制和靶点 作为AMPs的主要理化性质之一,表面电荷显著影响其抗菌效果。阳离子抗结核AMPs发挥抗菌活性的主要因素之一是与细菌外层的带负电成分产生静电作用,如脂多糖、脂磷壁酸和甘露糖蛋白等。例如,AMPs LL-37能够与MTB带负电荷的细胞壁结合并使其破裂,从而引起细菌死亡[16]。而阴离子AMPs可能存在不同于阳离子AMPs的作用机制。例如,一种来自人体汗腺的阴离子AMPs—Dermcidin,其抗结核活性主要是通过抑制核糖核酸、蛋白质或细胞壁的生物合成来实现的[17-18]。并且,很多抗结核AMPs的作用机制并不唯一,如β-防御素除了直接作用于细胞膜导致细胞膜破坏外,还可以通过诱导单链DNA断裂来导致大分子生物合成的普遍抑制[19]。各抗结核AMPs的作用靶点与机制、以及抑菌浓度见表1和图1。此外,AMPs在对抗MTB的先天免疫应答中也发挥着重要作用[20],可以直接或间接地影响和调节不同细胞群的各种细胞活性[21],如通过吸引中性粒细胞、单核细胞、巨噬细胞,来调节炎症细胞的反应,控制促炎和抗炎细胞因子的表达[22]。

表1 抗结核AMPs的作用机制Tab.1 Mechanism of action of anti-tuberculosis AMPs
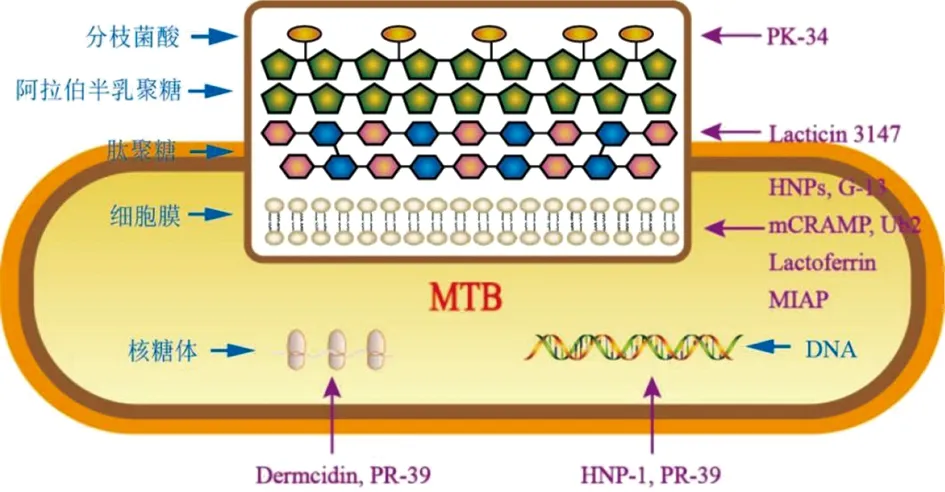
注:本图整体描述的是抗菌肽对结核分枝杆菌作用靶点的结构模型;长椭圆形图形代表结核分枝杆菌菌体;中间方框内为菌体细胞壁和细胞膜的结构模式展示,包括两者的结构与组成。蓝色文字及箭头指示的是结核分枝杆菌的具体内部结构的名称。紫色文字是各抗菌肽的名称;紫色箭头指示的是各抗菌肽作用的具体靶点,如HNP-1的作用靶点是菌体DNA,PK-34的作用靶点是菌体分枝菌酸。图1 抗结核AMPs的作用靶点Fig.1 Targets of action of anti-tuberculosis AMPs
2 抗结核AMPs研究现状
2.1 抗结核AMPs与抗结核药物的联合作用 AMPs与结核化疗药物联用可以显著提升治疗效果,减少耐药菌的不利影响。Khara等[23]报道,多肽M(LLKK)2M增强了MTB对利福平的渗透性,与利福平的联合使用提高了单独使用一种药物对MTB的抑制作用。Rao等[24]证明了NZX(一种真菌AMPs)与异烟肼和乙胺丁醇具有对MTB的叠加抑菌效应;AMPs与抗生素联合用药在小鼠模型中比单独使用抗生素能更好地保护肺部结构。细菌素AS-48是由粪肠球菌产生的AMPs,在感染MTB H37Rv的Raw 264.7细胞模型中,其和乙胺丁醇的部分抑菌浓度指数为0.18~0.5,表现出协同作用;药物联用能更有效地抑制巨噬细胞内感染的MTB。且AS-48在浓度低于128 μg/mL时(对MTB的MIC为64 μg/mL),对THP-1、MHS和J774.2巨噬细胞系未表现出任何细胞毒性[25]。由此可见,AMPs与抗菌药物联用,有助于缩短结核病的疗程,减少化疗药物的用量,降低毒副作用,达到“事半功倍”的效果,具有广阔的发展前景。
2.2 抗结核AMPs的生产 化学合成、重组DNA技术、无细胞表达系统和转基因植物或动物,都已经被用于经济高效的生产AMPs,来有效克服从原始生物样本中纯化出天然AMPs的低效性、高成本的问题。尤其是重组DNA技术在AMPs的生产中具有巨大优势,已广泛、成熟的应用于AMPs的异源表达。如使用大肠杆菌生产重组LL-37,不仅保持了LL-37的抗菌和免疫调节活性[26],并且LL-37以融合蛋白的形式表达,保护它们不易被蛋白酶降解。Wang等[27]利用大肠杆菌原核表达系统生产了AMPs PK34,获得的重组PK34对MTB的MIC低于合成PK34,具有更好的抑菌活性。此外,苏峰[28]构建了HBD-3真核表达载体并将其转入靶细胞;结果表明转基因细胞分泌的HBD-3蛋白在MTB侵染时极显著升高,且分泌的HBD-3蛋白能够显著地抑制MTB的生长。
2.3 抗结核AMPs的修饰和优化设计 AMPs的修饰、优化设计策略在增强抗菌活性、提高自身稳定性方面表现出巨大的潜力,是AMPs研究的重要领域。改变AMPs的疏水性可以影响其抗菌活性。Khara等[29]通过研究一系列由骨架序列(LLKK)2构成的短α螺旋抗结核肽,发现疏水性和α螺旋性的差异导致这些肽的抗分枝杆菌活性不同;其中最疏水的肽与利福平还具有协同作用,可能是通过增强药物在细胞内的接触而介导的。增加AMPs的净正电荷可以增强AMPs分子与细菌细胞膜之间的静电作用,使膜聚集肽的数量更容易达到膜破裂的阈值浓度,同样可以增强AMPs的抗菌活性。LLKKK-18是LL-37的截短变体,其中极性不带电荷的残基谷氨酰胺(Q22)、天冬酰胺(N30)和带负电荷的天冬氨酸(D26)被带正电荷的赖氨酸取代。与LL-37相比LLLKKK-18对耻垢分枝杆菌的抗菌活性更强,并且对巨噬细胞没有细胞毒性作用[30]。此外,基团的引入或修饰也可以提高AMPs的活性。Li等[31]在一种新型尿苷肽Sansanmycin A的氨基末端引入异丙基提高了其抗MTB活性。对AMPs的优化设计还有很多,但是AMPs的临床应用仍是一个漫长而艰巨的过程。对AMPs的持续研究将逐渐明确其结构与功能的关系,持续改善其稳定性和生物活性,进一步促进药物治疗和医疗保健领域的创新。
2.4 抗结核AMPs的局限和面临的挑战 AMPs为防治MTB感染提供了可靠选择,但实现其临床应用仍有许多问题需要考虑。AMPs的低代谢稳定性是临床应用中的常见问题,是限制其临床应用的关键因素。由于消化道酶的消化作用和肠道黏膜通透性较差的问题,使得口服AMPs生物利用度较低。而血液中蛋白酶的酶解,及肝脏和肾脏的清除作用,缩短了静脉给药的半衰期[32]。因而目前AMPs的临床应用多局限于皮肤局部用药。若要提高AMPs的治疗潜力,急需找到更合适的给药途径,提高给药利用率。此外,作为抗菌药物使用的多肽需要在体内达到足够高的浓度才可以有效地杀死病原体,如人HNP 1-3、兔中性粒细胞肽、protegrin、PR-39只有在浓度高达50 μg/mL时才能杀死MTB。而高浓度多肽可能对人体产生毒副作用[33-34]。如人HNP-1在高浓度下可对人类淋巴细胞、中性粒细胞、内皮细胞等多种细胞表现出细胞毒性[35]。同时,AMPs的广谱抗菌特性也可能会造成人体内固有正常菌群的清除和微生物菌群的紊乱[36]。
3 抗结核AMPs纳米药物递送系统的应用
3.1 抗结核药物载体药物递送系统 传统的结核病治疗方案常常导致患者依从性降低、感染复发或多重耐药性的产生。因此,研究和制定更科学有效的治疗方案,以克服化疗药物面临的问题,显得尤为迫切。药物递送系统可以在空间、时间及剂量上全面调控药物在生物体内分布,达到在恰当的时机将适量的药物递送到正确位置的目的。纳米材料递送系统可以直接将药物递送到受感染的细胞,具有稳定性高、载药量高、药物靶向性增强、改变给药途径及延长药物从基质释放时间等多项优点,能够提高药物生物利用度并降低给药频率[37]。因此,纳米材料在结核病治疗和预防领域表现出了相当大的潜力,为结核病治疗提供了一个新视角[38]。
目前已有多项研究证明了基于纳米材料的抗结核化疗药物递送载体的有效性。例如,脂质体具有易生物降解、无免疫原性和无毒性等特点,被广泛用作为多种药物的载体[39]。Khatak等[40]制备的负载抗结核药物的脂质体,能使药物的释放变缓,其体外抗菌效果比原始药物提高了约一倍。脂质体甚至也可以作为一种有效的疫苗递送系统,提供更高的抗结核病感染的长期保护效力[41]。无机纳米材料因其易于表面修饰、载药率高等优点,也常作为抗结核药物的载体。Ellis等[42]开发了含有银纳米颗粒和氧化锌纳米颗粒的可生物降解多金属微粒,用于将利福平等抗结核药物递送到肺部感染巨噬细胞的内体系统,增加了MTB膜通透性,提高了药物效力。由此可见,纳米药物递送系统在结核病的治疗方面具有较高的应用前景。
3.2 抗结核AMPs纳米药物递送系统 尽管AMPs有望成为结核耐药的有效解决方式,但AMPs的细胞毒性、稳定性差等问题,严重阻碍了它们的临床应用。纳米载体递送抗结核化疗药物的研究成果和成功经验,给研究人员带来启发,并将其应用于抗结核AMPs的递送。
3.2.1 无机纳米颗粒 由碳、介孔硅、金或银等构建的无机纳米载体,在抗结核药物递送上的展现出巨大潜力,也在AMPs药物递送领域受到广泛关注。Casciaro等[43]报道了金纳米颗粒和蛙皮AMPs衍生物之间的共价共轭方法。与游离的AMPs相比,共轭的纳米颗粒对铜绿假单胞菌的抗菌活性明显增强,并且对胰蛋白酶水解的抵抗力更强。Fei等[44]将银纳米粒子与AMPs结合起来,发现AMPs封端的银纳米簇表现出显著增强的抗菌活性,而且不会在哺乳动物细胞中引起显著的细胞毒性。而介孔二氧化硅纳米颗粒因其出色的生物相容性、可降解性以及巨大的化学和生物稳定性,在递送抗结核AMPs的优势日益显著[45]。Tenland等[46]制备了含有NZX的介孔二氧化硅颗粒纳米颗粒(MSP),为治疗结核感染提供了一个有效的策略。研究发现,含有NZX的MSP可以被感染MTB H37Rv的原代巨噬细胞摄取;与游离NZX相比,含有NZX的MSP显示出更强的杀菌能力。并且在小鼠感染模型中证明,MSP可以在体内更好的保留NZX消除MTB的活性。NapFab是一种通过从支气管肺泡灌洗液中分离和肽优化得到的新型AMPs,对细胞外MTB表现出强大的活性,但由于细胞内摄取量低,对细胞内MTB的活性有限。因此,Beitzinger等[47]将NapFab加载到树突状介孔二氧化硅纳米颗粒上,发现被纳米颗粒负载的肽可以被感染MTB的巨噬细胞摄取并逐渐释放,对细胞内MTB的杀伤活性至少提高了20倍;与游离NapFab相比,纳米颗粒负载的肽可以直接靶向细菌吞噬体,使感染部位的局部肽浓度提高,减少治疗用量。由此可见,无机纳米颗粒载体具有良好的递送效果,可以提高AMPs稳定性与抗菌性能,在结核病治疗中具有一定的应用潜力。
3.2.2 聚合物纳米载体 聚合物纳米载体同样适用于抗结核AMPs的递送,并获得了良好的治疗效果。它是由天然大分子材料或合成的聚合物材料通过简单工艺制备而成。聚合物纳米载体具有药物可控制药物释放、稳定性好、包封率高、保护药物不被破坏等优点,是使用最广泛的药物载体之一。Sharma等[48]采用聚ε-己内酯纳米颗粒(PCL-NPs)包裹的合成AMPs HHC-8和MM-10,并研究其对分枝杆菌的抑制作用。结果表明,纳米颗粒中多肽的持续释放提高了抗菌活性,使其对耻垢分枝杆菌的MIC50从75 μg/mL降至18.75 μg/mL,对MTB的MIC50从75 μg/mL降至9 μg/mL;并且PCL-NPs的封装为AMPs提供了保护,增加了AMPs的膜通透性,并增强了抗生素在分枝杆菌中的积累,AMPs-PCL-NPs与抗生素从而产生了药物协同作用。Sharma等[49]将合成抗菌肽MIAP纳米封装在聚(D, L-乳酸)中,并制备多孔纳米颗粒聚集粒(PNAP)以改善MIAP肽向肺部的输送并增强其稳定性。这些MIAP-PNAP纳米组件对MTB的抗菌作用至少持续96 h,并且MIAP-PNAP的细胞毒性远低于同等浓度的纯MIAP溶液。因此,基于聚合物纳米载体可以降低毒性和通过靶向和持续递送提高AMPs的治疗潜力,或与化疗药物联合治疗,有助于减少给药频率和药物剂量。从而降低药物的不良反应,增加患者依从性,有望成为一种新的结核病治疗方案。
透明质酸(HA)是一种天然生物聚合物,在生物医学工程,制药科学和医学领域越来越受到关注。HA表现出优异的生物相容性、生物降解性、免疫调节性和抗菌性能,在递送抗AMPs治疗结核病方面也具有很大的潜力。Silva等[50]将外源性AMPs LLKKK18装载到自组装的HA纳米凝胶中。这些纳米凝胶为LLKKK18提供了更高的稳定性,降低了细胞毒性和可降解性,同时增强了其在主要感染部位的定位。搭载AMPs的HA纳米凝胶同样可以被巨噬细胞有效地内化,并且体外实验证明,感染了鸟分枝杆菌或致病性MTB的巨噬细胞经过治疗后,细胞中的分枝杆菌数量显著减少。并且,有人提出HA可以作为治疗细胞内结核感染的抗生素载体。与HA结合的抗生素能够通过CD44介导的途径被感染的真核细胞吞噬,并能够根除细胞内的细菌。此外,由于HA还具有抑菌特性,因此将抗生素包封在HA基质中可以具有协同作用,以阻止细菌增殖并治疗多重耐药细菌菌株[51]。因此,聚合物纳米载体在药物输送系统的开发中具有非常重要的地位。
以上研究成果表明,纳米药物递送系统作为药物载体具有保护药物生物活性和稳定性、延长药物作用时间等诸多独特优势,提高了抗结核AMPs的生物利用度,减少治疗的剂量,减少或避免不良反应的发生。纳米载体为抗结核AMPs递送系统开辟了一条新道路,为结核病的治疗提供了新的途径。
4 结论与展望
AMPs在结核治疗方面的优势已经尤为明显,引起了微生物学家、医学家的广泛关注。尽管AMPs也存在着易被蛋白酶水解、活性低、细胞毒性等一系列亟待解决的问题,且目前仅有一种人工合成的抗结核AMPs完成前期临床试验[52]。但随着AMPs设计与优化的深入研究以及纳米技术递送抗结核AMPs方面的不断发展,AMPs很有可能成为极具价值的新一代抗结核药物。相信在不远的将来,AMPs终将被广泛应用于临床结核病的治疗。
利益冲突:无
引用本文格式:袁廷勋,何欣雨,王佳齐,等.抗结核抗菌肽及其纳米药物递送系统的研究进展[J].中国人兽共患病学报,2023,39(8):805-813. DOI:10.3969/j.issn.1002-2694.2023.00.089
