一株鸡源鸭疫里默氏杆菌的分离鉴定
2023-09-18李富金汪建华
李富金,汪建华,高 凤,赵 远,陈 辉
(1.齐鲁动物保健品有限公司,山东 济南 250100;2.山东和康源生物育种股份有限公司,山东 济南)
鸭疫里默氏杆菌(Riemerella anatipestifer,RA)是一种能够引起鸡、鸭、鹅等家禽、水禽及鸟类患流行性传染性浆膜炎的细菌,给养禽业带来严重的经济损失。浆膜炎以纤维素性心包炎、肝周炎、气囊炎、脑膜炎及纤维素性输卵管炎为特征[1-2]。临床上关于鸭疫里默氏杆菌感染鸭、鹅的报道比较多,感染鸡的报道较少[3-8],近几年笔者在临床发生传染病鼻炎、关节炎的病鸡中多次分离到该菌。2022年4月,河北沧州某肉种鸡场15周肉种鸡出现瘸腿、瘫痪病鸡,发病率10%,日淘汰率近0.15%,怀疑因呼肠孤病毒引起的病毒性关节炎,对病鸡进行实验室病原检测,结果在检测到呼肠孤病毒的同时也分离到一株细菌,经鉴别为鸭疫里默氏杆菌,因该菌在鸡上分离案例增多,现将鉴定结果汇报如下,供养殖从业者参考。
1 材料和方法
1.1 材料
1.1.1 病料 来源河北沧州某肉种鸡场,无菌采集15周龄瘸腿瘫痪肉种鸡的肝、脑和关节。
1.1.2 实验动物 1日龄樱桃谷雏鸭,购自德州某孵化场。
1.1.3 实验试剂 营养琼脂培养基、麦康凯培养基、马丁肉汤培养基均购自青岛海博生物技术有限公司,血清营养琼脂培养基由齐鲁动物保健品有限公司自制,病毒DNA/RNA纯化试剂盒购自杭州博日科技有限公司,2×Taq Master Mix、DNA Marker DL2000、GelRed核酸染料均购自诺唯赞生物科技有限公司,细菌微量生化鉴定管购自杭州微生物试剂有限公司。
1.1.4 实验器材 核酸提取仪、PCR仪、电泳仪、凝胶成像系统、生物安全柜、电子天平、CO2培养箱、显微镜等均由齐鲁动物保健有限公司研究院疫苗研究所自备。
1.1.5 药敏片 强力霉素、氟苯尼考、安普霉素、新霉素、阿莫西林、恩诺沙星、土霉素、粘杆菌素、头孢噻呋钠、头孢喹肟、泰地罗新、卡那霉素、林可大观霉素、加米霉素均由齐鲁动物保健有限公司研究院化药研究所惠赠。
1.1.6 PCR引物 根据GenBank发布的鸭疫里默氏杆菌(ATCC11845)标准菌株的全基因序列,设计16S rRNA特异性引物,由上海生工生物工程有限公司合成,引物序列信息:(F: 5′-CA GCTTAACTGTAGAACTGC-3′;R: 5′-TCGAGAT TTGCATCACTTCG-3′)。
1.1.7 阳性血清 鸭疫里默氏杆菌1、2、4、5、6、7、10型阳性血清,由齐鲁动物保健有限公司研究院疫苗研究所自备。
1.2 方法
1.2.1 细菌分离培养及纯化 无菌取病鸡肝、脑和关节,分别接种营养琼脂培养基、血清营养琼脂培养基、麦康凯培养基各2份,分别放普通培养箱及含5% CO2培养箱,37 ℃ 培养24~48 h,挑取血清琼脂培养基上长势良好的单个菌落进行纯培养。
1.2.2 染色镜检 挑取纯培养的菌株,按照常规方法涂片、固定,并用革兰染色液及瑞氏染液染色,镜检。
1.2.3 生化试验 在常规微量发酵管内滴加5%~10%牛血清,然后接种分离纯化菌株,37 ℃ 培养3 d。
1.2.4 PCR检测及测序 取纯培养的菌株菌液,利用核酸提取仪提取分离株DNA,以提取的DNA为反应模板,按照2×Taq Master Mix说明书,进行PCR反应。反应程序:95 ℃ 预变性3 min;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 60 s,共30个循环,72 ℃ 延伸5 min,4 ℃ 保温。将反应产物进行琼脂糖凝胶电泳,利用凝胶成像仪观察电泳结果。选择条带清晰无杂带、目的条带位置正确的PCR产物送至上海生工生物工程有限公司进行测序。
1.2.5 药敏试验 挑取纯培养的菌株均匀涂布在血清琼脂培养基平板上,将头孢噻呋钠、恩诺沙星等14种药物的药敏片紧贴于平皿表面,置于含5% CO2培养箱,37 ℃ 培养24 h,用游标卡尺测量每片药敏片周围抑菌圈直径,判断分离菌对各药敏片的敏感性。
1.2.6 动物回归试验 将分离菌株接种于含血清马丁肉汤培养基,37 ℃ 振荡培养24 h。活菌计数后,攻毒10只7日龄健康非免疫雏鸭,每只静脉注射5×107CFU活菌。接种后连续观察10 d,记录雏鸭临床表现,对病死鸭进行病理剖检观察,未死亡鸭处死后剖检观察,并无菌采集脑、肝脏分离细菌。
1.2.7 血清型鉴定 采用玻片凝集试验方法,按照文献方法进行,混合后反复震荡载玻片,注意观察,出现清晰的乳白色絮状凝集块者,判定为阳性,不出现凝集块则判定为阴性,阳性的重复为3次以防止假阳性[9-12]。
2 结果
2.1 细菌分离培养
分离菌在普通培养基和麦康凯培养基上不能生长,在含5% CO2条件下,在血清琼脂培养基上生长良好,如图1所示呈针尖大小、圆形、表面光滑、小露珠状半透明小菌落。

图1 分离菌在血清琼脂培养平板的菌落形态
2.2 染色镜检
染色后在显微镜下观察为革兰阴性短小杆菌,大小为0.3~0.5 µm,如图2所示菌体多单个存在,少数成对,偶尔呈链状排列,无芽孢,有荚膜,短杆状菌。
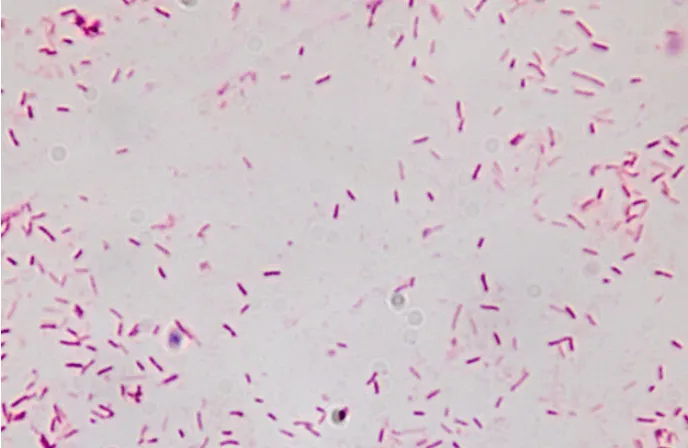
图2 分离菌革兰染色菌体形态
2.3 生化鉴定结果
分离的菌株不能发酵葡萄糖、蔗糖、果糖、半乳糖、乳糖、甘露酵和山梨醇,靛基质、VP试验、硝酸盐还原试验、硫化氢产生、甲基红试验均为阴性,触酶、氧化酶试验为阳性,以上结果符合鸭疫里默氏杆菌的生化培养特性。
2.4 PCR鉴定及测序结果
(1)如图3所示,以分离的菌株DNA作为模板进行PCR扩增,结果显示,扩增产物片段(2号)与目的条带(1666 bp)大小相符。(2)对上述PCR扩增产物进行测序,登陆NCBI网站与已公布序列进行BLAST分析发现,该核苷酸序列与已知Riemerella anatipestifer 16S rRNA的部分序列同源性达到99.78%,确定分离到的菌株为鸭疫里默氏杆菌,命名为QLHB01。

图3 分离菌株16S rRNA基因扩增结果1. 阴性对照孔;2. 样品孔;M. Marker DL2000。
2.5 药敏试验结果
结果表明分离菌对头孢噻呋钠、头孢喹肟敏感,对强力霉素、氟苯尼考、安普霉素、新霉素、阿莫西林、恩诺沙星中介,而对土霉素、粘杆菌素、泰地罗新、卡那霉素、维可观(林可大观霉素)、加米霉素则不敏感。详细结果见下表1。

表1 分离菌株药敏试验结果
2.6 动物回归试验结果
雏鸭接种分离菌株12 h后,精神沉郁,食欲、饮欲下降,眼鼻分泌物增多,部分鸭出现典型的神经症状,表现为共济失调、头颈震颤等(图4、图5)。攻毒后雏鸭3 d开始出现死亡,剖检后可见心脏和肝脏表面覆有纤维素性渗出物(图6、图7),气囊上有干酪样物,脑膜血管树枝状充血。10 d后将未死亡鸭处死剖检,见心脏和肝脏表面的纤维素性渗出物增多,气囊混浊,脑膜出血。从脑组织中均分离到鸭疫里默氏杆菌,培养特性及镜检形态与分离菌株相同。

图4 对照鸭无异常

图5 攻毒鸭精神沉郁共济失调

图6 攻毒鸭死亡

图7 攻毒鸭剖检有典型浆膜炎病变
2.7 血清型鉴定
经玻片凝集试验,分离菌株可以与10型阳性血清产生凝集反应,与1、2、4、5、6、7型阳性血清不反应,被鉴定为10型。
3 讨论与结论
(1)本案例是从怀疑病毒性关节炎发病肉种鸡关节中分离到细菌,通过菌落观察、染色镜检、生化试验、分子生物学检测、药敏试验、血清型鉴定及动物回归试验的结果,判定分离菌为鸭疫里默氏杆菌,应该是呼肠孤病毒与鸭疫里默氏杆菌共感染。
(2)通过药敏试验发现分离菌对头孢噻呋钠及头孢喹肟较敏感,强力霉素、氟苯尼考、安普霉素、新霉素、阿莫西林、恩诺沙星也可以临床应用,鉴于主要病变在关节,养殖场选择用头孢噻呋钠(10 mg/kg体重)对出现症状的鸡进行注射,大群用强力霉素(15 mg/kg体重)配合氟苯尼考(15 mg/kg体重)饮水预防,追踪用药后的效果,部分鸡症状有缓解、恢复,但仍有部分瘫痪鸡进行了淘汰。本案例不是单纯细菌感染,药敏试验对选择敏感性药物来控制细菌感染是有帮助的,也能减少部分经济损失。
(3)血凝试验及动物回归试验结果显示,分离菌为10型鸭疫里默氏杆菌,且对雏鸭致病性较强。因与以前分离鸡源鸭疫里默氏杆菌发病日龄、感染器官及血清型(1型、2型)均不相同,且案例不多,因此未做SPF鸡的回归试验。
(4)鸭疫里默氏杆菌目前主要感染水禽,特别是15~35日龄的水禽,发病急,死亡快,死亡率高,给养殖场带来巨大经济损失,水禽养殖场非常重视该病的防控。在家禽上的案例不多,但有增多趋势,特别是水禽养殖密集区,感染鸡的几率增加,希望养殖场多关注该病的发展及流行情况。
