特发性膜性肾病合并静脉血栓栓塞的机制研究进展
2023-09-16李安壮梁黎明许冬梅
李安壮 梁黎明 许冬梅
山东第一医科大学第一附属医院肾脏病学科,山东 济南 250014
特发性膜性肾病(idiopathic membranous nephropathy, IMN)一种自身免疫相关的肾小球疾病,大多表现为以大量蛋白尿和低白蛋白血症为主的肾病综合征(nephrotic syndrome, NS)。近些年来IMN 的患病率逐年攀升,自2000 年至2019 年其发病率从11.31%上升至37.05%,多发于男性且发病年龄逐渐年轻化[1]。目前85%的膜性肾病被归类为IMN,是成人和老年人NS最常见的原因之一[2]。静脉血栓栓塞症(venous thromboembolism, VTE)是IMN最严重的并发症之一,其发生率高达36%[3],可表现为深静脉血栓(deep venous thrombosis, DVT)、肾静脉血栓(renal venous thrombosis, RVT)和肺血栓(pulmonary thromboembolism, PTE),其中以RVT的形成最具代表性。在VTE事件发生时,81.5%的IMN患者处于NS状态[4],患者发生VTE时大多病情隐匿迁延,致使VTE 在临床中很容易被忽视,严重威胁IMN患者生命安全及预后。
1 IMN合并VTE的发病机制
低白蛋白血症、大量蛋白尿导致的凝血和纤溶系统失衡,内皮损伤和糖皮质激素等药物的应用导致了IMN患者机体高凝状态,高凝状态在IMN患者伴发VTE的过程中至关重要。另外,抗凝功能降低、血小板活化、抗磷脂酶A2受体(M-type phospholipase A2 receptor, PLA2R)及其抗体、炎症介质及免疫调节的参与共同促进了IMN患者VTE的发生(图1)。
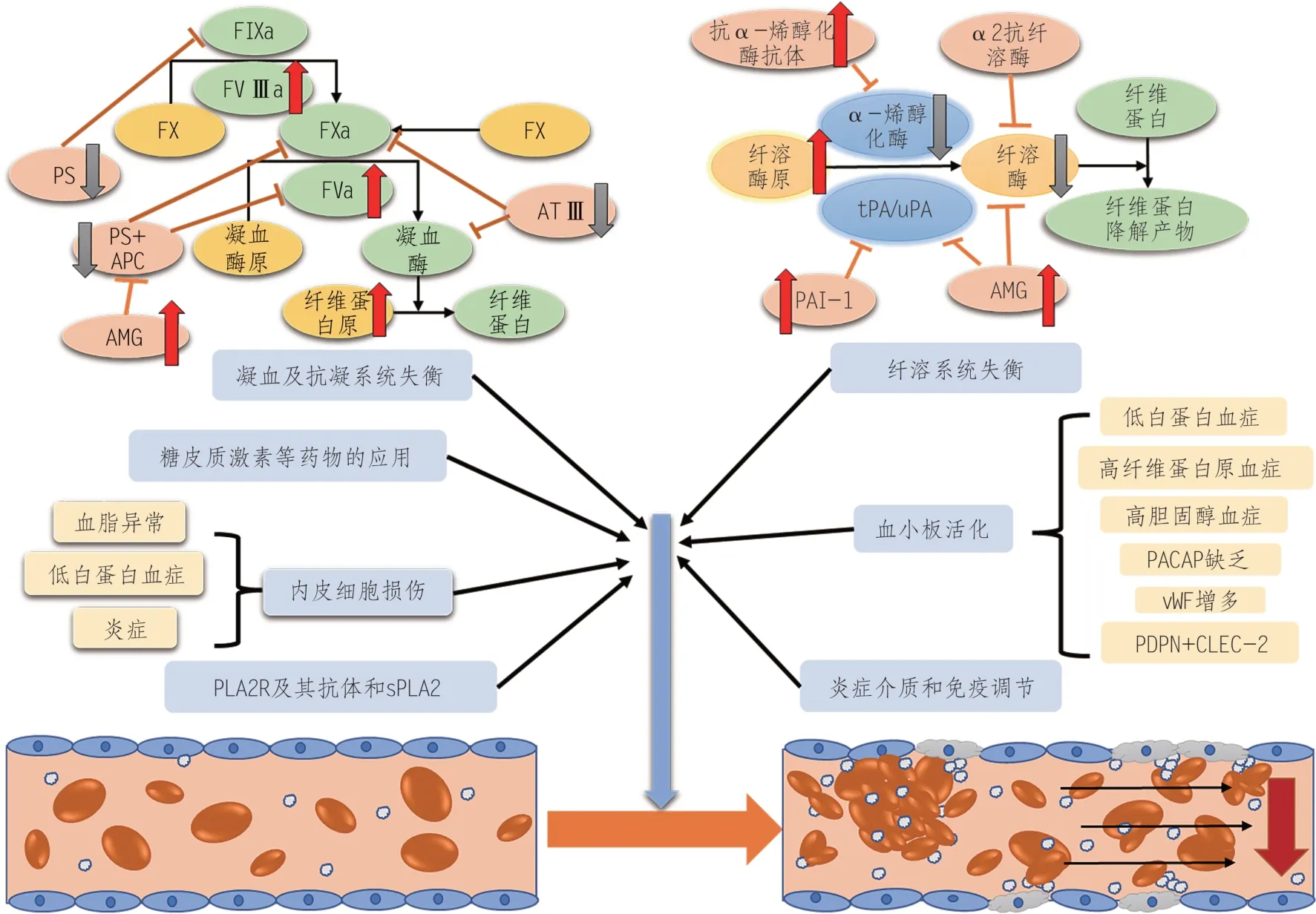
图1 IMN患者在各因素的相互影响下共同导致VTE的发生
1.1 IMN患者的高凝状态
IMN 患者的高凝状态是指在促凝和抗凝过程中的任何步骤出现异常,使机体血栓前状态倾向性增加,是早期诊断血栓栓塞性疾病的重要组成部分。IMN 合并VTE 时的NS 状态与获得性、复杂的高凝状态相关,被认为是与VTE 风险相关的驱动因素[5]。
1.1.1 促凝蛋白水平升高 NS患者中某些大分子蛋白如凝血因子Ⅴ、Ⅷ、纤维蛋白原(fibrinogen,Fib)、血管性血友病因子(von willebrand factor,vWF)、α2-巨球蛋白(α2-macroglobulin,AMG)等含量增加,促进高凝状态的发展[6-7]。Fib 的增加促进了血小板和红细胞的聚集,增加血液粘度从而推进促凝血状态。在初期止血时,Fib 与活化血小板表面的整合素受体αIIbβ3 结合,促进血小板聚集;二期止血时,凝血酶切割Fib,产生纤维蛋白单体,各纤维蛋白单体之间相互聚合,形成纤维蛋白网络,随后FXIIIa 与纤维蛋白网络交联稳定并加强了纤维蛋白凝块的结构完整性[8]。NS 患者血浆中vWF水平显著增加,vWF 介导血小板的粘附与聚集,引发初始血凝块的生成,此外,vWF与FVIII结合后能防止其降解并维持FVIII 水平,FVIIIa 作为FIXa 的辅助因子发挥促凝作用[9-10],因此vWF 水平能够影响纤维蛋白的形成和凝血因子的激活。在NS患者血浆中AMG的浓度是健康对照的2倍,AMG能够与活化蛋白C(activated protein C,APC)结合形成APCAMG复合物从而抑制APC的抗凝活性,促进凝血反应,但在VTE 患者中发现低水平的APC-AMG 复合物浓度与VTE 的发生风险增加有关,其可能与APC-AMG 复合物的半衰期较短有关,APC-AMG 水平降低的相关机制还有待进一步研究[11-12]。促凝蛋白水平的升高促进机体高凝,加速血栓的生成,因此调节IMN 患者促凝蛋白的生成能够降低VTE 的发生风险。
1.1.2 纤维蛋白溶解系统功能失衡 纤溶系统主要是靠纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor type 1,PAI-1)调控纤溶酶原的生成和组织型纤溶酶原激活物(tissue plasminogen activator,tPA)调控纤溶酶的生成来发挥作用[13]。NS 患者PAI-1 的表达水平升高[14],PAI-1 水平的升高使纤溶解系统受到抑制。研究发现, IMN患者抗α-烯醇化酶抗体IgG4 明显高于正常对照或其他肾病类型,α-烯醇化酶能够结合并激活纤溶酶原,保护纤溶酶不受α2-抗纤溶酶的影响,因此抗α-烯醇化酶抗体水平的升高能够抑制纤溶酶原的激活,拮抗纤维蛋白溶解[15-16],进而促进机体高凝状态。此外,NS患者血浆中的AMG除抑制纤溶酶外,还能抑制tPA、尿激酶(urokinase-type plasminogen activator,uPA)和激肽释放酶,因此纤维蛋白降解的纤溶过程受到显著影响[11],纤溶系统活性降低,促进血栓的发展。ISHIKAWA 等[17]通过旋转血栓弹性测定法(rotational thromboelastometry,ROTEM®)评估显示,NS患儿在发病初期纤溶系统活性降低明显,使机体倾向高凝状态,导致血栓的持续。但在VTE发生前期,由于凝血系统的激活,纤维蛋白生成增加,引起继发性纤溶亢进。因此,纤维蛋白溶解系统功能的失衡在IMN患者血栓形成过程中起重要作用,进一步明确该机制的作用对血栓的预防至关重要。
1.1.3 血管内皮损伤和糖皮质激素等药物的应用 血管内皮细胞产生的NO扩散进入血液中的血小板,导致血小板活性降低,防止血栓的形成。而IMN 状态下的血脂异常、炎症、低白蛋白血症都会导致NO 的生物利用率受损,进而导致内皮功能紊乱,使血栓发生风险升高[18]。IMN 患者血清中的内皮标志物vWF、syndecan-1(SDC-1)、血管细胞粘附因子-1(vascular cell adhesion molecule-1, VCAM-1)和E-selectin水平显著升高,可溶性尿激酶型纤溶酶原激活剂受体(soluble urokinase-type plasminogen activator receptor, suPAR)在炎症刺激时被释放到体液中,其水平与vWF、SDC-1和VCAM-1之间存在关联,提示suPAR 水平与内皮功能障碍有关[19],同时vWF 水平的增加可提高IMN 患者VTE 发病风险。SDC-1 是内皮糖萼的主要成分,具有维持血管屏障的功能,SDC-1 与高凝状态显著相关,此外,SDC-1在感染引起的血栓中聚集,因此以高水平的SDC-1为标志的严重内皮损伤会导致血栓前状态并增加血栓形成的风险[20]。IMN 患者的低白蛋白血症等会加剧血管内皮细胞的损伤,各内皮标志物的变化也警示着IMN患者血栓栓塞的风险增加,因此预防IMN患者内皮细胞损伤对VTE的预防同样重要。
IMN 患者由于利尿剂和外源性糖皮质激素的使用造成有效循环血容量降低,以及FⅦ、FⅧ和Fib的含量增加,发生VTE的风险随着糖皮质激素累积用量的增加而增加[21-22]。Van Zaane 等[23]发现在炎症增加的情况下使用糖皮质激素治疗,显示PAI-1水平的显著升高,而PAI-1 是纤溶解系统的主要抑制剂,因此糖皮质激素不仅可以增加凝血因子的水平,还可降低纤溶系统活性,进而促进VTE的形成。
1.2 抗凝功能降低
NS 状态下异常的抗凝血因子包括蛋白S、蛋白C、蛋白Z、抗凝血酶Ⅲ(antithrombin,ATⅢ),其活性或水平的降低促进血栓形成。在NS患者体内蛋白C的活性和蛋白S的水平降低,蛋白C在产生凝血酶时被激活,APC 通过灭活FVa 和FVIIIa 下调凝血酶的生成,因此蛋白C活性的降低导致凝血酶的灭活减少,促进凝血级联反应的持续,加速血栓形成[6]。蛋白S 是APC 和组织因子途径抑制物(tissue factor pathway inhibitor, TFPI)的重要辅助因子,同时蛋白S能够直接抑制FⅨa因子和凝血酶原复合物,调节凝血的起始和传播阶段,血小板蛋白S 能特异性地限制静脉血栓的形成,因此蛋白S 的缺乏与血栓发生风险的增加有关[24-25]。NS 患儿的ATⅢ活性显著降低,当ATⅢ水平低于正常70%时,因VTE 风险增加,应给予抗凝治疗[26]。ATⅢ是肝脏中合成的重要的抗凝蛋白,AT可以灭活FXa和FIIa并较低程度地灭活FIXa、FXIa、FXIIa[27],因此,AT的缺乏导致其生理功能的降低是VTE 发生的重要因素。蛋白Z(protein Z,PZ)是蛋白Z 依赖性蛋白酶抑制剂(protein Z-dependent protease inhibitor, ZPI)的辅助因子,ZPI在有PZ、促凝血脂和钙的情况下迅速抑制活化的FXa,发挥重要的抗凝血作用[28]。NS患儿血浆PZ 水平显著降低,且与血浆ATIII 的水平正相关[29],PZ 水平的降低导致抗凝血功能降低,加速血栓形成。上述抗凝血因子不同程度地促进了血栓的持续,增加了IMN患者发生VTE的风险。
1.3 血小板的活化
血小板活化水平的升高,加重了IMN患者的高凝状态,加速VTE 发生。低白蛋白血症时,因低水平的白蛋白很少与游离的花生四烯酸(arachidonic acid, AA)结合,导致AA利用率增加,在环氧合酶-1(cyclooxygenase-1, COX-1)的作用下,其产物血栓烷A2 (thromboxane A2, TXA2)增多,而TXA2 是有效的血小板激动剂,促进血小板聚集[30]。研究证明,高脂血症增加了血小板在纤维蛋白形成中的反应性,血小板中Src蛋白激酶的活性形式pTyr419增加,高脂血症使血小板对胶原蛋白的反应具有更高的血小板膜糖蛋白 VI(platelet membrane glycoprotein VI, GPVI)表面水平[31-32]。GPVI 是血小板表面的胶原蛋白受体,血小板活化后诱导血小板金属蛋白酶(metalloproteinase,MMP)裂解GPVI 产生可溶性GPVI,重组人平足蛋白(podoplanin,PDPN)能够结合血小板上的c型凝集素样受体2(Ctypelectin-likereceptor-2,CLEC-2)进而促进血小板聚集和激活,在NS患者血清中可溶性PDPN与可溶性GPVI 水平显著升高,两者水平显著相关且可溶性PDPN 水平与高凝状态相关[33]。IMN 患者NS 状态下血小板活化增加,加速血栓形成。血浆中的垂体腺苷酸环化酶激活多肽(pituitary adenylate cyclase activating polypeptide, PACAP)通过激活血小板上的腺苷酸环化酶偶联的G 蛋白偶联受体抑制血小板功能,在NS 中观察到PACAP 在尿液中丢失所致的PACAP 缺乏症,导致了血小板计数和聚集性增加,增加血栓形成的风险[34]。此外,IMN 患者vWF的增加使血小板活化,活化的血小板与中性粒细胞结合导致中性粒细胞胞外杀菌网络 (neutrophil extracellular traps, NETs)的形成,促进静脉血栓发展[35]。
1.4 PLA2R及其抗体和sPLA2的潜在作用
PLA2R 抗体对于IMN 具有高度特异性,与IMN疾病的活动和对治疗的反应密切相关。IMN 伴发VTE 患者的抗PLA2R 抗体水平明显高于无VTE 的患者,高水平的PLA2R抗体会加重患者的蛋白尿和低白蛋白血症[36]。在IMN患者中,肾病型蛋白尿患者血清中的分泌型磷脂酶A2-IB(sPLA2-IB)水平高于非肾病型蛋白尿患者,其水平随着IMN疾病的进展而升高。sPLA2-IB 作为PLA2R 的内源性配体,sPLA2-IB 在PLA2R 参与下激活p38MAPK/mTOR/ULK1ser757信号通路,下调足细胞自噬,加重足细胞损伤,sPLA2-IB 与PLA2R 结合后还可激活ERK1/2 和胞浆型磷脂酶A2(cPLA2),使足细胞中AA 水平增加进而促进足细胞凋亡[37-38]。在sPLA2-IB和PLA2R的共同作用下,IMN 患者足细胞自噬水平的降低和凋亡水平的增加使患者高蛋白尿和低白蛋白血症等症状加重,同时AA 水平的增加引发血小板的活化,又进一步加重了IMN 患者的高凝状态。因此,在IMN 疾病进展过程中对PLA2R 及其抗体和sPLA2的监测对预防VTE尤为重要。
1.5 炎症介质和免疫调节
IMN 作为一种自身免疫介导紊乱的肾炎疾病,炎症介质在IMN 的疾病发展过程中发挥了重要作用。研究表明,IMN 患者中循环脂多糖(lipopolysaccharide, LPS)、组织因子(tissue factor,TF)和阳性微粒(microparticles, MPs)明显升高,体外实验证实,LPS 的增加可能介导并释放单核细胞来源的TF 阳性MPs,IMN 患者血浆MPs TF 活性与DD 水平呈正相关,这提示血浆MPs TF 活性的增加促进了IMN患者的高凝状态,其机制可能是MPs的增多导致红细胞和血小板中磷脂酰丝氨酸(phosphatidylserine, PS)暴露显著增加,PS为FXa和凝血酶原复合物提供了结合位点,并在TF的参与下共同促进凝血级联反应,导致凝血酶生成急剧增加,加速VTE 的发生,为IMN 伴发VTE 的机制探寻提供了另一可能[39-40]。
在IMN中,Th17、Th2、Th1细胞以及调节性T细胞(regulatory cells, Tregs)参与自身免疫疾病的发展和调节。研究表明,IMN患者的Th17和Th2细胞分泌的因子IL-17A 和IL-4 水平显著升高,而Th1 相关细胞因子IFN-g 和IL-12p70 以及Tregs 细胞因子IL-10 的浓度较低,这些差异表明,MN 患者中存在Th17和Th2通路的激活与Th1和Tregs通路的缺失,其中血清IL-17A 浓度与IMN 伴发VTE 最为相关,IL-17A阳性患者出现更多的血栓栓塞事件,复发也更频繁,IL-17A 阳性患者暴露于更高水平的PM2.5的环境中,这可能更易诱发自身免疫反应,导致VTE 的发生[41]。IMN 患者NS 状态下血小板和红细胞中MPs 释放和PS 暴露的增加以及各免疫调节细胞分泌的细胞因子的作用为IMN 患者发生VTE 的机制提供了新的研究方向。
2 小结
IMN患者伴发VTE的风险升高,其发病机制与凝血和抗凝及纤溶系统失衡、血小板异常活化、内皮细胞受损以及药物的应用等有关。随着IMN 患者疾病的进展,伴发VTE 的风险也随之提升。因此,需要及时评估IMN 患者伴发VTE 的风险,对于高风险的IMN 患者在免疫抑制治疗的同时进行预防性抗凝及抗血小板聚集药物的治疗,可以改善预后,提高患者的生存质量。
利益冲突所有作者均声明不存在利益冲突
