水稻颖壳类病斑突变体glmm1的鉴定与基因定位
2023-09-14徐欢周涛孙悦王木妹杨亚春马卉李浩徐大伟周海杨剑波倪金龙
徐欢 周涛 孙悦 王木妹 杨亚春 马卉 李浩 徐大伟 周海 杨剑波 倪金龙,*
水稻颖壳类病斑突变体的鉴定与基因定位
徐欢1,#周涛2,#孙悦1王木妹3杨亚春2马卉2李浩2徐大伟1周海3杨剑波2倪金龙2,*
(1安徽农业大学 农学院,合肥 230036;2安徽省农业科学院 水稻研究所,合肥 230001;3华南农业大学 生命科学学院,广州 510642;#共同第一作者;*通信联系人,email: jlni09@163.com)
【目的】鉴定水稻颖壳类病斑突变体,并进行基因定位,为基因克隆及其分子机制研究奠定基础。【方法】对野生型材料LR005和经EMS诱变得到的颖壳类病斑突变体()进行农艺性状分析、扫描电镜分析、DAB染色和全硅含量测定。与广亲和材料L422杂交获得的F2群体用于遗传分析,利用图位克隆和BSA-seq方法进行基因定位。【结果】突变体在抽穗10 d后颖壳和叶片逐渐出现褐色斑点,成熟后颖壳完全呈现褐色。与野生型相比,突变体的株高、穗长、每穗总粒数、结实率和千粒重等都极显著降低。DAB染色表明颖壳和叶片的活性氧含量增多;扫描电镜显示突变体颖壳和叶片表面硅质细胞皱缩。遗传分析结果表明,突变体的颖壳类病斑表型受到一对隐性基因控制。利用与L422的F2分离群体,通过图位克隆和BSA-seq等策略将定位在水稻第2染色体上68 kb的区间内。该区间内有10个候选基因。序列分析发现该区间仅有一个SNP位点,位于基因()的第5个外显子上,导致第238位氨基酸由异亮氨酸变为苏氨酸。对颖壳和叶片全硅含量的测定表明,突变体中硅的积累减少,说明可能是的等位突变。【结论】是新的等位突变基因,该突变造成植株硅含量的降低和活性氧的积累,致使颖壳和叶片产生褐色类病斑。
水稻;突变体;类病斑;硅转运蛋白;基因定位
类病斑(lesion mimic)是植物在生长发育过程中未受到胁迫而自发产生的坏死斑,在形态上类似于植物遭受病原菌侵染引起过敏反应而产生的病斑,常见于植物的叶片、叶鞘、茎秆和种皮上[1, 2]。类病斑突变体在高等植物中广泛存在。水稻中已报道了100多个类病斑突变体,主要以叶片类病斑居多,如~[3],[4],[5],[6]和[7]等。类病斑突变体往往表现发育迟缓或早衰,严重影响产量的形成;另一方面,大多数类病斑突变体体内防御基因的表达水平显著提高,植株抗病性增强[8]。因此,对水稻类病斑突变体的研究能促进人们对水稻产量形成与抗病性的协同调控机制的深入理解。
随着对水稻类病斑突变体研究的深入,越来越多的基因被定位和克隆。这些基因的不同功能决定了类病斑发生机制的差异。抗病基因是水稻抵抗病原侵染和扩展的重要基因,其突变可能会导致类病斑产生。编码一个典型的CC-NB-LRR蛋白,其突变导致过氧化氢和水杨酸过量积累,在水稻叶鞘上出现自发坏死斑[9]。细胞程序性死亡失控同样能导致水稻类病斑的产生。编码E3泛素连接酶[4],该基因突变会导致细胞程序性死亡调控失效,出现大面积的细胞死亡,产生斑点叶。光合色素含量的下降会影响正常的光合作用,导致细胞死亡产生类病斑。水稻突变体中叶绿体严重降解,叶绿素含量下降,光合蛋白活性变弱,影响光合作用和叶绿素生物合成,导致活性氧的积累和类病斑的形成[10]。一些信号分子的大量积累也会导致类病斑发生,如活性氧[11]、水杨酸[12]和一氧化氮[13]等。
水稻是典型的“喜硅作物”,在水稻生长发育中硅元素的重要性不言而喻。硅是土壤中含量第二的元素[14],它主要以单硅酸的形式存在于土壤中。虽然硅并非水稻的必需营养元素,但硅在水稻逆境调节中发挥着非常重要的作用,能很好地抵御真菌、害虫等生物胁迫以及盐胁迫、金属毒害、干旱胁迫、辐射损伤、营养失衡、高温、冰冻等多种非生物胁迫[15]。硅的吸收和转运是通过硅转运蛋白来调节的,是高等植物中第一个被鉴定出来的硅转运蛋白基因,它主要定位于根的外皮层和内皮层外侧细胞膜,它的突变会导致硅吸收缺陷[16, 17]。基因为硅外排转运蛋白,在大田环境下,突变体植株矮化,颖壳颜色稍有变化,结实率降低,地上部分和颖壳中硅积累量下降[18]。突变体地上部硅沉积混乱,导致硅酸盐作为硅质体在剑叶中重新沉积从而使叶片上的硅浓度比野生型高很多,而在颖壳中的沉积减少,导致穗部的水分散失,最终表现为白穗[19, 20]。根吸收的硅被硅转运蛋白Lsi1运进植物体内,然后硅外排转运蛋白Lsi2负责将硅外排到中柱细胞,通过装载进入木质部,最终通过Lsi1蛋白进入水稻各组织[21, 22]。硅以单硅酸Si(OH)4被植物吸收,然后以水合二氧化硅(SiO2·H2O)的形式留存在表皮和维管束等组织中形成植硅石[23]。植硅石的研究测试手段包括光学显微镜、X射线衍射、透射电子显微镜和扫描电子显微镜等[24]。
在众多水稻类病斑突变体中,颖壳类病斑突变体鲜见报道。本研究从稳定遗传的甲基磺酸乙酯(ethylmethane sulfonate, EMS)诱变材料中发现一个颖壳类病斑突变体,该突变体在抽穗10 d后,颖壳和叶片逐渐出现褐色斑点,成熟后颜色更深,通过基因定位和MutMap分析发现,是基因突变引起的,而基因编码一种硅转运蛋白。因此,我们推测突变体颖壳类病斑的出现可能与硅的转运有关。本研究对该突变体进行表型鉴定、基因定位、理化分析和组织微观结构观察,旨在为解析水稻类病斑形成的分子机制提供更多的线索。
1 材料与方法
1.1 试验材料
本研究所用试验材料包括安徽省农业科学院水稻研究所自育材料籼稻LR005和粳型常规稻L422,以及LR005经EMS诱变获得的突变体(颖壳类病斑突变体,)。材料种植于安徽农业科学院水稻研究所庐江试验基地,每行种10株,株行距16.5 cm×25 cm,合理施肥和排灌水,抽穗期前后考查颖壳颜色和取样,成熟期随机取20株考查株高、穗长、有效穗数、每穗总粒数、结实率和千粒重等农艺性状。
1.2 DAB染色法
利用二氨基联苯胺(DAB)能和H2O2发生反应生成红褐色物质的特性,参考沈旺鑫的方法[25],进行活性氧的染色。1%DAB溶液配制:将DAB粉末溶于pH为3.8的Tris-HCl,4℃下遮光保存,现配现用。取抽穗期野生型和突变体剑叶放入1%的DAB溶液中,真空处理15 min,后室温暗处理20 h。将DAB溶液倒出加入无水乙醇,沸水浴褪色至无色。将叶片转移到提前配制好的固定液(等体积的无水乙醇甘油乳酸混合)中固定8 h后,取出观察是否有红褐色出现并拍照。
1.3 遗传分析及定位群体的构建
以为母本与正常材料L422杂交获得F1,收获F1种子,种植于安徽省农业科学院水稻研究所庐江试验基地。观察F1植株表型并自交得到F2种子。将F2材料种植于安徽省农业科学院水稻研究所庐江试验基地,观察F2群体表型,统计F2群体中野生型和突变体分离比,利用F2群体进行遗传分析及基因定位。
1.4 精细定位和候选基因确定
以F2群体为定位群体,采用改良的CTAB法[26]提取DNA。从F2群体中分别选取30株正常植株与30株极端突变表型植株,分单株提取DNA并等量混合,构建野生型池和突变型池。然后使用120个InDel和180个SSR标记在双亲间进行多态性筛选,再利用筛选出的均匀分布于水稻12条染色体的多态性标记扩增两个混池,选择突变型池与突变体亲本带型相同而与野生型池带型不同的标记,为可能的连锁标记,完成初步定位。再根据双亲的变异信息在初步定位区间内设计高密度InDel引物进一步缩小定位区间,进行精细定位(表1)。

表1 InDel标记引物信息
取颖壳类病斑表型植株30株提取DNA,等量混合,构建突变型池并随双亲进行二代测序,用于MutMap分析和预测候选基因。
1.5 扫描电镜观察
使用锋利的刀片将野生型和突变体的颖壳和叶片切成小块,固定在2.5%的戊二醛溶液里,再用30 %、50 %、70 %、80 %、90 %、100 %乙醇梯度脱水。将脱水的颖壳和叶片冷冻干燥并镀金。使用扫描电镜(Zeiss,EVO MA 15型)观察野生型和突变体的颖壳和叶片。
1.6 硅含量测定
采集成熟后的野生型和突变体的颖壳和叶片进行全硅含量的测定,每个样本3次重复。采用硅钼蓝比色法[27]测定硅含量。首先将水稻组织经强碱消煮,将浸出的硅酸与钼试剂反应生成硅钼酸,再将硅钼酸还原为硅钼蓝,在分光光度计上比色,通过与硅标准溶液对比来测定硅含量。
2 结果与分析
2.1 突变体glmm1的表型特征
突变体在幼苗期和成熟期都比野生型矮(图1-A, B)。在抽穗初期,和野生型的颖壳和叶片上均未出现褐色斑点(图1-F, I);抽穗10 d后突变体的颖壳和叶中部逐渐开始出现褐色斑点,叶尖开始干枯(图1-G, J);至成熟期,叶中部的褐色斑点不断延伸,叶尖干枯更加严重,颖壳布满褐色斑点(图1-E, H, K)。成熟期的性状调查表明,突变体的分蘖数与野生型无显著差异,但株高、穗长、每穗总粒数、结实率和千粒重等都极显著降低(表2),并且粒长变短,粒宽变窄(图1-C, D)。

A, B−苗期和成熟期的野生型(WT)和glmm1的表型;C, D, E−WT和glmm1的籽粒;F, I−抽穗初期;G, J−抽穗中期;H, K−成熟期。标尺分别为15 cm(A, B), 1 cm(C, D, E)和4 cm(F, G, H, I, J, K)。
Fig. 1. Phenotypic comparison of WT and mutant.
2.2 活性氧染色
活性氧具有很强的氧化能力,它的积累会损害细胞,严重时造成细胞的死亡。类病斑的出现往往与活性氧过度积累引起的细胞程序性死亡有关[8]。为了探究颖壳和叶片类病斑是否也与活性氧过度积累有关,采用DAB染色法分析突变体H2O2在颖壳和叶片中的积累情况。检测结果显示,与野生型相比,的颖壳和叶片均被染上褐色(图2-A, B),表明颖壳和叶片有大量H2O2的积累。由此推测,颖壳和叶片出现的类病斑症状可能是活性氧的过度积累所致。

图2 野生型和突变体glmm1的颖壳和叶片DAB染色
Fig. 2. DAB staining results of glumes and leaves of the wild-type and its mutant.
2.3 基因定位及候选基因确定
2.3.1 遗传分析
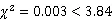
2.3.2 精细定位
选取120个InDel和180个SSR标记对亲本L422和进行多态性筛选,共选出覆盖在水稻12条染色体上的多态性标记91个。利用这91个多态性标记进行初定位,结果显示位于第2染色体标记X1和X6之间,物理距离约为2.48 Mb(图3-A)。通过在该区间设计高密度标记(表1),并结合染色体步移策略,将精细定位在标记Y3和Y5之间,物理距离为68 kb,覆盖10个编码基因(图3-B和图3-C)。根据水稻基因组注释计划数据库(http://rice.uga.edu/)提供的信息,对该区间的10个基因进行注释分析(表4),其中()和()已被克隆。编码硅转运蛋白,它的突变会导致地上部组织硅含量的减少[16];编码Cullin蛋白,是RING型E3泛素连接酶的一部分,该基因突变体的叶片表面会出现浅红色褐斑,叶片中积累更多过氧化氢[28]。由于突变体颖壳和叶片表面植硅石结构和二氧化硅细胞均发生了变异,同时颖壳和叶片活性氧也均出现了过度积累,这暗示和都有可能是的候选基因。

表2 野生型与突变体glmm1的主要农艺性状比较
表中各数据以“平均值±标准差”形式呈现。**代表野生型与突变体间的差异达0.01显著性水平。样本量:株高=20,穗长=20,有效穗数=20,每穗总粒数=10,结实率=10,千粒重=4。
The data in the table are listed as means ± standard deviation. **Difference between WT and mutant is significantat0.01 level. Sample size: for plant height,=20; for panicle length,=20; for grain number per panicle,=20; for seed-setting rate,=10; for thousand grain weight,=4.
表3 glmm1颖壳类病斑性状的遗传分析
2.3.3 MutMap分析
通过对亲本L422、LR005和突变体混池高通量测序(MGI-DNB Seq测序平台),共获得34.6G数据,GC含量为43%~44%。参考基因组为日本晴,基因组大小365M,来源于Rice Genome Annotation Project网站(http://rice.uga.edu/)。三个样本的GC含量分别为43.95%、43.3%和44%,Q30分别为91.22%、91.5%和89.59%。表明测序质量高,一致性好,可用于MutMap分析。
采用YuSugihara的MutMap分析脚本,将滑动窗口(slide windou)设置为2M、以步长100 k,利用QTL-seq(https://github.com/YuSugihara/mutmap)进行分析。根据分析结果发现,在第2染色体上检测到一个超过0.99阈值线的正态分布峰,该区域与之前定位的结果一致(图3-D)。在该区域内仅有1个SNP的SNP指数达到了1,位于基因()上。通过对该基因测序,结果表明该突变位于基因的第5个外显子上(图3-F),突变造成编码的第238位氨基酸从异亮氨酸(Ile)变为苏氨酸(Thr)(图3-E),与之前SNP指数为1的位点一致;而基因组序列在野生型和突变体之间没有差异。根据以上结果我们推测,突变体表型可能是基因突变所致。
2.4 扫描电镜分析
为了探究颖壳和叶片出现褐色斑点的原因,对野生型和突变体的颖壳及叶片进行了扫描电镜分析。颖壳扫描电镜结果表明,与野生型双乳突状的结构相比(图4-A, B和图4-E, F),在突变体植株出现褐色斑点前后,颖壳表面植硅石结构遭到破坏,表现为粗糙和皱缩(图4-C, D和图4-G, H)。叶片的扫描电镜结果显示,野生型正常(图4-I, J和图4-M, N),叶片出现褐色斑点前后表面的哑铃型二氧化硅细胞也遭到了破坏(图4-K, L和图4-O, P)。这表明基因的突变导致了水稻颖壳植硅石结构和叶片表面硅质细胞的破坏。

表4 候选区间基因注释
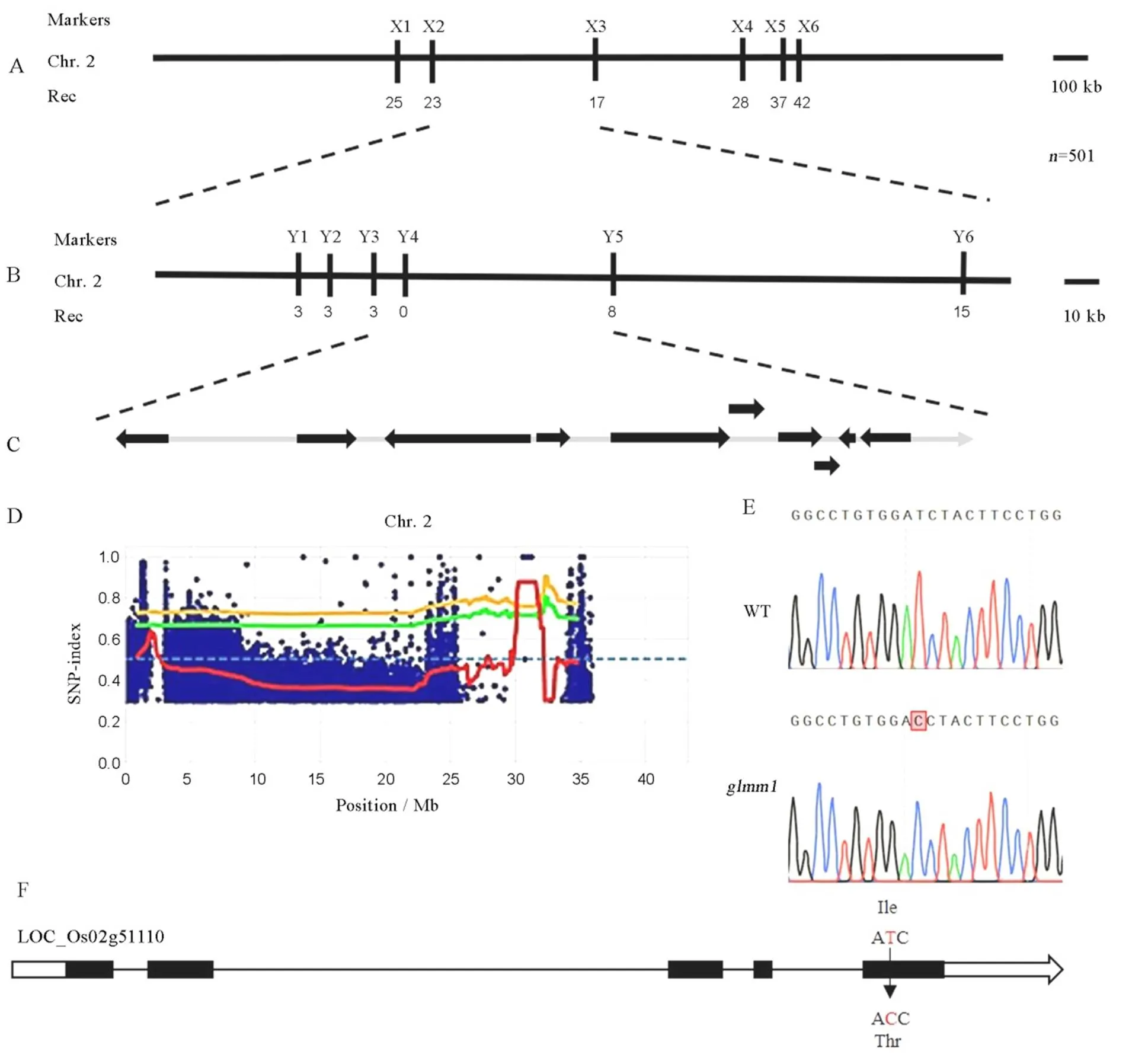
图3 水稻GLMM1基因的精细定位
Fig. 3. Fine mapping of ricegene.
2.5 全硅含量的测定
由于编码产物为硅转运蛋白,为了探讨该突变是否会造成植株硅含量的变化,对成熟后的野生型和突变体的颖壳和叶片进行全硅含量的测定。结果显示,的颖壳和叶片的全硅含量和野生型比较均显著降低(图5),野生型中颖壳的全硅含量为23.00 g/kg,突变体中叶片的全硅含量为3.43 g/kg;野生型中叶片的全硅含量为31.23 g/kg,突变体中叶片的全硅含量为4.82 g/kg。表明的基因突变导致了其体内全硅含量的降低,进一步表明即为。

A, C, I, K−抽穗初期野生型(WT)和glmm1的穗和叶片的表型特征;B, D, J, L−抽穗初期WT和glmm1的穗和叶片的扫描电镜观察;E, G, M, O−成熟期WT和glmm1的穗和叶片的表型特征;F, H, N, P−成熟期WT和glmm1的穗和叶片的扫描电镜观察。标尺为4 cm(A, C, E, G, I, K, M, O),40 μm(B, D, F, H, J, L, N, P)。红色箭头指向植硅石和二氧化硅细胞。
Fig. 4. Scanning electron microscopy observation of rice glumes and leaves.
3 讨论
在已发现的100多个类病斑突变体中,大多数的斑点出现在叶片上,但它们出现的时间各不相同,[29]、[30]、[31]和[32]等突变体分别在播种10、14、20和30 d后叶片开始出现斑点,[33]在3~4叶期,[34]在开花期,[6]在分蘖后期。本研究的突变体在抽穗前不出现类病斑,抽穗10 d后逐渐出现褐色病斑,随着水稻的不断成熟,褐色病斑的数量不断增多,并且这些褐斑不仅出现在叶片上还出现在颖壳表面。这表明类病斑的出现依赖于一定的生长发育进程。

A−颖壳;B−叶片。**代表野生型与突变体间的差异达0.01显著水平(n=3)。
Fig. 5. Determination of total silicon content of the wild type (WT) and its mutant.
水稻类病斑发生过程中活性氧发挥着重要作用。活性氧物质主要存在于细胞的线粒体和叶绿体中,通常在植物体内维持低浓度的动态平衡,在受到病原菌侵害时,激活植物的免疫反应,抵御病原菌的侵染,是植物限制病原菌侵染的重要途径[35]。然而,大量积累的活性氧会影响细胞正常的生理活动,破坏细胞结构和稳态,进而引起细胞程序性死亡,产生褐色类病斑[36]。Lin等[37]发现的类病斑突变体由于体内活性氧含量升高,激活了硝酸还原酶的活性,造成一氧化碳的大量积累,产生类病斑。本研究的颖壳类病斑突变体不仅在叶片上检测到活性氧积累,而且在颖壳上同样检测到大量的活性氧存在。活性氧的积累通常是由于细胞内活性氧清除机制受到干扰,如细胞内超氧化物歧化酶、过氧化氢酶和谷胱甘肽等含量或活性降低,导致不足以清除新产生的活性氧。水稻缺硅会导致抗氧化能力的降低和活性氧的积累。前人研究表明,过表达的水稻比野生型和转基因水稻拥有更多的抗氧化酶类,如抗坏血酸过氧化物酶、超氧化物歧化酶和过氧化氢酶等,在应对紫外线辐射时表现出更好的耐受性[38],推测突变体可能对硅元素吸收减弱导致抗氧化能力衰退,进而引起活性氧的积累。
本研究对突变体进行了遗传分析和基因定位,发现受单隐性基因控制,通过精细定位和MutMap分析预测该基因可能为(),测序分析发现突变体在基因的第5个内含子的碱基由T变为C,造成编码的第238位氨基酸从异亮氨酸Ile变为苏氨酸Thr;而突变体是单碱基突变,由G变为A,造成第132位的丙氨酸变成苏氨酸。这两种突变都会降低硅元素积累,但其他性状不尽相同,可能是突变位点不同所致。由此推测,是基因的新等位型。
水稻是典型的“喜硅作物”,硅元素在水稻表皮细胞的硅质化,病虫害的防御和养分转运等方面都发挥着重要的作用[39]。植硅石广泛存在于水稻的颖壳表皮,它的中空状隆起体区别于别的禾本科植物,具有光滑的外壁丘形隆起和双乳状突起。植硅石的形成主要是通过“硅质化”代谢产生的,水稻由根部吸收的硅酸通过蒸腾作用至地上部,然后沉积在叶片和颖壳等器官的表皮细胞上[40-43]。这种沉积与水稻的硅元素吸收情况密切相关,水稻的新嫩叶片在缺硅处理后未出现明显的硅化细胞并且乳突较小,而供硅处理的情况则截然不同,呈现均匀分布的硅化细胞和较大的乳突[44]。本研究发现颖壳和叶片表面的植硅石形态和结构异常,均出现了不同程度的皱缩和破损。对野生型LR005和突变体颖壳和叶片的全硅含量检测结果表明,硅元素在的吸收和积累受到抑制,从而导致了植硅石形态和结构的异常。初步阐释了水稻突变体的表型及候选基因,为解析颖壳类病斑的基因克隆和分子机理的解析提供理论基础。
谢辞:本研究二代测序工作得到了国家基因库的支持,特此致谢。
[1] 孙志广, 代慧敏, 陈庭木, 李景芳, 迟铭, 周振玲, 刘艳, 刘金波, 徐波, 邢运高, 杨波, 李健, 卢百关, 方兆伟, 王宝祥, 徐大勇. 水稻类病斑突变体的鉴定与基因定位 [J]. 中国水稻科学, 2022, 36(4): 357-366.
Sun Z G, Dai H M, Chen T M, Li J F, Chi M, Zhou Z L, Liu Y, Liu J B, Xu B, Xing Y G, Yang B, Li J, Lu B G, Fang Z W, Wang B X, Xu D Y. Phenotypic identification and gene mapping of a lesion mimic mutantin rice [J]., 2022, 36(4): 357-366. (in Chinese with English abstract)
[2] Kelly D, Vatsa A, Mayham W, Kazic T. Extracting complex lesion phenotypes in[J]., 2016, 27(1): 145-156.
[3] Wu C, Bordeos A, Madamba M R, Baraoidan M, Ramos M, Wang G L, Leach J E, Leung H. Rice lesion mimic mutants with enhanced resistance to diseases [J]., 2008, 279(6): 605-619.
[4] Liu J, Park C H, He F, Nagano M, Wang M, Bellizzi M, Zhang K, Zeng X, Liu W, Ning Y, Kawano Y, Wang G L. The RhoGAP SPIN6 associates withandand negatively regulates programmed cell death and innate immunity in rice [J]., 2015, 11(2): e1004629.
[5] Shen X, Liu H, Yuan B, Li X, Xu C, Wang S.negatively regulates rice bacterial resistance via activation of ethylene biosynthesis [J]., 2011, 34(2): 179-191.
[6] Zeng L, Yin Z, Chen J, Leung H, Wang G L. Fine genetic mapping and physical delimitation of the lesion mimic geneto a 160-kb DNA segment of the rice genome [J]., 2002, 268(2): 253-261.
[7] Hong Y, Zhang Y, Sinumporn S, Yu N, Zhan X, Shen X, Chen D, Yu P, Wu W, Liu Q, Cao Z, Zhao C, Cheng S, Cao L. Premature leaf senescence 3, encoding a methyltransferase, is required for melatonin biosynthesis in rice [J]., 2018, 95(5): 877-891.
[8] 焦然, 徐娜, 胡娟, 宋周琳, 胡佳青, 饶玉春, 王跃星. 水稻类病变突变体性状及分子机理研究进展[J]. 中国水稻科学, 2018, 32(3): 285-295.
Jiao R, Xu N, Hu J, Song Z L, Hu J Q, Rao Y C, Wang Y X. Advances in traits of lesion mimic mutants and its molecular mechanisms in rice [J]., 2018, 32(3): 285-295. (in Chinese with English abstract)
[9] Tang J, Zhu X, Wang Y, Liu L, Xu B, Li F, Fang J, Chu C. Semi-dominant mutations in the CC-NB-LRR-typegene,, lead to constitutive activation of defense responses in rice [J]., 2011, 66(6): 996-1007.
[10] Cui Y, Peng Y, Zhang Q, Xia S, Ruan B, Xu Q, Yu X, Zhou T, Liu H, Zeng D, Zhang G, Gao Z, Hu J, Zhu L, Shen L, Guo L, Qian Q, Ren D. Disruption of, encoding a cytochrome P450 monooxygenase, induces ROS accumulation and cell death in rice[J]., 2021, 105(4): 942-956.
[11] Wei Q, Yan Z, Xiong Y, Fang Z. Altered expression ofinfluences rice lesion mimic and leaf senescence by regulating arginine transport and nitric oxide pathway [J]., 2021, 22(4): 2181.
[12] Liu X, Li F, Tang J, Wang W, Zhang F, Wang G, Chu J, Yan C, Wang T, Chu C, Li C. Activation of the jasmonic acid pathway by depletion of the hydroperoxide lyasereveals crosstalk between the HPL and AOS branches of the oxylipin pathway in rice[J]., 2012, 7(11): e50089.
[13] Lin A, Wang Y, Tang J, Xue P, Li C, Liu L, Hu B, Yang F, Loake G J, Chu C. Nitric oxide and protein-nitrosylation are integral to hydrogen peroxide-induced leaf cell death in rice [J]., 2011, 158(1): 451-464.
[14] Ingestad T. Mineral Nutrition of Plants: Principles and Perspectives [J]., 1973, 19(2): 156.
[15] Ma J F. Role of silicon in enhancing the resistance of plants to biotic and abiotic stresses [J]., 2004, 50(1): 11-18.
[16] Ma J F, Tamai K, Yamaji N, Mitani N, Konishi S, Katsuhara M, Ishiguro M, Murata Y, Yano M. A silicon transporter in rice [J]., 2006, 440(7084): 688-691.
[17] Azeem S, Li Z, Zheng H, Lin W, Arafat Y, Zhang Z, Lin X, Lin W. Quantitative proteomics study onin regulation of rice (L.) cold resistance [J]., 2016, 78(3): 307-323.
[18] Ma J F, Yamaji N, Mitani N, Tamai K, Konishi S, Fujiwara T, Katsuhara M, Yano M. An efflux transporter of silicon in rice [J]., 2007, 448(7150): 209-212.
[19] Yamaji N, Ma J F. A transporter at the node responsible for intervascular transfer of silicon in rice [J]., 2009, 21(9): 2878-2883.
[20] Yamaji N, Mitatni N, Ma J F. A transporter regulating silicon distribution in rice shoots[J]., 2008, 20(5): 1381-1389.
[21] Mitani N, Ma J F, Iwashita T. Identification of the silicon form in xylem sap of rice (L.)[J]., 2005, 46(2): 279-283.
[22] Huang S, Yamaji N, Sakurai G, Mitani-Ueno N, Konishi N, Ma J F. A pericycle-localized silicon transporter for efficient xylem loading in rice [J]., 2022, 234(1): 197-208.
[23] Currie H A, Perry C C. Silica in plants: Biological, biochemical and chemical studies[J]., 2007, 100(7): 1383-1389.
[24] 崔鹏,苑世领,徐桂英. 玉米植株中的植硅石及其纳米SiO2的制备 [J]. 无机材料学报, 2009, 24(3): 512-516.
Cui P, Wan S L, Xu G Y. Phytoliths in mealies corns and preparation of SiO2nano-materials[J]., 2009, 24(3): 512-516. (in Chinese with English abstract)
[25] 沈旺鑫, 史小品, 杜海波, 冯志明, 陈宗祥, 胡珂鸣, 范江波, 左示敏. 水稻类病斑突变体基因克隆及发生机制研究进展[J]. 江苏农业学报, 2022, 38(03): 837-48.
Sen W X, Shi X P, Du H B, Feng Z M, Chen Z X, Hu K M, Fan H B, Zuo S M. Research advances in gene cloning and occurrence mechanism of rice lesion mimic mutants[J]., 2022, 38(3): 837-848. (in Chinese with English abstract)
[26] Rogers S O, Bendich A J. Extraction of DNA from milligram amounts of fresh, herbarium and mummified plant tissues[J]., 1985, 5(2): 69-76.
[27] 华海霞, 于慧国, 刘德君. 硅钼蓝比色法测定植株中的硅[J]. 现代农业科技, 2013(24): 173-4.
Bi H X, Xu H G, Liu D J. Determination of silicon concentration in the plants by colorimetric molybdenum blue method[J]., 2013(24): 173-174. (in Chinese with English abstract)
[28] Liu Q, Ning Y, Zhang Y, Yu N, Zhao C, Zhan X, Wu W, Chen D, Wei X, Wang G L, Cheng S, Cao L.negatively regulates cell death and immunity by degradingin rice[J]., 2017, 29(2): 345-359.
[29] 奉保华, 杨杨, 施勇烽, 林璐, 陈洁, 黄奇娜, 魏彦林, Leung H, 吴建利. 水稻淡褐斑叶突变体的遗传分析与基因定位[J]. 中国水稻科学, 2012, 26(3): 297-301.
Feng B H, Yang Y, Shi Y F, Lin L Chen J, Huang Q N, Wei Y L, Leung H, Wu J L. Genetic analysis and gene mapping of a light brown spotted leaf mutant() in rice[J]., 2012, 26(3): 297-301. (in Chinese with English abstract)
[30] Tong X, Qi J, Zhu X, Mao B, Zeng L, Wang B, Li Q, Zhou G, Xu X, Lou Y, He Z. The rice hydroperoxide lyasefunctions in defense responses by modulating the oxylipin pathway[J]., 2012, 71(5): 763-775.
[31] Chen X, Hao L, Pan J, Zheng X, Jiang G, Jin Y, Gu Z, Qian Q, Zhai W, Ma B., a cell death and defense-related gene, encodes a putative splicing factor 3b subunit 3 () in rice[J]., 2012, 30(2): 939-949.
[32] Takahashi A, Agrawal G K, Yamazaki M, Onosato K, Miyao A, Kawasaki T, Shimamoto K, Hirochika H. Ricenegatively regulates-dependent defense responses [J]., 2007, 19(9): 2940-2951.
[33] 王建军, 朱旭东, 王林友, 张利华, 薛庆中, 何祖华. 水稻类病斑突变体的生理与遗传分析[J]. 植物生理与分子生物学学报, 2004(3): 331-338.
Wang J J, Zhu X D, Wang L Y, Zhang L H, Xue Q Z, He Z H. Physiological and genetic analysis of the disease-like mutant of rice[J]., 2004(3): 331-338. (in Chinese with English abstract)
[34] Yoshimura A, Ideta O, Iwata N. Linkage map of phenotype and RFLP markers in rice[J]., 1997, 35(1-2): 49-60.
[35] 钱婧雅, 刘芬, 屈成, 王悦. 水稻类病斑突变基因的克隆及其机制研究进展[J]. 分子植物育种, 2021, 19(10): 3274-3280.
Qian J Y, Liu F, Qu C, Wang Y. Research progress on cloning and mechanism of rice lesion mimic genes[J]., 2021, 19(10): 3274-3280. (in Chinese with English abstract)
[36] 陈萍萍, 叶胜海, 赵宁春, 陆艳婷, 刘合芹, 杨玲, 金庆生, 张小明. 浙粳22类病斑突变体特征及其基因定位[J]. 核农学报, 2010, 24(1): 1-6.
Chen P P, Ye H S, Zhao N C, Lu Y T, Liu H Q, Yang L, Jin Q S, Zhang X M. Characteristics and genetic mapping of a lesion mimic mutantin japonica rice variety Zhejing 22[J]., 2010, 24(1): 1-6. (in Chinese with English abstract)
[37] Lin A, Wang Y, Tang J, Xue P, Li C, Liu L, Hu B, Yang F, Chu C. Nitric oxide and protein S-nitrosylation are integral to hydrogen peroxide-induced leaf cell death in rice [J]., 2012, 158(1): 451-464.
[38] Fang C, Li L, Zhang P, Wang D, Yang L, Reza B M, Lin W.modulates the antioxidant capacity of rice and protects against ultraviolet-B radiation[J]., 2019, 278: 96-106.
[39] 曾仁杰. 硅肥对水稻产量、品质及抗倒伏特性的影响[J]. 中国农学通报, 2021, 37(22): 1-4.
Zeng R J. Effect of silicon fertilizer on rice yield, grain quality and lodging resistance[J]., 2021, 37(22): 1-4. (in Chinese with English abstract)
[40] 张文绪. 稻属植物叶背亚显微结构的观察研究[J]. 中国水稻科学, 1995(2): 71-76.
Zhang W X. The observation of submicrostructure on leaves-back in[J]., 1995(2): 71-76. (in Chinese with English abstract)
[41] 张文绪, 裴鑫德. 水稻稃面双峰乳突的研究[J]. 作物学报, 1998(6): 691-697.
Zhang W X, Pei X D. Study of double-peaked papillae on the lemma side of rice[J]., 1998(6): 691-697. (in Chinese with English abstract)
[42] 张良平, 陈良碧, 沈晓勤. 水稻叶片表面结构电镜观察 [J]. 电子显微学报, 1990(3): 43.
Zhang L P, Chen L B, Shen X Q. Electron microscopic observation of the surface structure of rice leaves[J]., 1990(3): 43. (in Chinese with English abstract)
[43] 周少凡, 黎根, 彭紫登, 杨文广, 邹志云, 杨秉耀, 何波仔, 黄琫. 水稻施硅之抗虫机制的研究 [J]. 电子显微学报, 1993(3): 247-250.
Zhou S F, Li G, Peng Z D, Yang W G, Zou Z Y, Yang B Y, He B Z, Huang B. Studies on insect-resistance mechanism after silicon applied in rice[J]., 1993(3): 247-250. (in Chinese with English abstract)
[44] 水茂兴, 陈德富, 秦遂初, 蒋式洪. 水稻新嫩组织的硅质化及其与稻瘟病抗性的关系[J]. 植物营养与肥料学报, 1999(4): 352-358.
Shui M X, Chen D F, Qin S C, Jiang S H. The silicification of young tissues of rice and relationship with its resistance to blast of rice[J]., 1999(4): 352-358. (in Chinese with English abstract)
Characterization and Gene Mapping of a Glume Lesion Mimic Mutantin Rice
XU Huan1,#, ZHOU Tao2,#, SUN Yue1, WANG Mumei3, YANG Yachun2, MA Hui2, LI Hao2, XU Dawei1, ZHOU Hai3, YANG Jianbo2, NI Jinlong2,*
(College of Agriculture, Anhui Agricultural University, Hefei 230036, China;Rice Research Institute, Anhui Academy of Agricultural Sciences, Hefei 230001, China; College of Life Sciences, South China Agricultural University, Guangzhou 510642, China; These authors contributed equally to this paper; Corresponding author, email: jlni09@163.com)
【Objective】The aim of this study is to identify and map the glume lesion mimics mutant genein rice, and to lay a foundation for gene cloning and molecular mechanism research. 【Method】Agronomic traits analysis, scanning electron microscopy observation, DAB staining, and total silicon content determination were performed on the wild-type material LR005 and the glume lesion mimics mutantobtained through EMS mutagenesis. The F2population derived fromand L422 was used for genetic analysis, and gene mapping by map-based cloning and BSA-seq method. 【Result】The mutant gradually showed brown spots on the glumes and leaves 10 days after heading, and the glumes were completely brown at mature stage. Compared with the wild type, the mutant showed highly significant reductions in plant height, panicle length, total number of grains per panicle, seed setting rate and 1000-grain weight. DAB staining showed that theglumes and leaves had increased ROS(reactive oxygen species) content; Scanning electron microscopy observation showed that the siliceous cells on the surface of the mutant glumes and leaveswrinkled. The genetic analysis showed that the glume lesion mimics phenotype ofwas controlled by a pair of recessive genes. Using the F2segregating population ofand L422,was localized to a 68-kb interval containing 10 genes on chromosome 2 by map-based cloning and BSA-seq. Sequence analysis revealed only one SNP in this interval, which located in the fifth exon of the gene(LOC_Os02g51110), resulting in a substitution of Ile with Thr. The reduced accumulation ofsilicon was found by measuring total silicon content of the glumes and leaves, suggesting thatmay be a mutant allele of. 【Conclusion】is a new mutant allele of, which causes a reduction in silicon content and accumulation of reactive oxygen species in plants, resulting in brownspots on glumes and leaves.
rice; mutant; lesion mimic; silicon transporters; gene mapping
10.16819/j.1001-7216.2023.221201
2022-12-05;
2023-01-31。
安徽省重点研发计划资助项目(202104g01020013, 202104b11020008); 安徽省农业科学院青年英才计划资助项目(QNYC2019, QNYC2022);水稻遗传育种安徽省重点实验室开放课题(SDKF-2021-02)。
