硅对镉胁迫下水稻苗期抗氧化酶系统及镉离子吸收和转运相关基因表达水平的影响
2023-09-14黄奇娜徐有祥林光号党洪阳郑振权张燕王晗邵国胜尹献远
黄奇娜 徐有祥 林光号 党洪阳 郑振权 张燕 王晗 邵国胜, * 尹献远
硅对镉胁迫下水稻苗期抗氧化酶系统及镉离子吸收和转运相关基因表达水平的影响
黄奇娜1, #徐有祥2, #林光号3党洪阳3郑振权1张燕1王晗1邵国胜1, *尹献远4, *
(1中国水稻研究所,杭州310006;2龙游县农业农村局,浙江 衢州 324400;3常山县农业农村局,浙江 衢州 324200;4衢州市农业农村局,浙江 衢州 324000.#共同第一作者;*通信联系人,email: shaoguosheng@caas.cn;yyxxyy1688@163.com)
【目的】探究在镉(Cadmium,Cd)胁迫下,外源硅(Silicon,Si)对水稻株高、干物质量、抗氧化酶系统及对Cd2+相关基因表达水平的影响,以期为阐明Si缓解Cd对水稻毒害作用机理提供理论依据。【方法】以辐品36(FP36)和中嘉早17(ZJZ17)为研究对象,通过设置不同Cd胁迫浓度(0、5 µmol/L)和Si处理(0、10 µmol/L、1 mmol/L)进行水培实验,重点分析处理后水稻农艺性状和抗氧化酶活性,以及Cd2+吸收、转运相关基因表达水平的差异。【结果】Cd胁迫可以显著抑制水稻株高、干物质量和抗氧化酶(SOD、POD、CAT和APX)活性;但Si能有效缓解Cd毒害,显著提高水稻生物量,增强抗氧化酶活性,其中1 mmol/L Si缓解效果更佳。此外,Si还能有效增加可溶性蛋白并降低MDA含量。Cd胁迫显著增加了FP36和ZJZ17不同组织的重金属含量,其中,根系中Cd积累量显著高于地上部。在添加较低浓度Si(10 µmol/L)后,水稻根系和地上部Cd含量无显著差异;但1 mmol/L Si能显著降低水稻根系和地上部Cd含量。、、、、等Cd2+吸收和转运相关基因的表达水平在镉胁迫和Si处理后呈不同的变化趋势。其中,、、的表达量受Cd胁迫影响有所上调,表达量呈下调趋势,而则无显著变化。而外源添加1 mmol/L Si可显著下调上述Cd2+吸收和转运相关基因的表达水平,重金属镉积累量下降。【结论】Si通过改善水稻的农艺性状、激活抗氧化系统,以及调控重金属Cd2+吸收和转运相关基因的表达水平来缓解镉对水稻的毒害作用。
水稻;镉胁迫;硅;抗氧化酶系统;基因表达水平
镉(Cadmium, Cd)在植物生长发育过程中属于非必需元素,具有较高的可迁移性,对植物易产生毒害作用,影响农作物的产量和品质。重金属Cd复合物比其他重金属更易溶解[1],因此Cd更容易被植物吸收和转移,并在植物的不同组织部位积累,并由此通过食物链进入人体[2]。水稻对Cd具有较强的积累能力,其根系吸收镉之后,通常大部分会富集在根部。但随着地上部的蒸腾作用、呼吸作用等一系列的生理生化过程,根系中积累的Cd会向地上部(茎秆、叶片和籽粒等)迁移和转运。研究表明,Cd干扰了植物的光合作用和生物量,阻碍根系对其他必需营养元素的吸收,影响植物正常生长发育[3]。镉还能引起氧化应激反应诱导产生大量的活性氧(Reactive oxygen species, ROS),中断一系列生理生化过程,直接或间接地破坏植物细胞分子生物学功能[4, 5]。硅(Silicon, Si)是水稻生长发育过程中必不可少的营养元素之一,不仅能有效提升植物生物量,还能缓解重金属Cd的毒害作用,增加抵御逆境的耐受力[6, 7]。近年来,关于硅调控水稻重金属镉毒害的研究备受关注。研究发现,酸性红壤中土施硅肥能显著降低水稻糙米镉含量(降幅约38.7%~48.5%)[8];若结合全生育期淹水,糙米中的镉降幅可高达86.7%[9]。偏中性土壤中叶面喷施硅肥也可有效降低糙米镉含量(降幅约为58.33%[10]和45.26%[11])。由此可见,土壤类型和理化性质、栽培措施、施用方式等的不同导致稻米降镉效果存在差异。此外,部分研究还表明,施用硅肥后糙米中的镉含量有所增加[12, 13]。关于硅肥影响水稻镉毒害的研究虽取得一定进展,但其具体调控机制尚不清楚。
大量研究表明,硅主要通过参与植物体的生理代谢活动来缓解Cd毒害,包括影响叶片光合作用、增强水稻抗氧化酶系统活性,以及抑制Cd的吸收和转运等。施加Si能增加镉胁迫后水稻叶绿素a、b和类胡萝卜含量,增大叶绿体和叶肉细胞体积[14],延缓叶片衰老,提高水稻叶片光合效率。Si可增强水稻供氧量,提升抗氧化酶的氧化能力和活性[15];同时,还可与MDA结合形成络合物,降低MDA含量,缓解镉毒害作用[16]。硅还能抑制根系对镉的吸收及其在地上部的转运。研究表明,植物根系通过不同的转运载体蛋白在吸收其他营养元素的同时对Cd2+进行吸收[17, 18]。在植物体受到Cd胁迫时,水稻重金属Cd膜转运蛋白NRAMP(Natural resistance-associated macrophage protein)蛋白家族(OsNRAMP1、OsNRAMP5等)、HMA(Heavy metal ATPases)蛋白家族(OsHMA2和OsHMA3)、铁转运离子通道相关蛋白(OsIRT1和OsIRT2)等基因的表达水平会发生显著变化[19-23]。因此,在探究Si如何缓解重金属Cd对植物的毒害机理过程中,前人对这些Cd吸收和转运相关基因表达水平进行了分析。水稻植株在Cu/Cd胁迫下,外源添加Si可以显著上调基因的表达水平[24]。 Ma等[25]研究发现,在水稻植株中,Si存在时参与Cd运输的基因下调表达。 Si还可以调控其他重金属转运相关基因(、等)的表达水平,影响植物根系对Cd的吸收和转运[26, 27]。此外,硅还能与镉在水稻体内螯合并产生区隔化作用。Si可与水稻细胞壁上的半纤维素组分共价交联形成Si-半纤维素复合物[28, 29],增加根细胞的非蛋白巯基螯合Cd[30],降低Cd有效性和向地上部的转运量。
到目前为止,硅肥缓解Cd对植株的毒害机制研究虽然取得一定的进展,但在生理生化、分子和遗传水平上对其减毒机制尚不清楚,需要更多的相关研究来证实Si与Cd之间的连锁关系及其互作机制。因此,本研究拟通过重金属Cd胁迫处理和外源添加Si的水培试验,以辐品36(FP36)和中嘉早17(ZJZ17)水稻品种为研究对象,测定相关的农艺性状和抗氧化酶指标,以及Cd2+吸收和转运相关基因的表达水平,旨在深入探究Si如何缓解重金属Cd对植物的毒害机制,以期为硅肥精准高效防治重金属镉污染提供科学依据,为进一步的实践和应用奠定理论基础。
1 材料与方法
1.1 供试品种与试验处理
以籼稻品种辐品36(FP36,镉高积累品种)和中嘉早17(ZJZ17,镉低积累品种)为研究材料[31],在中国水稻研究所富阳试验基地进行水培实验。30℃条件下浸种48 h,清洗干净后35℃下催芽24 h,撒播于沙培容器中进行育秧。两叶一心时移栽至5 L塑料桶中进行全营养液预培养10 d,每桶种植5穴,每穴3株,各穴用树脂塑料板进行分隔,海绵固定,全营养液的配制参照Huang等[32]。水培处理实验设置2个镉浓度(0、5 µmol/L;以CdSO4·8H2O为Cd源),3个硅浓度(0、10 µmol/L、1 mmol/L;以Na2SiO4·9H2O为Si源)。每隔3 d更换1次水培处理营养液,调节其pH值约为5.0(± 0.1)。
处理14 d后,进行相关指标测定和分析,其中一部分用于根系和地上部重金属Cd含量的测定,另一部分取根系用液氮冷冻后,保存于−80℃低温冰箱中,用于重金属Cd2+吸收、转运相关基因的表达分析。
1.2 株高、地上部干物质量测定
在水培处理14 d后,对FP36和ZJZ17的株高、地上部干物质量进行测定。测量株高,每个处理6次生物学重复,取其平均值。然后将地上部105℃下杀青2 h后,再用烘箱65℃下烘干至恒重(约3 d),称量其地上部干物质量,每个处理3次生物学重复,取其平均值进行数据分析。
1.3 不同处理下水稻根系和地上部Cd含量测定
FP36和ZJZ17水培处理14 d后对根系和地上部进行取样,用0.1 mol/L的盐酸将根系样品浸泡15 min后再用蒸馏水冲洗2~3次。用烘箱将根系和地上部样品在65℃下烘干至恒重(约3 d)后,并研磨、粉碎;然后分别称取0.25 g根系和叶片样品用HNO3-H2O2法[32]进行硝化处理,再将收集的硝化液(10 mL)使用电感耦合等离子体原子发射光谱(ICAP 61E trace analyser, Thermo- Jarrell Ashe, Franklin, MA, USA)测定重金属Cd 含量,每个处理生物学重复3次,取其平均值进行数据分析。
1.4 水稻根系中抗氧化酶相关活性、可溶性蛋白和丙二醛(MDA)含量测定
称取不同水培实验处理下两个水稻品种新鲜根系0.5 g,测定抗氧化酶(超氧化物歧化酶,SOD;过氧化物酶,POD;过氧化氢酶,CAT;抗坏血酸氧化酶,APX)活性、可溶性蛋白和丙二醛(MDA)含量。将植株用冰浴后的磷酸缓冲液(0.05 mol/L; pH = 7.0; 10 mL)研磨成匀浆后,在10 000 r/min下离心10~15 min,取其上清液(酶的粗提液)。分别采用氮蓝四唑(NBT)光还原法、紫外吸收法、愈创木酚法、比色法、考马斯亮蓝染色法和丙二醛-硫代巴比妥酸(MDA-TBA)显色法对SOD、POD、CAT、APX等酶活性,以及可溶性蛋白和MDA含量进行测定[33],每个处理生物学重复3次,取其平均值进行数据分析。
1.5 Cd2+吸收和转运相关基因表达水平测定
以不同Cd浓度和Si处理浓度水培14 d的FP36和ZJZ17根系为样品,进行实时荧光定量PCR(Real-time quantitative PCR,qRT-PCR)分析,测定Cd2+吸收和转运相关基因的表达水平(引物序列参考Huang等[34])。采用TRIZOL法提取水培处理后ZJZ17和FP36根系总RNA,采用反转录试验体系(TaKara Primescyipt Tm RT reagent Kit with gDNA Eraser)将RNA反转录成cDNA后,以基因为内参,以不添加Cd和Si为对照,运用实时荧光定量PCR系统(StepOnePlus Real-Time PCR System, ABI, Thermo Fisher Scientific, USA)进行qRT-PCR(反应体系为20 µL),数据采用2-ΔΔCT方法进行计算[35]。
1.6 数据方差分析
采用Statistix 9方差分析软件(Analytical Software Tallahassee, FL)对试验数据进行处理与统计分析,采用LSD法进行差异显著性检验。
2 结果与分析
2.1 外源添加硅对不同Cd积累水稻品种株高和干物质量影响
不同Cd和Si处理14 d后,测定水稻辐品36(FP36)和中嘉早17(ZJZ17)的株高和干物质量,结果显示(表1):与0 µmol/L相比,5.0 µmol/L Cd胁迫对水稻的生长发育有显著影响,表现为水稻株高和地上部干物质量均显著降低。其中FP36中两者分别降低约33.62%和31.37%;ZJZ17中分别下降9.47%和26.21%。与0 µmol/L Si相比,外源添加10 µmol/L和1 mmol/L Si可以提高FP36和ZJZ17的株高和干物质量,尤其是在5.0 µmol/L Cd胁迫处理下效果更加明显。此外,两个水稻品种的株高、地上部干物质量在较高浓度的Si(1 mmol/L)处理下其增幅显著高于较低浓度(10 µmol/L)。由此可见,镉胁迫对水稻的生长发育有显著抑制作用,外源添加Si可以有效缓解镉胁迫对水稻的毒害作用。
FP36-辐品36;ZJZ17-中嘉早17。同一列中不同大写字母表示在不同Cd和Si处理下ZJZ17差异显著(< 0.05),同一列中不同小写字母表示FP36差异显著(< 0.05)。下同。
FP36, Fupin 36; ZJZ17, Zhongjiazao 17; For ZJZ17, different uppercase letters indicate significant difference under different Cd and Si treatments (< 0.05), and for FP36, different lowercase letters indicate significant difference (< 0.05). The same below.
2.2 外源添加Si对抗氧化酶系统的影响
对水稻根系的抗氧化酶活性进行测定,发现在0 µmol/L Cd处理下,外源添加10 µmol/L和1 mmol/L Si后,ZJZ17和FP36根系中SOD、POD、CAT和APX等酶活性均呈显著增加趋势(图1)。其中,添加1 mmol/L Si对抗氧化酶系统的影响明显,APX酶活性增加尤为显著。但在5.0 µmol/L Cd胁迫下,SOD、POD、CAT和APX等酶活性均呈降低趋势,而外源添加Si可以显著缓解Cd对水稻抗氧化酶活性的影响,其中1 mmol/L Si对镉胁迫的缓解效果最佳。
对可溶性蛋白和MDA含量测定结果显示(表2,3),Cd胁迫显著降低了可溶性蛋白含量并增加了MDA的含量,而外源Si可以有效缓解这一现象。结果显示,用1 mmol/L Si处理后,FP36和ZJZ17根系中的可溶性蛋白含量分别增加50.65%和54.70%。此外,Si处理降低了水稻MDA含量,其中,在FP36和ZJZ17根系中分别减少38.26%和25.41%。上述结果表明,Si可以激活抗氧化酶活性,有效减轻水稻在镉胁迫下受到的毒害。

表2 在不同Cd和Si处理下水稻FP36和ZJZ17根系中可溶性蛋白和MDA含量
2.3 外源Si对水稻Cd吸收和积累的影响
外源Cd胁迫会显著影响水稻根系和地上部的Cd积累(图2)。在5.0 µmol/L Cd胁迫下,FP36和ZJZ17根系和地上部的Cd含量极显著增加,其中FP36中Cd浓度分别增加为854.69 mg/kg和86.95 mg/kg,ZJZ17分别增加为1091.42 mg/kg和52.37 mg/kg。但在外源添加10 µmol/L Si后,两水稻品种根系和地上部的Cd含量与对照相比无显著差异;而1 mmol/L Si可以显著降低ZJZ17和FP36的Cd含量。其中,FP36根系和地上部中Cd含量降幅为20.70%和31.34%,ZJZ17中Cd含量降幅约为30.21%和37.75%。因此,低浓度Si(10 µmol/L)对水稻镉积累无显著影响,但当Si浓度(1 mmol/L)较高时则能有效降低Cd富集。
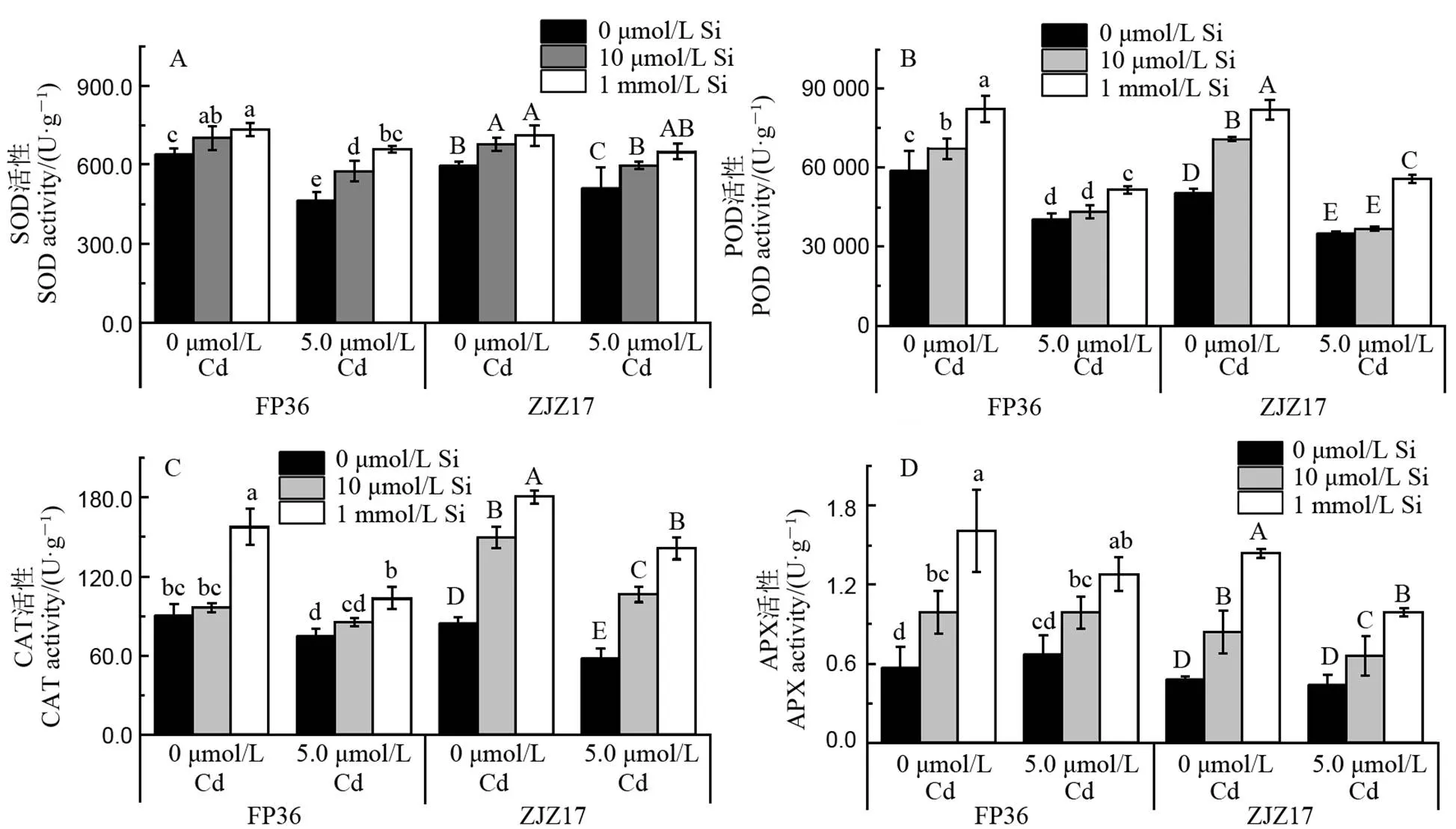
A-超氧化物歧化酶(SOD);B-过氧化物酶(POD);C-过氧化氢酶(CAT);D-抗坏血酸氧化酶(APX)。平均数±标准差(n=3)。不同大小写字母分别表示不同Cd和Si处理下ZJZ17和FP36在P < 0.05水平上差异显著。
Fig. 1. Antioxidant enzyme activities in roots of FP36 and ZJZ17 under different Cd and Si treatments.

图2 不同Cd胁迫和Si处理下水稻FP36和ZJZ17地上部(A,C)和根系(B,D)中Cd含量
Fig. 2. Cd content in shoots (A, C) and roots (B, D) of FP36 and ZJZ17 under different Cd stress and Si treatments.
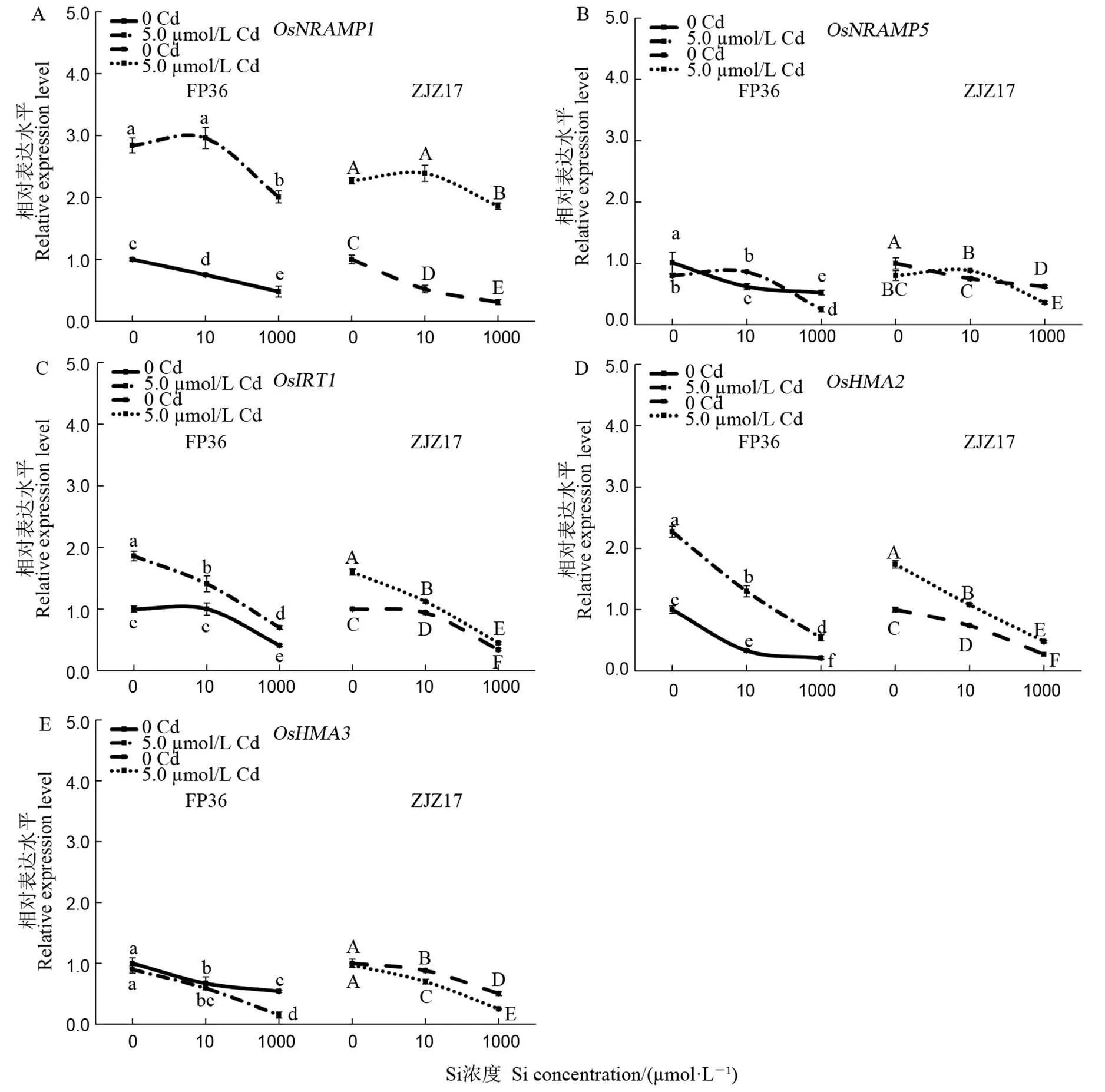
数值表示平均数±SD(n=3)。A~E分别表示OsNRAMP1、OsNRAMP5、OsIRT1、OsHMA2、OsHMA3基因的表达水平。
Fig. 3. Relative expression of Cd2+uptake/transport-related genes in roots of FP36 and ZJZ17 under different Cd and Si treatments.
2.4 外源硅对镉吸收/转运相关基因表达的影响
检测Si处理14 d后水稻根系中镉吸收和转运相关基因的表达水平(图3)。与0 µmol/L Cd相比,在5.0 µmol/L Cd胁迫下,两水稻根系中、和基因表达量呈显著上调趋势,其中,FP36根系中上调2.84、1.86和2.27倍;ZJZ17中分别上调2.27、1.60和1.74倍;而表达水平在镉胁迫下呈降低趋势,的表达量则无显著差异。在5.0 µmol/L Cd胁迫下,10 µmol/L Si处理下、、、及基因的表达量与0 µmol/L Si相比无显著差异。但在1 mmol/L Si处理下,、、及的表达量与0 µmol/L Si相比均呈显著降低趋势,在FP36中分别下调29.18%、62.33%、68.75%、76.41%和83.66%;在ZJZ17中分别降低约18.07%、71.91%、55.13%、72.41%和74.31%。结果表明,低浓度Si(10 µmol/L)对Cd吸收和转运相关基因的表达水平存在不同的调控作用,而较高浓度的Si(1 mmol/L)处理则会显著降低该基因的表达量。
3 讨论
当前农田镉污染和“镉大米”事件频发,关于硅增强水稻抗逆性,缓解镉毒害的研究备受关注。水稻是喜硅作物,施用Si肥可以增强水稻阻镉能力,降低稻米Cd含量,有效解决镉超标问题,提升水稻产量和稻米品质[6, 24, 31]。研究发现土施和叶面喷施硅肥的降镉效果略有差异,其中,结合全生育期淹水,稻米降镉效果十分显著[36, 37]。尽管Si对Cd吸收转运的阻碍机制已在大部分植物中得到证实,但在其他植物中却有促进Cd转运的作用。施加外源Si能增强Cd在植物体内的转运能力,在玉米[38]、芸薹属植物(油菜和印度芥菜)[39]、柏属植物(圆柏和侧柏)[40]、番茄[41]等植物中均有发现。此外,Si能增强Cd在高积累品种中的转运能力,但对低积累品种影响不显著[42]。硅对植物镉吸收转运的影响还与施用的硅酸盐种类和浓度有关。酸性土壤施用不同硅酸盐(硅钾肥、硅钙肥和硅酸钠)后,硅钙肥降镉效果最优(稻米降幅为71.5%)[43]。与本研究结果相似,在土壤中施加50 mg/kg SiO2导致大蒜地上部和鳞茎中镉含量增加,高浓度(500 mg/kg) SiO2则显著降低植物不同部位镉的积累[44]。由此,硅可能通过其他更重要的机制来提高植物耐受性,缓解镉毒害。
目前,关于硅对重金属毒害作用的缓解机制主要包含两个方面:1)避免机制。水稻幼苗从土壤中吸收主要成分为硅酸,其与Cd等进入水稻幼苗的迁移能力直接相关[45]。Si被植物吸收后在根系表皮细胞形成硅化细胞(硅质层),增加水稻其他组织的机械性从而降低蒸腾速率,减少因蒸腾流失导致的Cd转运[45, 47]。赵颖等[48]发现添加Si对水稻根系镉吸收无显著影响,但其地上部镉积累量呈明显降低趋势。此外,Si肥质外体运输途径跟踪研究表明,施加Si肥后,荧光染料向地上部的运输量显著降低,其中水稻地上部镉含量降低约24%,根系镉积累量则增加近21%[49]。Guo等[50]发现外源施加Si肥可显著降低水稻对镉的生物富集系数和从根部到茎部的转移系数。究其原因,可能在于外源添加大量Si元素(SiO2)在水稻根系细胞表面沉积,阻塞细胞壁孔隙,并且可与Cd2+螯合形成活性较低的大分子复合物Si-Cd2+ [51],从而影响根系对Cd的质外体运输和向地上部转运的能力,导致稻米镉含量降低[26];也可能由于部分硅酸盐化合物可以水解形成凝胶状的H2SiO3,其对部分游离状态的Cd2+有一定吸附作用,从而降低了植物生长外界环境中的Cd浓度及其活性[52]。可见,外源硅使得水稻吸收的Cd元素大部分滞留在根系,阻碍其向地上部转运和积累。2)耐受机制。主要包括Si调控抗氧化防御系统[53],改善光合作用提高根系对其他营养物质的吸收[54];促进细胞内重金属Cd的螯合,影响Cd吸收和转运蛋白基因表达,减少其细胞间运输和积累[55]。研究发现,硅主要通过参与水稻的生理生化途径改善水稻细胞超微结构,增强抗氧化酶的活性,清除镉胁迫诱导的自由基积累等方式缓解镉对其的毒害作用[6]。本研究结果显示,外源添加硅可以增强SOD、POD、CAT和APX等抗氧化酶活性,增加可溶性蛋白含量并降低MDA含量,缓解镉毒害作用。贾茜茹等[56]研究发现外源添加300 mg/kg硅显著提高受镉胁迫后的黄瓜叶片CAT、POD和SOD等酶活性,且MDA含量呈降低趋势。此外,添加外源60 mg/L Si对Cd胁迫后的板蓝根抗氧化酶(POD、SOD)活性有显著提高作用[57]。与之相反,Wang等[58]研究发现,在镉胁迫下,叶面喷施硅肥可以有效降低Cd SOD、POD、CAT等抗氧化酶活性。Srivastava等[59]研究表明添加硅肥、钙肥可以抑制SOD和GPX等酶的活性,而提高CAT酶的活性。由此可见,外源施加硅肥可以有效缓解植物对重金属镉的胁迫作用,降低脂质氧化反应对水稻细胞的毒害。
另外,水稻根系对镉的吸收和转运受Cd2+相关基因的调控,如、、、、等。其中,OsNRAMP1和OsNRAMP5属于NRAMP蛋白家族,参与根系Cd吸收和转运[19, 21]。HMA蛋白家族相关基因(和)主要参与植物中Cd2+迁移(区隔化于液泡),减少Cd2+向地上部运输[23, 60, 61]。此外,水稻能通过Fe2+转运蛋白(OsIRT1和OsIRT2)从土壤中吸收Cd2+,并向地上部运输[20]。在Cd胁迫下,外源添加Si可以调节水稻根系中负责Cd从外源溶液运输到细胞中相关基因的表达,从而抑制植物体根系对Cd2+的吸收[27]。与Zhang等[62]和 Chen等[27]研究结论相同,、、表达量在Cd胁迫处理后呈上调趋势,其中表达水平极显著上调。与Huang等[63]研究结果相似,表达量在Cd处理后呈降低趋势;而表达量则无显著差异。与Cd胁迫处理相比,低Si(10 µmol/L)处理下表达水平与0 µmol/L Si无显著差异,但在较高Si浓度处理下其表达量呈显著降低趋势,该结果与本研究中水稻Cd含量变化相呼应。部分研究还发现施加硅肥可能导致糙米中重金属镉含量提高[12, 13],本研究结果可在分子水平上一定程度解释该现象。由此,基因在外源添加Si降低Cd积累途径中起重要作用。此外,与前人研究结果相似[24, 27],、、等表达量在Si处理下均呈降低趋势。原因可能在于Cd与外源的Si螯合沉积在根系表面,根系细胞中的Cd浓度降低,促使Cd吸收和转运相应的基因表达水平降低。有鉴于此,低浓度的Si处理对水稻根系吸收Cd无显著影响,而外源添加一定浓度Si后则可通过调控Cd吸收、转运相关基因的表达水平,影响镉积累从而缓解镉对植株的毒害作用。
4 结论
硅元素可以有效缓解镉对水稻的毒害作用。通过Cd胁迫和不同浓度Si的水培实验,证实外源添加硅元素对受镉胁迫后水稻株高和干物质量等农艺性状均有显著的改善作用,其中较高浓度Si(1 mmol/L)对镉毒害作用的改善效果更佳。Si可以显著减少水稻根部对重金属Cd的吸收、积累和向地上部的转运,增强抗氧化酶(SOD、POD、CAT和APX等)活性,增加植株可溶性蛋白含量,降低MDA含量;还可以调控Cd2+吸收/转运相关基因(、、、、等)的表达水平,进而影响水稻植株中的Cd含量。此外,施用较低浓度Si对水稻Cd富集无显著影响,这可能与Cd2+吸收/转运基因的表达水平相关,但具体调控机制有待进一步研究。
[1] Chang C, Yin R, Zhang H, Yao L. Bioaccumulation and health risk assessment of heavy metals in the soil-rice system in a typical seleniferous area in Central China[J]., 2019, 38(7): 1577-1584.
[2] Mclaughlin M J, Whatmuff M, Warne M, Heemsbergen D, Barry G, Bell M, Nash D, Pritchard D. A field investigation of solubility and food chain accumulation of biosolid-cadmium across diverse soil types[J]., 2006, 3: 428-432.
[3] Ismael M A, Elyamine A M, Moussa M G, Cai M, Zhao X, Hu C. Cadmium in plants: Uptake, toxicity, and its interactions with selenium fertilizers[J]., 2019, 11(2): 255-277.
[4] Uraguchi S, Kiyono M, Sakamoto T, Watanabe I, Kuno K. Contributions of apoplasmic cadmium accumulation, antioxidative enzymes and induction of phytochelatins in cadmium tolerance of the cadmium-accumulating cultivar of black oat (Schreb.)[J]., 2009, 230(2): 267-276.
[5] Wu Z, Yin X, Bañuelos G S, Lin Z Q, Liu Y, Li M, Yuan L. Indications of selenium protection against cadmium and lead toxicity in oilseed rape (L.)[J]., 2016, 7: 1875.
[6] 戴青云, 刘代欢, 王德新, 李鹏祥, 朱维, 桂娟. 硅对水稻生长的影响及其缓解镉毒害机理研究进展[J]. 中国农学通报, 2020, 36(5): 86-92.
Dai Q Y, Liu D H, Wang D X, Li P X, Zhu W, Gui J. A review on silicon: Effect on rice growth and its mechanism of relieving cadmium toxicity[J]., 2020, 36(5): 86-92. (in Chinese with English abstract)
[7] Khan I, Awan S A, Rizwan M, Ali S, Hassan M J, Brestic M, Zhang X, Huang L. Effects of silicon on heavy metal uptake at the soil-plant interphase: A review[J]., 2021, 222: 112510.
[8] 高子翔, 周航, 杨文弢, 辜娇峰, 陈立伟, 杜文琪, 徐珺, 廖柏寒. 基施硅肥对土壤镉生物有效性及水稻镉累积效应的影响[J]. 环境科学, 2017(12): 5299-5307.
Gao Z X, Zhou H, Yang W T, Gu J F, Chen L W, Du W Q, Xu J, Liao B H. Impacts of silicon fertilizer as base manure on cadmium bioavailability in soil and on cadmium accumulation in rice plants[J]., 2017(12): 5299-5307. (in Chinese with English abstract)
[9] 魏晓, 张鹏博, 赵丹丹, Bocharnikova E, Matichenkov V, Dmitry D. 水稻土施硅对土壤-水稻系统中镉的降低效果[J]. 生态学报, 2018, 38(5): 1600-1606.
Wei X, Zhang P B, Zhao D D, Elena B, Vladimir M, Demin D. Cadmium status in paddy soil in a rice system under silicon fertilization[J]., 2018, 38(5): 1600-1606. (in Chinese with English abstract)
[10] 秦淑琴, 黄庆辉. 硅对水稻吸收镉的影响[J]. 新疆环境保护, 1997, 19(3): 51-53.
Qin S Q, Huang Q H. Effect of silicon on cadmium uptake by rice[J]., 1997, 19(3): 51-53. (in Chinese with English abstract)
[11] 郑文杰, 卢剑, 刘模发. 施用液体硅肥降低稻米中镉含量效果研究[J]. 现代化农业, 2016(7): 30-31.
Zheng W J, Lu J, Liu M F. Effect of liquid silicon fertilizer on reducing cadmium content in rice[J]., 2016(7): 30-31. (in Chinese with English abstract)
[12] Wang H Y, Wen S L, Chen P, Zhang L, Cen K, Sun G X. Mitigation of cadmium and arsenic in rice grain by applying different silicon fertilizers in contaminated fields[J]., 2016, 23(4): 3781-3788.
[13] 赵明柳, 唐守寅, 董海霞, 李荭荭, 吴竹麟, 黄俊星, 王果. 硅酸钠对重金属污染土壤性质和水稻吸收Cd Pb Zn的影响[J]. 农业环境科学学报, 2016, 35(9): 1653-1659.
Zhao M L, Tang S Y, Dong H X, Li H H, Wu Z L, Huang J X, Wang G. Effects of sodium silicate on soil properties and Cd, Pb and Zn absorption by rice plant[J]., 2016, 35(9): 1653-1659. (in Chinese with English abstract)
[14] Nwugo C C, Huerta A J. Silicon-induced cadmium resistance in rice ()[J]., 2008, 171(6):841-848.
[15] 龚金龙, 张洪程, 龙厚元, 胡雅杰, 戴其根, 霍中洋, 许轲, 魏海燕, 高辉. 水稻中硅的营养功能及生理机制的研究进展[J]. 植物生理学报, 2012, 48(1): 1-10.
Gong J L, Zhang H C, Long H Y, Hu Y J, Dai Q G, Huo Z Y, Xu K, Wei H Y, Gao H. Progress in research of nutrition functions and physiological mechanisms of silicon in rice[J]., 2012, 48 (1): 1-10. (in Chinese with English abstract)
[16] 胡瑞芝, 方水娇, 陈桂秋. 硅对杂交水稻生理指标及产量的影响[J]. 湖南农业大学学报: 自然科学版, 2001, 27(5): 335-338.
Hu R Z, Fang S J, Chen G Q. Effects of silicon on the physiological targets and yield of hybrid rice[J].:, 2001, 27(5): 335-338. (in Chinese)
[17] Enstone D E, Peterson C A, Ma F. Root endodermis and exodermis: Structure, function, and responses to the environment[J]., 2002, 21: 335-351.
[18] Sasaki A, Yamaji N, Yokosho K, Ma J F. Nramp5 is a major transporter responsible for manganese and cadmium uptake in rice[J]., 2012, 24(5): 2155-2167.
[19] Takahashi R, Ishimaru Y, Senoura T, Shimo H, Ishikawa S, Arao T, Nakanishi H, Nishizawa N K. The OsNRAMP1 iron transporter is involved in Cd accumulation in rice[J]., 2011, 62(14): 4843-4850.
[20] Nakanishi H, Ogawa I, Ishimaru Y, Mori S, Nishizawa N K. Iron deficiency enhances cadmium uptake and translocation mediated by the Fe2+transporters OsIRT1 and OsIRT2 in rice[J]., 2006, 52(4): 464-469.
[21] Ishimaru Y, Takahashi R, Bashir K, Shimo H, Senoura T, Sugimoto K, Ono K, Yano M, Ishikawa S, Arao T, Nakanishi H, Nishizawa N K. Characterizing the role of rice NRAMP5 in manganese, iron and cadmium transport[J]., 2012, 2: 286.
[22] Takahashi R, Ishimaru Y, Shimo H, Ogo Y, Senoura T, Nishizawa N K, Nakanishi H. The OsHMA2 transporter is involved in root-to-shoot translocation of Zn and Cd in rice[J]., 2012, 35(11): 1948-1957.
[23] Sasaki A, Yamaji N, Ma J F. Overexpression of OsHMA3 enhances Cd tolerance and expression of Zn transporter genes in rice[J]., 2014, 65(20): 6013-6021.
[24] Kim Y H, Khan A L, Kim D H, Lee S Y, Kim K M, Waqas M, Jung H Y, Shin J H, Kim J G, Lee I J. Silicon mitigates heavy metal stress by regulating P-type heavy metal ATPases,low silicon genes, and endogenous phytohormones[J]., 2014, 14: 13.
[25] Ma J, Cai H, He C, Zhang W, Wang L. A hemicellulose-bound form of silicon inhibits cadmium ion uptake in rice () cells[J]., 2015, 206(3): 1063-1074.
[26] Adrees M, Ali S, Rizwan M, Zia-Ur-Rehman M, Ibrahim M, Abbas F, Farid M, Qayyum M F, Irshad M K. Mechanisms of silicon-mediated alleviation of heavy metal toxicity in plants: A review[J]., 2015, 119: 186-197.
[27] Chen D, Chen D, Xue R, Long J, Lin X, Lin Y, Jia L, Zeng R, Song Y. Effects of boron, silicon and their interactions on cadmium accumulation and toxicity in rice plants[J]., 2019, 367: 447-455.
[28] Liu J, Ma J, He C, Li X, Zhang W, Xu F, Lin Y, Wang L. Inhibition of cadmium ion uptake in rice () cells by a wall-bound form of silicon[J]., 2013, 200(3): 691-699.
[29] 李江遐, 张军, 马友华, 蔡慢弟, 高飞. 硅对镉胁迫条件下两个水稻品种镉亚细胞分布、非蛋白巯基物质含量的影响[J]. 农业环境科学学报, 2018, 36(6): 1066-1071.
Li J, Zhang J, Ma Y, Cai M D, Gao F. Effects of silicon on cadmium accumulation and non-protein thiol content in the seedlings of two rice varieties under cadmium stress[J]., 2018, 37(6): 1066-1071. (in Chinese with English abstract)
[30] Riaz M, Kamran M, Rizwan M, Ali S, Parveen A, Malik Z, Wang X. Cadmium uptake and translocation: Selenium and silicon roles in Cd detoxification for the production of low Cd crops: A critical review[J]., 2021, 273: 129690.
[31] Zhou Q, Shao G S, Zhang Y X, Dong Q, Wang H, Chen S H, Cao L Y, Shen X H. The difference of cadmium accumulation between the indica and japonica subspecies and the mechanism of it[J]., 2017, 81: 523-532.
[32] Huang Q N, An H, Yang Y J, Liang Y, Shao G S. Effects of Mn-Cd antagonistic interaction on Cd accumulation and major agronomic traits in rice genotypes by different Mn form[J]., 2017, 82: 317-331.
[33] 赵世杰, 苍晶. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2015: 143-145, 225-236.
Zhao S J, Cang J. Laboratory Guides for Plant Physiology[M]. Beijing: Chinese Agricultural Science and Technology Press, 2015: 143-145, 225-236. (in Chinese with English abstract)
[34] Huang Q N, Wu Y L, Shao G S. Root aeration promotes the cadmium accumulation in rice by regulating the iron uptake system[J]., 2021, 28(5): 511-520.
[35] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real time quantitative PCR and the 2-ΔΔctmethod[J]., 2001, 25: 402-408.
[36] 陈喆, 张淼, 叶长城, 毛懿德, 周细红, 雷鸣, 魏祥东, 铁柏清. 富硅肥料和水分管理对稻米镉污染阻控效果研究[J]. 环境科学学报, 2015, 35(12): 4003-4011.
Chen Z, Zhang M, Ye C C, Mao Y D, Zhou X H, Lei M, Wei X D, Tie B Q. Mitigation of Cd accumulation in rice (L.) with Si fertilizers and irrigation managements[J]., 2015, 35(12): 4003-4011. (in Chinese with English abstract)
[37] 李园星露, 叶长城, 刘玉玲, 李丹阳, 刘寿涛, 罗海艳, 刘孝利, 铁柏清, 孙健. 硅肥耦合水分管理对复合污染稻田土壤As-Cd生物有效性及稻米累积阻控[J]. 环境科学, 2018, 39(2): 944-952.
LI-Yuan X L, Ye C C, Liu Y L, Li D Y, Liu S T, Luo H Y, Liu X L, Tie B Q, Sun J. Bioavailability of silicon fertilizer coupled water management on soil bioavailability and cumulative control of rice in compound contaminated paddy soils[J]., 2018, 39(2): 944-952. (in Chinese with English abstract)
[38] Vaculík M, Lux A, Luxová M, Tanimoto E, Lichtscheidl I. Silicon mitigates cadmium inhibitory effects in young maize plants[J]., 2009, 67(1): 52-58.
[39] Vatehová Z, Kollárová K, Zelko I, Richterová-Kučerová D, Bujdoš M, Lišková D. Interaction of silicon and cadmium inand[J]., 2012, 67(3): 498-504.
[40] Guo B, Liu C, Ding N F, Fu Q L, Li N Y. Silicon alleviates cadmium toxicity in two cypress varieties by strengthening the exodermis tissues and stimulating phenolic exudation of roots[J]., 2016, 35(2): 420-429.
[41] Wu J, Guo J, Hu Y, Gong H. Distinct physiological responses of tomato and cucumber plants in silicon-mediated alleviation of cadmium stress[J]., 2015, 6: 453.
[42] Shi G R, Zhang Z, Liu C F. Silicon influences cadmium translocation by altering subcellular distribution and chemical forms of cadmium in peanut roots[J]., 2017, 63(1) : 117-123.
[43] Wang H Y, Wen S L, Chen P, Zhang L, Cen K, Sun G X. Mitigation of cadmium and arsenic in rice grain by applying different silicon fertilizers in contaminated fields[J]., 2016, 23(4): 3781-3788.
[44] Wang Y C, Hu Y H, Duan Y K, Feng R, Gong H. Silicon reduces long-term cadmium toxicities in potted garlic plants[J]., 2016, 38: 211.
[45] Cui J, Liu T, Li F, Yi J, Liu C, Yu H. Silica nanoparticles alleviate cadmium toxicity in rice cells: Mechanisms and size effects[J]., 2017, 228: 363-369.
[46] Bhat J A, Shivaraj S M, Singh P, Navadagi D B, Tripathi D K, Dash P K, Solanke A U, Sonah H, Deshmukh R. Role of silicon in mitigation of heavy metal stresses in crop plants[J]., 2019, 8(3): 71.
[47] Cui J, Li Y, Jin Q, Li F. Silica nanoparticles inhibit arsenic uptake into rice suspension cells via improving pectin synthesis and the mechanical force of the cell wall[J]., 2020, 7: 162-171.
[48] 赵颖, 李军. 硅对水稻吸收镉的影响[J]. 东北农业大学学报, 2010, 41(3): 59-64.
Zhao Y, Li J. Effect of silicon on cadmium uptake by rice[J]., 2010, 41(3): 59-64. (in Chinese with English abstract)
[49] Shi X H, Zhang C C, Wang H, Zhang F S. Effect of Si on the distribution of Cd in rice seedlings[J]., 2005, 272: 53-60.
[50] Guo L, Chen A, He N, Yang D, Liu M D. Exogenous silicon alleviates cadmium toxicity in rice seedlings in relation to Cd distribution and ultrastructure changes[J]., 2018, 18: 1691-1700.
[51] 黄秋蝉, 黎晓峰, 沈方科, 阳继辉, 李耀燕, 张维珺. 硅对水稻幼苗镉的解毒作用及其机制研究[J]. 农业环境科学学报, 2007, 26(4): 1307-1311.
Huang Q C, Li X F, Shen F K, Yang J H, Li Y Y, Zhang W J. Cadmium resistance improved by silicon and corresponding mechanisms inL. seedlings[J]., 2007, 26(4): 1307-1311. (in Chinese with English abstract)
[52] 孙梦梦, 徐劼, 张玲玲, 施德剑, 赵玺童. 硅对镉胁迫下植物生长影响的研究进展[J]. 广州化工, 2019, 47(13): 41-43.
Sun M M, Xu J, Zhang L L, Shi D J, Zhao X T. Research progress on effects of silicon on plant growth under cadmium stress[J]., 2019, 47(13): 41-43. (in Chinese with English abstract)
[53] Farooq M A, Ali S, Hameed A, Ishaque W, Mahmood K, Iqbal Z. Alleviation of cadmium toxicity by silicon is related to elevated photosynthesis, antioxidant enzymes; suppressed cadmium uptake and oxidative stress in cotton[J]., 2013, 96: 242-249.
[54] Feng J, Shi Q, Wang X, Wei M, Yang F, Xu H. Silicon supplementation ameliorated the inhibition of photosynthesis and nitrate metabolism by cadmium (Cd) toxicity inL[J]., 2010, 123(4): 521-530.
[55] Keller C, Rizwan M, Davidian J C, Pokrovsky O S, Bovet N, Chaurand P, Meunier J D. Effect of silicon on wheat seedlings (L.) grown in hydroponics and exposed to 0 to 30 μM Cu[J]., 2015, 241(4): 847-860.
[56] 贾茜茹, 刘奋武, 樊文华. 硅对Cd胁迫下黄瓜苗期光合及抗氧化酶系统的影响[J]. 水土保持学报, 2018, 32(4): 321-326.
Jia Q R, Liu F E, Fan W H. Effects of silicon on photosynthesis and antioxidant enzymes of cucumber seedling under cadmium stress[J]., 2018, 32(4): 321-326. (in Chinese with English abstract)
[57] 孟红梅, 汤燕. 硅对镉胁迫下板蓝根种子萌发及生理特性的影响[J]. 种子, 2011, 30(11): 37-40.
Meng H M, Tang Y. Effect of silicon on radix isatidis seed germination and seedings growth phyiological characteristics under cadmium stress[J]., 2011, 30(11): 37-40. (in Chinese with English abstract)
[58] Wang S H, Wang F Y, Gao S C. Foliar application with nano-silicon alleviates Cd toxicity in rice seedlings[J]., 2015, 22(4): 2837-2845.
[59] Srivastava R K, Pandey P, Rajpoot R, Rani A, Gautam A, Dubey R S. Exogenous application of calcium and silica alleviates cadmium toxicity by suppressing oxidative damage in rice seedlings[J]., 2015, 252(4): 959-975.
[60] Wu Z, Wang F, Liu S, Du Y, Li F, Du R, Wen D, Zhao J. Comparative responses to silicon and selenium in relation to cadmium uptake, compartmentation in roots, and xylem transport in flowering Chinese cabbage (L. ssp.var) under cadmium stress[J]., 2016, 131: 173-180.
[61] Miyadate H, Adachi S, Hiraizumi A, Tezuka K, Nakazawa N, Kawamoto T, Katou K, Kodama I, Sakurai K, Takahashi H, Satoh-Nagasawa N, Watanabe A, Fujimura T, Akagi H. OsHMA3, a P1B-type of ATPase affects root-to-shoot cadmium translocation in rice by mediating efflux into vacuoles[J].2011, 189(1): 190-199.
[62] Zhang X F, Hu Z H, Yan T X, Lu R R, Peng C L, Li S S, Jing Y X.fungi alleviate Cd phytotoxicity by altering Cd subcellular distribution and chemical forms in[J]., 2019, 171: 352-360.
[63] Huang H, Li M, Rizwan M, Dai Z, Yuan Y, Hossain M M, Cao M, Xiong S, Tu S. Synergistic effect of silicon and selenium on the alleviation of cadmium toxicity in rice plants[J]., 2021, 401: 123393.
Effects of Silicon on Antioxidant Enzyme System and Expression Levels of Genes Related to Cd2+Uptake and Transportation in Rice Seedlings Under Cadmium Stress
HUANG Qina1,#, XU Youxiang2,#, LIN Guanghao3, DANG Hongyang3, ZHENG Zhenquan1, ZHANG Yan1, WANG Han1, SHAO Guosheng1,*, YIN Xianyuan4,*
(Agricultural and Rural Bureau of Longyou County, Quzhou 324400, China; Agricultural and Rural Bureau of Changshan County, Quzhou 324200, China; Agricultural and Rural Bureau of Quzhou, Quzhou 324000, China; These authors contributed equally to this work; Corresponding author, email: shaoguosheng@caas.cn
【Objective】To elucidate the effects of exogenous silicon (Si) on plant height, dry weight, antioxidant enzyme system, and the expression levels of Cd2+related genes in rice under cadmium (Cd) stress, so as to lay a theoretical basis for clarifying the mechanism of Si in alleviating Cd toxicity in rice. 【Method】rice Fupin 36 (FP36) and Zhongjiazao 17 (ZJZ17) were hydrocultured under two Cd2+concentrations (0, 5 µmol/L) and three Si treatments (0, 10 µmol/L, 1 mmol/L). The agronomic traits, antioxidant enzyme activities, and the expression levels of Cd2+uptake/transport-related genes were analyzed. 【Result】Cadmium stress significantly inhibited the agronomic traits and activities of antioxidant enzymes (superoxide dismutase, peroxidase, catalase, and ascorbic acid oxidase) of ZJZ17 and FP36, but exogenous Si addition could effectively alleviate the toxicity of Cd to rice, and enhance the activities of antioxidant enzymes. Moreover, 1 mmol/L Si treatment exerted a better alleviating effect on Cd stress than 10 µmol/L Si. In addition, Cd stress also affected the contents of soluble protein and malondialdehyde (MDA) in rice, while Si exposure increased soluble protein content but decreased the MDA content, respectively. Cd intervention significantly increased Cd content in different tissues of FP36 and ZJZ17, and its accumulation in roots was significantly higher than that in shoots. However, there was no significant difference in Cd content in rice plants under 10 µmol/L Si addition; and Cd accumulation in rice was significantly decreasedas exposed to 1 mmol/L Si at 5 µmol/L Cd2+concentration, indicating that the Cd accumulation in shoots was higher than that in roots. The expression levels of Cd2+uptake/transport-related genes followed different trends as subjected to Cd stress and Si treatments. Compared with zero-Cd treatment, the expression levels of,andwere up-regulated under Cd stress, whileexpression tended to be down-regulated, and the expression level ofremained unchanged. Moreover, the expression levels of,,,,were significantly decreased at 1 mmol/L Si concentration. 【Conclusion】Silicon alleviates the toxicity of Cd to rice by improving the agronomic traits, activating the antioxidant system, and regulating the expression levels of Cd2+uptake/transport-related genes.
rice; cadmium stress; silicon; antioxidase system; relative expression of genes
10.16819/j.1001-7216.2023.230203
2023-02-14;
2023-03-22。
浙江省自然科学基金重点项目(LZ22D030001);浙江省自然科学基金探索项目(LQ22C130002);龙游县受污染耕地安全利用示范项目(QZZCZB2023-042);受污染耕地安全利用田间试验项目(CSZZ-GK-2022007);中国水稻研究所中央级公益性科研院所基本科研业务费专项(CPSIBRF-CNRRI-202121);中国水稻研究所所级重点研发项目(CNRRI-2020-05)。
