印度梨形孢对盐胁迫下水稻幼苗生长及抗氧化系统的影响
2023-09-14夏杨李传明刘琴韩光杰徐彬黄立鑫祁建杭陆玉荣徐健
夏杨 李传明 刘琴, 韩光杰 徐彬 黄立鑫 祁建杭 陆玉荣 徐健,*
印度梨形孢对盐胁迫下水稻幼苗生长及抗氧化系统的影响
夏杨1李传明2刘琴1,2韩光杰1徐彬1黄立鑫1祁建杭2陆玉荣1徐健1,*
(1江苏里下河地区农业科学研究所/国家农业微生物扬州观测实验站,江苏 扬州 225007;2扬州绿源生物化工有限公司,江苏 扬州 225008;*通信联系人,email: bio-xj@163.com)
【目的】探究印度梨形孢()PI-020对盐胁迫下水稻幼苗生长、抗氧化相关酶活性及基因表达水平的影响。【方法】以不同浓度的PI-020菌丝体悬液接种南粳9108水培苗,显微镜观察及qPCR技术分析PI-020在水稻秧苗根系的定殖能力,并测定水稻叶片丙二醛(MDA)含量,分析水稻秧苗的表型参数、光合色素含量、抗氧化相关酶活性及基因表达的变化。【结果】与对照相比,盐胁迫条件下(100 mmol/L NaCl),PI-020定殖后,水稻叶片MDA含量显著降低。200倍菌丝体稀释液处理的效果最好,MDA含量减少了67.2%。PI-020定殖后,水稻株高、根长、叶面积、鲜质量和干质量分别增加了34.67%、23.62%、58.04%、59.53%和67.25%,与对照相比均差异显著;同时PI-020定殖还显著提高了叶片光合色素含量,抗氧化酶CAT、APX、POD活性及抗氧化相关基因、、的表达水平。【结论】印度梨形孢PI-020通过提高水稻幼苗抗氧化能力减少盐胁迫引起的氧化损伤,从而降低MDA含量,同时缓解光合色素的降解,保护了水稻光合系统,进而提高水稻耐盐性。
印度梨形孢;水稻;盐胁迫;抗氧化酶;抗氧化基因
土壤盐渍化是制约作物生长发育的重要非生物胁迫因子,严重影响作物产量形成。中国盐渍土壤面积近1×108hm2,约占全球盐渍土壤面积的1/10[1, 2]。受全球气候变暖影响,加之不合理灌溉、过量施肥等人类活动,土壤次生盐渍化问题也在不断加剧。水稻是世界重要的粮食作物之一,对盐胁迫非常敏感,盐胁迫主要在离子稳态、渗透平衡、活性氧(ROS)清除和营养平衡方面对水稻造成伤害,引起水稻生长发育减缓,最终导致产量减少、品质下降[3]。近年来,受土壤盐渍化影响的水稻种植面积逐年扩大,提高水稻耐盐性对于盐碱农田的修复和改良,以及水稻产量和品质的提升具有重要意义[4, 5]。
印度梨形孢()属担子菌门(Basidiomycota)层菌纲(Hymenomycetes)蜡壳耳目(Sebacinales)蜡壳耳科(Sebacinaceae)梨形孢属(),最早由印度科学家Verma等[6]于1998年自塔尔沙漠灌木根际分离获得,能定殖于植物根系表面、表皮细胞和细胞间隙,并形成典型的梨形厚垣孢子,存活于植物根系[7]。寄主范围广泛,可以与200多种单子叶、双子叶植物共生,通过增强植物对N、P等营养物质的吸收,促进植物生长,增强植物系统抗性,是一种具有广泛应用潜力的多功能植物内生真菌[8]。Abdelaziz等[9]研究发现能通过调节Na+/K+稳态、抗氧化酶活性和基因表达来诱导番茄(L.)对盐胁迫的抗性,进而促进生长,提高产量。为此,美国《Science》杂志发表评论,称向土壤中添加真菌是应对盐碱化的低成本可行方法。
对多种植物具有显著的盐胁迫缓解作用,且作用机制多样。接种的大麦(L.),由于谷胱甘肽-抗坏血酸循环(GSH-AsA)的激活,抗氧化能力得到提升,表现出更好的耐盐胁迫潜力[10]。接种玉米(L.)后能改善玉米气孔运作,提高钾向嫩枝的输送速率,增强植株对盐胁迫的抗性[11]。此外,研究表明通过上调、和基因的表达缓解盐胁迫对非洲菊(L.)的负面影响[12]。可见,可以在活性氧清除、离子平衡、基因表达等方面与植物互作,提高植株的耐盐能力。在对水稻盐胁迫影响方面,研究发现能促进盐胁迫下水稻幼苗生长,增强水稻对盐胁迫的耐性[13, 14]。进一步研究表明接种的水稻幼苗,叶片中的耐盐相关基因、、和的表达量上调[15]。目前,关于在水稻耐盐方面的研究较少,其定殖对水稻抗氧化系统的影响还不清楚,调控水稻耐盐的机制尚不明确。本研究选用南粳9108水稻品种作为供试材料,在盐胁迫条件下测定定殖对水稻生长、光合色素含量、抗氧化酶活性和抗氧化基因表达的影响,系统探究调控水稻耐盐性的机制,以期为应用内生真菌提高水稻耐盐性提供理论依据。
1 材料与方法
1.1 供试材料
供试菌株PI-020由江苏里下河地区农业科学研究所应用微生物研究室分离并保存[16];供试水稻品种为南粳9108,由江苏金土地种业有限公司提供。
1.2 PI-020菌丝体的制备
取PI-020于PDA(马铃薯葡萄糖琼脂培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L)平板上活化,28 ℃下培养7 d后,截取边缘活性菌丝块3个接种于100 mL PDB(不含琼脂的PDA)培养液中,28 ℃、180 r/min下振荡培养7 d,待孢子形成后,收集菌丝体20 g,加入100 mL无菌水,经切碎机破碎后备用。
1.3 水稻种植与处理
选取颗粒饱满的水稻种子,漂洗后于70%乙醇浸泡5 min,再用1%次氯酸钠溶液浸泡5 min,无菌水冲洗3遍,浸种1 d,于28 ℃黑暗条件下催芽3 d。以水稻水培营养液作为稀释液对PI-020菌丝体进行50倍(P1)、100倍(P2)、200倍(P3)、400倍(P4)和800倍(P5)5种浓度稀释,挑选长势良好、出芽一致的种子置于水培盒中,加入不同浓度的菌丝体稀释液,于26 ℃、14/10 h(光照/黑暗)、相对湿度70%的条件下培养,每3 d更换一次水培液[17]。15 d后进行盐胁迫处理,盐胁迫所用NaCl浓度为100 mmol/L(预实验设置0、50、100、150、200 mmol/L不同NaCl浓度处理,根据幼苗生长状态并结合王建飞等[18]研究结果确定),以无盐胁迫处理组为对照,盐胁迫处理7 d后进行取样和测定各项指标,每个处理3次重复。

表1 qRT-PCR所用引物序列
1.4 测定指标与方法
1.4.1 PI-020定殖检测
盐胁迫之前,每个处理随机选取水稻幼苗,用无菌水冲洗幼苗根系3遍,待除去根系表面附着的菌丝体后,切成1 cm长小段。参考武美燕等[19]方法对根系样品进行处理、染色和制片,观察PI-020在水稻根系的定殖情况并拍照。提取接种和未接种处理的水稻根系DNA,参考夏杨等[20]的方法采用qPCR法进行定殖量检测,每个处理随机检测5株水稻,试验设3次重复。
1.4.2 丙二醛(MDA)含量测定
取各个处理的水稻叶片样品,采用10%三氯乙酸提取MDA,参考Yun等[11]的方法利用硫代巴比妥酸(TBA)与MDA显色反应进行测定和计算。
1.4.3 植株表型参数测定
收集盐胁迫和无盐胁迫处理7 d后的水稻植株,用去离子水冲洗干净,吸水纸擦干后测量株高和根长,采用LI-3000C便携式叶面积仪(美国LI-COR公司)测定叶面积,并立即称重记录数据,完成后用纸包好后放入电热鼓风干燥箱(上海博迅实业有限公司),先105℃下杀青40 min,再80℃下烘干至恒重进行称重。
1.4.4 光合色素含量测定
参考王学奎等[21]的方法采用乙醇浸提法测定样品中叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量。
1.4.5 抗氧化酶活性测定
取新鲜的水稻叶片样品,置于研钵中液氮研磨后,加入等体积预冷的磷酸缓冲液,12 000 r/min下离心10 min,吸取上清液作为粗酶液用于过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、超氧化物歧化酶(SOD)及过氧化物酶(POD)活性测定,酶活性测定方法参考吴强盛[22]的方法。
1.4.6 抗氧化基因表达测定
按照TRNzol Universal总RNA提取试剂(天根生化科技有限公司)使用说明书提取水稻叶片总RNA,参照cDNA第一链合成试剂盒(宝日医生物技术有限公司)说明书进行反转录合成cDNA第一链,-20 ℃保存备用。
通过NCBI数据库获取目的基因序列,利用Primer Premier 5.0设计荧光定量引物(表1),引物由通用生物(安徽)股份有限公司合成。采用7500实时荧光定量PCR仪(美国应用生物系统公司)进行qRT-PCR扩增,以为内参基因,测定水稻过氧化氢酶基因()、抗坏血酸过氧化物酶基因()、超氧化物歧化酶基因()以及谷胱甘肽还原酶基因()的表达量。反应体系参考高灵敏性染料法定量PCR检测试剂盒(南京诺唯赞生物科技股份有限公司)说明书配制,反应程序为95℃下30 s;95℃下10 s,60℃下30 s(收集荧光信号),共40个循环,每个样品重复3次。采用2-ΔΔCt法计算目的基因的相对表达量[23]。
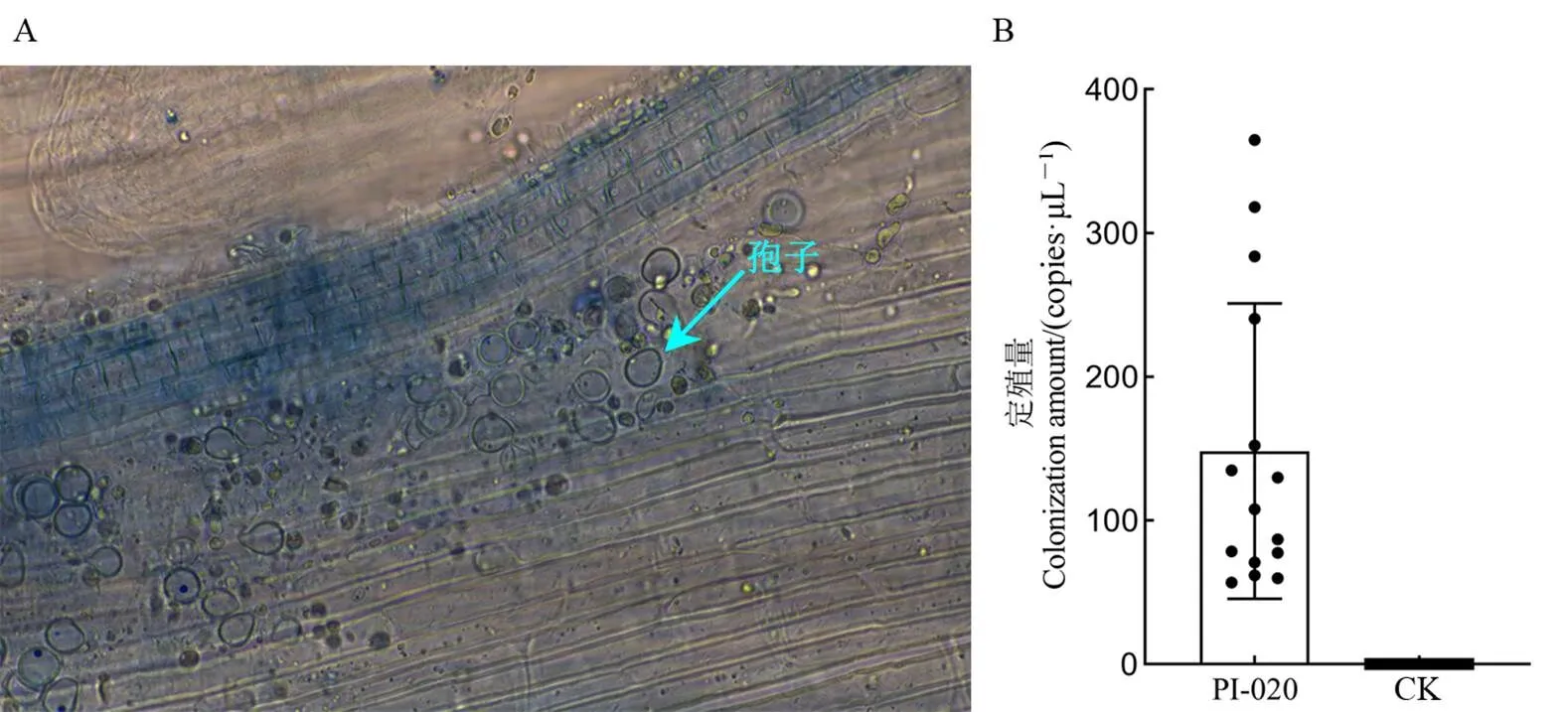
A-显微镜观察;B-定殖量测定。PI-020为接种处理;CK为未接种处理。
Fig. 1. Colonization of PI-020 in rice roots.
1.5 数据分析
每个试验设3次生物学重复。采用Excel 2019进行数据统计与分析,利用SPSS 22.0进行方差分析和差异显著性分析,运用GraphPad Prism 8进行图形绘制。
2 结果与分析
2.1 PI-020定殖检测及对水稻MDA含量的影响
PI-020接种处理水稻苗15 d,取水稻根系组织进行染色,并用光学显微镜观察PI-020在根系的定殖情况。结果表明,所有接种处理的植株根皮层组织中均能观察到梨形状孢子(图1-A)。qPCR检测结果显示,接种处理的15株水稻苗均能检测到PI-020,定殖量如图1-B所示,而未接种处理的水稻苗均未能检测到。表明PI-020已稳定定殖于水培水稻苗根系,水稻植株可用于后续盐胁迫试验。
对不同浓度PI-020菌丝体悬液处理的水稻苗进行盐胁迫处理,结果显示盐胁迫显著抑制了水稻秧苗的生长,表现为株高、根长减小,而PI-020定殖不同程度地缓解了水稻的盐胁迫(图2-A)。MDA含量测定结果表明(图2-B),无盐胁迫时,对照水稻叶片MDA含量处于较低水平,为4.83±0.15 nmol/g。盐胁迫下,无PI-020定殖的水稻MDA含量为17.76±0.17 nmol/g,是对照的3.7倍,差异显著。与对照相比,虽然PI-020定殖的水稻MDA含量也显著升高,但均显著低于无PI-020定殖的处理组。叶片MDA含量与PI-020处理浓度相关,随浓度升高,MDA含量先降低后升高,其中以100倍(P2N)和200倍(P3N)稀释浓度的菌丝体悬液处理的水稻MDA含量最低,较无PI-020定殖的处理分别降低了65.7%和67.2%。PI-020定殖均能显著减轻盐胁迫对水稻细胞膜造成的伤害,后续以200倍浓度稀释菌丝体作接种处理的水稻苗进行试验。

A-水稻盐胁迫7 d后的表型,标尺为3 cm;B-水稻盐胁迫7 d后叶片丙二醛含量。CK为对照;N为盐胁迫;P1N为50倍梨形孢稀释液+盐胁迫;P2N为100倍梨形孢稀释液+盐胁迫;P3N为200倍梨形孢稀释液+盐胁迫;P4N为400倍梨形孢稀释液+盐胁迫;P5N为800倍梨形孢稀释液+盐胁迫。不同小写字母表示处理之间差异达0.05显著水平。下同。
Fig. 2. Effects of PI-020 colonization on salt tolerance of rice.

图3 水稻盐胁迫7 d后的表型
Fig. 3. Phenotypes of rice seedlings after 7 days of salt stress.
2.2 PI-020对盐胁迫下水稻生长及光合色素含量的影响
水稻受到盐胁迫后,生长发育受抑,叶片干枯(图3)。由图3可见,无PI-020定殖的水稻苗受盐胁迫7 d后第二片完全叶发黄内卷,第三片完全叶叶尖也已渐趋发黄。PI-020定殖能够显著缓解盐胁迫带来的叶片损伤,有PI-020定殖的水稻苗第二、三片完全叶仍呈绿色展开状。生长参数测定结果显示PI-020定殖能够促进水稻生长,同时显著减小盐胁迫对生长的抑制作用(图4)。正常情况下,PI-020定殖后水稻株高、根长、叶面积、鲜质量和干质量较对照分别提高了10.89%、23.75%、29.39%、32.09%和33.75%。在受到盐胁迫后,PI-020定殖的水稻株高、根长、叶面积、鲜质量和干质量也高于未定殖的盐胁迫植株,分别提高了34.67%、23.62%、58.04%、59.53%和67.25%,差异显著。
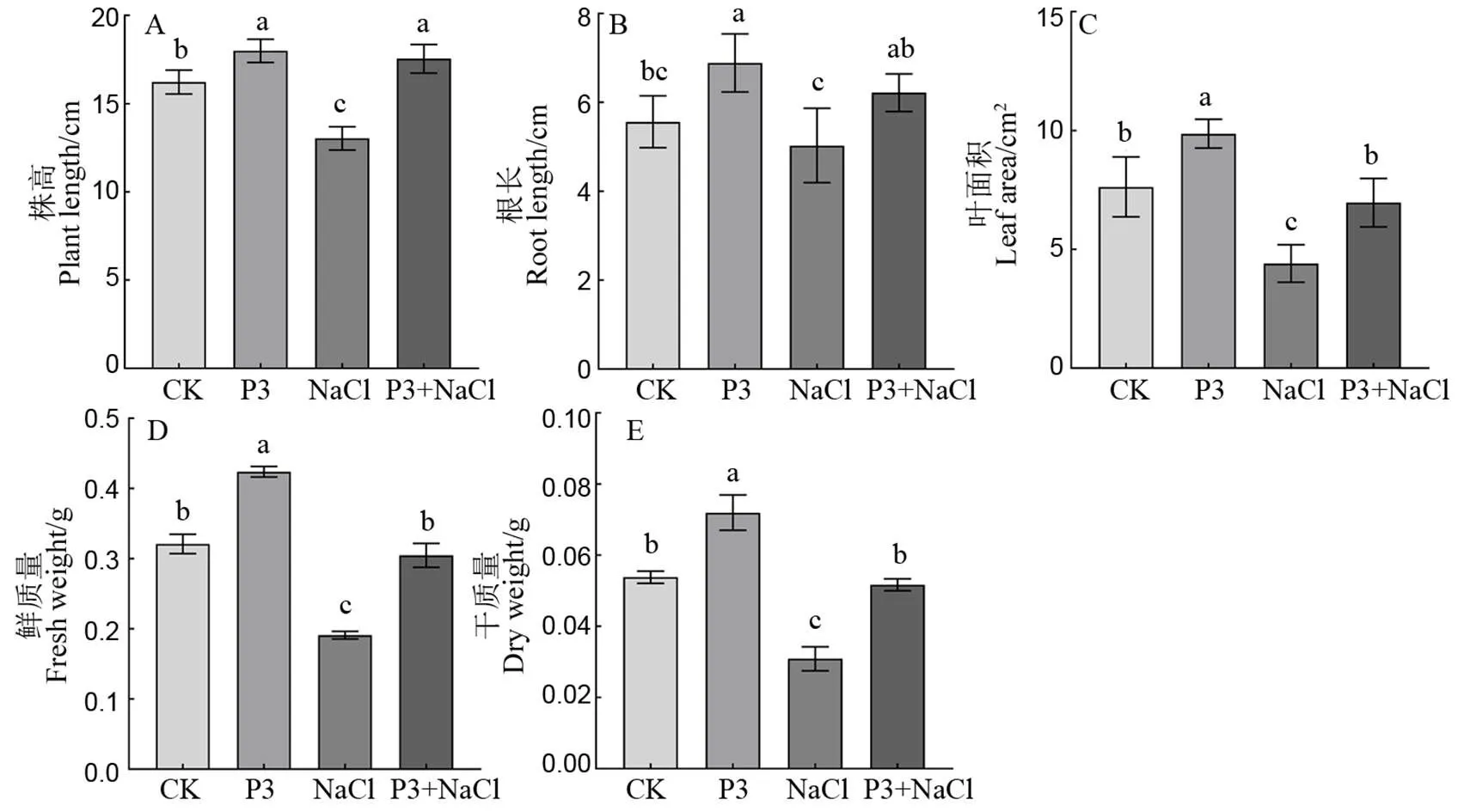
图4 PI-020定殖对盐胁迫下水稻生长的影响
Fig. 4. Effects of PI-020 colonization on rice growth under salt stress.
叶绿素和类胡萝卜素属于光合色素,在植物光合作用过程中发挥着重要作用。PI-020定殖对水稻叶片叶绿素和类胡萝卜素含量的影响如图5所示。无盐胁迫时,PI-020定殖对水稻叶片叶绿素、类胡萝卜素含量无影响,与对照差异不显著。受到盐胁迫后,水稻叶片中光合色素含量与对照相比均显著下降。PI-020定殖降低了盐胁迫对水稻叶片光合色素含量的影响。有PI-020定殖的水稻叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量分别为0.57、0.17、0.74和0.12 mg/g,均显著高于无PI-020定殖的盐胁迫处理水稻。
Fig. 5. Effects of PI-020 colonization on photosynthetic pigment contents in rice leaves.
2.3 PI-020对盐胁迫下水稻抗氧化酶活性及抗氧化基因表达水平的影响
正常条件下,PI-020定殖显著提高水稻叶片SOD活性,对CAT、APX、POD活性无显著影响(图6)。受到盐胁迫后,叶片CAT活性无变化,APX活性显著下降,SOD和POD活性显著提高。但有PI-020定殖的水稻CAT、APX和POD活性显著上升,分别为无PI-020定殖水稻的1.5倍、2.7倍和1.3倍,SOD活性无显著变化。
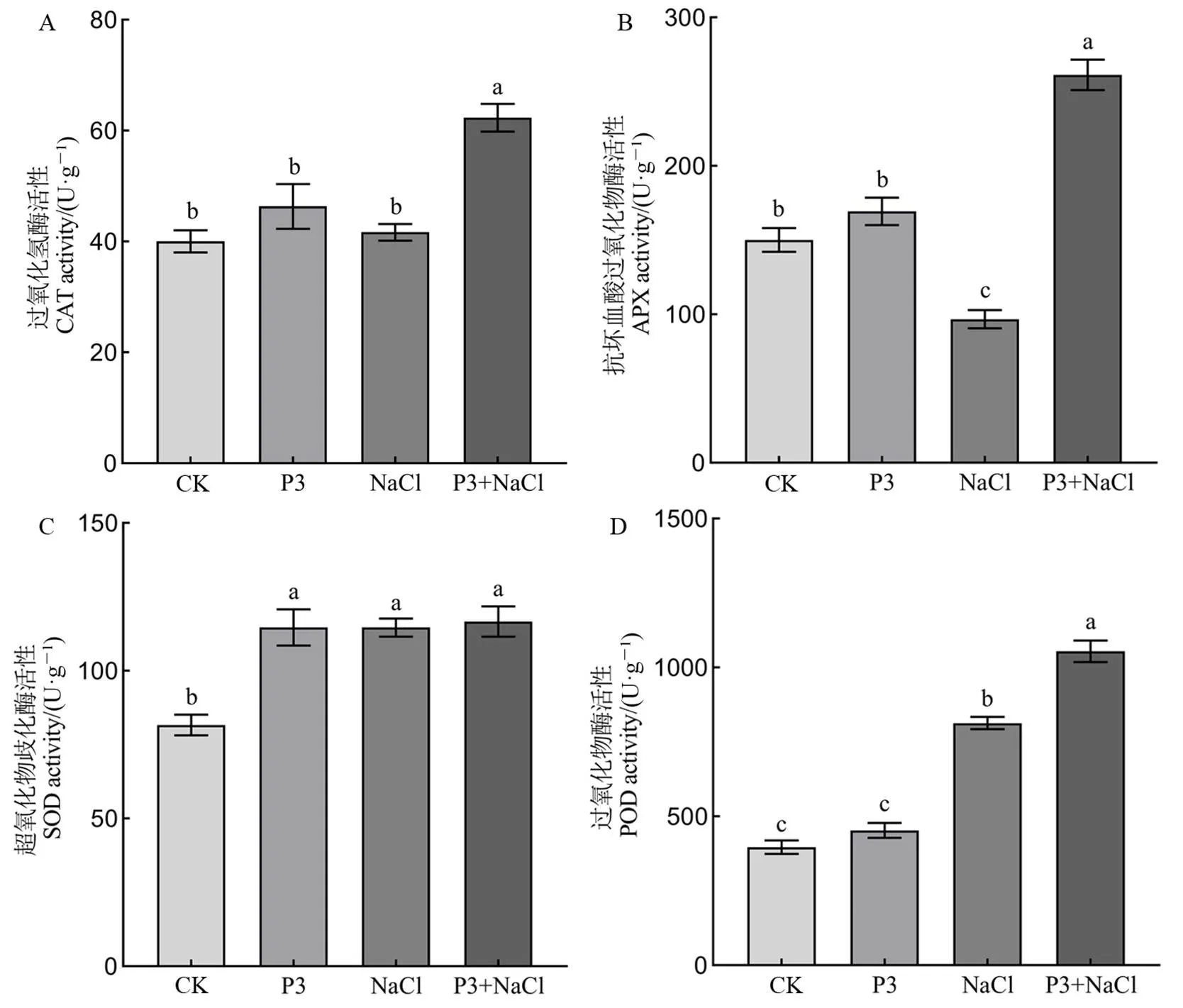
图6 PI-020定殖对水稻抗氧化酶活性的影响
Fig. 6. Effects of colonization of PI-020 on the activities of antioxidant enzymes in rice.
由图7可知,正常条件下,与对照相比,PI-020定殖对、和基因表达量没有显著影响,基因表达量显著上调了1.3倍。盐胁迫下,PI-020定殖显著提高了、和基因的表达水平,分别上调了2.7倍、1.5倍和2.5倍,而基因的表达水平没有发生显著变化。
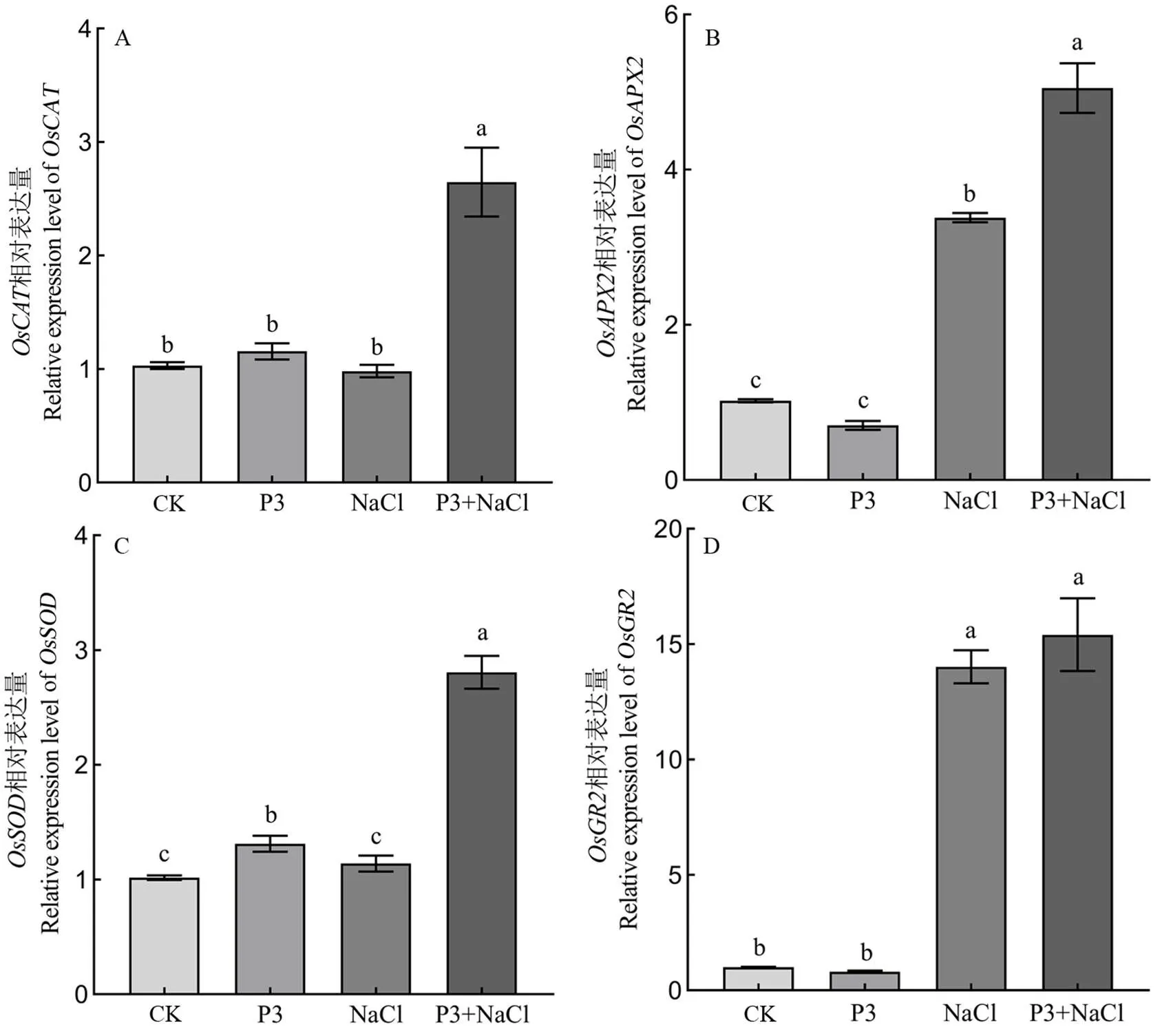
图7 PI-020定殖对水稻抗氧化酶活性相关基因表达水平的影响
Fig. 7. Effects of PI-020 colonization on gene expression levels related to antioxidant enzyme activities in rice.
3 讨论
在本研究中,我们采用了不同浓度的PI-020菌丝体稀释液对水稻进行接种,镜检观察及定量分析发现PI-020均能定殖于水稻苗根系。MDA为水稻在盐胁迫等逆境条件下发生膜脂过氧化反应的产物,其含量可以作为判断细胞膜对逆境反应强弱的指标。不同浓度PI-020定殖均可以显著降低盐胁迫条件下水稻叶片MDA含量,表明PI-020能缓解盐胁迫对水稻叶片的膜脂过氧化作用。同时,这种缓解作用与接种浓度相关,当菌丝体稀释倍数为200倍时,对膜脂过氧化反应缓解作用效果最好,浓度过低或过高都会影响PI-020作用的发挥。这可能是由于内生菌与寄主之间相互作用是平衡的拮抗关系,这一平衡一旦被打破,内生菌与寄主将会由互惠共生转变为致病感染[24]。内生菌同寄主之间的共生平衡是有条件的,只有接菌量适当时,与植物才能形成互惠互利的共生关系[25]。
生物量是植物对盐胁迫反应的综合体现,是植物耐盐性评价的重要指标[26]。Cruz等[27]发现与番茄共培养能缓解盐胁迫对植株生物量积累的抑制;Abdelaziz等[28]发现盐胁迫条件下,的定殖可以促进拟南芥的生长,增加植物的生物量。本研究中,有定殖的水稻,无论盐胁迫条件是否存在,其植株的生物量均显著高于对照。表明定殖能促进水稻生长,增加水稻生物量,且盐胁迫条件下,定殖缓解了盐胁迫对水稻的生长抑制。叶绿素、类胡萝卜素等光合色素对植物光合作用过程中光能的吸收、传递和转化极为重要。盐胁迫条件下,定殖显著提高了叶片中总叶绿素和类胡萝卜素含量,表明定殖能缓解盐胁迫对水稻叶绿素和类胡萝卜素的降解,一定程度上保护光合作用系统。Ghorbani等[29]同样发现接种可缓解盐胁迫对番茄光合色素的不利影响。
胁迫使得水稻叶片中MDA含量增加,可能是由于胁迫引起的代谢紊乱致使植物的氧化还原系统受到破坏,ROS大量积累对植物造成伤害[30]。PI-020的定殖能够显著提高盐胁迫下水稻的CAT、APX和POD等抗氧化酶活性,降低MDA含量,说明PI-020定殖有助于缓解氧化应激,减少盐胁迫给水稻带来的负面影响。李亮等[31]也发现可以通过激活抗氧化物酶活性来提高紫花苜蓿耐盐性。植物受到环境胁迫时,防御基因会被激活,如、等[32]。Li等[33]研究发现,高表达基因能提高拟南芥对氧化应激的抗性。Yan等[34]研究发现,和基因的过表达能增强甘薯的耐盐性。抗氧化基因表达水平的上升能提高细胞ROS清除效率,增强植物对非生物胁迫的抗性[35]。本研究中,PI-020定殖能显著提高盐胁迫下水稻、的表达水平,与酶活性水平变化一致,推测PI-020能通过诱导盐胁迫下水稻抗氧化基因的表达提高水稻耐盐性。Guan等[36]报道,(AK059841,LOC_Os08g44770)基因过表达提高了水稻活性氧的解毒能力,减轻了盐胁迫导致的氧化损伤,本研究发现PI-020定殖显著提高了基因的表达量。虽然PI-020定殖增强了盐胁迫下基因的表达量,但SOD酶活性无显著变化。刘家林等[37]报道水稻基因组中存在9个基因,Cu/Zn-SOD、Fe-SOD和Mn-SOD三类SOD相互作用,组建成相对稳定的抗胁迫体系,SOD酶活性可能受多个基因共同调控。Xu等[38]研究发现,在干旱胁迫和复水条件下,肯塔基蓝草叶片基因表达显著增强,而SOD酶活性却显著降低,这种差异性表明酶活性的变化不是由mRNA水平引起的,而是在转录后水平上受到调控,这也可能是本研究中SOD酶活性与基因表达之间出现差异性的原因。
长期以来,土壤盐渍化危害着水稻生长发育,造成产量下降。选育耐盐品种、改良盐碱土、优化栽培技术、施加外源物质是提高水稻耐盐性的主要途径和方法[39],的出现或可为水稻促生耐盐研究提供新思路。与丛枝菌根真菌(Abuscular Mycorrhizal Fungi, AMF)功能十分相似,对植物都能产生促生抗逆的效果,但性质上又有所不同,AMF是活体共生真菌,只能在活体植物根部寄生,而可以在多种人工合成培养基上进行培养,获得纯培养物[8, 40]。因此,不仅可用于科学研究,而且具有广阔的产业化应用前景。
4 结论
定殖可以促进水稻生长,显著缓解盐胁迫对生长的抑制,抗逆促生效果与浓度相关;定殖后通过提高水稻抗氧化基因的表达水平及抗氧化酶活性,减少盐胁迫对水稻造成的氧化损伤,降低MDA含量。此外还可通过缓解光合色素降解的方式,保护水稻光合系统,增强水稻对盐胁迫的抗性。
[1] Fang S, Tu W, Mu L, Sun Z, Yang Y. Saline alkali water desalination project in Southern Xinjiang of China: A review of desalination planning, desalination schemes and economic analysis[J]., 2019, 113: 109268.
[2] Hossain M S. Present scenario of global salt affected soils, its management and importance of salinity research[J]., 2019, 1(1): 1-3.
[3] Liu C, Mao B, Yuan D, Chu C, Duan M. Salt tolerance in rice: Physiological responses and molecular mechanisms[J]., 2021, 10(1): 13-25.
[4] Qin H, Li Y, Huang R. Advances and challenges in the breeding of salt-tolerant rice[J]., 2020, 21(21): 8385.
[5] 巫明明, 曾维, 翟荣荣, 叶靖, 朱国富, 俞法明, 张小明, 叶胜海. 水稻耐盐分子机制与育种研究进展[J]. 中国水稻科学, 2022, 36(6): 551-561.
Wu M M, Zeng W, Zhai R R, Ye J, Zhu G F, Yu F M, Zhang X M, Ye S H. Research progress in molecular mechanism and breeding status of salt tolerance in rice[J]., 2022, 36(6): 551-561. (in Chinese with English abstract)
[6] Verma S, Varma A, Rexer K H, Hassel A, Kost G, Sarbhoy A, Bisen P, Bütehorn B, Franken P., gen. et sp. nov., a new root-colonizing fungus[J]., 1998, 90(5): 896-903.
[7] Deshmukh S, Hückelhoven R, Schäfer P, Imani J, Sharma M, Weiss M, Waller F, Kogel K H. The root endophytic fungus Piriformospora indica requires host cell death for proliferation during mutualistic symbiosis with barley[J]., 2006, 103(49): 18450-18457.
[8] 李亮, 郭楠楠, 郝瑞颖, 常乐乐. 印度梨形孢()增强植物抗逆境胁迫能力的研究进展[J]. 微生物学通报, 2022, 49(7): 2862-2874.
Li L, Guo N N, Hao R Y, Chang L L. Research progress ofin enhancing stress resistance of plant[J]., 2022, 49(7): 2862-2874. (in Chinese with English abstract)
[9] Abdelaziz M E, Abdelsattar M, Abdeldaym E A, Atia M A, Mahmoud A W M, Saad M M, Hirt, H. Piriformospora indica alters Na+/K+homeostasis, antioxidant enzymes and LeNHX1 expression of greenhouse tomato grown under salt stress[J]., 2019, 256: 108532.
[10] Waller F, Achatz B, Baltruschat H, Fodor J, Becker K, Fischer M, Heier T, Hückelhoven R, Neumann C, Wettstein D V, Franken P, Kogel K H. The endophytic fungus Piriformospora indica reprograms barley to salt-stress tolerance, disease resistance, and higher yield[J]., 2005, 102(38): 13386-13391.
[11] Yun P, Xu L, Wang S S, Shabala L, Shabala S, Zhang W Y. Piriformospora indica improves salinity stress tolerance inL. plants by regulating Na+and K+loading in root and allocating K+in shoot[J]., 2018, 86(2): 323-331.
[12] Chen W, Lin F, Lin K H, Chen C, Xia C, Liao Q, Chen S P, Kuo Y W. Growth promotion and salt-tolerance improvement ofby root colonization of[J]., 2022, 41(3): 1219-1228.
[13] 吴金丹, 陈乾, 刘晓曦, 林福呈, 高其康, 楼兵干. 印度梨形孢对水稻的促生作用及其机理的初探[J]. 中国水稻科学, 2015, 29(2): 200-207.
Wu J D, Wu J D, Chen G, Liu X X, Lin F C, Gao Q K, Lou B G. Preliminary study on mechanisms of growth promotion in rice colonized by[J]., 2015, 29(2): 200-207. (in Chinese with English abstract)
[14] 吴金丹. 印度梨形孢诱导水稻促生、抗逆、抗病作用及其机理的初步研究[D]. 杭州: 浙江大学, 2014.
Wu J D. Growth promotion, stress tolerance and disease resistance in rice conferred by Piriformospora indica and the preliminary study of mechanisms[D]. Hangzhou: Zhejiang University, 2014. (in Chinese with English abstract)
[15] 刘雪琳, 朱志炎, 何勇, 叶开温, 田志宏. 内生真菌印度梨形孢对水稻苗期耐盐性的影响[J]. 南方农业学报, 2019, 50(4): 719-725.
Liu X L, Zhu Z Y, He Y, Ye K W, Tian Z H. Effects of endophytic fungus Piriformospora indica on salt stress tolerance of rice seedling[J]., 2019, 50(4): 719-725. (in Chinese with English abstract)
[16] 徐彬, 刘琴, 李传明, 刘雪梅, 韩光杰, 夏杨, 黄立鑫, 陆玉荣, 祁建杭, 徐健. 油菜根际内生真菌PI-020的分离鉴定和定殖促生作用[J]. 扬州大学学报: 农业与生命科学版, 2022, 43(5): 129-135.
Xu B, Liu Q, Li C M, Liu X M, Han G J, Xia Y, Huang L X, Lu Y R, Qi J H, Xu J. Isolation and identification of endophytic fungus PI-020 from root of rape and its promoting and colonization effect[J].:, 2022, 43(5): 129-135. (in Chinese with English abstract)
[17] Yoshida S, Forno D A, Cock J H, Gomez K A. Laboratory manual for physiological studies of rice[M]. Manila: International Rice Research Institute, 1976: 61-66.
[18] 王建飞, 陈宏友, 杨庆利, 姚明哲, 周国安, 张红生. 盐胁迫浓度和胁迫时的温度对水稻耐盐性的影响[J]. 中国水稻科学, 2004(5): 75-80.
Wang J F, Chen H Y, Yang Q L, Yao M Z, Zhou G A, Zhang H S. Effects of salt concentration and temperature on the screening of salt-tolerance in rice[J]., 2004(5): 75-80. (in Chinese with English abstract)
[19] 武美燕, 蒿若超, 张文英. 印度梨形孢真菌对干旱胁迫下紫花苜蓿生长及抗旱性的影响[J]. 草业学报, 2016, 25(5): 78-86.
Wu M Y, Hao R C, Zhang W Y. Effects of Piriformospora indica fungus on growth and drought resistance in alfalfa under water deficit stress[J]., 2016, 25(5): 78-86. (in Chinese with English abstract)
[20] 夏杨, 徐彬, 李传明, 刘琴, 韩光杰, 黄立鑫, 祁建杭, 陆玉荣, 徐健. 印度梨形孢的荧光定量PCR检测及其在水稻根系的定殖测定[J]. 江苏农业科学, 2023, 51(2): 231-235.
Xia Y, Xu B, Li C M, Liu Q, Han G J, Huang L X, Qi J H, Lu Y R, Xu J. Quantitative real-time PCR detection and rice-root colonization of Piriformospora indica[J]., 2023, 51(2): 231-235. (in Chinese with English abstract)
[21] 王学奎, 黄见良. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2015.
Wang X K, Huang J L. Principles and Techniques of Plant Physiological Biochemical Experiment[M]. Beijing: Higher Education Press, 2015. (in Chinese)
[22] 吴强盛. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2018.
Wu Q S. Experimental Guidelines in Plant Physiology[M]. Beijing: China Agriculture Press, 2018. (in Chinese)
[23] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2− ΔΔCTmethod[J]., 2001, 25(4): 402-408.
[24] Schulz B, Römmert A K, Dammann U, Aust H J, Strack D. The endophyte-host interaction: A balanced antagonism?[J]., 1999, 103(10): 1275-1283
[25] Eaton C J, Cox M P, Scott B. What triggers grass endophytes to switch from mutualism to pathogenism [J]., 2011, 180(2): 190-195.
[26] 李悦, 陈忠林, 王杰, 徐苏南, 侯伟. 盐胁迫对翅碱蓬生长和渗透调节物质浓度的影响[J]. 生态学杂志, 2011, 30(1): 72-76.
Li Y, Chen Z L, Wang J, Xu S N, Hou W. Effects of salt stress on Suaeda heteroptera Kitagawa growth and osmosis-regulating substance concentration[J]., 2011, 30(1): 72-76. (in Chinese with English abstract)
[27] Cruz C, Martins-Loução M A, Varma A. The influence of plant co-culture of tomato plants with Piriformospora indica on biomass accumulation and stress tolerance[J]., 2010, 868: 123-128.
[28] Abdelaziz M E, Kim D, Ali S, Fedoroffa N V, Al-Babilia S. The endophytic fungusgrowth and modulates Na+/K+homeostasis under salt stress conditions[J]., 2017, 263: 107-115.
[29] Ghorbani A, Razavi S M, Ghasemi Omran V O, Pirdashti H. Piriformospora indica inoculation alleviates the adverse effect of NaCl stress on growth, gas exchange and chlorophyll fluorescence in tomato (L.)[J]., 2018, 20(4): 729-736
[30] 李格, 孟小庆, 蔡敬, 董婷婷, 李宗芸, 朱明库. 活性氧在植物非生物胁迫响应中功能的研究进展[J]. 植物生理学报, 2018, 54(6): 951-959.
Li G, Meng X Q, Cai J, Dong T T, Li Z Y, Zhu M K. Advances in the function of reactive oxygen species in plant responses to abiotic stresses[J]., 2018, 54(6): 951-959. (in Chinese with English abstract)
[31] 李亮, 陈希, 王奋, 王晓阳, 齐树亭. 印度梨形孢通过激活抗氧化物酶活性及诱导基因表达提高紫花苜蓿耐盐性[J]. 河北工业大学学报, 2016, 45(4): 29-36.
Li L, Chen X, Wang F, Wang X Y, Qi S T. Piriformospora indica confers salt tolerance inby stimulating antioxidant enzymes activities and the expression ofgenes[J]., 2016, 45(4): 29-36. (in Chinese with English abstract)
[32] Scandalios J G. Oxidative stress: Molecular perception and transduction of signals triggering antioxidant gene defenses[J]., 2005, 38: 995-1014.
[33] Li Z, Han X, Song X, Zhang Y, Jiang J, Han Q, Liu M, Qiao G, Zhuo R. Overexpressing theCu/Zn superoxide dismutase increased resistance to oxidative stress in transgenic[J]., 2017, 8: 1010.
[34] Yan H, Li Q, Park S C, Wang X, Liu Y J, Zhang Y G, Tang W, Kou M, Ma D F. Overexpression of CuZnSOD and APX enhance salt stress tolerance in sweet potato[J]., 2016, 109: 20-27.
[35] 阮孟斌, 彭明. 植物响应非生物胁迫相关基因的研究进展[J]. 热带生物学报, 2011, 2(4): 364-372.
Ruan M B, Peng M. Progresses of the study on plant abiotic stress response genes[J]., 2011, 2(4): 364-372. (in Chinese with English abstract)
[36] Guan Q J, Liao X, He M L, Li X F, Wang Z Y, Ma H Y, Yu S, Liu S K. Tolerance analysis of chloroplastoverexpressing rice under NaCl and NaHCO3stress[J]., 2017, 12(10): e0186052.
[37] 刘家林, 欧阳林娟, 曾嘉丽, 傅军如, 贺浩华, 朱昌兰, 彭小松, 贺晓鹏, 陈小荣, 边建民, 徐杰, 孙晓棠, 周大虎, 胡丽芳. 水稻SOD基因家族的全基因组分析及逆境胁迫下表达研究[J]. 分子植物育种, 2018, 16(9): 2753-2760.
Liu J L, Ouyang L J, Zeng J L, Fu J R, He H H, Zhu C L, Peng X S, He X P, Chen X R, Bian J M, Xu J, Sun X T, Zhou D H, Hu L F. Genome-wide analysis of rice SOD gene family and expression research under stress[J]., 2018, 16(9): 2753-2760. (in Chinese with English abstract)
[38] Xu L X, Han L B, Huang B R. Antioxidant enzyme activities and gene expression patterns in leaves of Kentucky bluegrass in response to drought and post-drought recovery[J]., 2011, 136(4): 247-255.
[39] 王洋, 张瑞, 刘永昊, 李荣凯, 葛建飞, 邓仕文, 张徐彬, 陈英龙, 韦还和, 戴其根. 水稻对盐胁迫的响应及耐盐机理研究进展[J]. 中国水稻科学, 2022, 36(2): 105-117.
Wang Y, Zhang R, Liu Y H, Li R K, Ge J F, Deng S W, Zhang X B, Chen Y L, Wei H H, Dai Q G. Rice response to salt stress and research progress in salt tolerance mechanism[J]., 2022, 36(2): 105-117. (in Chinese with English abstract)
[40] Rai M, Varma A.-like biotechnological potential of, which promotes the growth ofNees[J]., 2005, 8(1): 1-6.
Effects ofon the Growth and Antioxidant System of Rice Seedlings Under Salt Stress
XIA Yang1, LI Chuanming2, LIU Qin1,2, HAN Guangjie1, XU Bin1, HUANG Lixin1, QI Jianhang2, LU Yurong1, XU Jian1,*
(Jiangsu Lixiahe District Institute of Agricultural Sciences/National Experimental Station of Yangzhou for Agricultural Microbiology, Yangzhou 225007, China; Yangzhou Lyuan Bio-chemical Ltd. Co., Yangzhou 225008, China; Corresponding author, email: bio-xj@163.com)
【Objective】This study aims to investigate the impact ofPI-020 on rice seedling growth, antioxidant-related enzyme activities and gene expression levels in response to salt stress. 【Method】Different concentrations of PI-020 mycelial suspensions were used to inoculate Nanjing 9108 hydroponic seedlings. The colonization ability of PI-020 in rice seedling roots was evaluated using a microscopy and qPCR. The malondialdehyde (MDA) content of rice leaves was determined, and changes of phenotypic parameters, photosynthetic pigment contents, antioxidant-related enzyme activities and gene expression levels in rice seedlings were analyzed. 【Result】Under salt stress (100 mmol/L NaCl), PI-020 colonization significantly reduced the MDA content in rice leaves compared to the control. The 200-fold mycelial dilution was the most effective, resulting in a 67.2% decrease in MDA content. After PI-020 colonization, the plant height, root length, leaf area, fresh weight, and dry weight of rice seedlings significantly increased by 34.67%, 23.62%, 58.04%, 59.53%, and 67.25%, respectively, compared to the control. Additionally, PI-020 colonization significantly increased the photosynthetic pigment contents, CAT, APX, POD activities, and the expression levels of antioxidant-related genes,, andin leaves. 【Conclusion】PI-020 reduces the oxidative damage caused by salt stress through improving the antioxidant capacity of rice seedlings, thereby reducing the content of MDA, while alleviating the degradation of photosynthetic pigments, protecting the photosynthetic system. Consequently, it improves the salt tolerance of rice.
; rice; salt stress; antioxidant enzyme; antioxidant gene
10.16819/j.1001-7216.2023.230201
2023-02-01;
2023-05-11。
江苏省科技支撑计划资助项目(BE2020321);江苏省自主创新资金资助项目[CX(20)1004];江苏省亚夫科技服务项目[KF(22)1020];农业基础性长期性科技工作资助项目(NAES069AM04, NAES-EE-041)。
