基于CRISPR/Cas9技术创制耐盐香稻
2023-09-14李景芳温舒越赵利君陈庭木周振玲孙志广刘艳陈海元张云辉迟铭邢运高徐波徐大勇王宝祥
李景芳 温舒越 赵利君 陈庭木 周振玲 孙志广 刘艳 陈海元 张云辉 迟铭 邢运高 徐波 徐大勇 王宝祥,*
基于CRISPR/Cas9技术创制耐盐香稻
李景芳1温舒越2赵利君2陈庭木1周振玲1孙志广1刘艳1陈海元3张云辉3迟铭1邢运高1徐波1徐大勇1王宝祥1,*
(1连云港市农业科学院, 江苏 连云港 222000;2南京农业大学, 南京 210095;3江苏省农业科学院 种质资源与生物技术研究所, 南京 210014;*通信联系人,email:wbxrice@163.com)
【目的】为了促进耐盐香稻育种,利用CRISPR/Cas9系统对粳稻品种连粳11的和基因进行编辑,以期快速获得一批不含有转基因成分且具有耐盐性和香味的纯合水稻材料。【方法】根据和基因序列中编辑位点的敲除效率设计靶位点,构建pH-Ubi-Cas9--敲除载体,利用农杆菌介导法转入受体品种连粳11中。对转基因后代进行潮霉素和Cas9标记PCR检测以及靶基因测序,获得无外源基因插入的-纯合株系,并对后代种子性状和苗期耐盐性进行分析。【结果】T2代成熟种子中2-AP含量较背景材料连粳11显著增加,千粒重、粒长、粒宽无明显变化;128 mmol/L氯化钠处理14 d后株系21-30较连粳11苗高增加15.2%,苗鲜质量增加45.2%,苗干质量增加13.2%。【结论】利用CRISPR/Cas9技术对和基因编辑获得能稳定遗传且无外源基因插入的耐盐香稻材料,加快了水稻多性状聚合的选育进程。
水稻; CRISPR/Cas9; 耐盐; 香味;;
土壤盐碱化是制约水稻生产的主要非生物胁迫因素之一。我国盐碱地面积广,综合利用潜力巨大。培育能够利用沿海滩涂资源的耐盐水稻品种是增加土地利用率、提高水稻种植面积和产量的重要途径。
近年来,水稻中大量耐盐相关基因被报道,如[1][2][3][4]、[5]、[6]等水稻耐盐正调控基因以及[7]、[8]、[9]、[10]等水稻耐盐负调控基因。其中,编码一个包含696个氨基酸的B型反应调节蛋白转录因子,参与细胞分裂素信号转导等过程,它的功能缺失显著提高了耐盐性。Zhang等[11]通过CRISPR/Cas9技术靶向编辑基因显著提高了水稻耐盐性。研究者也通过RNAi[8, 12]、T-DNA插入[13]、基因编辑[14]等手段获得一系列耐盐水稻材料。
优质米已经成为我国水稻生产的发展方向,米饭的香味是影响食味品质的重要因素之一。控制水稻香味的挥发性物质种类有很多,而绝大多数香米与普通大米2-乙酰-1-吡咯啉(2-AP)的含量存在显著差异,2-AP的含量也常被用来评价稻米是否具有香味的重要参考指标[15]。水稻香味调控基因编码甜菜碱醛脱氢酶,其突变使得BADH2蛋白功能丧失,导致γ-氨基丁醛积累,导致2-AP含量增加,使稻米具有香味[16-17]。目前已有很多报道通过TALEN[18]、CRISPR/Cas9[19]等技术对水稻基因进行定向修饰,使BADH2蛋白功能缺失,成功创制具有香味的水稻。
对现有水稻品种性状进行改良或者研发出具有优异性状的品种是许多研究者一直努力的方向,目前选育优质抗逆品种主要是通过杂交和回交改良等常规育种手段,品种选育周期长,CRISPR/Cas9技术作为应用最为广泛的基因编辑技术,可以对内源基因组进行敲除、插入、碱基替换、点突变等修饰,快速改良品种关键性状,克服基因连锁效应带来的障碍,获得具有优良性状的新品种,未来可能在水稻遗传育种改良中发挥重要作用。
本研究利用CRISPR/Cas9技术对连粳11水稻品种的耐盐和香味基因同时进行编辑,对转基因分离后代进行鉴定,筛选既耐盐又具有香味且不含有外源基因插入的纯合株系,以期为商业化育种技术的创新和产业发展提供思路。
1 材料与方法
1.1 试验材料
本研究以连粳11为遗传转化受体,开展遗传转化试验。
1.2 载体构建及转基因研究
通过NCBI网站获得(Os08g0424500)和(Os06g0183100)基因组序列,登录CRISPR-GE网站(http://skl.scau.edu.cn/)设计、基因靶位点,前引物为靶点序列5’端加上GGCA碱基,后引物为靶序列反向互补后5’端加上AAAC碱基(表1),通过酶切、连接分别构建两个靶点的sgRNA入门载体,进一步酶切、连接,将和基因靶标sgRNA连接形成一个入门载体并与pH-Ubi-Cas9载体连接构建水稻最终表达载体[20]。所用引物由南京金斯瑞生物科技有限公司合成,基因测序由南京擎科生物有限公司完成。测序验证正确的质粒转入到农杆菌EHA105菌株中,利用农杆菌介导的方法侵染连粳11愈伤组织,并通过愈伤组织的筛选和分化等步骤获取转基因植株。
1.3 PCR鉴定及分析
1.3.1 T0代植株转基因鉴定
分蘖前期取连粳11和转基因植株叶片,采用CTAB法提取基因组DNA,用潮霉素标记进行PCR鉴定,挑选T0代转基因阳性株系种植。
1.3.2 T1代植株转基因鉴定
分蘖前期取叶片,提取DNA,用潮霉素引物和Cas9标记引物进行扩增,剔除含有外源片段的植株,将不含有载体片段的植株用含有靶位点的引物进行PCR扩增和产物测序,测序结果使用DSDecodeM网站(http://skl.scau.edu.cn/dsdecode/)和BioXM软件分析,选取、编辑成功且纯合的株系后代用于香味和耐盐性鉴定。
1.4 耐盐性鉴定
连粳11和基因编辑T1代纯合种子用75%酒精消毒,室温下浸种2d,催芽1 d至种子露白,将露白种子播到底部剪开的96孔PCR板中进行水培,2~3 d换一次水。待幼苗长至1叶1心时,换成IRRI营养液培养[21],每2~3 d更换一次营养液。当幼苗长至两叶一心时,用含128 mmol/L NaCl的IRRI营养液培养[11, 22],以标准IRRI营养液作为对照,每2~3 d更换一次营养液,处理2周后,拍照,测定苗高、苗鲜质量、苗干质量,并进行耐盐性评价。所有测定均进行3次生物学重复。耐盐相关基因相对表达水平测定,以作为内参基因,数据采用2−法进行分析[23]。
1.5 基因编辑后代表型分析
将成熟的连粳11和基因编辑T2代种子置于烘箱中60℃下烘至恒重,考查千粒重,并对粒长、粒宽进行测定。稻米香味物质2-乙酰-1-吡咯啉(2-AP)的含量采用气相色谱-质谱(GC-MS)联用仪测定[19]。
2 结果与分析
2.1 基因编辑载体的构建
基因包含15个外显子,基因包含6个外显子,利用CRISPR-GE在线设计和基因靶位点,选取两个分别位于第6外显子和第3外显子上的靶位点,对和基因进行编辑(图1-A)。

A―Badh2和OsRR22基因结构及靶位点位置信息,绿色碱基代表PAM序列;B―Badh2和OsRR22基因靶点CRISPR/Cas9载体构建;C―表达载体中靶位点测序结果。
Fig. 1.andtarget sites and CRISPR/Cas9vector construction.
水稻pH-Ubi-Cas9终转化载体构建完成后(图1-B),进行靶位点测序,载体测序结果表明设计靶点序列能够完全比对(图1-C),将测序验证正确的质粒转化到农杆菌中并开展后续转基因实验。

表1 本研究中使用的引物
2.2 Badh2-OsRR22的编辑及无标记后代的鉴定
将和基因编辑载体转化到连粳11的愈伤组织中,通过遗传转化获得T0代转基因苗,利用潮霉素标记筛选阳性转基因植株,并进行下一代繁殖。
分别提取T1代转基因单株DNA,通过Cas9载体引物筛选无外源标记的株系(图2),并对筛选到的无外源标记的株系进行靶位点突变信息检测,共检测到6种不同的纯合双突变植株,其中,基因有4种突变类型,分别为插入A、缺失TA、缺失AGTCCTATA和缺失TAT。插入A导致蛋白翻译过程中第267I→N、268V→S、269V→G、270F→V位氨基酸的替换,进而导致蛋白翻译提前终止;缺失TA导致第267I→S、268V→G位氨基酸的替换,进而导致蛋白翻译提前终止;缺失AGTCCTATA,导致第265S、266P、267I位这3个氨基酸的缺失;缺失TAT导致第267I位氨基酸缺失。基因有插入T、插入G和34 bp缺失等3种突变类型,分别导致出现一段氨基酸的替换后终止翻译(图3)。

M―DNA标记;“+”―阳性对照;“−”―阴性对照;1~9为T1代部分植株。Cas9标记目标片段大小为906 bp。
Fig. 2. Identification of Cas9 markers in some T1plants.

红色箭头表示突变位置。“+”代表插入;“-”代表缺失。黑色箭头表示氨基酸位置。
Fig. 3. Mutation types at theandloci of the homozygous lines in T1
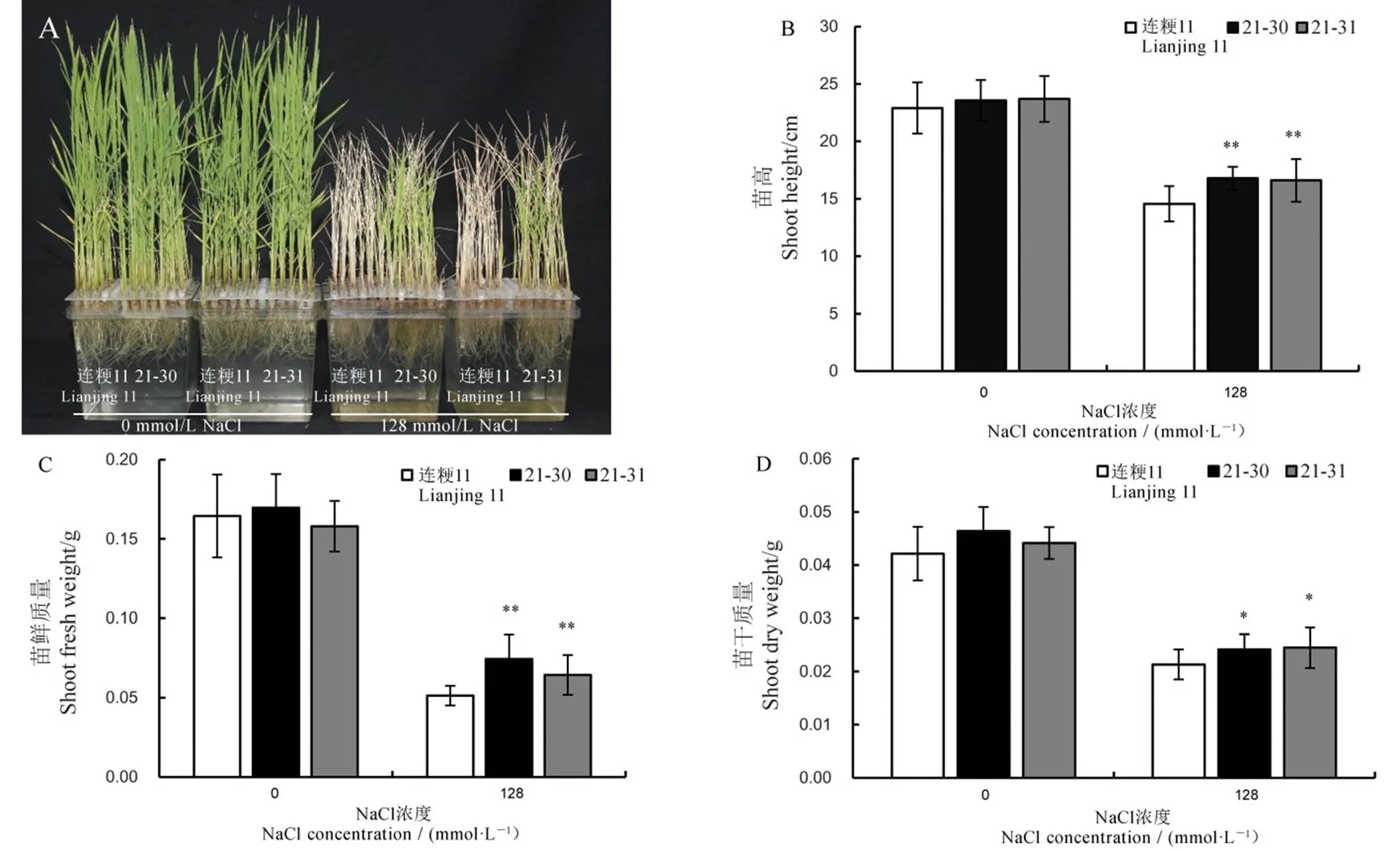
数据用平均数±标准差表示。*和**分别表示在5%和1%水平上差异显著(t检验)。
Fig. 4. Salt tolerance identification of T2homozygous lines 21-30, 21-31 at the seedling stage.
2.3 基因编辑水稻耐盐性鉴定
为了对基因编辑后代进行耐盐性鉴定,我们挑选了T2代两个纯合株系21-30、21-31进行温室苗期耐盐性鉴定。分别使用水稻营养液和含有128 mmol/L氯化钠的营养液处理,数据分析表明盐处理条件下21-30和21-31株系苗高、苗鲜质量和苗干质量均显著高于连粳11。21-30苗高较连粳11增加15.2%,苗鲜质量增加45.2%,苗干质量增加13.2%(图4)。因此,与连粳11相比,基因编辑后代的耐盐性增强。
对水稻耐盐相关基因、、、、的相对表达量进行分析,定量结果显示与连粳11相比,5个耐盐调控基因均上调表达,其中、和在基因编辑后代中表达量显著升高(图5),表明基因编辑引起了耐盐相关基因表达的改变。

数值用平均数±标准差表示。*表示在5%水平上差异显著(t检验)。
Fig. 5. Relative expression levels of salt resistance related genes in the wild-type and its T2line 21-30.
2.4 T2代植株农艺性状和2-AP含量测定
将野生型连粳11与T2代21-30、21-31株系成熟种子进行比较,与野生型相比,21-30、21-31后代千粒重、粒长、粒宽均无明显差异。利用GC-MS对连粳11、21-30和21-31株系种子中2-AP物质含量进行测定,发现21-30和21-31种子中2-AP含量分别为0.277 mg/kg、0.294 mg/kg,而在连粳11种子中未检测到2-AP(图6)。

数值用平均数±标准差表示。**表示在1%水平上差异显著 (t检验)。
Fig. 6. Performance of rice yield and fragrance related traits in the wild-type and its positive transgenic lines.
3 讨论
连云港属于沿海城市,大面积沿海滩涂地不适合种植水稻等农作物,目前选育的适宜该地区种植的耐盐水稻品种相对匮乏,选育高耐盐水稻品种可以增加土地利用率,提高水稻种植面积和产量。香味是一种特色的水稻品质,也是稻米重要的品质指标。选育耐逆的优质稻米品种是近年来育种的主要目标,杂交育种技术是水稻传统育种的主要方法。与传统育种方法相比,基因编辑技术具有编辑效率高、不携带外源基因等优点,CRISPR/Cas9基因编辑技术的出现使基因定向修饰更为简便,是水稻种质改良技术中的重大突破,加快了水稻育种进程。本研究针对连云港地区水稻品种种植需求,利用基因编辑技术以耐盐负调控基因和香味调控基因为靶标基因,构建双基因串联的CRISPR/Cas9基因敲除载体,转入到连粳11愈伤组织中,对两个基因同时进行编辑,通过转基因后代鉴定,获得无外源标记且稳定遗传的耐盐香味水稻株系。
利用基因编辑技术改良水稻的报道已有很多,如抽穗期、抗稻瘟病、香味、直链淀粉含量、粒型等性状的改良,但同时对耐盐和香味基因进行编辑的报道较少。Xu等[24]利用碱基精准编辑技术对基因进行三个靶位点的编辑,获得了直链淀粉含量为1.4%~11.9%的一系列水稻突变体,一方面为水稻品质改良育种创制了新资源,另一方面也为水稻品质精准育种和快速改良提供了新思路。Liu等[25]利用基因编辑技术对的上游开放阅读框(uORF)进行编辑,可以使水稻实现不同程度延迟开花(4.6~11.2 d)的目的,对未来微效改变水稻开花性状的研究提供重要依据。徐善斌等[26]以、和为靶基因,构建CRISPR/Cas9敲除载体,转入到龙粳11中,获得无T-DNA元件的纯合长粒香型水稻。
和分别为水稻耐盐性和香味的负调控基因。本研究构建了和的双基因敲除载体,利用农杆菌介导法转到连粳11中,对这2个基因同时进行编辑,获得了耐盐香型水稻材料。通过对后代转基因株系的筛选,获得6个不含有外源基因的纯合基因编辑株系,对其中21-30和21-31株系种子中2-AP含量测定结果表明香味物质含量增加至0.277和0.2294 mg/kg,苗期耐盐性较连粳11显著增强,且转基因株系千粒重、粒长、粒宽等性状无明显差异,以上纯合株系的获得为耐盐香型水稻的培育提供技术支撑和育种材料。
谢辞:北京大学瞿礼嘉教授课题组提供了本研究所用的CRISPR载体,在此深表谢意。
[1] El Mahi H, Perez-Hormaeche J, de Luca A, Villalta I, Espartero J, Gamez-Arjona F, Fernandez J L, Bundo M, Mendoza I, Mieulet D. A critical role of sodium flux via the plasma membrane Na+/H+exchanger SOS1 in the salt tolerance of rice[J]., 2019, 180(2): 1046-1065.
[2] Yang A, Dai X Y, Zhang W H. A R2R3-type MYB gene,, is involved in salt, cold, and dehydration tolerance in rice[J]., 2012, 63(7): 2541-2556.
[3] Wang R, Jing W, Xiao L G, Jin Y K, Shen L K, Zhang W H. The rice high-affinity potassium pransporter1;1 is involved in salt tolerance and regulated by an MYB-type transcription factor[J]., 2015, 168(3): 1076-1090.
[4] Liu S P, Zheng L Q, Xue Y H, Zhang Q, Wang L, Shuo H X. Overexpression ofandincreases tolerance to drought and salinity in rice[J]., 2010, 53: 444-452.
[5] 张霞, 唐维, 刘嘉, 刘永胜. 过量表达水稻和基因提高烟草脯氨酸的生物合成及其非生物胁迫抗性[J]. 应用与环境生物学报, 2014, 20(4): 717-722.
Zhang X, Tang W, Liu J, Liu Y S. Co-expression of riceandgenes in transgenic tobacco resulted in elevated proline biosynthesis and enhanced abiotic stress tolerance[J]., 2014, 20(4): 717-722. (in Chinese with English abstract)
[6] Li H W, Wang X P. Overexpression of the trehalose- 6-phosphate synthase geneenhances abiotic stress tolerance in rice[J]., 2011, 234(5): 1007-1018.
[7] Lan T, Zheng Y L, Su Z L, Yu S B, Song H B, Zheng X Y, Lin G G, Wu W R., a SBP-box gene, plays a dual role in salt tolerance and trichome formation in rice (L.) [J]., 2019, 9(12): 4107-4114.
[8] Yang C, Ma B, He S J, Xiong Q, Duan K X, Yin C C, Chen H, Lu X, Chen S Y, Zhang J S.andregulate ethylene response of roots and coleoptiles and negatively affect salt tolerance in rice[J]., 2015, 169(1): 148-165.
[9] Koh S, Lee S C, Kim M K, Koh J H, Lee S, An G, Choe S, Kim S R. T-DNA tagged knockout mutation of rice, an orthologue of, with enhanced tolerance to various abiotic stresses[J]., 2007, 65(4): 453-466.
[10] Takagi H, Tamiru M, Abe A, Yoshida K, Uemura A, Yaegashi H, Obara T, Oikawa K, Utsushi H, Kanzaki E, Mitsuoka C, Natsume S, Kosugi S, Kanzaki H, Matsumura H, Urasaki N, Kamoun S, Terauchi R. MutMap accelerates breeding of a salt-tolerant rice cultivar[J]., 2015, 33(5): 445-449.
[11] Zhang A N, Liu Y, Wang F M, Li T F, Chen Z H, Kong D Y, Bi J G, Zhang F Y, Luo X X, Wang J H, Tang J J, Yu X Q, Liu G L, Luo L J. Enhanced rice salinity tolerance via CRISPR/Cas9-targeted mutagenesis of thegene[J]., 2019, 39: 47.
[12] 李晶岚, 陈鑫欣, 石翠翠, 刘方惠, 孙静, 葛荣朝.基因过表达和RNA干涉对水稻苗期耐盐性的影响[J]. 作物学报, 2020, 46(8): 1217-1224.
Li J L, Chen X X, Shi C C, Liu F H, Sun J, Ge R C. Effects ofgene overexpression and RNAi on the salt-tolerance at seedling stage in rice[J]., 2020, 46(8): 1217-1224. (in Chinese with English abstract)
[13] 魏晓东, 张亚东, 赵凌, 路凯, 宋雪梅, 王才林. 稻米香味物质2-乙酰-1-吡咯啉的形成及其影响因素[J]. 中国水稻科学, 2022, 36 (2): 131-138. Wei X D, Zhang Y D, Zhao L, Lu K, Song X M, Wang C L. Research progress in biosynthesis and influencing factors of 2-acetyl-1-pyrroline in fragrant rice[J]., 2022, 36(2): 131-138.(in Chinese with English abstract)
[14] Jiang M, Liu Y H, Li R Q, Li S, Tan Y Y, Huang J Z, Shu Q Y. An inositol 1, 3, 4, 5, 6-pentakisphosphate 2-kinase 1 mutant with a 33-nt deletion showed enhanced tolerance to salt and drought stress in rice[J]., 2021, 10(1): 23.
[15] Bradbury L M, Fitzgerald T L, Henry R J, Jin Q S, Waters D L. The gene for fragrance in rice[J]., 2005, 3(3): 363-370.
[16] Chen S H, Yang Y, Shi W W, Ji Q, He F, Zhang Z D, Heng Z K, Liu X N, Xu M L., encoding betaine ldehyde dehydrogenase, inhibits the biosynthesis of -acetyl-1-pyrroline, a major component in rice fragrance[J]., 2008, 20(7): 1850-1861.
[17] Bradbury L M, Gillies S A, Brushett D J, Waters D L, Henry R J. Inactivation of an amino aldehyde dehydrogenase is responsible for fragrance in rice[J]., 2008, 68(4-5): 439-449.
[18] Shan Q W, Zhang Y, Chen K L, Zhang K, Gao C X. Creation of fragrant rice by targeted knockout of thegene using TALEN technology[J]., 2015, 13(6): 791-800.
[19] Hui S Z, Li H J, Mawia A M, Zhou L, Cai J Y, Ahmad S, Lai C K, Wang J X, Jiao G A, Xie L H, Shao G N, Sheng Z H, Tang S Q, Wang J L, Wei X J, Hu S K, Hu P S. Production of aromatic three-line hybrid rice using novel alleles of[J]., 2022, 20(1): 59-74.
[20] Miao J, Guo D, Zhang J, Huang Q, Qin G, Zhang X, Wan J, Gu H, Qu L. Targeted mutagenesis in rice using CRISPR-Cas system[J]., 2013, 23(10): 1233-1236.
[21] Yoshida S, Forno D A, Cook J H, Gomez K A. Laboratory Manual for Physiological Studies of Rice[M]. International Rice Research Institute, Philippines, 1976: 61-66.
[22] Liu Y, Wang B X, Li J, Song Z Q, Lu B G, Chi M, Yang B, Liu J B, Lam Y W, Li J X, Xu D Y. Salt-response analysis in two rice cultivars at seedling stage[J]., 2017, 39: 215.
[23] Wang B X, Xu B, Liu Y, Li J F, Sun Z G, Chi M, Xing Y G, Yang B, Li J, Liu J B, Lu B G, Xu D Y, Bello B K. A novel mechanism of the signaling cascade associated with the SAPK10-bZIP20-NHX1 synergistic interaction to enhance tolerance of plant to abiotic stress in rice [J]., 2022, 323: 111393.
[24] Xu Y, Lin Q P, Li X F, Wang F J, Chen Z H, Wang J, Li W Q, Fan F J, Tao Y J, Jiang Y J, Wei X D, Zhang R, Yang J, Gao C X. Fine-tuning the amylose content of rice by precise base editing of thegene[J]., 2021, 19(1): 11-13.
[25] Liu X X, Liu H L, Zhang Y Y, He M L Li R T, Meng W, Wang Z Y, Li X F, Bu Q Y. Fine-tuning flowering time via genome editing of upstream open reading frames of heading date 2 in rice[J]., 2021, 14(1): 59.
[26] 徐善斌, 郑洪亮, 刘利锋, 卜庆云, 李秀峰, 邹德堂. 利用CRISPR/Cas9 技术高效创制长粒香型水稻[J]. 中国水稻科学, 2020, 34(5): 406-412. Xu S B, Zheng H L, Liu L F, Bu Q Y, Li X F, Zou D T. Improvement of grain shape and fragrance by using CRISPR/Cas9 system[J].2020, 34(5): 406-412. (in Chinese with English abstract)
Development of Aromatic Salt-tolerant Rice Based on CRISPR/Cas9 Technology
LI Jingfang1, WEN Shuyue2, ZHAO Lijun2, CHEN Tingmu1, ZHOU Zhenling1, SUN Zhiguang1, LIU Yan1, CHEN Haiyuan3, ZHANG Yunhui3, CHI Ming1, XING Yungao1, XU Bo1, XU Dayong1, WANG Baoxiang1,*
(1Lianyungang Academy of Agricultural Science, Lianyungang 222000, China;2Nanjing Agricultural University, Nanjing 210095, China;3Institute of Germplasm Resources and Biotechnology, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;*Corresponding author, email: wbxrice@163.com)
【Objective】It is of importance to promotesalt-tolerant and fragrant rice breeding. We obtainedtransgene free homozygous rice materials with salt-tolerance and fragrance by CRISPR/Cas9-mediated editing ofandinvariety Lianjing 11. 【Method】Targetsites were designed according to knockout efficiency of editing sites inandgene sequence. The pH-Ubi--knockout vector was constructed and transferred into the recipient variety Lianjing 11 by the-mediated technology. PCR detection for hygromycin, Cas9 marker and target gene sequencing were performed in thetransgenic progenies to obtain-homozygous lines without exogenous gene insertion. The seed traits and salt tolerance at seedling stage were analyzed. 【Result】Compared with the background material Lianjing 11, the 2-AP content ofT2significantly increased. After treated with 128 mmol/L NaCl solution for 14 days, the seedling height, the fresh and the dry weight of T2line 21-30 increased by 15.2%,45.2% and 13.2%, respectively. 【Conclusion】The successfulediting ofandby CRISPR/Cas9 technology developed aromatic salt-tolerant homozygous lines without exogenous gene insertion, speeding up the breeding process of pyramiding multiple traitsin rice.
rice; CRISPR/Cas9; salt-tolerant; fragrance;;
10.16819/j.1001-7216.2023.220907
2022-09-28;
2022-12-19。
连云港市财政专项资金资助项目(QNJJ2102; QNJJ2211; QNJJ1803);江苏省农业重大品种创制计划资助项目(PZCZ201704);江苏省政策引导类计划(苏北科技专项)资助项目(LYG-SZ202040)。
