芍药甘草汤对急性肺损伤大鼠肠道菌群的影响Δ
2023-09-14张甘纯宋信莉刘兴德舒万芬王洪鑫贵州中医药大学药学院贵阳550025贵州医科大学药学院贵阳550025
张甘纯 ,刘 文 ,宋信莉 ,刘兴德 ,舒万芬 ,秦 琴 ,王洪鑫 (.贵州中医药大学药学院,贵阳 550025;2.贵州医科大学药学院,贵阳 550025)
急性肺损伤(acute lung injury,ALI)是一种常见而复杂的炎症性疾病,由肺内外各种致病因素引起。其特征是急性、进行性呼吸窘迫和持续低氧血症,病死率高达40%[1]。机械通气和激素给药是目前较为有效的ALI治疗方案[2],但仍缺乏副作用较小的有效治疗药物。ALI属于中医“爆喘”“喘脱”范畴[3],治疗上主要涉及清热解毒、活血化瘀、益气扶正等中药及方剂[4]。芍药甘草汤(Shaoyao gancao decoction,SGD)源于张仲景之《伤寒杂病论》,2018年作为第一批经典名方收录在《古代经典名方目录》中。该方由芍药和炙甘草2味药材组成。方中白芍性微寒,能够养血调经、敛阴止汗;甘草性平,能够补脾益气、清热解毒、缓急止痛。现代研究和临床实践也证实,SGD具有显著的抗炎、镇痛、止咳、平喘、调节免疫等作用,对多种炎症性疾病有显著的治疗作用[5]。选用SGD治疗ALI具有中医理论与现代研究基础。
肺肠轴理论与中医基础理论“肺与大肠相表里”揭示了肺脏与胃肠道的关联性,二者胚胎起源相同、结构相似[6]。现代研究亦证实肺和肠道在生理和病理条件下相互影响。如近年研究表明,肠道微生物能够影响肺功能,参与多种肺系疾病,包括支气管哮喘、肺癌、ALI和慢性阻塞性肺疾病等[7]。而肺部疾病也可表现出肠道菌群改变的特征,如采用粪菌移植治疗手段可显著降低Toll样受体4/核因子κB 信号通路活性和氧化应激水平,从而改善脂多糖(lipopolysaccharide,LPS)诱导的ALI[8]。可见,机体肠道菌群的改变对于肺部疾病的发生、发展和治疗都起着重要作用。本研究拟探讨SGD 对ALI 大鼠肠道菌群的影响,从而阐明其防治ALI 的作用机制,为中医药治疗ALI提供实验依据。
1 材料
1.1 主要仪器
本研究所用主要仪器为FlexStation3 型多功能酶标仪(美国Molecular Devices公司)、AE/240型十万分之一电子天平[梅特勒-托利多(上海)仪器有限公司]、KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司)、H1650R型冷冻高速离心机(湘潭湘仪仪器有限公司)。
1.2 主要药品与试剂
白芍(批号220101)、炙甘草(批号210601)饮片均购自贵州一品药业连锁有限公司,经贵州中医药大学药学院孙庆文教授鉴定白芍为毛茛科植物芍药PaeonialactifloraPall.的干燥根,炙甘草为豆科植物甘草GlycyrrhizauralensisFisch.的干燥根和根茎的炮制加工品。地塞米松(dexamethasone,DEX)原料药(批号C13694947,纯度≥98%)购自上海麦克林生化科技有限公司;LPS(批号527N031)购自上海索莱宝生物科技有限公司;白细胞介素1β(interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫吸附检测(enzyme-linked immunosorbent assay,ELISA)试剂盒(批号分别为ZC-36391、ZC-36404、ZC-37624)购自上海茁彩生物科技有限公司。
1.3 动物
本研究所用动物为SPF 级雄性大鼠,共60 只,体重(200±20) g,由北京华阜康生物科技有限公司提供,动物生产许可证号为SCXK(京)2019-0008。大鼠饲养于通风良好、室温18~25 ℃、相对湿度50%~70%的动物房中,饲养期间确保大鼠能够自由进食与饮水。本动物实验获得了贵州中医药大学动物实验伦理委员会批准(伦理批准号20210133)。
2 方法
2.1 SGD的制备
SGD由白芍和炙甘草按1∶1(m/m)配伍组成。称取白芍、炙甘草各55 g,加入600 mL水[9],浸泡30 min,用电陶炉以武火(1 200 W)煮沸后再以文火(600 W)煎煮至300 mL,滤液减压浓缩,得到按生药量计为2.0 g/mL 的SGD药液,置于4 ℃冰箱中保存备用。
2.2 大鼠分组、给药及ALI模型建立
将60只大鼠按随机数字表法分为正常组(CON组,生理盐水)、模型组(MOD 组,生理盐水)、阳性对照组(DEX 组,5 mg/kg 地塞米松)[10]和芍药甘草汤低、中、高剂量组(SGD-L、SGD-M、SGD-H 组,给药剂量以生药量计分别为5.8、11.6、23.2 g/kg,分别为临床等效剂量的0.5、1、2倍[9]),每组10只。各组大鼠每天灌胃1次,灌胃体积均为10 mL/kg,连续7 d。末次给药30 min后,CON组大鼠气道滴注等体积的生理盐水,其余各组大鼠气道滴注LPS(5 mg/kg)建立ALI模型[10]。
2.3 样本采集
造模12 h 后,麻醉大鼠,经气管注射冰磷酸盐缓冲液5 mL灌洗左肺,30 s后缓慢回抽,重复2次,收集肺泡灌洗液(bronchial alveolar lavage fluid,BALF)并置于离心管中,在4 ℃下以3 000 r/min离心15 min,取上清液置于-80 ℃冰箱中保存备用。随后取右肺上叶用于病理形态学观察,右肺下叶则用于计算肺组织湿/干重比。取粪便置于-80 ℃冰箱中冻存备用。
2.4 肺组织病理形态学观察
取右肺上叶组织用5%多聚甲醛固定、梯度乙醇脱水、常规石蜡包埋、切片(厚度4 μm)后,以苏木素-伊红(hematoxylin-eosin,HE)染色,然后在光学显微镜下对肺组织进行病理形态学观察。
2.5 肺组织湿/干重比计算
取右肺下叶用生理盐水清洗后吸干水分,称重,得湿重。然后将肺组织置于干燥箱中,70 ℃干燥48 h,称重,得干重。计算肺组织湿/干重比,即肺组织湿重/肺组织干重×100%。
2.6 BALF中炎症因子水平检测
取“2.3”项下BALF,采用ELISA 法检测大鼠BALF中TNF-α、IL-6和IL-1β水平,具体操作根据相应试剂盒说明书进行。
2.7 肠道菌群检测
以CON组、MOD组和药效最优的SGD剂量组大鼠的粪便为检测样本(每组随机选择6只大鼠的样本进行检测),委托杭州联川生物技术股份有限公司进行16S rRNA 测序和生物信息学分析。对粪便样本进行DNA提取后,采用引物341F(5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′)对可变区(V3~V4)扩增,之后在lllumina MiSeq平台测序,按照相似度97%聚类,获得操作分类单元(operational taxonomic units,OTUs)。对所获OTUs进行分类学注释并生成不同分类水平下的物种丰度,利用Mothur软件计算样品的Observed-species、Shannon、Simpson、Chao1 和Goods-coverage指数,分析单个样品内部的物种多样性,即Alpha多样性;基于weighted UniFrac算法中的主坐标分析(principal co-ordinates analysis,PCoA)和非度量多维标度分析(non-metric multidimensional scaling,NMDS)比较不同样品在物种多样性方面的相似程度,即Beta 多样性;最后,通过线性判别分析进行效应大小[linear discriminant analysis(LDA) effect size,LEfSe]分析并寻找差异菌群(以LDA score log10>4为标准)。
2.8 统计学方法
采用SPSS 21.0软件对数据进行统计分析。符合正态分布的计量资料用±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,检验水准α=0.05。为了确定在ALI 进展中起作用的关键菌群,将MOD 组和SGD-L 组的差异菌属与炎症因子进行Pearson相关性分析。
3 结果
3.1 大鼠肺组织病理形态学变化观察结果
CON 组大鼠肺组织结构正常,未见明显水肿、炎症细胞浸润或纤维结缔组织增生,肺泡上皮细胞形态较为正常,未见明显变性、坏死,间质未见明显炎症细胞浸润及纤维组织增生;MOD组大鼠肺组织可见肺泡隔增厚,肺泡轻微水肿伴大量炎症细胞浸润,且以淋巴细胞和中性粒细胞为主,血管周围间质性水肿,说明ALI 模型复制成功;与MOD组比较,各给药组大鼠的肺组织病变程度均明显减轻,具体表现为肺组织炎症细胞浸润减少、肺泡隔增厚和肺泡水肿情况有所改善。结果见图1。
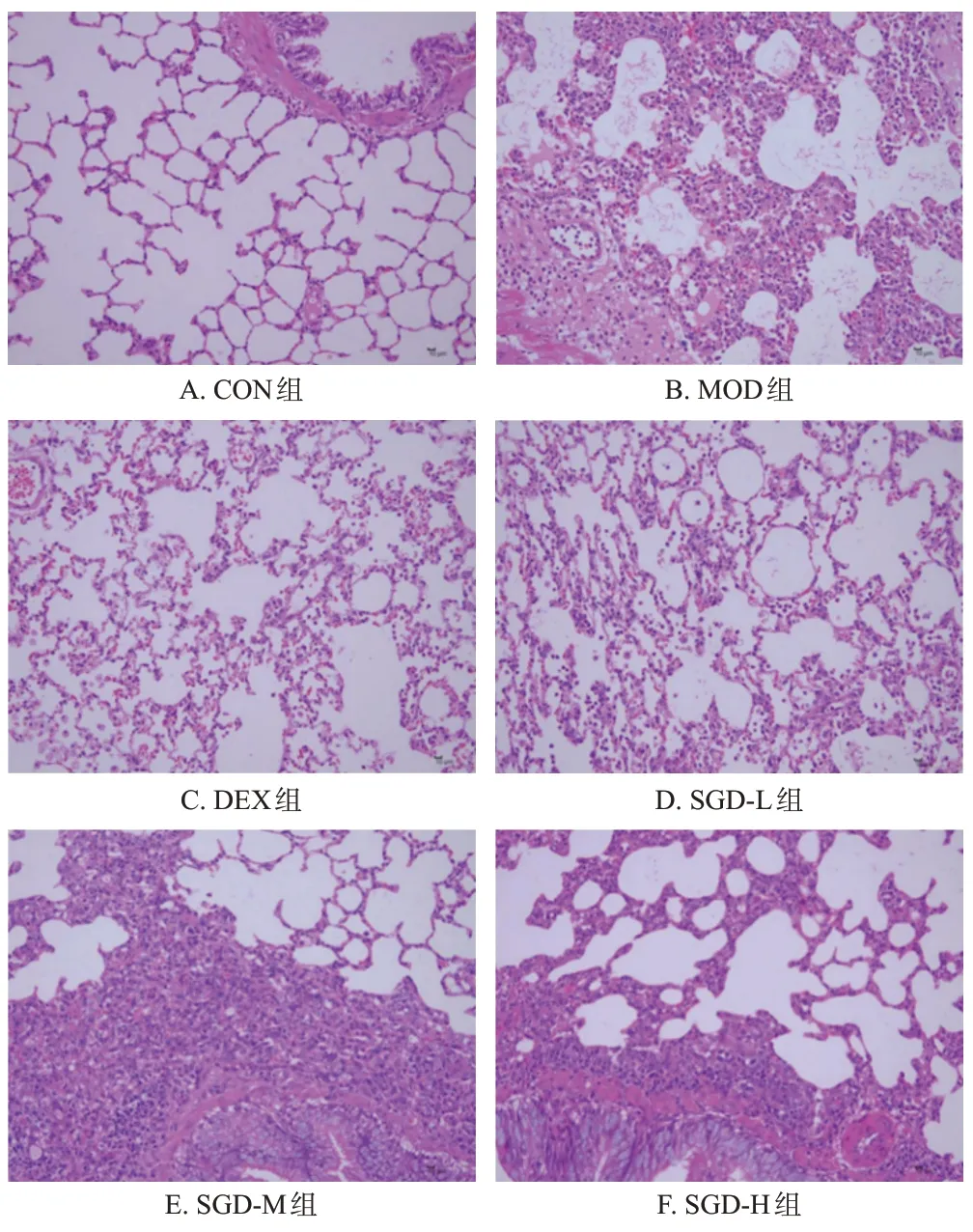
图1 各组大鼠肺组织病理形态学观察的显微图(HE染色,×200)
3.2 大鼠肺组织湿/干重比计算结果
与CON组比较,MOD组大鼠肺组织湿/干重比显著升高(P<0.01);与MOD 组比较,各给药组大鼠的肺组织湿/干重比均显著降低(P<0.05 或P<0.01)。结果见表1。
表1 各组大肺组织湿/干重比和BALF 中IL-1β、IL-6、TNF-α水平测定结果(±s,n=10)

表1 各组大肺组织湿/干重比和BALF 中IL-1β、IL-6、TNF-α水平测定结果(±s,n=10)
a:与CON组比较,P<0.01;b:与MOD比较,P<0.01;c:与MOD组比较,P<0.05。
TNF-α/(pg/mL)22.19±5.27 90.27±6.80a 42.66±5.03b 54.04±5.65b 59.44±16.67b 67.50±10.50b组别CON组MOD组DEX组SGD-L组SGD-M组SGD-H组肺组织湿/干重比/%6.80±0.59 8.23±0.62a 7.31±0.64b 7.40±0.68b 7.53±0.63c 7.58±0.60c IL-1β/(pg/mL)12.62±0.77 33.07±3.12a 23.34±2.29b 22.19±3.63b 24.57±3.17b 28.22±3.65b IL-6/(pg/mL)33.41±9.58 137.33±12.39a 69.03±7.89b 86.49±9.67b 99.19±12.49b 104.24±14.12b
3.3 大鼠BALF中炎症因子水平测定结果
与CON 组比较,MOD 组大鼠BALF 中IL-1β、IL-6、TNF-α水平显著升高(P<0.01)。与MOD组比较,各给药组大鼠BALF 中上述炎症因子水平均显著降低(P<0.01)。结果见表1。
3.4 大鼠肠道菌群分析结果
3.4.1 Alpha多样性分析结果
如表2 所示,各组样本的Goods-coverage 指数均大于0.98,表明测序结果良好,能够反映各样本的微生物群落情况[11]。与CON 组比较,MOD 组的Observedspecies、Shannon、Simpson、Chao1 指数均显著降低(P<0.01),说明ALI 大鼠肠道内菌群的丰富度和多样性降低。与MOD 组比较,SGD-L 组上述4 项指数均显著升高(P<0.05或P<0.01),表明SGD能够增加ALI大鼠肠道内菌群的丰富度和多样性,恢复其菌群结构。
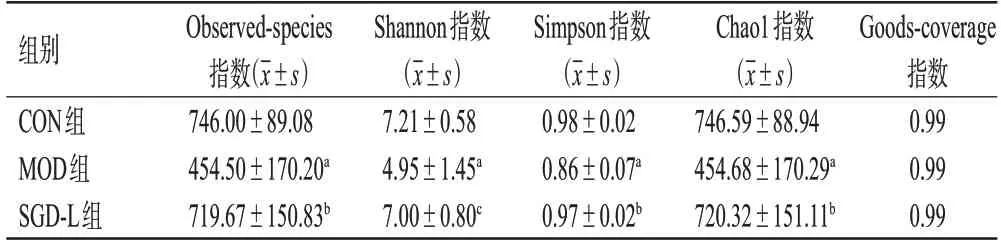
表2 各组大鼠肠道菌群的Alpha 多样性分析结果(n=6)
3.4.2 Beta多样性分析结果
在PCoA 图和NMDS 图中,各组样本内部均能够显著聚类,表明各组样本内部肠道菌群趋于一致。CON组和MOD 组的菌群结构组成差异显著(P<0.05),表明ALI大鼠的肠道菌群结构发生了紊乱;SGD-L组的肠道菌群结构偏离了MOD 组,并趋向CON 组,表明经SGD干预后,ALI大鼠的肠道菌群结构向正常状态回调。结果见图2。

图2 各组大鼠肠道菌群的Beta多样性分析结果
3.4.3 肠道菌群结构分析结果
如图3所示,在门水平下与CON组比较,MOD组大鼠粪便中拟杆菌门(Bacteroidota)和变形菌门(Proteobacteria)的相对丰度显著升高(P<0.01),厚壁菌门(Firmicutes)的相对丰度显著降低(P<0.01);与MOD 组比较,SGD-L组大鼠粪便中拟杆菌门和变形菌门的相对丰度显著降低(P<0.01),厚壁菌门的相对丰度显著升高(P<0.01)。

图3 各组大鼠粪便中门水平菌群物种的相对丰度结果
如图4所示,在属水平下与CON组比较,MOD组大鼠粪便中乳杆菌属(Lactobacillus)、大肠埃氏菌属-志贺氏菌属(Escherichia-Shigella)和链球菌属(Streptococcus)的相对丰度显著升高(P<0.05 或P<0.01),梭状芽孢杆菌属(Clostridia_UCG-014)、毛螺菌属(Lachnospira ceae_NK4A136_group)、厚壁菌属(Firmicutes)的相对丰度显著降低(P<0.05 或P<0.01);与MOD 组比较,SGD-L 组大鼠粪便中乳杆菌属、大肠埃氏菌属-志贺氏菌属和链球菌属的相对丰度显著降低(P<0.05 或P<0.01),梭状芽孢杆菌属、毛螺菌属、瘤胃球菌属(Ruminococcus)、杜氏杆菌属(Dubosiella)、阿克曼菌属(Akkermansia)的相对丰度显著升高(P<0.05 或P<0.01)。上述结果表明,SGD 能够逆转ALI 大鼠的肠道菌群紊乱,并使其恢复到与正常情况相似的菌群结构。

图4 各组大鼠粪便中属水平菌群物种的相对丰度
3.4.4 菌群差异分析结果
CON 组与MOD 组、MOD 组与SGD-L 组大鼠的肠道菌群组成和结构均存在显著差异。相比于CON 组,MOD 组的差异菌属为乳杆菌属、链球菌属和大肠埃氏菌属-志贺氏菌属;相比于MOD 组,SGD-L 组的差异菌属为厚壁菌属、毛螺菌属、瘤胃球菌属、梭状芽孢杆菌属、杜氏杆菌属、阿克曼菌属。这些菌群可能作为ALI的生物标志物和SGD改善ALI的肠道指标。结果见图5。
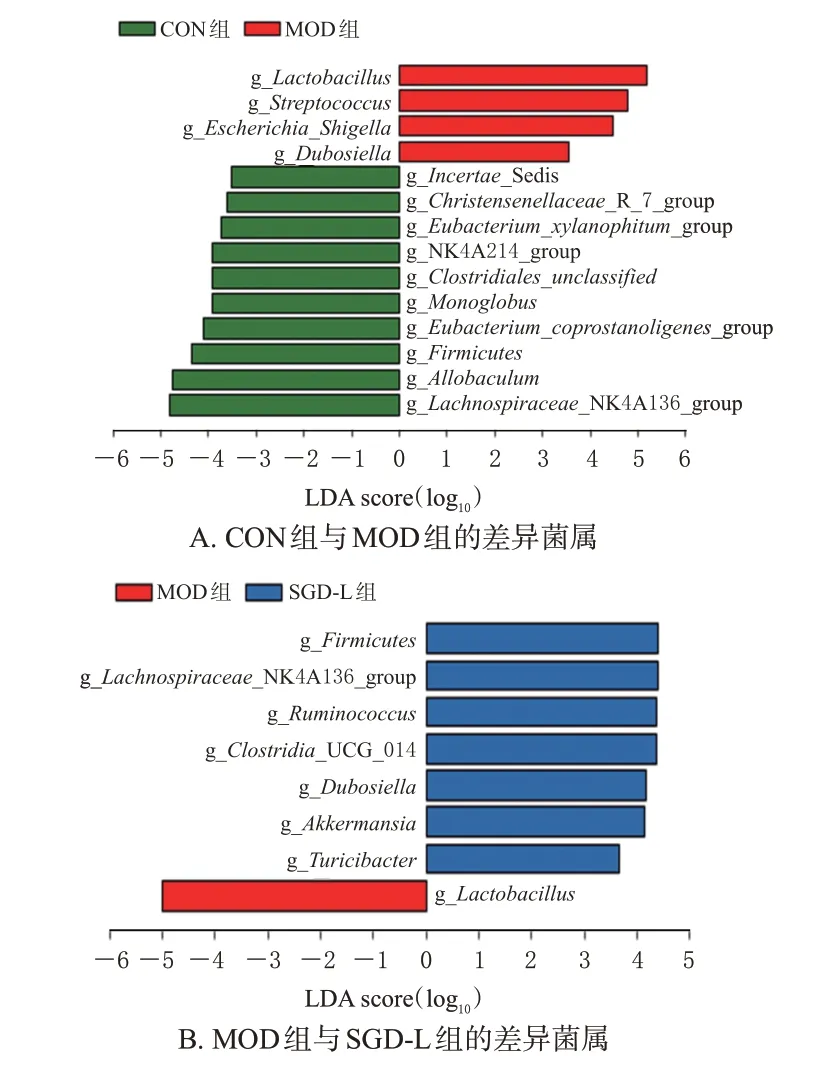
图5 3组大鼠粪便中的差异菌属分析结果
3.4.5 肠道菌群与炎症因子的相关性分析结果
乳杆菌属、链球菌属、大肠埃氏菌属-志贺氏菌属的相对丰度与炎症因子IL-1β、IL-6、TNF-α 的水平呈显著正相关(P<0.05或P<0.01);毛螺菌属、杜氏杆菌属、厚壁菌属的相对丰度与上述炎症因子的水平呈显著负相关(P<0.05或P<0.01)。结果见图6。

图6 差异菌属与炎症因子的相关性热图
4 讨论
LPS 诱导的ALI 模型被认为是一种重复性好、与临床病理变化相似度高的动物模型[12]。不同的LPS诱导方式与临床ALI 的严重程度有一定的相关性。如气管内注射或鼻腔滴注LPS可直接诱导肺中性粒细胞募集,上调肺ALI炎症因子,模拟ALI炎症的初始症状。而腹腔内注射LPS 可诱发全身脓毒性ALI,模拟更严重的临床阶段[13]。本研究采用气道滴注LPS复制ALI模型,MOD组大鼠肺组织病理切片可见肺泡隔增厚、炎症细胞浸润、肺间质水肿等病理变化,说明模型构建成功。ALI的特点之一是浆液涌入肺泡腔,导致肺泡水肿[14]。为了量化肺水肿的程度,本研究检测了肺组织湿/干重比,发现经SGD 预处理后可降低肺组织湿/干重比,表明SGD 可减缓肺水肿的发展。
维护机体内炎症环境的平衡及阻断级联放大的失控性炎症反应是防治ALI的重要策略[15]。IL-1β、IL-6和TNF-α 是ALI 发病过程中重要的炎症因子[16],TNF-α 和IL-1β不仅放大了炎症级联反应,引起炎症性损伤,还招募了中性粒细胞进入肺部,并表现出髓过氧化物酶活性增加,从而加重了肺损伤[17]。研究发现,IL-6水平是预测ALI 患者发病率和死亡率的重要指标[18]。因此,抑制上述炎症因子的表达可以起到减轻ALI 的作用。为了检测SGD 对LPS 诱导的ALI 大鼠的抗炎作用,笔者采用ELISA 法检测了大鼠BALF 中炎症因子水平。结果显示,SGD 明显抑制了模型大鼠BALF 中IL-1β、IL-6 和TNF-α的产生,有效缓解了ALI的炎症反应。
肠道菌群在ALI的发生发展和治疗中起关键作用。人体肠道菌群在门水平下主要由厚壁菌门和拟杆菌门组成,其同样也是大鼠肠道中最丰富的2个菌门。厚壁菌门的相对丰度降低与拟杆菌门的相对丰度升高常被认为是菌群失调的标志[19]。厚壁菌门和拟杆菌门主要参与宿主体内脂肪和胆汁酸代谢的调节,维持能量平衡,其中前者能够帮助身体吸收和储存能量,而后者则相反[20]。也有研究表明,厚壁菌门与IL-17 信号通路和补体信号通路密切相关,可能在免疫和炎症的调节中起重要作用[21]。变形菌门是肠道的4 个主要菌门(厚壁菌门、拟杆菌门、变形菌门、放线菌门)中随时间变化最不稳定的菌门,其相对丰度被视为反映肠道菌群紊乱的标志之一及潜在的疾病诊断指标。变形菌门能够有效利用炎症反应产生的硝酸盐作为电子受体,进行厌氧呼吸。因此在炎症环境中,变形菌门比依赖发酵生长的厚壁菌门和拟杆菌门更具增殖优势,其过度生长可进一步加重局部炎症反应[22]。本研究发现,MOD组大鼠粪便中厚壁菌门的相对丰度降低,拟杆菌门和变形菌门的相对丰度升高;经SGD 干预后,逆转了这种趋势,使SGD-L组大鼠恢复到了与CON组相似的菌群结构。
宿主体内许多促炎因子的产生都是由肠道微生物群诱导的,如链球菌及其细胞壁成分已被证明可诱导TNF-α 和IL-1β 分泌,链球菌及其家族的多个成员与肺功能下降有关[23];乳杆菌能在人淋巴细胞中诱导IL-6和TNF-α 分泌[24];过度生长的大肠埃希菌可以促进趋化因子配体5及CXC趋化因子配体1的表达,从而加重炎症损伤的程度[22]。而部分益生菌(如瘤胃球菌属、杜氏杆菌属、毛螺菌属)可以抑制炎症细胞因子的表达,以抑制炎症发生[25]。本研究中,菌群与炎症因子的相关性分析结果显示,差异菌属与炎症因子具有显著的相关性。这提示SGD可能通过恢复菌群结构、调节有害菌与有益菌比例发挥抗炎作用。如阿克曼菌是一种黏液降解菌,对维持肠黏膜的完整性起到了重要作用。而肠道屏障的损坏可能导致微生物转运到血液中,并使炎症反应持续,从而加剧肺损伤[26]。这提示SGD可能通过维持肠道稳态,发挥抗ALI作用。
综上所述,SGD 可能通过改善肺组织损伤、减轻炎症反应、调节菌群结构来发挥改善ALI的作用。然而在本研究中,药效学结果出现剂量和效应“倒挂”的现象,这可能是中药提取物产生的双向调节作用,具体原因有待进一步分析。此外,本研究并未对在肠道菌群研究中确定的差异菌属进行单独验证,后续可开展验证实验对本研究结果加以证实。
