秃叶黄檗果实祛痰止咳物质基础的初步研究Δ
2023-09-14张桂荣李杨松杨转珍朱宝洁江莉媛吕光华成都中医药大学药学院成都611137西南特色中药资源国家重点实验室成都611137
张桂荣 ,李杨松 ,罗 婕 ,张 瑾 ,杨转珍 ,朱宝洁 ,江莉媛 ,吕光华 ,龙 飞 #(1.成都中医药大学药学院,成都 611137;2.西南特色中药资源国家重点实验室,成都 611137)
芸香科黄檗属植物在全球约有4 种,主产于亚洲东部,在我国有2 个种及1 个变种:黄檗Phellodendron amurenseRupr.、川黄檗P.chinenseSchneid.及变种秃叶黄檗P.chinensevar.glabriusculumSchneid.。《中国药典》自2005年版起,将川黄柏与关黄柏列为2种药材,以“川黄柏”作“黄柏”,关黄柏单列[1]。黄檗为中药关黄柏的基原植物,主要分布在黑龙江、河北、山西、内蒙古、陕西等地[2]。川黄檗为中药黄柏的基原植物,因被过度开采使用导致其野生资源急剧减少。调查发现,至20世纪末,野生的川黄檗植物基本消失殆尽,而今中药黄柏的主流商品来源实则为变种秃叶黄檗,主要分布在四川、重庆、贵州、湖北、湖南和云南等地[3]。
秃叶黄檗的树皮作为黄柏药材使用,具有清热燥湿、泻火除蒸、解毒疗疮的功效,主要用于治疗湿热泻痢、热淋涩痛、骨蒸劳热、盗汗、遗精、疮疡肿毒等病症[4]。据文献报道,黄檗属植物除树皮可作药用之外,其果实也可入药[5—6]。李焕荣等[7]研究发现,黄檗的果实中含有挥发油类、酚酸类、生物碱类和三萜类成分,其水煎液和挥发油均有祛痰止咳作用,民间多用于治疗慢性支气管炎[5—6]。另有研究发现,秃叶黄檗果实的主要成分包括挥发油类、生物碱类和三萜类化合物[8],但其作药用还未见报道。本研究拟通过氨水引咳和药物祛痰小鼠模型实验研究秃叶黄檗果实的祛痰止咳作用;利用气相色谱-质谱联用(GC-MS)和超高效液相色谱-质谱(UPLCMS)联用技术对秃叶黄檗果实的挥发油和非挥发性部位进行成分分析;并在药效研究和成分分析鉴定的基础上,通过网络药理学进一步探索秃叶黄檗果实祛痰止咳的物质基础及作用机制,为秃叶黄檗果实资源的综合利用研究提供依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括7890A-5975C 系列GCMS 联用仪(美国Agilent 公司)、Vanquish 型超高效液相色谱联用Q-Exactive 四极杆-静电场轨道阱高分辨质谱仪(美国Thermo Fisher Scientific公司)、SQP型十万分之一天平[赛多利斯科学仪器(北京)有限公司]、Spectra-Max i3x型酶标仪[美谷分子仪器(上海)有限公司]等。
1.2 主要药品与试剂
药材样品采自四川省雅安市荥经县,经成都中医药大学药学院龙飞副教授鉴定为芸香科黄檗属植物秃叶黄檗P.chinensevar.glabriusculumSchneid.的成熟果实,低温干燥后密封储存。甜菜碱、小檗碱、小檗红碱、绿原酸、木犀草素对照品(批号分别为CYR-T0049200815、CYRX0024210628、CYR-X004021022、CYR-L0098200419、CYR-M0072200308)均购自四川萃益润生物科技有限公司,熊果苷、柠檬苦素、红景天苷、山柰酚、延胡索乙素、秦皮甲素、巴马汀、黄柏酮、黄柏碱、吴茱萸碱对照品(批号分别为PS020727、PS010363、PS011476、PS011676、PS000988、PS012121、PS020011、PS010197、PS000447、PS012147)均购自成都普思生物科技股份有限公司,葫芦巴碱对照品(批号RDD-H05711801010)购自成都瑞芬思德丹生物科技有限公司,盐酸药根碱对照品(批号20081905)购自成都普菲德生物技术有限公司,槲皮素对照品(批号CHB190110)购自成都克洛玛生物科技有限公司,所有对照品的纯度均≥98%。氢溴酸右美沙芬片(批号51-221211,规格15 mg)购自北京天衡药物研究院南阳天衡制药厂;氯化铵(分析纯)购自成都市科隆化学品有限公司。乙腈、甲醇、甲酸均为色谱纯,其余试剂均为分析纯,水为超纯水。
1.3 动物
本研究所用动物为SPF 级健康KM 小鼠,共70 只,雌雄各半,体重18~22 g,购自北京SPF生物科技有限公司,动物生产许可证号为SCXK(京)2019-0010。将小鼠饲养于成都中医药大学中医药管理局中药药理三级科研实验室。适应性饲养1周后用于实验。本实验方案经成都中医药大学实验动物伦理委员会批准,伦理批号为2021-80。
2 方法与结果
2.1 试药的制备
2.1.1 秃叶黄檗果实水煎液试药
称取秃叶黄檗果实粉末(过三号筛)200 g,用10 倍体积的水回流煎煮2 h,用纱布过滤后滤渣再用6倍体积的超纯水回流煎煮2 h,合并2 次煎液,减压浓缩定容至100 mL,得生药量为2 g/mL的秃叶黄檗果实浸膏,临用时用生理盐水稀释至给药浓度。
2.1.2 秃叶黄檗果实挥发油试药
称取秃叶黄檗果实粉末(过三号筛)100 g,加入10倍体积的水,采用水蒸气蒸馏法提取挥发油,挥发油得率为1.43%,临用时用2%聚山梨酯80稀释至给药浓度。
2.2 秃叶黄檗果实水煎液和挥发油的止咳祛痰活性考察
2.2.1 止咳活性考察
采用氨水引咳实验进行考察,具体操作参照文献[9]。取小鼠60只,雌雄各半,随机分为6组:正常对照组(生理盐水),右美沙芬组(阳性对照氢溴酸右美沙芬片,15 mg/kg),秃叶黄檗果实水煎液高、低剂量组(后文简称为“水煎液高、低剂量组”,给药剂量以生药量计分别为12、3 g/kg),秃叶黄檗果实挥发油高、低剂量组(后文简称为“挥发油高、低剂量组”,给药剂量以挥发油量计分别为0.8、0.2 g/kg),每组10只。灌胃相应药物/生理盐水,每天1次,连续7 d。末次灌胃后0.5 h,将小鼠放入1 000 mL烧杯中,再迅速放入注有0.4 mL浓氨水的棉球刺激小鼠,以小鼠腹肌强烈收缩且张嘴为咳嗽动作指标,记录其咳嗽潜伏期和2 min内咳嗽次数。采用SPSS 26.0软件对数据进行统计分析。实验结果以±s表示,多组间比较采用单因素方差分析,进一步的组间两两比较采用LSD-t检验;检验水准α=0.05。结果显示,与正常对照组比较,各给药组小鼠的咳嗽潜伏期均显著延长(P<0.05 或P<0.01),右美沙芬组、水煎液高剂量组和挥发油高剂量组小鼠2 min内咳嗽次数均显著减少(P<0.05或P<0.01)。结果见表1。
表1 各组小鼠的咳嗽潜伏期、2 min内咳嗽次数及气管中酚红分泌量测定结果(±s,n=10)

表1 各组小鼠的咳嗽潜伏期、2 min内咳嗽次数及气管中酚红分泌量测定结果(±s,n=10)
a:与正常对照组比较,P<0.01;b:与正常对照组比较,P<0.05。
组别正常对照组右美沙芬组/氯化铵组水煎液高剂量组水煎液低剂量组挥发油高剂量组挥发油低剂量组酚红分泌量/(μg/mL)0.91±0.079 1.36±0.070a 1.45±0.121a 1.22±0.119b 1.19±0.037b 1.12±0.058咳嗽潜伏期/s 45.20±5.213 69.90±4.375a 68.90±4.100a 57.80±3.593b 68.70±3.887a 55.00±5.108b 2 min内咳嗽次数/次44.30±1.862 31.40±1.368a 35.10±0.936b 42.50±5.636 34.20±3.010b 36.80±2.752
2.2.2 祛痰活性考察
采用药物祛痰小鼠实验进行考察。动物选取及给药方式同“2.2.1”项,阳性对照药变更为氯化铵(1 g/kg)。末次给药0.5 h 后,各组小鼠按1 g/kg 腹腔注射5%酚红溶液,0.5 h后颈椎脱臼处死小鼠。取下气管放入2 mL生理盐水中,加1 mol/L NaOH 溶液0.2 mL,以3 000 r/min离心15 min,取上清液于酶标仪546 nm波长处测定光密度(OD)值。根据标准曲线Y=0.059 6X-0.028 3(R2=0.996 9)(式中X为酚红质量浓度,Y为OD 值)计算气管中酚红分泌量。数据结果按“2.2.1”项下方法进行统计学分析。结果显示,与正常对照组比较,氯化铵组和水煎液高剂量组、水煎液低剂量组、挥发油高剂量组小鼠气管中的酚红分泌量均显著增加(P<0.05或P<0.01)。结果见表1。
2.3 秃叶黄檗果实挥发油的GC-MS成分分析
2.3.1 色谱条件
色谱柱为Agilent HP-5MS 柱(30 m×250 μm×0.25 μm);采用程序升温:初始温度50 ℃,保持2 min,以4 ℃/min 升温至280 ℃,保持2 min;进样口温度为280 ℃;载气为氦气,流速为1.0 mL/min;分流比为20∶1;进样量为1 μL。
2.3.2 质谱条件
电离方法为电子轰击电离(electron ionization,EI);电子能量为70 eV;离子源温度为230 ℃;质量扫描范围为20~450;质谱检索标准库为NIST14。
2.3.3 GC-MS分析供试品溶液的制备
取秃叶黄檗果实打粉,过三号筛,精密称取粉末约100 g,采用水蒸气蒸馏法提取挥发油,得淡黄色挥发油液体约1.5 mL。加入无水硫酸钠约0.5 g,静置过夜,以除去水分。取挥发油约1.0 mL置于10 mL容量瓶中,用无水乙醚定容,以0.22 μm微孔滤膜过滤,即得。
2.3.4 数据处理及结果分析
将所得质谱裂解数据信息与NIST14 数据库匹配,得到匹配度≥90%的化合物共38 个,总离子流图见图1。其中,相对百分含量>1%的主要化合物有8个,分别为α-蒎烯(1.27%)、月桂烯(64.08%)、石竹烯(1.07%)、germacrene D(2.77%)、isospathulenol(1.08%)、α-cadinol(1.32%)、4(15),5,10(14)-大根香叶三烯-1-醇(1.24%)、金合欢醇(1.29%),具体化合物的匹配度与相对百分含量信息见表2。
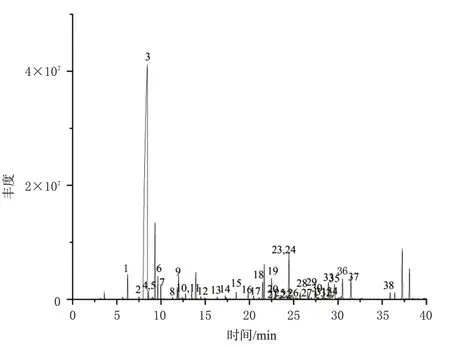
图1 秃叶黄檗果实挥发油的GC-MS总离子流图
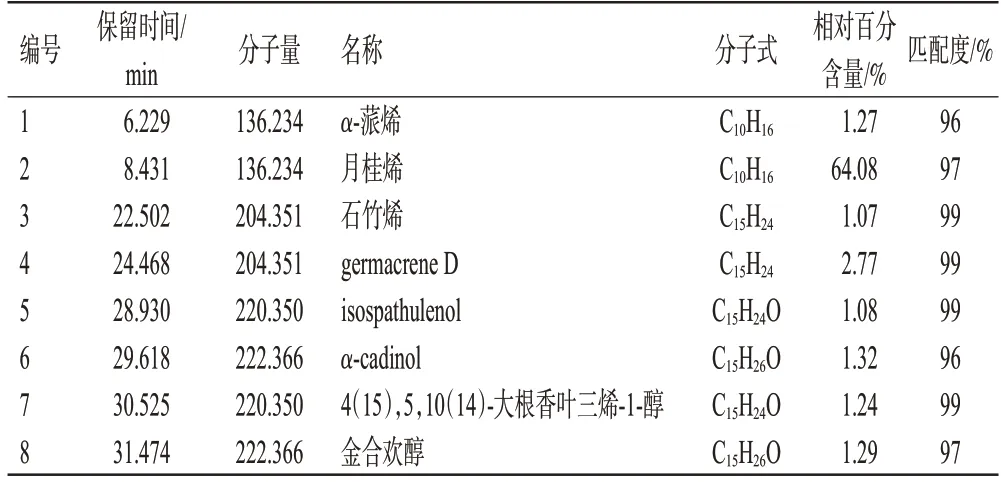
表2 秃叶黄檗果实主要挥发油成分及其相对百分含量
2.4 秃叶黄檗果实非挥发油的UPLC-Q-Orbitrap HRMS成分分析
2.4.1 色谱条件
采用Thermo Acclaim RSLC 120 C18色谱柱(100 mm×3 mm×2.2 μm),以0.1%甲酸溶液(A)-0.1%甲酸乙腈溶液(B)为流动相进行梯度洗脱(0~5 min,5%B→8%B;5~12 min,8%B;12~13 min,8%B→10%B;13~17 min,10%B;17~25 min,10%B→15%B;25~28 min,15%B→22%B;28~32 min,22%B→25%B;32~35 min,25%B;35~42 min,25%B→28%B;42~48 min,28%B→30%B;48~52 min,30%B→55%B;52~63 min,55%B→100%B);流速为0.2 mL/min;柱温为35 ℃;进样量为2 μL。
2.4.2 质谱条件
采用电喷雾离子源,在正、负离子模式下检测。喷雾电压为3.5 kV;辅助气温度为350 ℃;辅助气流速为10 arb;鞘气流速为35 arb;离子传输管温度为320 ℃。扫描模式为全扫描/数据依赖二级扫描(Full MS/dd-MS2),一级分辨率为70 000,二级分辨率为17 500;扫描范围为m/z100~1 500;阶梯碰撞能量为20、40、60 eV。
2.4.3 对照品溶液的制备
取甜菜碱、葫芦巴碱、熊果苷、红景天苷、秦皮甲素、绿原酸、黄柏碱、槲皮素、山柰酚、延胡索乙素、小檗红碱、药根碱、巴马汀、小檗碱、木犀草素、吴茱萸碱、柠檬苦素和黄柏酮对照品各适量,置于同一容量瓶中,加入甲醇配制成各成分质量浓度均约为100 μg/mL 的混合对照品溶液,混匀,用0.22 μm微孔滤膜过滤,即得。
2.4.4 UPLC-MS分析供试品溶液的制备
精密称取秃叶黄檗果实粉末1.0 g,置于50 mL锥形瓶中,加入30 mL 甲醇,超声(功率45 kHz,频率250 W)处理30 min,过滤,滤液旋转蒸干,加入适量甲醇溶解后,置于10 mL容量瓶中并以甲醇定容,以0.22 μm微孔滤膜过滤,即得。
2.4.5 数据处理及结果
将采集得到的原始数据导入Compound Discoverer 3.0软件,通过其向导设置及方法模板,建立未知化合物的鉴定流程,对原始数据进行峰对齐和峰提取。通过提取得到的分子离子色谱峰、同位素峰拟合出可能的分子式,并将二级碎片实测谱图与mzCloud网络数据库及本地中药成分数据库OTCML 进行匹配,对匹配结果设置过滤参数为:峰面积阈值80 000,一级及二级质量偏差5 ppm,匹配度分值高于80。对过滤后的离子与数据库中的化合物信息及对照品进行比对,结合相关文献和在线数据库(PubChem)对化学成分进行进一步的分析鉴定。结果,通过UPLC-Q-Orbitrap HRMS技术,共从秃叶黄檗果实中鉴定出69个化合物,包括酚酸类化合物16个、生物碱类化合物13个、黄酮类化合物10个、氨基酸类化合物7个、核苷类化合物5个、香豆素类化合物3个、三萜类化合物3个、其他类化合物12个,其中18个化合物经过对照品比对确认。在正、负离子检测模式下,秃叶黄檗果实供试品及混合对照品UPLC-Q-Orbitrap HRMS的总离子流图见图2,具体化合物信息见表3。
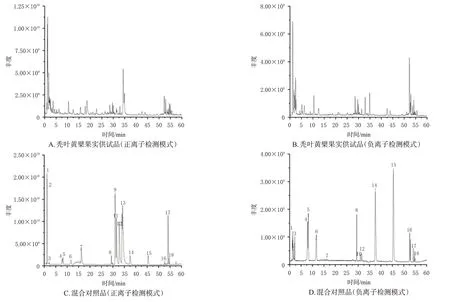
图2 秃叶黄檗果实与混合对照品UPLC-Q-Orbitrap HRMS的总离子流图

表3 秃叶黄檗果实非挥发性化学成分分析结果
2.5 网络药理实验筛选秃叶黄檗果实祛痰止咳的活性成分及机制
2.5.1 活性成分的筛选
以口服生物利用度(oral bioavailability,OB)>30%和类药性(drug-likeness,DL)>0.18 为筛选条件对“2.3”和“2.4”项下所鉴定出的秃叶黄檗果实的化学成分进行活性筛选[10]。结果显示,满足筛选条件的化学成分共有10个,包括槲皮素、延胡索乙素、山柰酚、小檗红碱、药根碱、巴马汀、小檗碱、木犀草素、吴茱萸苦素、黄柏酮。此外,虽然所鉴定成分中α-蒎烯和月桂烯的DL 值略低于0.18,绿原酸的OB 值略低于30%,但据报道[6,11—12],三者均具有良好的祛痰止咳活性,故也纳入后续研究中。因此,共筛选获得13个活性成分。
2.5.2 潜在作用靶点预测
通过SwissTargetPrediction、TCMSP 和SuperPred 等数据库共获得活性成分的靶点681个,以“cough”和“expectoration”为关键词,通过GeneCards 数据库获得与咳嗽和咳痰相关的疾病靶点378个。在Venny2.1.0在线作图工具平台上获取两者交集靶点,即为潜在作用靶点,共57个。
2.5.3 蛋白互作网络构建和核心靶点获取
通过String 数据库对潜在作用靶点进行蛋白互作(protein-protein interaction,PPI)网络关系数据分析,使用Cytoscape 3.7.1 软件对数据结果进行可视化分析,选取连接度最大的5个节点作为核心作用靶点,结果见图3。图3中包含55个节点,节点的颜色由浅逐渐变深,而颜色越深表示节点的连接度越大;核心靶点为肿瘤坏死因子(tumor necrosis factor,TNF)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、丝氨酸/苏氨酸蛋白激酶(serine/threonine kinase proteins,AKT1)、Toll样受体4(Toll-like receptor 4,TLR4)。
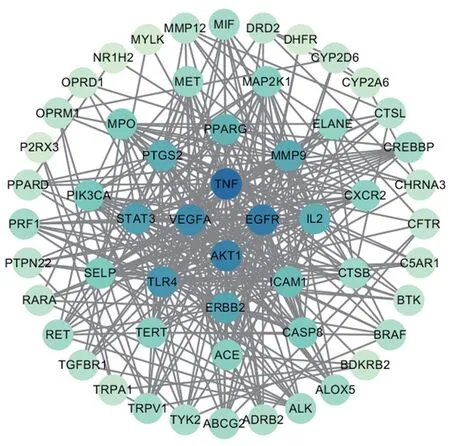
图3 秃叶黄檗果实祛痰止咳靶点的PPI网络图
2.5.4 通路富集分析
利用DAVID 网站对潜在作用靶点进行GO 富集分析和KEGG信号通路富集分析,以P<0.05进行筛选,共得到生物过程通路233 条、细胞组成通路35 条、分子功能通路49条,均选择其中P值排前10位的条目绘制GO富集分析条形图,见图4A。结果显示,GO 功能条目包括对脂多糖的反应、肽基丝氨酸磷酸化的正向调节、一氧化氮生物合成过程的积极调节等生物过程。同样选择P值排前10 位的KEGG 信号通路绘制KEGG 分析气泡图,结果见图4B。结果显示,KEGG 信号通路包括癌症、非小细胞肺癌、癌症中的蛋白聚糖等信号通路。
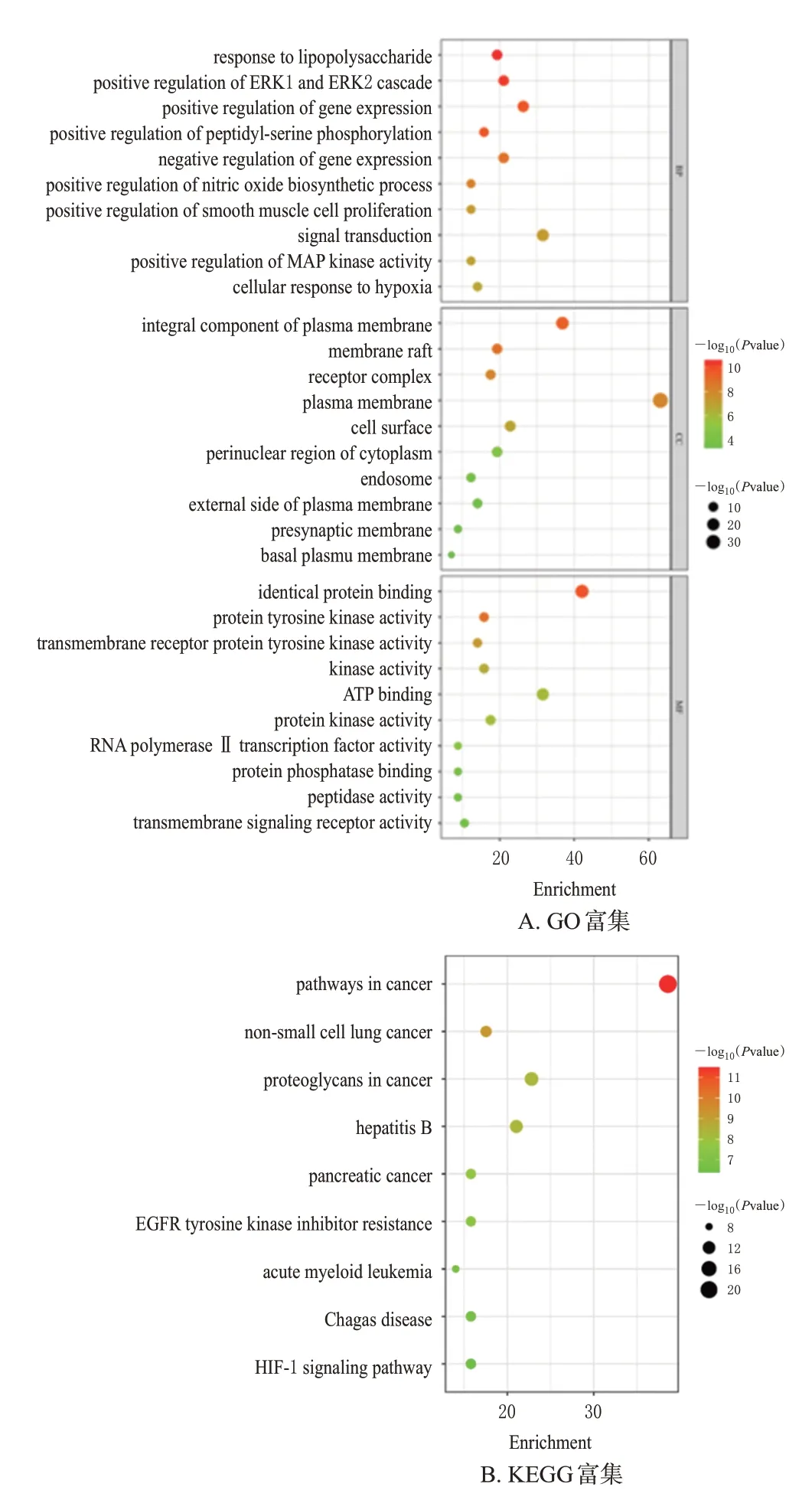
图4 秃叶黄檗果实祛痰止咳GO 富集分析条形图和KEGG富集分析气泡图
2.5.5 分子对接验证
使用AutoDock Tools 1.5.6 软件将“2.5.1”项下筛选获得的活性成分、镇咳阳性药物右美沙芬与“2.5.3”项下分析所得的5个核心作用靶点进行分子对接,结果见表4。一般认为,对接结合能≤-5.0 kcal/mol(1 cal=4.184 J),说明两者结合活性较好[13]。本研究中,除靶点VEGFA 与成分月桂烯和α-蒎烯的结合能略大于-5.0 kcal/mol 外,其他成分和靶点的结合能均不大于-5.0 kcal/mol,提示其均具有较好的结合能力。这说明所筛选的活性成分均有可能是秃叶黄檗果实祛痰止咳的物质基础成分。
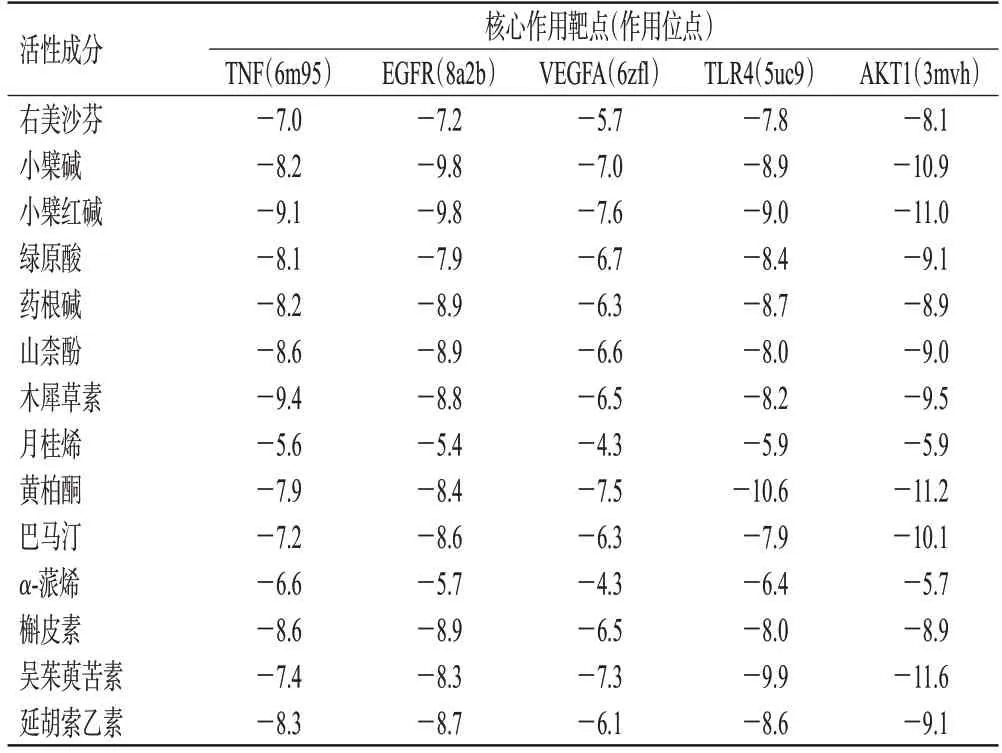
表4 右美沙芬、秃叶黄檗果实活性成分与核心靶点分子的对接结合能(kcal/mol)
3 讨论
据报道,黄檗果实水煎液祛痰止咳的治疗剂量以每日15 g为宜[5]。以成人体质量60 kg计,按照小鼠与人剂量的换算系数12.3计算,得到小鼠给药剂量约为3 g/kg。另有研究表明,灌胃给予小鼠0.2~0.8 g/kg 的黄檗果实挥发油对小鼠有明显的祛痰作用[6]。本研究参考黄檗果实的治疗剂量,将12、3 g/kg 和0.8、0.2 g/kg 分别作为水煎液和挥发油祛痰止咳的高、低治疗剂量。此外,氯化铵在药物祛痰实验研究中常被用作阳性对照药物;右美沙芬属于非成瘾性中枢镇咳药,主要通过抑制延髓咳嗽中枢而发挥镇咳作用,常被用作小鼠镇咳实验的阳性对照药物。故本研究选择右美沙芬和氯化铵作为阳性对照药物,其给药剂量参考文献[9]设置。本研究结果表明,秃叶黄檗果实水煎液和挥发油均具有明显的祛痰止咳作用,并呈明显的剂量依赖趋势。
晏晨等[14]研究发现,不同产地川黄檗果实的挥发油化学成分组成有较大差异。蒋太白等[8]研究表明,贵州产秃叶黄檗果实的挥发油主要成分为月桂烯(相对百分含量为66.9%)。本研究首次鉴定了四川产秃叶黄檗果实挥发油的化学成分组成,发现其主要成分同样为月桂烯(相对百分含量为64.08%),表明不同产地秃叶黄檗果实的挥发油化学成分组成具有良好的一致性。本研究首次采用UPLC-MS技术对秃叶黄檗果实非挥发性成分进行鉴定分析,共鉴定出酚酸类、生物碱类、黄酮类等69个化合物,进一步补充完善了其化学成分的研究。
笔者查阅所鉴定出的化合物的祛痰止咳活性研究报道后发现,α-蒎烯具有祛痰止咳的活性,是祛痰药桉柠蒎肠溶软胶囊的指标性成分之一[11]。据《中华本草》记载,黄檗果实挥发油镇咳作用的有效单体为月桂烯[7];绿原酸为返魂草、石韦等祛痰止咳中药的指标成分之一[12,15];木犀草素为石韦、筋骨草和三子养亲汤等祛痰止咳中药和方剂的指标成分之一[15—16];小檗碱为藏成药十味龙胆花颗粒的指标成分之一,适用于治疗慢性支气管炎[17]。且分子对接结果表明,上述成分与祛痰止咳核心靶点间均有较好的结合活性。因此,笔者推断α-蒎烯、月桂烯、绿原酸、木犀草素和小檗碱等成分可能为秃叶黄檗果实祛痰止咳的物质基础。
笔者利用网络药理学探究了秃叶黄檗果实祛痰止咳的作用机制,发现其核心作用靶点为TNF、EGFR、VEGFA、AKT1和TLR4。其中,TNF可诱导氧自由基的产生并导致组织损伤,还可以进一步激活核因子κB(nuclear factor kappa-B,NF-κB)通路中炎症介质的转录和表达,促进炎症的发生和发展[18]。TLR4 被激活后可通过一系列级联反应激活NF-κB,使其入核并结合促炎基因启动子,从而增强炎症基因表达,释放炎症细胞因子[19]。AKT在细胞生长、迁移、增殖、炎症和血管生成方面有重要作用,其亚型AKT1参与细胞的生长与存活,并在多种组织中表达[20]。咳嗽、咳痰是慢性支气管炎患者最典型的症状,现代医学认为慢性支气管炎是因感染或其他非感染因素引起的支气管及其周围组织的非特异性炎症。这说明,秃叶黄檗果实挥发油和水煎液可能主要通过缓解支气管及其周围组织的非特异性炎症从而达到祛痰止咳的作用。GO分析和KEGG富集分析结果表明,秃叶黄檗果实祛痰止咳的作用机制主要是通过影响脂多糖的反应、肽基丝氨酸磷酸化的正向调节、一氧化氮生物合成过程的积极调节等生物过程,调节癌症、非小细胞肺癌、癌症中的蛋白聚糖等信号通路。
综上所述,秃叶黄檗果实主要通过作用于TNF、EGFR、VEGFA、AKT1 和TLR4 等靶点及其显著富集的信号通路发挥祛痰止咳的作用,其物质基础可能为α-蒎烯、月桂烯、绿原酸、木犀草素和小檗碱等成分。但是,本研究仅对秃叶黄檗果实的化学成分作了GC-MS 和UPLC-MS 的定性分析,以及通过网络药理学分析了其祛痰止咳的物质基础,缺乏对物质基础化学成分的定量分析。本课题组后续将继续开展对物质基础成分的定量研究工作,为秃叶黄檗果实资源的进一步开发利用研究奠定理论基础。
