基于代谢组学探讨快松饮防治便秘的作用机制Δ
2023-09-14于小聪刘沈林王泽琨李丹婷赵毅萌陈亚军束雅春南京中医药大学附属医院药学部南京009南京中医药大学附属医院脾胃病科南京009南京市妇幼保健院检验科南京0004
于小聪 ,刘沈林 ,王泽琨 ,李丹婷 ,赵毅萌 ,陈 辰 ,陈亚军 ,束雅春 #(.南京中医药大学附属医院药学部,南京 009;.南京中医药大学附属医院脾胃病科,南京 009;.南京市妇幼保健院检验科,南京 0004)
便秘是一种影响患者健康和生活质量的常见慢性疾病,在人群中的发病率为2%~28%。随着年龄的增长,便秘的患病率明显升高,老年人群中有15%~20%为便秘患者,其中女性要多于男性[1—2]。长期的便秘不仅会造成患者生活质量下降,同时还会危害患者的身体健康,如诱发心脑血管疾病、引起胃肠功能紊乱、引起或加重直肠肛门疾病或结肠癌等[3—4]。化学药物针对便秘的治疗虽然可以有效缓解症状,但是从长期来看会引起很多副作用,产生药物依赖。而中医药治疗便秘已有上千年历史,近年来中医药治疗慢性功能性便秘的报道逐渐增多。循证医学研究证实,中医药在治疗功能性便秘方面安全、有效,能改善功能性便秘患者的临床症状,在总体疗效方面较化学药具有明显优势[5]。
快松饮(原麻仁通颗粒)由火麻仁、郁李仁、莱菔子、黑芝麻4味中药组方而成,是江苏省中医院全国名中医刘沈林教授在从医40 余年的经验中总结而得的用于治疗便秘的经验方。该方临床疗效确切,但成分与作用机制尚不清楚。代谢组学可以通过定性、定量方法分析生物体受外界刺激或扰动后体内所有代谢物的变化[6],这与中医药治疗疾病的“整体观”相符。本研究拟采用慢传输型便秘(slow transit constipation,STC)动物模型来研究快松饮改善便秘的效果,然后利用超高效液相色谱-飞行时间质谱(UPLC-Q-TOF-MS/MS)技术对大鼠血清、尿液进行代谢组学分析,探讨快松饮改善便秘的作用机制,为其后续研究提供科学的实验依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有:ExionLC 型UPLC 仪、QTof 5600+型高分辨质谱仪(美国AB SCIEX 公司),Heraeus Megafuge 8R 型高速冷冻离心机(美国Thermo Fisher Scientific 公司),CPA225D 型电子天平(德国Sartorius公司)等。
1.2 主要药品与试剂
本研究所用的主要药品与试剂有:快松饮(江阴天江药业有限公司,批号20210321,规格6 g/包),麻仁软胶囊(佛山手心制药有限公司,批号2101524,规格0.6 g/粒),复方地芬诺酯片(常州康普药业有限公司,批号2005020,规格为每克含盐酸地芬诺酯2.5 mg、硫酸阿托品0.025 mg);乙腈、甲醇均为质谱级,甲酸为分析级,水为屈臣氏蒸馏水。
1.3 实验动物
本研究所用动物有SPF 级ICR 雄性小鼠120 只(体重20~24 g)和SPF 级SD 雄性大鼠39 只(体重180~200 g),均由南通大学实验动物中心提供,动物生产许可证号为SCXK(苏)2019-0001。动物均于温度(22±4) ℃、相对湿度(55±15)%的条件下饲养。本动物实验经南京中医药大学附属医院实验动物伦理委员会批准后实施(批件号为2021DW-13-01)。
2 方法
2.1 小鼠药效实验
2.1.1 小鼠肠推进实验
将60 只小鼠随机分为空白组,模型组,阳性对照组(麻仁软胶囊0.64 g/kg,相当于10.6 倍临床等效剂量),快松饮低、中、高剂量组(3.2、6.4、12.8 g/kg,分别为2.7、5.3、10.6 倍临床等效剂量),每组10 只。空白组和模型组小鼠灌胃等体积水,各给药组小鼠灌胃相应药物(均以蒸馏水为溶剂配制药液);每天给药1 次,连续14 d。实验期间小鼠自由饮食、摄水,每周记录其体重。第14天灌胃结束后,各组小鼠禁食不禁水24 h。在第15 天,以墨汁为溶剂配制各组药液,空白组小鼠灌胃等体积水,其余各组小鼠均先灌胃复方地芬诺酯片(4 mg/kg,以水为溶剂)[7],建立STC 小鼠模型。30 min 后,各给药组小鼠再次灌胃相应药物(以墨汁为溶剂),模型组和空白组小鼠灌胃等体积墨汁。25 min 后立即脱颈椎处死小鼠,打开腹腔分离肠系膜,剪取上端自幽门下端至回盲部的肠管,置于托盘上,轻轻将小肠拉成直线,测量肠管长度并记为小肠总长度;从幽门至墨汁前沿的距离为墨汁推进长度。计算墨汁推进率:墨汁推进率(%)=墨汁推进长度(cm)/小肠总长度(cm)×100%。
2.1.2 小鼠排便实验
另取60 只小鼠按“2.1.1”项下方法分组、造模、给药和灌胃墨汁。每只小鼠单独放在笼内饲养,笼底放置1张白纸。从灌胃墨汁时开始计时,记录每只小鼠首次排便时间,并记录和观察小鼠5 h内的粪便质量和粪便数量。
2.2 大鼠代谢组学研究
2.2.1 分组、造模与给药
将39 只大鼠随机分为空白组、模型组、阳性对照组(麻仁软胶囊0.36 g/kg,相当于6 倍临床等效剂量)和快松饮低、高剂量组(快松饮2.4、4.8 g/kg,分别为3、6倍临床等效剂量)。空白组大鼠为7只,其余各组大鼠均为8只。适应性喂养3 d后,空白组大鼠灌胃水,其余各组大鼠灌胃复方地芬诺酯片(8 mg/kg,溶剂为水)建立STC模型[8],连续灌胃14 d。每天观察大鼠生活、毛发状态,第14天灌胃完成后,将大鼠放入代谢笼中收集其24 h粪便,记录粪便数量及质量。若空白组与模型组大鼠24 h粪便数量、质量差异均具有统计学意义则表明造模成功[8]。造模成功后,空白组大鼠继续灌胃水;其余各组大鼠均先灌胃复方地芬诺酯片(8 mg/kg),1 h 后模型组大鼠灌胃水,其余各给药组大鼠灌胃相应药物(以水为溶剂);每天灌胃水/药物1次,连续1周。实验期间让大鼠自由饮食、摄水,每周记录其体重。
2.2.2 生物样本收集及处理
末次灌胃后将大鼠放入代谢笼,第2 天收集其24 h尿液、粪便,分装放置于-80 ℃冰箱中储存备用。收集尿液和粪便后,空白组大鼠灌胃水;模型组大鼠灌胃复方地芬诺酯片;给药组大鼠先灌胃复方地芬诺酯片,1 h后灌胃相应药物。30 min后采集各组大鼠眼眶血,将血样于室温下放置1 h,以3 500 r/min 离心10 min,取上清液,再在4 ℃下以14 000 r/min离心10 min,收集上清液,分装,在-80 ℃冰箱中储存备用。
2.2.3 血清样品的制备
取-80 ℃冰箱中冻存的血清样本,室温解冻。取200 µL 解冻后的血清样本于2 mL 离心管中,加入600µL 乙腈,涡旋60 s,于4 ℃下以12 000 r/min 离心10 min,取上清液,转移至2 mL 离心管中,室温下氮吹至干。残渣加入100 µL乙腈复溶,于4 ℃下以12 000 r/min离心10 min,取上清液,待测。取上述39 只大鼠血清样本各40 μL于10 mL离心管中混合,加入4 680 µL乙腈,按血清样品的处理方式处理,室温下氮吹至干。残渣加入780 µL乙腈复溶,于4 ℃下以12 000 r/min离心10 min,取上清液,得到质量控制(quality control,QC)样本。
2.2.4 尿液样品的制备
取-80 ℃冰箱中的尿液样本,室温解冻。取400µL 解冻的尿液样本于2 mL 离心管中,加入1 200 µL 乙腈,涡旋60 s,于4 ℃下以12 000 r/min离心10 min,取上清液,转移至2 mL 离心管中,室温下氮吹至干;残渣加入300 µL 乙腈复溶,于4 ℃下以12 000 r/min 离心10 min,取上清液,待测。取上述39 只大鼠尿液样本各50 μL 于10 mL 离心管中混合,加入5 850 µL 乙腈,按上述尿液样品处理方式处理,室温下氮吹至干;残渣加入1 463 µL 乙腈复溶,于4 ℃下以12 000 r/min 离心10 min,取上清液,得到QC样本。
2.2.5 色谱与质谱条件
色谱条件:采用ACQUITY UPLC HSS T3 色谱柱(100 mm×2.1 mm,1.8 μm),以0.05%甲酸溶液(A)-乙腈(B)为流动相进行梯度洗脱(0~2 min,15%B→18%B;2~7 min,18%B→35%B;7~10 min,35%B→55%B;10~22 min,55%B→82%B;22~23 min,82%B→99%B;23~24 min,99%B;24~24.1 min,99%B→15%B;24.1~27 min,15%B);流速为0.3 mL/min;柱温为35 ℃;进样量为2 μL。
质谱条件:数据采集选用全扫描自动模式,离子源为电喷雾离子源(ESI),在正(ESI+)、负(ESI-)离子模式下扫描,扫描范围为质荷比(m/z)50~1 000。喷雾气压力为55 psi,辅助加热气压力为55 psi,气帘气压力为35 psi;温度为500 ℃;离子化电压为±4 500 V,去簇电压为50 eV(ESI+)、-60 eV(ESI-) eV;TOF-MS模式下设置碰撞电压为±10 eV;IDA-MS/MS 条件下设置碰撞电压为±35 eV,碰撞电压差为±15 eV。
2.2.6 数据处理
将采集所得代谢组学质谱原始数据通过Analysis Base File Converter软件转化为.abf格式的文件,随后通过MS-DAIL3.9软件以及SEERF平台(https://slfan2013.github.io/SERRF-online/)进行色谱峰对齐、峰过滤、归一化预处理,然后将数据导入SIMCA 14.1 软件进行偏最小二乘-判别分析(partial least squares discriminant analysis,PLS-DA)以及正交偏最小二乘-判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA),根据各样本聚集情况筛选离群样本。将筛选后的各组数据导入MetaboAnalyst 5.0 在线软件,当2 组代谢物差异倍数(fold change,FC)>1.2且P<0.05或FC<0.833 3且P<0.05 时,提示该代谢物可能为潜在的差异代谢物[6]。结合人类代谢组数据库(HMDB,https://hmdb.ca),将已鉴定的内源性差异代谢物利用MetaboAnalyst 5.0软件进行富集分析以及相关代谢通路分析。
2.3 统计学方法
采用SPSS 26.0 软件进行统计分析。实验结果以±s表示,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 小鼠药效学实验结果
3.1.1 小鼠肠推进实验结果
与空白组比较,模型组小鼠墨汁推进率显著降低(P<0.05);与模型组比较,阳性对照组和快松饮高剂量组小鼠墨汁推进率显著升高(P<0.05)。结果见表1。
表1 各组小鼠的肠推进实验结果(±s,n=10)
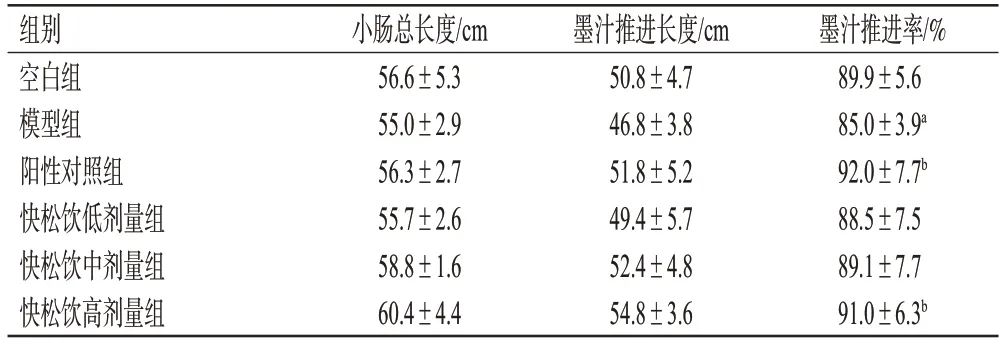
表1 各组小鼠的肠推进实验结果(±s,n=10)
a:与空白组比较,P<0.05;b:与模型组比较,P<0.05。
组别空白组模型组阳性对照组快松饮低剂量组快松饮中剂量组快松饮高剂量组墨汁推进率/%89.9±5.6 85.0±3.9a 92.0±7.7b 88.5±7.5 89.1±7.7 91.0±6.3b小肠总长度/cm 56.6±5.3 55.0±2.9 56.3±2.7 55.7±2.6 58.8±1.6 60.4±4.4墨汁推进长度/cm 50.8±4.7 46.8±3.8 51.8±5.2 49.4±5.7 52.4±4.8 54.8±3.6
3.1.2 小鼠排便实验结果
与空白组比较,模型组小鼠首次排便时间显著延长,5 h 内排便质量和排便数量均显著减少(P<0.01)。与模型组比较,阳性对照组和快松饮中、高剂量组小鼠的首次排便时间显著缩短(P<0.05 或P<0.01),5 h 内排便质量显著增加(P<0.01);阳性对照组和快松饮高剂量组小鼠5 h 内排便数量显著增加(P<0.05)。结果见表2。
表2 各组小鼠的排便实验结果(±s,n=10)

表2 各组小鼠的排便实验结果(±s,n=10)
a:与空白组比较,P<0.01;b:与模型组比较,P<0.01;c:与模型组比较,P<0.05。
组别空白组模型组阳性对照组快松饮低剂量组快松饮中剂量组快松饮高剂量组首次排便时间/min 77.5±16.5 147.4±14.0a 125.6±12.0b 132.4±26.8 128.4±21.1c 123.7±25.5c 5 h内排便质量/g 0.6±0.2 0.3±0.1a 0.5±0.1b 0.4±0.1 0.5±0.1b 0.5±0.1b 5 h内排便数量/粒18.9±3.9 13.8±3.4a 17.9±4.1 c 15.1±1.3 15.6±3.0 18.1±3.6 c
3.2 大鼠血清代谢组学分析结果
3.2.1 大鼠血清PLS-DA结果
大鼠血清PLS-DA分析图见图1。结果显示,QC样本在ESI+模式下聚集良好,表明该检测方法具有良好的稳定性与重复性,检测系统可靠。空白组散点与模型组散点分开,且快松饮高、低剂量组与模型组相比更趋于空白组,说明经过治疗后,大鼠的代谢紊乱趋于正常。
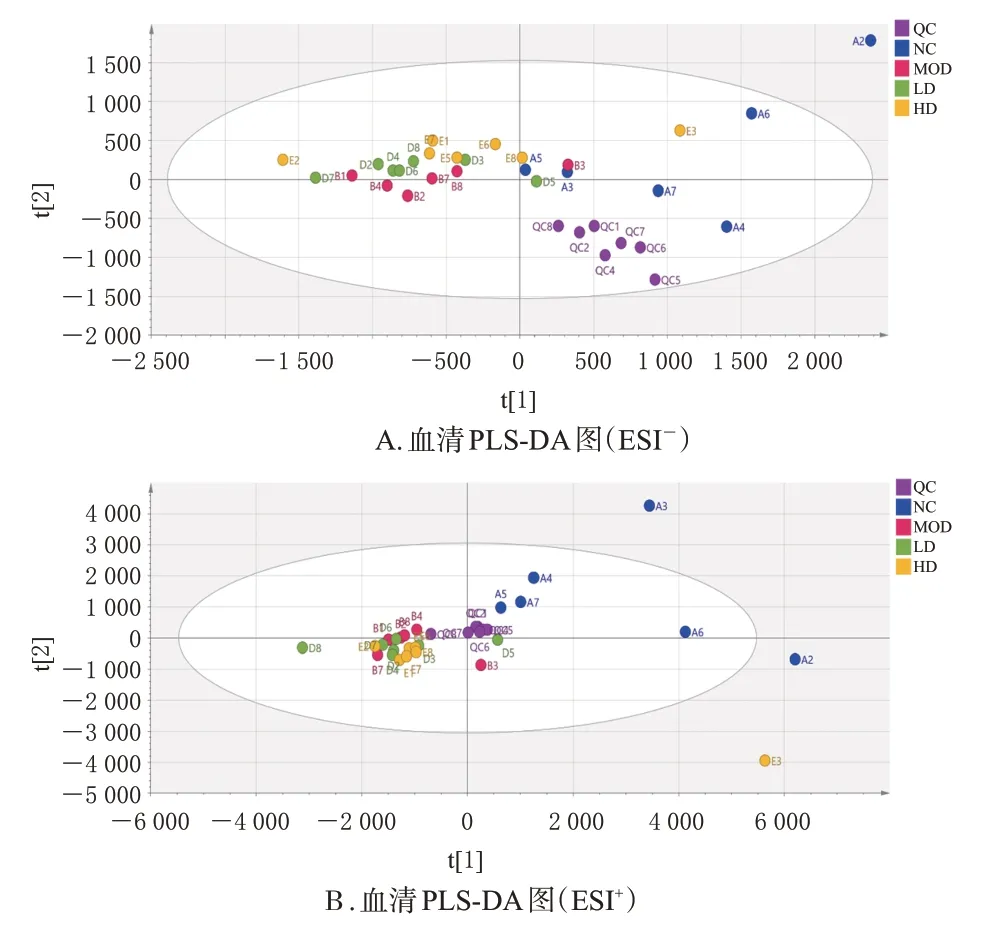
图1 不同检测离子模式下各组大鼠血清的PLS-DA图
3.2.2 血清差异代谢物筛选及通路富集分析结果
大鼠血清OPLS-DA 分析图见图2。结果显示,在ESI-模式下,模型组与空白组的R2X(表示所建模型对X矩阵的解释概率)、R2Y(表示所建模型对Y矩阵的解释概率)、Q2(表示模型的预测能力)分别为0.911、1.000、0.896,模型组与快松饮高剂量组的R2X、R2Y、Q2分别为0.878、1.000、0.785;在ESI+模式下,模型组与空白组的R2X、R2Y、Q2分别为0.777、0.978、0.757,模型组与快松饮高剂量组的R2X、R2Y、Q2分别为0.723、1.000、0.504。以FC>1.2 且P<0.05 或FC<0.8333 且P<0.05 为筛选条件,共鉴定出16个差异代谢物。与空白组比较,模型组大鼠血清中脯氨酸、环(L-脯氨酸-L-缬氨酸)、丙酰基肉碱等10 种差异代谢物的水平均显著下调(P<0.05),硬脂酰溶血性磷脂酰胆碱、琥珀酰二水杨酸、α-甲基间酪氨酸等6种代谢物的水平均显著上调(P<0.05);与模型组比较,快松饮高剂量组大鼠血清中上述差异代谢物的水平均显著回调(P<0.05)。结果见表3。
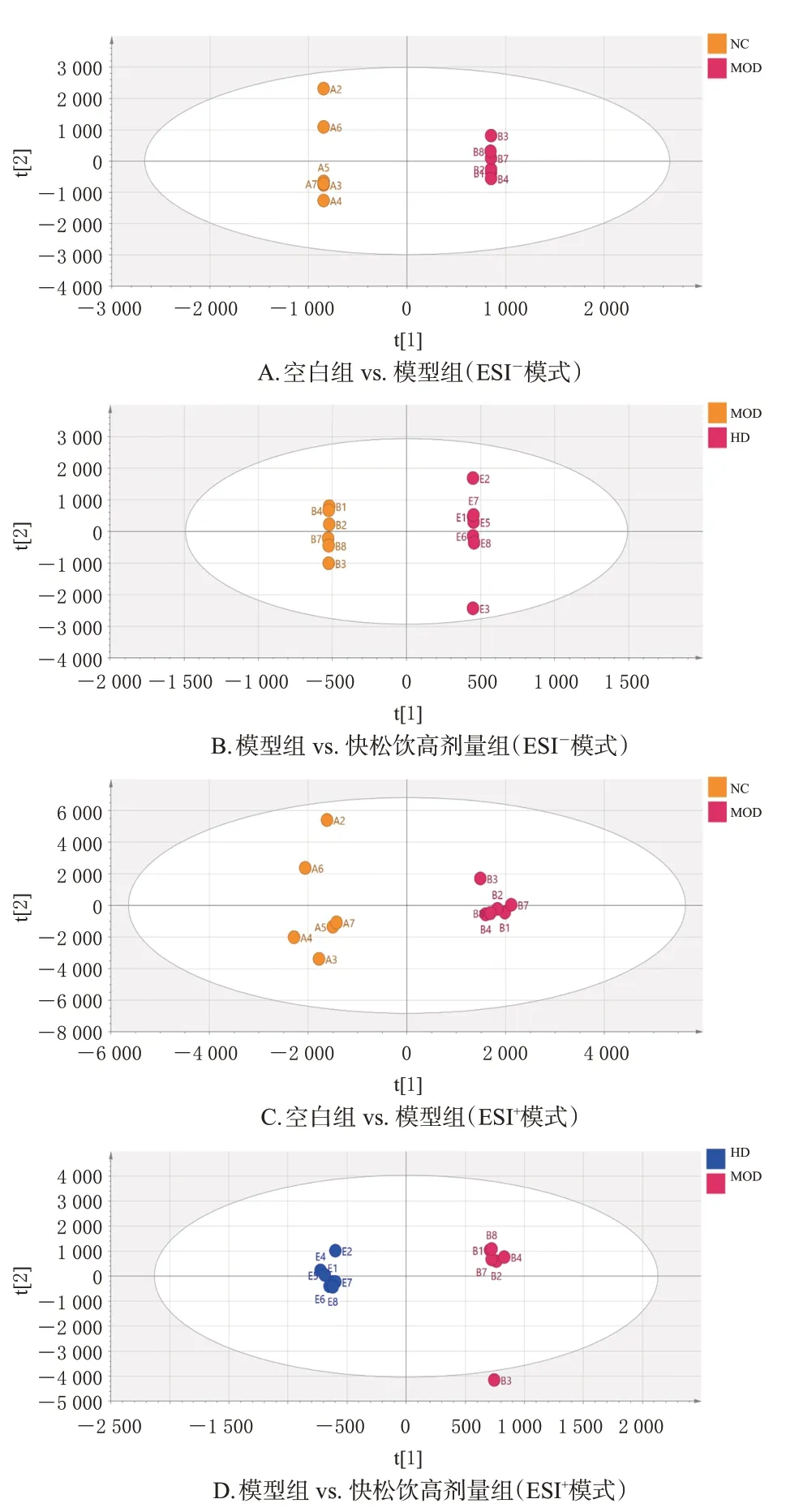
图2 不同离子模式下各组大鼠血清的OPLS-DA图
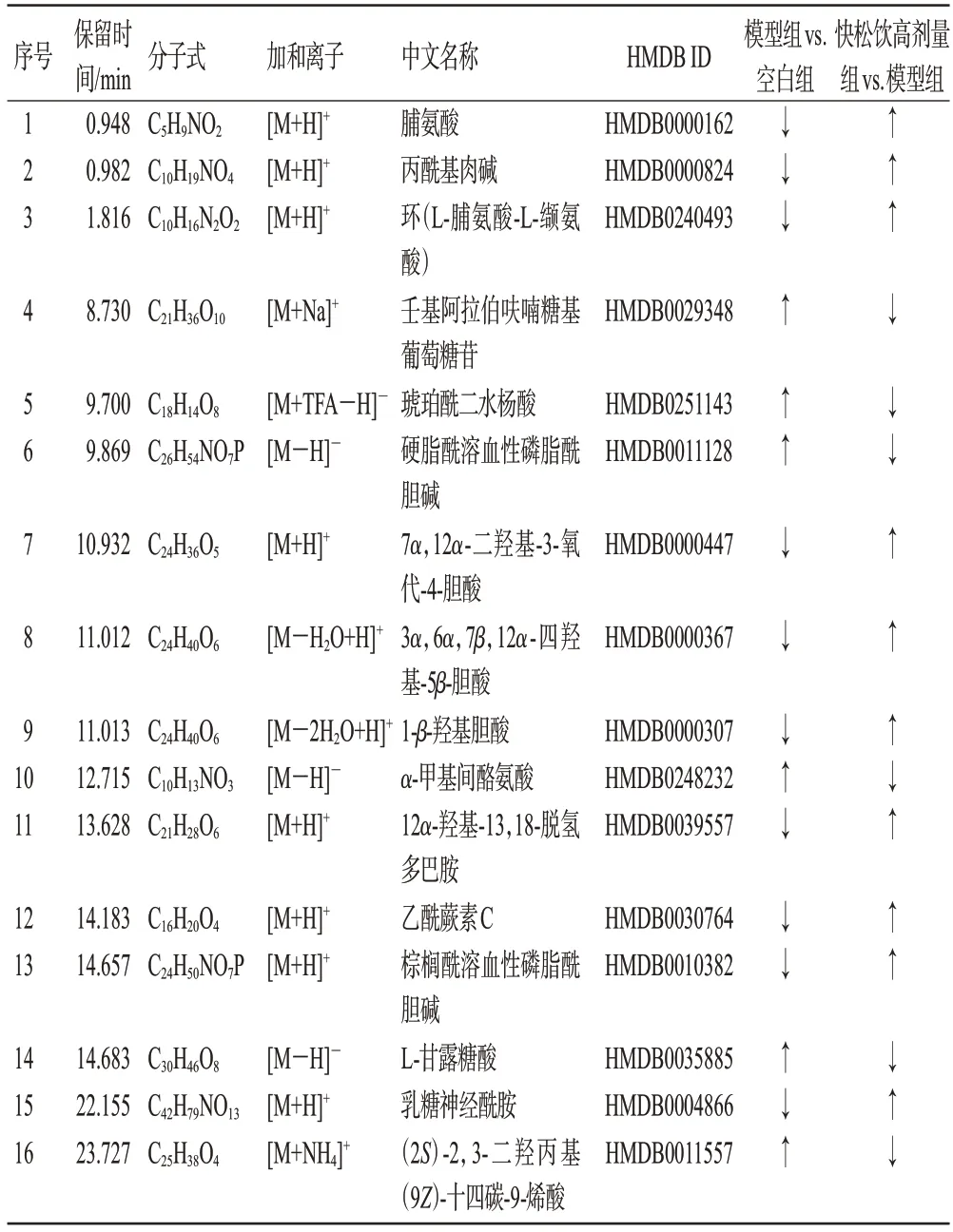
表3 大鼠血清内源性差异代谢物分析结果
将16 个差异代谢物的HMDB ID 导入MetaboAnalyst 5.0在线软件进行KEGG通路分析,共得到6条代谢通路,主要涉及鞘糖脂生物合成-球状和异球状系列、鞘糖脂生物合成-神经节系列、鞘磷脂代谢、精氨酸和脯氨酸代谢、鞘糖脂生物合成-乳糖和新内酯系列、氨酰-tRNA生物合成等生物途径。结果见图3。
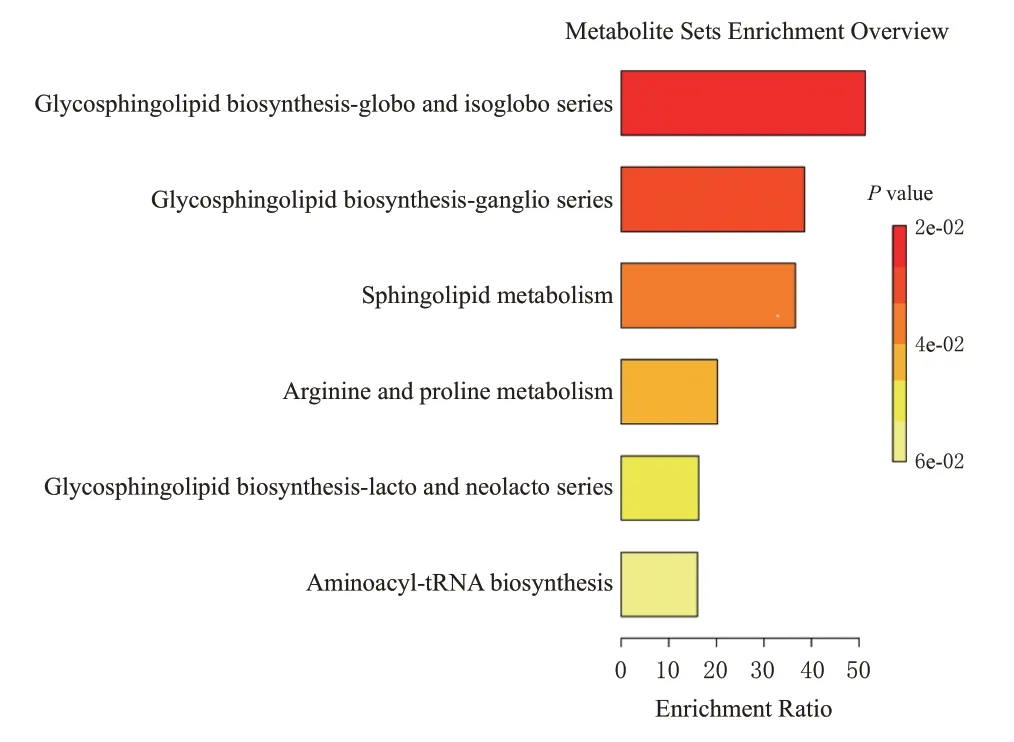
图3 大鼠血清中差异代谢物的通路富集分析图
3.3 大鼠尿液代谢组学分析结果
3.3.1 大鼠尿液PLS-DA结果
大鼠尿液PLS-DA 结果见图4。结果显示,空白组和模型组的散点区域与各给药组的散点区域分开,且给药组的散点位于空白组与模型组之间,快松饮高、低剂量组与模型组相比更靠近空白组,说明经过治疗后,大鼠紊乱的代谢已趋于正常。

图4 不同检测离子模式下各组大鼠尿液的PLS-DA图
3.3.2 尿液差异代谢物筛选及通路富集分析
大鼠尿液OPLS-DA图见图5。结果显示,在ESI-模式下,空白组与模型组的R2X、R2Y、Q2分别为0.580、0.994、0.627,模型组与快松饮高剂量组的R2X、R2Y及Q2分别为0.726、1.000、0.712;在ESI+模式下,空白组与模型组的R2X、R2Y、Q2分别为0.689、0.994、0.621,模型组与快松饮高剂量组的R2X、R2Y、Q2分别为0.851、1.000、0.942。以FC>1.2 且P<0.05 或FC<0.833 3 且P<0.05为筛选条件,共鉴定出 20 个差异代谢物。与空白组比较,模型组大鼠尿液中硬脂酰磷脂酰胆碱、N-羧甲基天冬氨酸、硬脂酸等5 种差异代谢物的水平均显著下调(P<0.05),L-缬氨酸、黄嘌呤酸、前列腺素A2等15 种差异代谢物的水平均显著上调(P<0.05);与模型组比较,快松饮高剂量组大鼠尿液中20 种差异代谢物的水平均显著回调(P<0.05)。结果见表4。
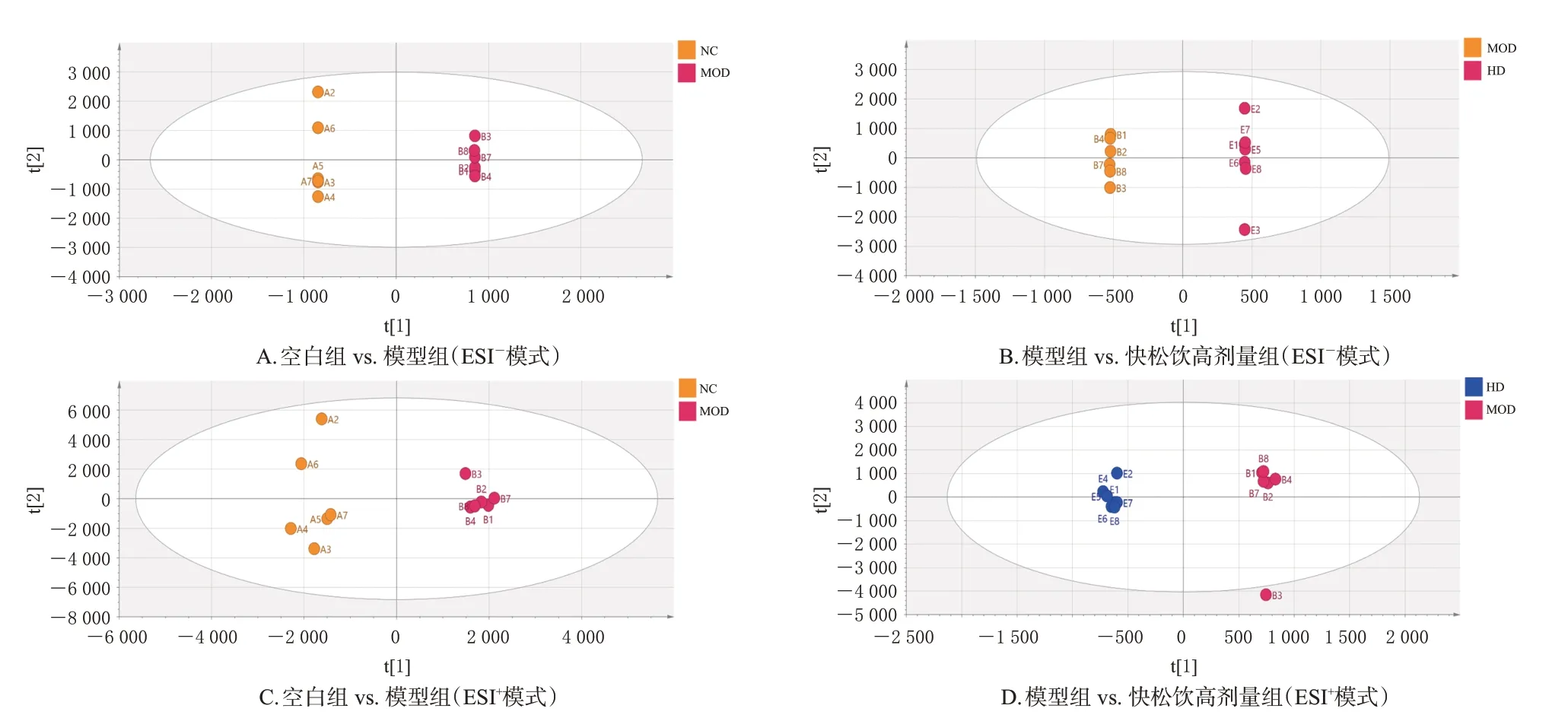
图5 不同离子模式下各组大鼠尿液的OPLS-DA图
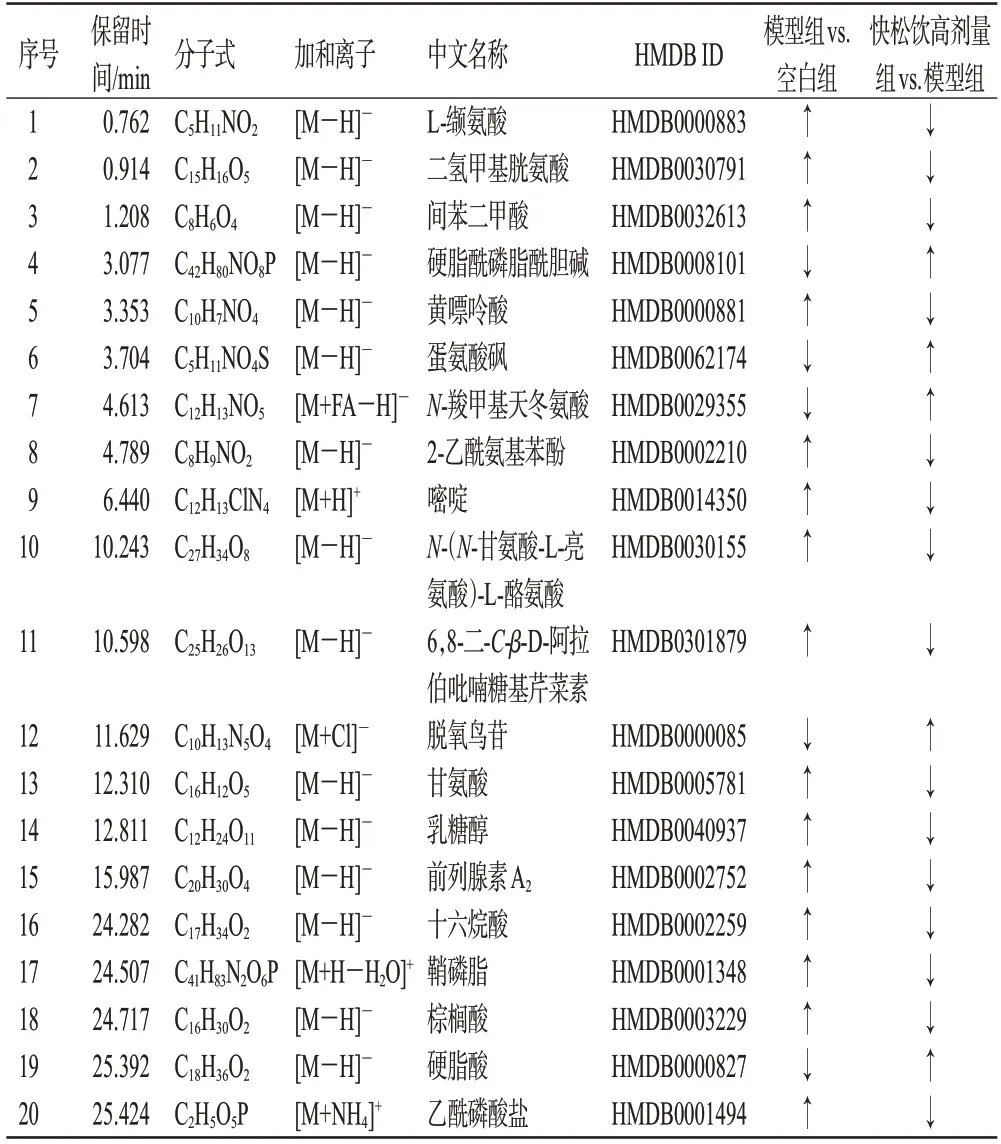
表4 大鼠尿液中内源性差异代谢产物分析结果
将20 个差异代谢物的HMDB ID 导入MetaboAnalyst 5.0 在线软件进行KEGG 通路分析,共得到8 条代谢通路,代谢途径主要涉及缬氨酸、亮氨酸和异亮氨酸生物合成,泛酸盐和辅酶A 生物合成,不饱和脂肪酸生物合成,鞘磷脂代谢,丙酮酸代谢等。结果见图6。
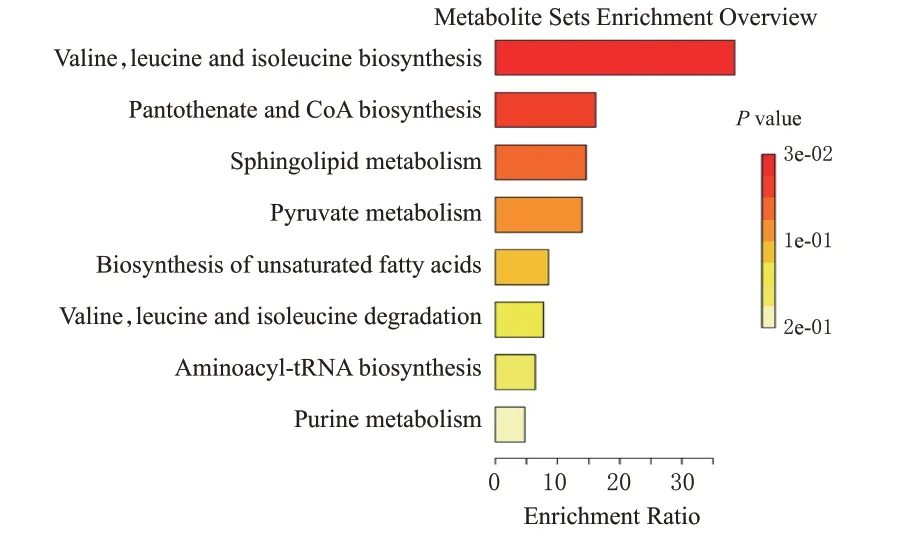
图6 大鼠尿液中差异代谢物的通路富集分析图
4 讨论
便秘在中医理论中属于“便秘”“脾约”“秘结”等范畴,《黄帝内经》最早提出“大便难”“不便”,也有文献提出“燥结”“脾约”“后不利”等[9—10]。中医基础理论认为,便秘的基本病机为气滞、寒凝、热结、气血阴阳亏虚;发病关键为大肠传导功能失常;病位在肠,与肝、肾、脾、胃、肺等脏腑有关[11—12]。快松饮由火麻仁、郁李仁、黑芝麻、莱菔子等药材加工而成。其中,火麻仁为君药,其质润而甘平,具有润燥滑肠之效,为老人、虚人、产后所致津亏血虚常用药;郁李仁为臣药,其味辛甘苦而性平,入脾、大肠、小肠经,主治肠燥便秘;莱菔子辛甘平,归肺、脾、胃经,为消食除胀、脘腹胀痛、大便秘结之要药;黑芝麻味甘,性平,归肝、肾、大肠经,具有益血润肠、通便的功效,常用于头晕眼花、肠燥便秘。以上4味中药合用,共奏润肠燥、益精血、补肝肾之效。在小鼠肠推进实验和小鼠排便实验中,快松饮高剂量组小鼠的墨汁推进率和排便情况均模型组明显改善,表明快松饮可以明显改善STC模型小鼠的便秘情况。
本研究通过对STC 模型大鼠的血清和尿液样本进行代谢轮廓描述,通过代谢物及代谢通路分析,发现了36种差异代谢物和14条代谢通路。L-缬氨酸是一种支链氨基酸,血清中支链氨基酸浓度的升高会激活核因子κB(nuclear factor-κB,NF-κB)通路,促进氧化应激与炎症发生,加重便秘程度[13]。硬脂酰磷脂酰胆碱和硬脂酰溶血性磷脂酰胆碱均为内源性脂质分子,有研究表明,二者与炎症相关:肠黏液中硬脂酰磷脂酰胆碱含量降低会导致黏液屏障被打破,细菌入侵,造成肠道炎症发生[14];硬脂酰磷脂酰胆碱可减少肿瘤坏死因子的分泌,从而抑制肿瘤坏死因子诱导的促炎因子上调[15]。在炎症条件下,硬脂酰磷脂酰胆碱能够被磷脂酶A2水解为硬脂酰溶血性磷脂酰胆碱,因此硬脂酰溶血性磷脂酰胆碱可以被看作一种便秘炎症的生物标志物[16]。便秘的发生常常伴随着肠道炎症的发生,前列腺素A2作为炎症因子,其水平在模型组大鼠尿液中上调可以侧面印证这一点[17]。结合血清和尿液2 种代谢组学结果来看,造模后大鼠有炎症发生,模型组大鼠尿液中硬脂酰磷脂酰胆碱较空白组显著下调,血清中硬脂酰溶血性磷脂酰胆碱较空白组显著上调;经快松饮治疗后,大鼠的炎症减轻,尿液中硬脂酰磷脂酰胆碱和血清中硬脂酰溶血性磷脂酰胆碱水平均显著回调。
血清和尿液代谢组学通路富集涉及了精氨酸、脯氨酸代谢途径和异亮氨酸、缬氨酸代谢途径等多种氨基酸的代谢途径。氨基酸不仅可以改善肠道屏障功能和抗炎细胞因子相关蛋白的表达,还可以减少氧化应激和肠道细胞凋亡以及肠道炎症中促炎细胞因子的表达。精氨酸利用分子氧在内皮一氧化氮合酶的作用下合成一氧化氮,而一氧化氮是胃肠道非肾上腺素能非胆碱能神经末梢的抑制性递质,可产生抑制性连接电位,从而抑制胃肠动力[18]。鞘磷脂主要来源于饮食和脱落的肠黏膜细胞,当便秘发生时,大便集结在肠道中,排便困难,严重时会加重肠黏膜脱落,故而模型组大鼠尿液中的鞘磷脂水平上调。
综上所述,本研究运用代谢组学技术明确了快松饮可通过回调硬脂酰溶血性磷脂酰胆碱、硬脂酰磷脂酰胆碱、前列腺素A2、L-缬氨酸、脯氨酸等差异代谢物以及调节多种氨基酸代谢途径、鞘磷脂代谢通路等来发挥改善便秘的作用。
