灯盏花乙素调节cGAS/STING 信号通路对创伤性脑损伤大鼠神经炎症的影响Δ
2023-09-14宋明明魏志玄王海均南阳医学高等专科学校第一附属医院神经外科河南南阳47000南阳医学高等专科学校第三附属医院神经外科河南南阳47007华中科技大学协和医院神经外科武汉400
宋 宇 ,宋明明 ,魏志玄 ,王海均 (.南阳医学高等专科学校第一附属医院神经外科,河南 南阳 47000;.南阳医学高等专科学校第三附属医院神经外科,河南 南阳 47007;.华中科技大学协和医院神经外科,武汉 400)
创伤性脑损伤(traumatic brain injury,TBI)作为一种由外部机械力引起的获得性脑损伤,可导致神经损伤、行为改变和认知功能下降,严重影响患者生活质量,且由于其高发病率和长期后遗症,给患者家庭和社会带来了沉重的医疗和经济负担[1]。尽管TBI引发的暂时性或永久性损伤的治疗策略已取得了一定进展,但目前TBI 的有效治疗仍面临巨大挑战[2],仍需探索其发生发展的分子机制,从而开发更有效的治疗方案。研究显示,TBI后会发生急性、强烈的炎症级联反应,其特征是小胶质细胞激活、外周免疫细胞迁移和募集、炎症介质释放等,且这些炎症介质会诱导继发性细胞死亡并阻碍神经功能恢复,故控制TBI后炎症反应被认为是一种很有前途的治疗方法[3—4]。
环鸟苷酸-腺苷酸合成酶(cyclic guanylate-adenylate synthase,cGAS)/干扰素基因刺激蛋白(stimulator of interferon genes,STING)信号通路是先天免疫系统中重要的模式识别及效应通路之一,能够识别存在于细胞质的异常DNA 分子,进而诱导Ⅰ型干扰素(interferon typeⅠ,IFN-Ⅰ)和其他炎症因子表达[5]。据报道,cGAS/STING信号通路作为IFN-Ⅰ反应的关键诱导因素,与多种神经退行性疾病中的神经炎症密切相关,且该通路激活后还会参与TBI后神经细胞死亡和功能障碍[6—7]。
灯盏花乙素(scutellarin,Scu)是一种从黄芩、灯盏花和半枝莲中提取的黄酮类化合物,具有抗炎、抗氧化和神经保护等多种药理作用[8—9]。已有研究表明,Scu通过抑制丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/核因子κB(nuclear factor-κB,NF-κB)通路抑制氧化应激和炎症反应,从而减轻脑缺血/再灌注大鼠的脑损伤[10]。但Scu对TBI后神经炎症的影响及其机制尚不清楚。据此,本研究构建了TBI 大鼠模型,着重观察了Scu 对TBI 大鼠神经炎症的影响以及cGAS/STING信号通路在此过程中的变化,以期为TBI治疗方法及相关机制的阐明提供新思路。
1 材料
1.1 主要仪器
本研究所用主要仪器有:SA-100型大鼠脑立体定位仪(上海玉研科学仪器有限公司)、DM IL LED型荧光显微镜(德国Leica公司)、SpectraMax iD3型多功能酶标仪[美谷分子仪器(上海)有限公司]。
1.2 主要药品与试剂
本研究所用的主要药品与试剂有:Scu 对照品、cGAS抑制剂RU.521(美国MedChemExpress公司,批号分别为HY-N0751、HY-114180,纯度均不低于98.56%);苏木素-伊红(hematoxylin-eosin,HE)染色试剂盒(北京索莱宝科技有限公司,批号20196537);原位末端标记(TdT-mediated dUTP nick-end labeling,TUNEL)细胞凋亡检测试剂盒(上海弗元生物科技有限公司,批号19273185);β 干扰素(interferon-β,IFN-β)、CXC 趋化因子配体10(CXC chemokine ligand-10,CXCL10)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)酶联免疫吸附检测(enzyme-linked immunosorbent assay,ELISA)试剂盒(上海酶研生物科技有限公司,批号分别为21071196、22551682、22670618、21348216);cGAS兔多克隆抗体(美国Invitrogen 公司,批号PA5-121188);STING、甘油醛-3-磷酸脱氢酶(GAPDH)兔单克隆抗体及辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)二抗(英国Abcam公司,批号分别为ab227704、ab181602、ab205718)。
1.3 动物
本研究所用动物为SPF级健康雄性SD大鼠,共124只,7~8周龄,体重240~280 g,购自湖北省实验动物研究中心,动物生产许可证号为SCXK(鄂)2020-0018。所有大鼠均在温度23~24 ℃、光照12 h/黑暗12 h、相对湿度50%~60%的环境中适应性饲养1 周后开展后续实验,饲养期间自由进食和饮水。本研究动物实验符合《实验动物护理和使用指南》中相关要求,并通过了南阳医学高等专科学校第一附属医院医学伦理委员会批准(伦理审查批号2022-6-7-2)。
2 方法
2.1 TBI动物模型构建、分组与给药
造模前大鼠禁食不禁水12 h。随机抽取24 只大鼠作为假手术组,其余100 只均采用改良Feeney 法构建TBI模型[11]:腹腔注射2%戊巴比妥钠(50 mg/kg)麻醉大鼠,将其呈俯卧位固定于脑立体定位仪上,以75%乙醇消毒头皮后沿脑正中线左侧切开,暴露左顶骨,于冠状缝后3 mm、矢状缝左3 mm处开一直径约5 mm的骨窗,并注意保持硬脑膜完整性;20 g 重锤从25 cm 高度自由落下,撞击硬脑膜,致大鼠左侧顶叶大脑皮质局灶性损伤,止血后以碘伏清洗,缝合头皮。假手术组大鼠仅开骨窗,不进行撞击,其余操作同造模大鼠。若大鼠出现短暂的呼吸暂停、四肢抽搐且昏迷2 h以上,则视为TBI模型构建成功[12]。选取造模成功的大鼠96只,采用随机数字表法分为TBI 组,Scu 低、高剂量组,cGAS 抑制剂组,每组24只。分组完成后,Scu低、高剂量组大鼠立即分别腹腔注射40、80 mg/kg Scu[以二甲基亚砜(DMSO)溶解后再以生理盐水稀释][10],并鼻内滴注等量的DMSO和生理盐水;cGAS 抑制剂组大鼠鼻内滴注450 μg/kg RU.521(以DMSO溶解后再以生理盐水稀释)[13],并腹腔注射等量DMSO和生理盐水;假手术组和TBI组大鼠均分别腹腔注射和鼻内滴注等量DMSO和生理盐水;每隔24 h给药1次,共给药4次(包括造模当天的给药)。
2.2 大鼠神经功能评估
采用改良神经功能缺损评分(modified neurological severity scores,mNSS)法进行评估。在第2、3 次和末次给药2 h 后(即给药1、2、3 d),采用mNSS 法评估所有大鼠的神经功能(包括运动、反射、感觉和平衡功能4个项目),0、1~6、7~12、13~18 分分别表示无、轻度、中度、重度神经功能障碍[14]。
2.3 大鼠脑含水量测定
采用干/湿比重法测定。末次mNSS 评分结束后每组随机抽取6只大鼠,麻醉后断头取脑,使用电子分析天平立即称定脑组织重量(即湿重),随后放入100 ℃烤箱中烘烤72 h,在此期间多次称重,直至恒重(即干重)。计算脑含水量:脑含水量(%)=(湿重-干重)/湿重×100%。
2.4 大鼠脑组织病理学变化观察
采用HE染色法进行观察。每组另随机抽取6只大鼠,麻醉后断头取脑,将左侧损伤部位脑组织使用4%多聚甲醛固定24 h后脱水、透明、石蜡包埋和常规切片(厚度4 µm)。切片脱蜡至水后依次进行苏木素、伊红染色,脱水、透明、封片后使用光学显微镜观察脑组织病理学变化并拍照。
2.5 大鼠脑组织细胞凋亡观察
采用TUNEL染色法进行观察。取“2.4”项下脑组织石蜡切片,参照TUNEL细胞凋亡检测试剂盒说明书,依次采用TUNEL 反应混合液、DAPI 染色,封片后使用荧光显微镜观察并拍照。TUNEL 染色阳性细胞(即凋亡细胞)的核呈绿色荧光。每张切片中随机取6个视野,使用Image J 图像分析软件计数凋亡细胞和总细胞(结果取平均值),并计算脑组织细胞凋亡率:脑组织细胞凋亡率(%)=凋亡细胞数/总细胞数×100%。
2.6 大鼠脑组织中炎症因子含量测定
每组另随机抽取6 只大鼠,麻醉后断头取脑,采用ELISA法检测大鼠脑组织中炎症因子(IFN-β、CXCL10、TNF-α、IL-6)含量,具体操作参照相应试剂盒说明书进行。检测仪器为酶标仪(波长450 nm)。
2.7 大鼠脑组织中cGAS、STING蛋白表达测定
采用Western blot 法进行检测。将每组剩余的6 只大鼠麻醉后断头取脑,将左侧损伤部位脑组织使用RIPA裂解液裂解,提取组织中总蛋白,测定蛋白浓度后进行变性,然后通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳进行分离,接着将分离的蛋白转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,以5%脱脂奶粉室温封闭1 h;加入cGAS、STING、GAPDH(内参)一抗(稀释比例分别为1∶1 000、1∶400、1∶10 000),4 ℃孵育过夜;次日洗涤后加入HRP 标记的山羊抗兔IgG 二抗(稀释比例为1∶20 000),室温孵育1.5 h;化学发光试剂(ECL)显色。扫描图像后用Image J1.8.0 软件分析蛋白条带灰度,以目的蛋白条带灰度值与内参(GAPDH)蛋白条带灰度值的比值表示目的蛋白的相对表达水平。
2.8 统计学方法
实验数据应用SPSS 25.0软件进行统计分析。符合正态分布的数据以±s表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验。检验水准α=0.05。
3 结果
3.1 大鼠神经功能评估结果
给药1、2、3 d 时,与假手术组比较,TBI 组大鼠mNSS 显著升高(P<0.05);与TBI 组比较,Scu 低、高剂量组和cGAS 抑制剂组大鼠mNSS 均显著降低(P<0.05);与Scu 低剂量组比较,Scu 高剂量组和cGAS 抑制剂组大鼠mNSS 均显著降低(P<0.05);Scu 高剂量组和cGAS 抑制剂组大鼠mNSS 比较,差异无统计学意义(P>0.05)。结果见表1。
表1 给药不同时间后各组大鼠的mNSS 结果(±s,n=24,分)
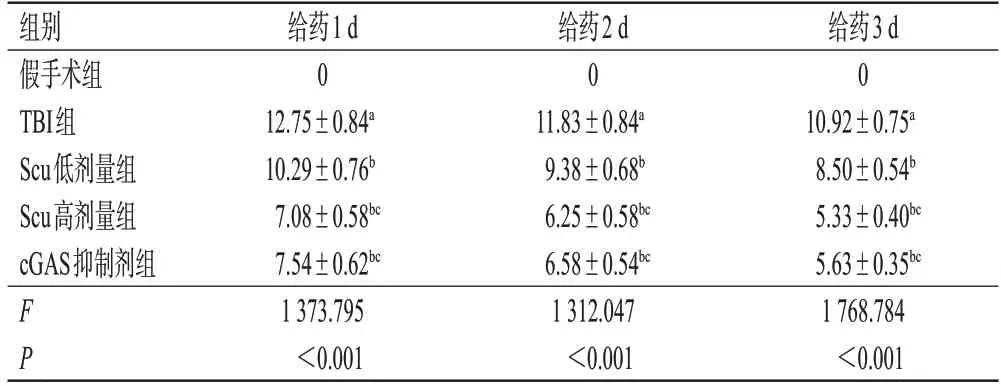
表1 给药不同时间后各组大鼠的mNSS 结果(±s,n=24,分)
a:与假手术组比较,P<0.05;b:与TBI组比较,P<0.05;c:与Scu低剂量组比较,P<0.05。
给药3 d 0 10.92±0.75a 8.50±0.54b 5.33±0.40bc 5.63±0.35bc 1 768.784<0.001组别假手术组TBI组Scu低剂量组Scu高剂量组cGAS抑制剂组F P给药1 d 0 12.75±0.84a 10.29±0.76b 7.08±0.58bc 7.54±0.62bc 1 373.795<0.001给药2 d 0 11.83±0.84a 9.38±0.68b 6.25±0.58bc 6.58±0.54bc 1 312.047<0.001
3.2 大鼠脑含水量测定结果
与假手术组比较,TBI 组大鼠脑含水量显著升高(P<0.05);与TBI组比较,Scu低、高剂量组和cGAS抑制剂组大鼠脑含水量显著降低(P<0.05);与Scu低剂量组比较,Scu 高剂量组和cGAS 抑制剂组大鼠脑含水量显著降低(P<0.05);Scu高剂量组和cGAS抑制剂组大鼠脑含水量比较,差异无统计学意义(P>0.05)。结果见表2。
表2 各组大鼠脑含水量和脑组织细胞凋亡率测定结果(±s,n=6,%)
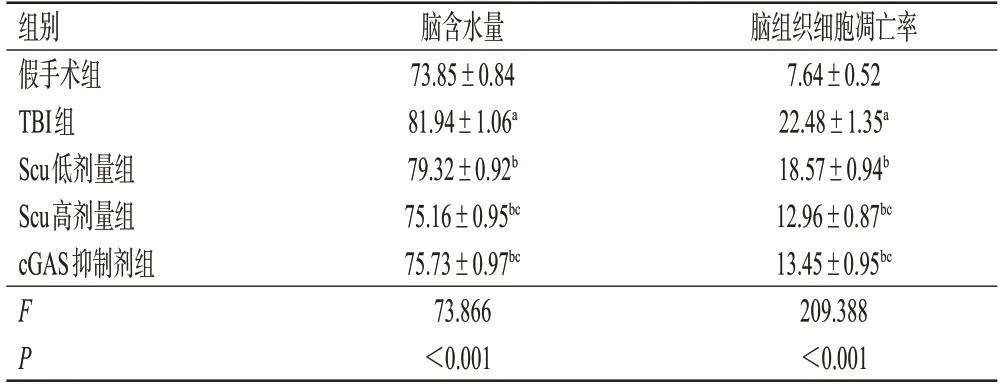
表2 各组大鼠脑含水量和脑组织细胞凋亡率测定结果(±s,n=6,%)
a:与假手术组比较,P<0.05;b:与TBI组比较,P<0.05;c:与Scu低剂量组比较,P<0.05。
脑组织细胞凋亡率7.64±0.52 22.48±1.35a 18.57±0.94b 12.96±0.87bc 13.45±0.95bc 209.388<0.001组别假手术组TBI组Scu低剂量组Scu高剂量组cGAS抑制剂组F P脑含水量73.85±0.84 81.94±1.06a 79.32±0.92b 75.16±0.95bc 75.73±0.97bc 73.866<0.001
3.3 大鼠脑组织病理学变化观察结果
假手术组大鼠脑组织无明显异常。与假手术组比较,TBI组大鼠脑组织存在病理学损伤,具体表现为:大量炎症细胞(包括淋巴细胞、嗜中性粒细胞等)浸润,间质水肿,明显出血,细胞排列不规则、结构模糊且出现核固缩和核裂解。与TBI 组比较,Scu 低、高剂量组和cGAS抑制剂组大鼠上述组织病理学损伤均有不同程度改善,且以Scu 高剂量组和cGAS 抑制剂组大鼠改善更明显。结果见图1。
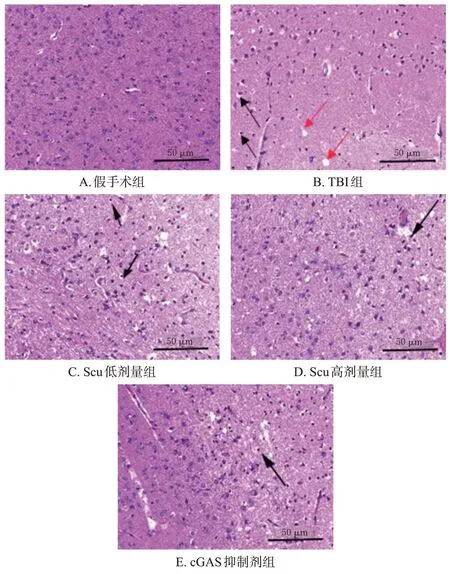
图1 各组大鼠脑组织病理学变化的HE染色图
3.4 大鼠脑组织细胞凋亡情况测定结果
与假手术组比较,TBI 组大鼠脑组织细胞凋亡率显著升高(P<0.05);与TBI 组比较,Scu 低、高剂量组和cGAS抑制剂组大鼠脑组织细胞凋亡率均显著降低(P<0.05);与Scu 低剂量组比较,Scu 高剂量组和cGAS 抑制剂组大鼠脑组织细胞凋亡率均显著降低(P<0.05);Scu高剂量组和cGAS 抑制剂组大鼠脑组织细胞凋亡率比较,差异无统计学意义(P>0.05)。结果见图2、表2。
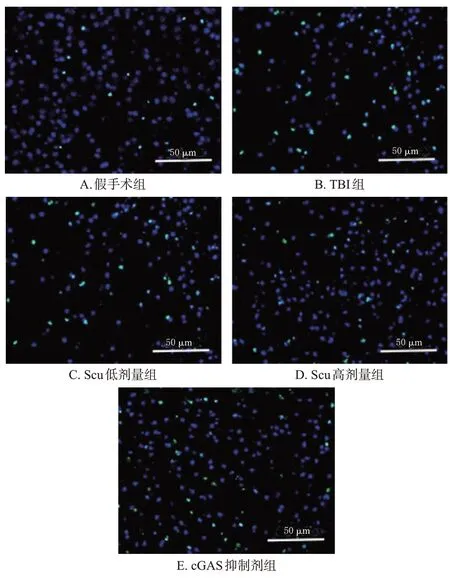
图2 各组大鼠脑组织细胞凋亡的TUNEL染色图
3.5 大鼠脑组织中炎症因子含量测定结果
与假手术组比较,TBI 组大鼠脑组织中IFN-β、CXCL10、TNF-α、IL-6 含量均显著升高(P<0.05);与TBI 组比较,Scu 低、高剂量组和cGAS 抑制剂组大鼠脑组织中上述指标含量均显著降低(P<0.05);与Scu低剂量组比较,Scu 高剂量组和cGAS 抑制剂组大鼠脑组织中上述指标含量均显著降低(P<0.05);Scu高剂量组和cGAS 抑制剂组大鼠上述指标含量比较,差异均无统计学意义(P>0.05)。结果见表3。
表3 各组大鼠脑组织中炎症因子含量测定结果(±s,n=6,pg/mg)
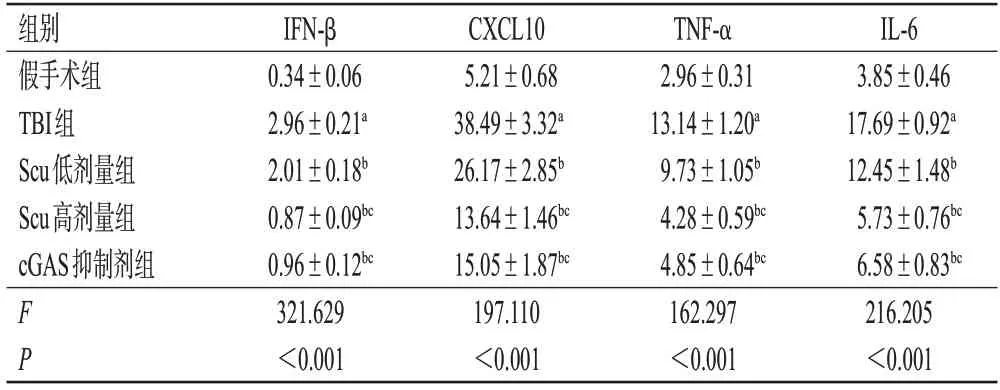
表3 各组大鼠脑组织中炎症因子含量测定结果(±s,n=6,pg/mg)
a:与假手术组比较,P<0.05;b:与TBI组比较,P<0.05;c:与Scu低剂量组比较,P<0.05。
IL-6 3.85±0.46 17.69±0.92a 12.45±1.48b 5.73±0.76bc 6.58±0.83bc 216.205<0.001组别假手术组TBI组Scu低剂量组Scu高剂量组cGAS抑制剂组F P IFN-β 0.34±0.06 2.96±0.21a 2.01±0.18b 0.87±0.09bc 0.96±0.12bc 321.629<0.001 CXCL10 5.21±0.68 38.49±3.32a 26.17±2.85b 13.64±1.46bc 15.05±1.87bc 197.110<0.001 TNF-α 2.96±0.31 13.14±1.20a 9.73±1.05b 4.28±0.59bc 4.85±0.64bc 162.297<0.001
3.6 大鼠脑组织中cGAS、STING蛋白表达测定结果
与假手术组比较,TBI 组大鼠脑组织中cGAS、STING蛋白的相对表达水平显著升高(P<0.05);与TBI组比较,Scu低、高剂量组和cGAS抑制剂组大鼠脑组织中上述蛋白的相对表达水平均显著降低(P<0.05);与Scu低剂量组比较,Scu高剂量组和cGAS抑制剂组大鼠脑组织中上述蛋白的相对表达水平均显著降低(P<0.05);Scu 高剂量组和cGAS 抑制剂组大鼠上述蛋白的相对表达水平比较,差异均无统计学意义(P>0.05)。结果见图3、表4。
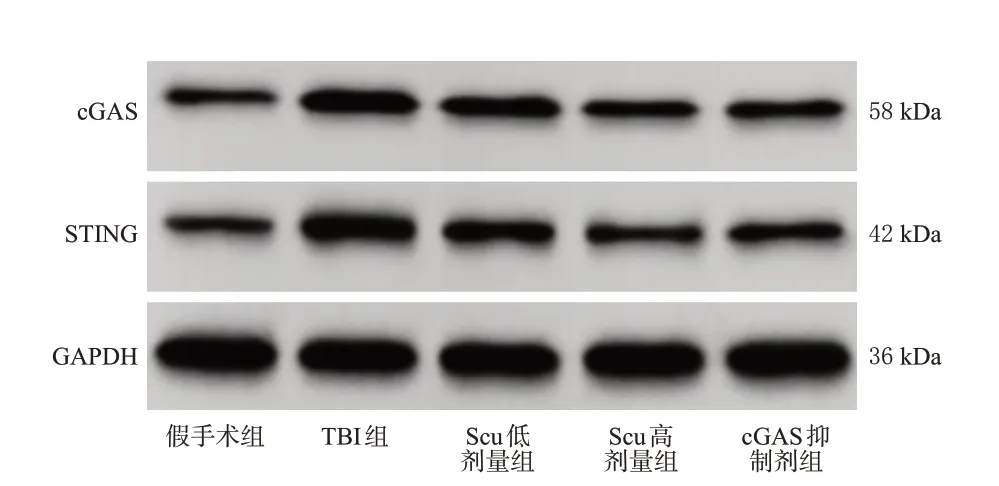
图3 各组大鼠脑组织中cGAS、STING 蛋白的免疫印迹图
表4 各组大鼠脑组织中cGAS、STING 蛋白相对表达水平测定结果(±s,n=6)
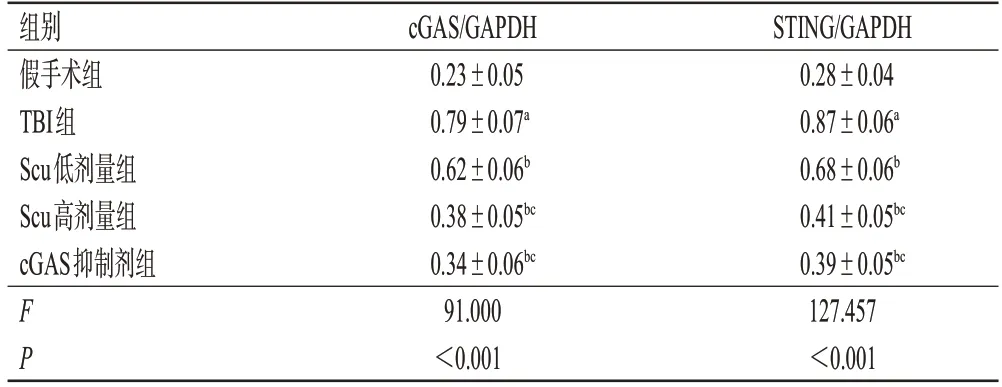
表4 各组大鼠脑组织中cGAS、STING 蛋白相对表达水平测定结果(±s,n=6)
a:与假手术组比较,P<0.05;b:与TBI组比较,P<0.05;c:与Scu低剂量组比较,P<0.05。
STING/GAPDH 0.28±0.04 0.87±0.06a 0.68±0.06b 0.41±0.05bc 0.39±0.05bc 127.457<0.001组别假手术组TBI组Scu低剂量组Scu高剂量组cGAS抑制剂组F P cGAS/GAPDH 0.23±0.05 0.79±0.07a 0.62±0.06b 0.38±0.05bc 0.34±0.06bc 91.000<0.001
4 讨论
目前,TBI 仍是全世界残疾和死亡的最常见原因之一,TBI继发性损伤在预后中的影响越来越受到关注,尤其是继发性损伤中的神经炎症反应[15]。鉴于神经炎症反应在TBI发生和病情进展中的重要作用,神经炎症相关分子靶点也一直是药物等治疗方式的主要研究方向[16]。本研究通过改良Feeney 法构建TBI 大鼠模型,结果显示,相比于假手术组大鼠,TBI 组大鼠的mNSS、脑含水量以及脑组织细胞凋亡率均升高,且脑组织存在大量炎症细胞浸润、间质水肿、明显出血等病理学损伤,表明TBI 大鼠出现神经功能缺损、脑水肿和脑组织损伤,这符合TBI临床症状,提示TBI大鼠模型制备成功,可用于药物治疗及相关机制研究。
Scu作为一种天然黄酮类活性成分,其抗炎、神经保护等特性已在多篇文献中报道。例如,Scu 可通过调节肠道菌群和抑制小胶质细胞中环磷酸腺苷/蛋白激酶A/环磷酸腺苷反应元件结合蛋白/组蛋白去乙酰化酶3 信号通路激活并逆转阿尔茨海默病β 淀粉样蛋白前体-早老蛋白-1小鼠的神经炎症和认知障碍[17];可通过抑制磷酸化氨基末端蛋白激酶和磷酸化p38丝裂原活化蛋白激酶下调小胶质细胞/脑巨噬细胞中促炎介质的表达,发挥抗炎和神经保护作用[18];可靶向作用于醛糖还原酶-烟酰胺腺嘌呤二核苷酸磷酸氧化酶轴发挥抗氧化作用,改善脑缺血/再灌注损伤小鼠的神经功能缺损和神经元损伤,缩小脑梗死面积[19]。但是,Scu 对TBI 的治疗作用及机制尚有待阐明。本研究中,40、80 mg/kg的Scu给药后均可降低TBI 大鼠mNSS、脑含水量以及脑组织细胞凋亡率,同时改善其脑组织病理学损伤。该结果表明,Scu可减轻TBI大鼠损伤脑组织的细胞凋亡和脑水肿,促进神经功能恢复。此外,本研究结果显示,TBI大鼠脑组织中促炎因子TNF-α、IL-6含量与行假手术的大鼠相比明显升高,这与脑组织病理结果中炎症细胞浸润情况相一致;而Scu治疗后可降低TBI大鼠脑组织中TNF-α、IL-6含量,减少其炎症细胞浸润。这表明Scu 可能通过抑制神经炎症缓解TBI。Lu 等[20]研究亦表明,Scu 可改善脂多糖诱导的TNF-α、IL-1β、IL-6等促炎因子升高,抑制海马神经炎症并减轻小鼠抑郁样行为,与本研究结果类似。
cGAS/STING信号通路作为一条与免疫炎症密切相关的信号转导途径,可介导IFN-Ⅰ反应,诱导IFN-β、CXCL10、TNF-α等细胞因子产生,近年该通路与神经炎症和脑损伤的关系备受关注[21—22]。研究显示,激活cGAS/STING 信号通路可诱导小胶质细胞活化,促进脑部炎症[23],而抑制该通路激活可减弱缺血/再灌注诱导的神经炎症和脑损伤[24]。本研究中,TBI 大鼠脑组织中IFN-β、CXCL10 含量及cGAS、STING 蛋白相对表达水平与行假手术的大鼠相比均显著升高,这提示TBI发生后cGAS/STING信号通路被激活,可能进而引发神经炎症。而经Scu 治疗后,TBI 大鼠脑组织中IFN-β、CXCL10 含量及cGAS、STING 蛋白相对表达水平均显著降低,表明Scu 减轻TBI 大鼠神经炎症的分子机制可能与抑制cGAS/STING 信号通路激活有关。为了更充分地验证cGAS/STING信号通路在TBI后神经炎症中的作用,本研究采用cGAS 选择性抑制剂RU.521 治疗TBI大鼠,结果显示,RU.521 除抑制cGAS/STING 信号通路激活外,同样可减轻TBI 大鼠神经炎症、损伤脑组织细胞凋亡和脑水肿,促进神经功能恢复,且作用效果与80 mg/kg Scu 几乎相当。这进一步证实了Scu 可能通过抑制cGAS/STING信号通路激活来减轻神经炎症,进而对TBI 大鼠发挥神经保护作用。Ding 等[25]研究亦表明,RU.521 可减轻脑静脉窦血栓形成小鼠的炎症和氧化应激反应,减少小胶质细胞和嗜中性粒细胞数量,同时改善神经细胞凋亡和变性以及神经功能缺损。
综上所述,Scu 可能通过抑制cGAS/STING 信号通路激活来减轻TBI大鼠神经炎症,减少其脑组织损伤及细胞凋亡,促进其神经功能恢复。但后续仍有待通过体外实验观察小胶质细胞介导的炎症反应在Scu缓解TBI中的作用及机制等,从而为Scu 应用于TBI 治疗增加说服力。
