亚临界水制备芝麻ACE抑制肽的分离纯化、构效、分子对接
2023-09-13王瑞丹黄纪念宋国辉
孙 强,王瑞丹,黄纪念,2,*,芦 鑫,宋国辉,游 静
(1.河南省农业科学院农副产品加工研究中心,河南 郑州 450002;2.河南省特色油料作物基因组学重点实验室,河南 郑州 450002)
芝麻,又称胡麻、脂麻,是中国主要的油料作物之一。目前,芝麻主要用于制油,由于国内对芝麻香油的喜爱,芝麻榨油工艺中有高温烘烤生香工艺。经过高温处理后,芝麻饼粕中芝麻蛋白发生严重变性,限制后续加工利用[1-2]。为了充分利用资源,扩大芝麻蛋白的应用范围,对高温芝麻饼粕进行一定处理进而制备功能肽具有重要意义。
大量研究证实,通过体内消化释放或体外制备的不同生物活性肽具有抗疲劳、降血压、提高免疫力、降血脂、抗菌等多种生理功能,且易被人体消化吸收,食用安全性高[3]。食源性功能肽的制备大多是利用酶法水解[4-5],但该方法存在转化率低、水解速率低、蛋白酶价格昂贵等局限性,长时间酶解还会导致微生物污染[6]。亚临界水是指温度在沸点(100 ℃)以上,临界温度(374 ℃)以下仍保持为液体状态的水,又称为高温水、高温液态水、超加热水等。在亚临界水状态下,酸/碱能够催化反应较快进行,且与常温状态相比,仅需要很少的酸/碱催化剂即可。可见,亚临界水技术是一种绿色环保、前景广阔的萃取技术,具有设备操作简单、成本低、提取率高等优点,又具有良好的渗透与溶解能力,在副产物深加工方面得到了广泛关注[7-8]。目前已有开展亚临界水制备寡肽与氨基酸等相关研究,并表明该技术利用高温芝麻粕资源可行[9],但尚未明确利用亚临界水技术制备功能肽的序列与构效关系。此外,如何克服亚临界水水解蛋白质断裂位点无专一性、获得的肽段重现性不好等缺点,控制反应产生所需要的寡肽仍需继续深入研究。
血管紧张素转化酶(angiotension converting enzyme,ACE)对血压起重要的调节作用。ACE能催化血管紧张素I过多地转化为血管紧张素II,使心肌收缩加强,致使血压升高。同时使具有血管舒张作用的舒缓激肽失活,引发血压升高。临床上高血压患者大多数使用合成ACE抑制剂(如赖诺普利)控制血压的升高,这类药物会产生味觉功能紊乱、皮疹、血压过度偏低等副作用[10-11],因此食源性ACE抑制肽是近年来的研究热点。本研究在亚临界水状态下,利用酸催化水解芝麻蛋白制备ACE抑制肽,并对其进行分离纯化,利用液相色谱-质谱联用仪进行结构鉴定,筛选典型芝麻ACE抑制肽,同时以比较分子场分析(comparative molecular force field analysis,CoMFA)方法建立寡肽的三维定量构效关系(three dimensional quantitative structure-activity relationship,3D-QSAR)模型,以揭示寡肽分子周围立体场和静电场分布对ACE抑制活性的影响,利用AdmetSAR对其吸收、代谢、毒性进行评价,并利用分子对接分析其与ACE分子的结合方式,探讨其抑制作用的分子机理,进而为芝麻蛋白的资源化利用提供理论依据。
1 材料与方法
1.1 材料与试剂
脱脂高温芝麻粕(蛋白(45.00±0.74)%、粗脂肪(2.54±0.03)%、水分(6.98±0.17)%、灰分(10.45±0.14)%、总糖(35.03±1.10)%)由本实验室自制;二喹啉甲酸(bicinchoninic acid,BCA)Genview科技有限公司;ACE、马尿酰组氨酰亮氨酸(N-hippuryl-His-Leu,HHL)、邻苯二甲醛(1,2-phthalic dicarboxaldehyde,OPA)美国Sigma-Aldrich公司;超滤膜UE010(截留分子质量10 kDa)、UE005(截留分子质量5 kDa)、UE003(截留分子质量3 kDa)、纳滤膜(截留分子质量150 Da)中科瑞阳膜技术有限公司;乙腈、三氟乙酸为色谱级,其他试剂均为国产分析纯;寡肽LFRAR、LFRAV、LFRYF、LFRNF、LFREF、AFRAF、MFRAF、VFRAF、NVFRGF、DVFRGF、LFRAFD、EVFRGF由无锡亚肽生物科技有限公司合成。
1.2 仪器与设备
WHF-0.5型反应釜 威海自控反应釜有限公司;TGL20M-II高速冷冻离心机 湖南凯达科学仪器有限公司;XS205电子天平 上海梅特勒-托利多仪器有限公司;Infinite200 Pro酶标仪 奥地利Tecan公司;NGC QuestTM10 Plus色谱系统 美国伯乐公司;Cary eclipse荧光光谱仪 美国安捷伦科技有限公司;Testcell C-70平膜装置 日本东电公司;Ultimate 3000毛细管高效液相色谱仪、Q ExactiveTMHybridQuadrupole-Orbitrap™电喷雾-组合型离子阱Orbitrap质谱仪 美国Thermo Fisher科技公司。
1.3 方法
1.3.1 低温亚临界水处理芝麻蛋白
采用碱溶酸沉的方法从脱脂高温芝麻粕中提取芝麻蛋白,以1∶50(g/mL)的比例向芝麻蛋白中加入蒸馏水,搅拌混匀后采用5 mol/L HCl溶液和5 mol/L NaOH溶液将混合液的pH值调节至1.5后,转移入反应釜中以125 ℃加热60 min。反应后的水解液以5000 r/min离心20 min,收集上清液并调至pH 7.0,5000 r/min再次离心20 min,取上清液于4 ℃保存。
1.3.2 超滤分离水解液
将水解液装入平膜装置,采用纳滤膜(截留分子质量150 Da)进行脱盐,操作压力3 MPa,转速400 r/min,透过液达到初始溶液体积的80%时,终止纳滤,重复3 次,截留液备用。将截留液依次通过UE010、UE005和UE003进行超滤,得到4 个组分,分别为>10、5~10、3~5、<3 kDa,采用BCA法[12]测定各组分寡肽浓度,并测定各组分ACE抑制活性的IC50值。
1.3.3 NGC QuestTM10 Plus色谱分析条件
将超滤获得的活性最强的组分采用0.22 μm的滤膜过滤后进样到NGC QuestTM10 Plus色谱系统。色谱柱:Shim-pack GIS C18制备柱(20 cm×250 mm,10 μm);流动相A为含有0.1%三氟乙酸的乙腈,流动相B为含有0.1%三氟乙酸的超纯水;流速7.5 mL/min;进样体积1 mL;检测波长220 nm;梯度洗脱条件为:0~50 min,45%~50% A、55%~50% B。使用收集器以0.5 min/管收集流动相,将各色谱峰对应试管混合,测定ACE抑制活性并计算IC50值,确定活性最强的峰组分进行质谱鉴定。
1.3.4 质谱分析条件
将活性最强的峰组分进行前处理后采用Ultimate 3000毛细管高效液相色谱仪进行检测,上样量5 μL,分析柱采用Acclaim PepMap RPLC C18(150 μm×150 mm,1.9 μm),洗脱条件为:流动相A为0.1%甲酸-2%乙腈溶液,流动相B为0.1%甲酸-80%乙腈溶液,流速600 nL/min,0~5 min,94%~91% A、6%~9% B;5~20 min,81%~86% A、9%~14% B;20~50 min,86%~70% A、14%~30% B;50~58 m i n,70%~60% A、30%~40% B;58~60 min,60%~5% A、40%~95% B。采用电喷雾-组合型离子阱Orbitrap质谱仪,毛细管温度270 ℃,电压2.2 kV,一级质谱参数:分辨率70000,电荷扫描范围m/z100.0~1500.0。二级质谱参数:分辨率17500,以碰撞诱导裂解方式激活产生碎片离子,激活Q为0.250 s-1,激活时间30.000 ms,最小信号要求1500.0,以m/z100开始扫描。质谱原始数据采用从头测序的方法进行寡肽序列解析。
1.3.5 ACE抑制肽生理活性与安全性预测
对鉴定到9 个芝麻ACE抑制肽的生理活性采用Admet SAR2.0(http://lmmd.ecust.edu.cn/admetsar2/)进行预测,其中以人体肠道吸收、经口生物利用度表征吸收特性,血脑屏障表征分布特性,以细胞色素P450底物与抑制活性表征代谢特性,以致癌性、埃姆斯诱变、钾离子通道的α亚基编码基因抑制活性、蜂毒性、生物降解表征毒性特性[13]。
1.3.6 3D-QSAR构效模型的建立
3D-QSAR是利用数学建模的方式描述一类具有相似特征结构与其生物活性之间定量关系的方法,其中最为广泛使用的是CoMFA法,CoMFA模型的三维等势图可以形象直观地显示分子结构区域与生物活性之间的关系[14]。将13 个寡肽序列在SYBYL-X 2.1.1软件中protein building模块录入,寡肽的电荷模式采用MMFF94模拟,能量优化采用MMFF94力场的Powell共轭梯度算法(最大运算次数10000,能量优化终止标准0.0005 kcal/(mol·Å))。采用ACE抑制活性最高的寡肽LFRAF为模板,其中以FR作为骨架构建CoMFA模型,分子叠加图见图1。采用偏最小二乘法和逐一剔除法对模型进行评价,在交叉验证系数(Q2)>0.5、误差预测标准差(R2)>0.6条件下证明模型建立成功,具有良好的预测能力[15-16]。

图1 LFRAF及其衍生肽的分子叠加图Fig.1 Structural alignment of LFRAF and its derived peptides
1.3.7 分子对接分析
采用分子对接软件Molecular Operating Environment(MOE)探究寡肽与人体ACE分子的结合方式。从PDB网站(https://www.rcsb.org/structure/1086)下载含有赖诺普利的人体ACE分子的PDB文件导入MOE软件,质子化后,除去水分子,作为模板[17]。所选肽段作为配体,能量最小化后载入MOE中Dock模块,拼接方法为Proxy Triangle,优化设置为Rigid Receptor,得分选用London d G和GBV/WSA d G方式,从30 个构型中选取最佳构型与ACE分子进行拼接。
1.3.8 ACE抑制活性的测定
参考Wang Ruidan等[18]的方法,将15 μL样液(无抑制的反应液中以蒸馏水代替)与30 μL底物溶液(5 mmol/L HHL的氯化钠磷酸缓冲液)混合,然后加入30 μL 12.5 mU/mL的ACE酶液,于37 ℃水浴反应30 min。反应结束后加入125 μL 1.2 mol/L NaOH溶液终止酶反应,接着加入30 μL含2% OPA的甲醇溶液,混合均匀后静置20 min,随后加入40 μL 6 mol/L HCl溶液终止衍生反应。对照液中以蒸馏水代替。将反应溶液稀释10 倍后使用荧光光谱仪测定荧光吸收强度,测定条件为:激发波长340 nm,发射波长455 nm,狭缝宽度5 nm。样液的ACE抑制率计算公式如下:
式中:a为抑制剂与ACE都存在时的荧光吸收强度;b为抑制剂不存在而ACE存在时的荧光吸收强度;c为抑制剂存在而ACE不存在时的荧光吸收强度;d为抑制剂与ACE都不存在时的荧光吸收强度。
1.4 数据处理与分析
所有实验均重复测定3 次,采用SPSS 13.0进行方差分析,其中P<0.01表示差异极显著,P<0.05表示差异显著。
2 结果与分析
2.1 芝麻水解液的超滤分离
采用超滤的方法分别获得分子质量>10、5~10、3~5 kDa和<3 kDa四个组分的寡肽溶液,其ACE抑制活性见表1。不同分子质量的ACE抑制活性存在显著差异。低分子质量组分的ACE抑制活性强,尤其<3 kDa的组分最强,而高分子质量组分的ACE抑制活性弱。此结果与Lin Kai[19]、Fu Weiqing[20]等的研究结果一致。低分子质量组分肽链短,空间位阻小,更易进入ACE活性口袋,从而改变ACE的催化活性。因此通过低分子质量超滤膜的寡肽溶液能够提高肽段的ACE活性。

表1 超滤分离芝麻蛋白水解液所得组分及ACE抑制活性Table 1 Ultrafiltration fractions from sesame protein hydrolysate and their ACE inhibitory activity
2.2 NGC QuestTM10 Plus色谱系统分离水解液
对<3 kDa组分进行NGC色谱系统分离,所得图谱见图2,共分离得到5 个色谱峰(P1~P5),该5 个峰组分的保留时间及ACE抑制活性测定结果见表2。由表2可知,峰1的IC50值最低,表明其ACE抑制活性最强。因此选择峰1组分进行后续质谱鉴定。

表2 NGC色谱系统分离芝麻蛋白水解液所得峰组分及ACE抑制活性Table 2 ACE inhibitory activity of peaks separated in NGC chromatography system
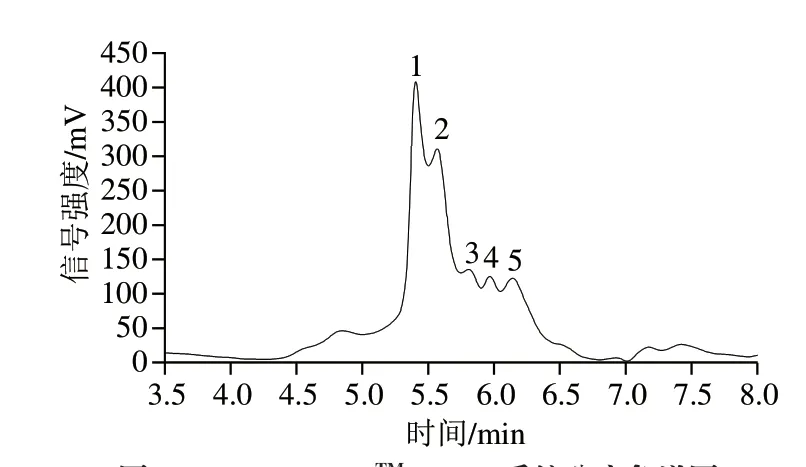
图2 NGC QuestTM10 Plus系统分离色谱图Fig.2 Chromatogram of the fraction less than 3 kD in NGC QuestTM 10 Plus system
2.3 芝麻ACE抑制肽的序列鉴定
通过液相色谱-质谱联用仪分析峰1组分,其总离子流图见图3。共鉴定得到9 个寡肽,理论分子质量范围在639.4319~933.4821 Da,其ACE抑制活性的IC50值见表3。其中KPLLK、LFRAFD的ACE抑制活性相对较弱,LFRAF的相对含量最高,且具有强ACE抑制活性,其二级质谱图如图4所示。

图3 液相色谱-质谱联用鉴定峰1组分的总离子流图Fig.3 Total ion current chromatogram of peak 1 identified by liquid chromatography-mass spectrometry
2.4 ACE抑制肽生理活性与安全性预测
吸收、分布、代谢和排泄特性是鉴定寡肽生物活性的关键因素[21]。功能肽在体内发挥作用必须能被人体吸收、代谢,且毒副作用小。因此有必要对寡肽的生理活性与安全性进行预测。由图5可知,除PELLRKL、PNPRSFF、LPLLK,其他寡肽能通过小肠吸收。除LPLLK的所有寡肽具有高血脑屏障,表明不会对中枢神经系统造成影响。此外,寡肽不属于细胞色素P450的底物,也没有其抑制活性,表明不会干扰细胞的正常代谢活动。由毒性特性结果可知,尽管DVFRGF、TFHNLFR、LFRAFD预测具有钾离子通道的α亚基编码基因抑制活性,但所有寡肽不会致癌,安全性高。上述结果表明,所得芝麻ACE抑制肽不会干涉人体正常的生理活动。

图5 ACE抑制肽的吸收、分布、代谢和排泄预测Fig.5 Prediction of absorption,distribution,metabolism,and excretion of ACE inhibitory peptides
2.5 3D-QSAR构效模型的建立
以LFRAF中FR为骨架,衍生其他寡肽,基于CoMFA方法建立LFRAF、LFRAR、LFRAV、LFRYF、LFRNF、LFREF、AFRAF、MFRAF、VFRAF、NVFRGF、DVFRGF、EVFRGF、LFRAFD的半数抑制浓度负对数值(pIC50)的3D-QSAR模型,以揭示寡肽周围立体场和静电场分布对ACE抑制活性的影响,探讨寡肽ACE抑制活性的分子机理。寡肽IC50及转换成相应的pIC50值如表4所示,其中pIC50用于CoMFA计算中的因变量,pIC50预测值与测量值之间的残差值均小于0.7。以ACE抑制肽LFRAF及其衍生寡肽所构建的CoMFA模型统计参数见表5。由表5可知,模型交叉验证系数(Q2)=0.514>0.5,非交叉验证相关系数(R2)=0.997>0.6,并且具有较低的预测标准误差0.032(<0.05)和较高的F值,表明建立的模型具有良好的内部稳定性,且模型中立体场与静电场对pIC50值的贡献率分别为50.9%和49.1%,说明CoMFA模型中立体场与静电场对抑制肽分子与ACE之间的相互作用都有重要影响,且立体场的影响较静电场大。上述结果证明所建立的CoMFA模型具有良好的预测能力和可靠性。
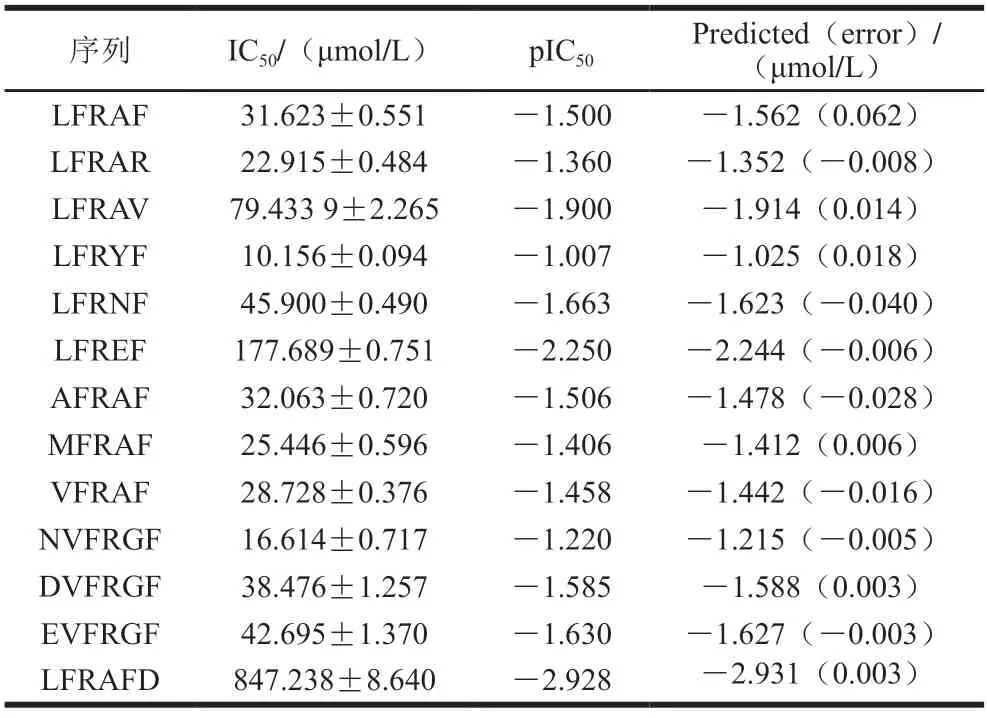
表4 LFRAF及衍生寡肽的ACE抑制活性Table 4 ACE inhibitory activity of LFRAF and its derived peptides

表5 LFRAF及衍生寡肽的CoMFA模型统计参数Table 5 Statistical parameters of LFRAF and its derived peptides in CoMFA model
图6A为以pIC50最高的寡肽LFRYF为模板的CoMFA模型的三维立体作用分布图,其中,绿色区域表示增大取代基体积有利于提高活性,黄色区域表示减小立体位阻有利于提高活性。由立体场的空间分布可知,在第1位氨基酸残基(N端)处存在绿色区域,表明在此处引入大基团有利于提高活性。例如寡肽MFRAF的ACE抑制活性强于LFRAF。Yan Wenli等[22]研究同样报道了这一结论,即N端处有大基团氨基酸的寡肽具有较强的ACE抑制活性。在末位氨基酸残基(C端)的羰基处存在黄色区域,表明在此处引入小基团有利于提高活性,其侧链处存在绿色区域,表明在此处引入大基团有利于提高活性。如寡肽LFRAF活性明显强于LFRAV的结果很好验证了这一点。活性比较高的ACE抑制肽的C末端多为色氨酸(Trp)、酪氨酸(Tyr)、苯丙氨酸(Phe)等芳香族氨基酸以及脯氨酸(Pro)。齐春艳[23]采用分子对接和3D-QSAR相结合的方法对以Phe为C末端的ACE抑制二、三肽进行研究,筛选出Gly-Glu-Phe(GEF)、Val-Glu-Phe(VEF)、Val-Arg-Phe(VRF)以及Val-Lys-Phe(VKF)4 种三肽。
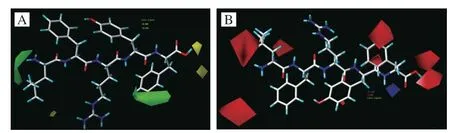
图6 CoMFA模型中立体场(A)和静电场(B)对LFRYF活性的影响Fig.6 Effect of steric field (A) and electrostatic field (B) on activity of LFRYF in CoMFA model
图6B为以pIC50最高的寡肽LFRYF为模板的CoMFA模型的分子周围静电场分布图,蓝色区域表示增大基团正电荷有利于化合物活性的提高,红色区域则表示在此处引入带负电荷的基团对活性有利。由静电场的空间分布可知,N端处存在红色区域,表明在N端处引入带负电荷的基团有利于寡肽活性的提高。C端羧基的羟基处存在红色区域,表明在此处引入带负电荷的基团能够提高ACE抑制活性。然而在氨基附近也存在蓝色区域,意味着在该处引入带正电荷的基团有利于ACE抑制活性的提高。尽管静电相互作用较为复杂,但C末端带正电荷取代基的作用是ACE抑制活性的主要因素。该研究结果与Lu Xin等[24]研究结果一致。例如,寡肽LFRAR中C端为带有正电荷的精氨酸(Arg)氨基酸残基,其活性与寡肽LFRAF、LFRAV相比大大提高。这一结果证实了之前的报道,Sun Lixia[25]、Mirzaeia[26]等研究发现带正电荷的氨基酸如赖氨酸和精氨酸的C端残基有助于提高ACE抑制活性。寡肽在C末端区域含有Phe、Leu、Val、Ile、Pro、Arg和Lys等疏水性氨基酸或碱性氨基酸,这些氨基酸更倾向于与ACE催化活性位点发生结合,从而抑制ACE的催化活性[27]。
由表4、5和图6可知,ACE抑制肽的氨基酸序列对其ACE抑制能力十分重要。3D-QSAR模型是研究氨基酸序列对ACE抑制肽抑制能力影响的较为准确的方法,目前利用该模型进行分析多以二肽、三肽为主,对于ACE抑制肽的QSAR研究还处于起步阶段,能够准确描述所有ACE抑制肽的结构与其抑制活性的模型鲜有报道,因此也存在着一定的局限性[28]。
2.6 分子对接分析
通过分子对接从分子层面探究寡肽分子与ACE的相互作用方式,揭示其抑制作用机理。据报道,ACE分子主要有S1、S2和S1’三个活性口袋。其中S1口袋包含Ala354,Glu384和Tyr523残基,S2口袋包含Gln281、His353、Lys511、His513和Tyr520残基,S1’口袋包含Glu162残基。同时ACE在其活性位点有一个辅酶因子锌离子(Zn2+),可以与His383,His387、Glu411形成离子键或配位键[29-30]。由图7a可知,LFRAF与赖诺普利的位置基本一致,能够整个嵌入ACE分子内部,与ACE分子良好对接。图7b显示了ACE氨基酸残基与LFRAF相互作用的结果。LFRAF通过氢键与ACE分子的Glu162、His353、Lys511结合,通过离子键与Asp377、His387及Zn701结合,通过疏水相互作用与Phe527、His353结合。因此,LFRAF能够占据ACE分子的催化活性中心(S2和S1’),同时与非活性中心的氨基酸残基紧密结合,从而有效抑制血管紧张素I进入ACE催化活性位点,进而抑制ACE的催化活性。同时,与Zn2+结合能够导致Zn2+与ACE分子间形成的四面体螯合结构发生扭曲变形,使ACE催化活性下降[31]。该结果同时验证2.4节的研究结果,即C末端侧链处大基团尤其芳香族氨基酸的存在有助于提高ACE抑制活性。

图7 LFRAF与ACE分子对接结果图Fig.7 Molecular docking results of LFRAF with ACE
3 结论
芝麻蛋白水解液经过超滤分离得到分子质量<3 kDa组分具有最强的ACE抑制作用。采用NGC QuestTM10 Plus色谱系统进一步纯化<3 kDa组分,并通过液相色谱-质谱联用仪从峰1组分中鉴定到9 个ACE抑制肽,这些寡肽安全性高,不会干涉人体正常的生理活动。基于CoMFA方法成功建立LFRAF的3D-QSAR模型,立体场与静电场对ACE抑制活性影响相当。ACE抑制肽的C端处带正电荷氨基酸残基与侧链处引入大基团能够提高ACE抑制能力。LFRAF通过占据ACE的S2、S1’活性口袋,并与Zn2+结合从而抑制ACE活性。后续有必要开展寡肽的酶抑制类型研究及体内评价,寻找并结合信息学手段快速筛选活性强的ACE肽段,为开发高效食源性ACE抑制肽提供理论指导。
