姜黄素纳米粒构建及体外细胞摄取
2023-09-13姚晓琳刘德春
杨 丹,袁 颖,姚晓琳,*,秦 丹,刘德春
(1.陕西科技大学食品科学与工程学院,生物与医药学院,陕西 西安 710021;2.西北工业大学医学研究院,陕西 西安 710072)
姜黄隶属于姜科、姜黄属,是一种药食同源植物[1]。姜黄素(curcumin,Cur)存在于姜黄根茎中,含有特殊的二酮类结构,作为天然的食品添加剂、着色剂被广泛使用[2]。Cur虽然具有抗肿瘤、抗炎症、降血糖、抗氧化、抗凋亡等多种生理活性[3-4],但其在光照和高温条件下会降解[5],不易存储与运输,同时由于其亲脂性强、水溶性差,因此口服生物利用度也较低[6]。在食品领域的研究中,会将姜黄素等对外界环境敏感的活性物质负载在食品运载体系中,以改善活性物质的水溶性,增加其对光和热的稳定性,调节活性物质的释放行为,进而提高它们的功效[7]。
纳米递送系统指用纳米级载体(粒径在10~1000 nm之间)包埋活性物质,提高活性物质的功能特性,从而改善活性物质的递送效率的系统[8]。纳米载体比表面积大,活性物质负载率高、稳定性强[9]、毒性低[10],在食品领域应用广泛。研究发现,与游离Cur相比,纳米载体包埋的Cur的水溶性[11]、胃肠道稳定性[12]、紫外稳定性[13]及抗氧化活性[14]均得到了显著提高。
聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolic acid),PLGA)生物相容性好,刺激性及毒副作用小,是目前应用最为广泛的纳米材料之一[15-16]。PLGA纳米粒(PLGA-nanoparticle,PLGA-NP)在降解时表面逐渐产生微孔,使包埋物逐渐暴露于纳米粒表面并缓慢释放,从而达到缓释的效果[17-18]。在口服递送纳米粒时,黏液层、肠上皮细胞层等多个屏障的存在会影响肠细胞对纳米粒的吸收,进而影响肠细胞对活性物质的吸收[19]。主动靶向纳米载体在纳米载体表面修饰可与细胞表面的受体特异性结合的配体,可增加纳米载体在细胞表面的吸附量,从而提高纳米载体的吸收量[20]。研究表明转铁蛋白受体(TfR)、整合素受体(αVβ3/5)、新生儿Fc受体(FcRn)、叶酸受体(FAR)等皆可作为主动靶向纳米载体的作用靶点[21],其中人转铁蛋白(transferrin,Tf)是参与铁吸收和细胞生长的必需蛋白,除了成熟的红细胞外,TfR存在于几乎所有细胞表面,Tf的修饰可提高纳米粒在肠细胞的穿透能力,进而提高活性物质的吸收效率。
基于以上研究背景,本实验将PLGA作为纳米载体材料对Cur进行包埋,以Cur负载率为指标,通过单因素筛选法对包埋Cur的PLGA-NP(Cur-PLGA-NP)的配方工艺进行优化。用Tf对PLGA-NP进行修饰,同时用与人血清白蛋白高度近似[22],安全无毒、无免疫原性、可生物降解、生物相容性好[23]的牛血清白蛋白(bovine serum albumin,BSA)作为Tf的阴性对照,以消除蛋白修饰的影响。以TfR高表达的结肠癌细胞系HT-29细胞[24]为细胞模型,对Tf修饰的主动靶向纳米粒(Tf-NP)及BSA修饰的纳米粒(BSA-NP)的细胞摄取进行评价,研究Tf-NP提高细胞对纳米粒摄取的效果,从而为增加肠细胞对Cur吸收的运载体系的设计提供参考。
1 材料与方法
1.1 材料与试剂
Cur 上海易恩化学技术有限公司;PLGA 济南岱罡生工程有限公司;乙腈 天津市科密欧化学试剂有限公司;泊洛沙姆F68(Poloxamer F68)巴斯夫股份公司;BSA 北京索莱宝科技有限公司;Tf 上海西格玛生物有限公司;香豆素6(coumarin 6,C6)上海阿拉丁生化科技股份有限公司;TRITC Phalloidin 翌圣生物科技(上海)股份有限公司;Hoechst33342 北京雷根生物技术有限公司。
1.2 仪器与设备
GL124-1SCN型分析天平 北京赛多利斯科学仪器有限公司;DF-101S型集热式恒温加热搅拌器 上海力辰邦西仪器科技有限公司;RE-52AA型旋转蒸发仪 上海亚荣生化仪器厂;KQ-300DE型数控超声清洗器 昆山市超声仪器公司;H1650R型高速台式冷冻离心机 湖南湘仪实验室仪器开发有限公司;XH-C型涡旋混合器常州越新仪器制造有限公司;Litesizer 500型动态光散射(dynamic light scattering,DLS)仪 奥地利安东帕有限公司;Mini-P4型电泳槽、JY600C型电泳仪 北京君意东方电泳设备有限公司;LSM800型激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)卡尔蔡司光学有限公司;洁净工作台 苏州安泰空气技术有限公司。
1.3 方法
1.3.1 PLGA-NP及Cur-PLGA-NP的制备
称取一定量的F68溶于去离子水中,得其水溶液,备用;称取一定量的PLGA、Cur分别溶于乙腈中,得其储备液,备用。
溶剂挥发法:在室温磁力搅拌状态下取一定量Cur和PLGA乙腈溶液缓慢匀速滴加至F68水溶液中,滴加完毕后可调节温度至40 ℃,待有机溶剂完全挥发后,1000 r/min、10 m i n 离心2 次以去除未包封的C u r,上层溶液12000 r/min、10 min离心洗涤3 次以去除多余的F68,收集下层纳米粒即得Cur-PLGA-NP。
薄膜分散法:取一定量Cur和PLGA乙腈溶液于25 mL茄形瓶中,40 ℃、1100 r/min旋蒸至瓶内液体成膜,加入一定量同温度的去离子水,涡旋振荡至薄膜脱落,水浴超声分散,1000 r/min、10 min离心2 次以去除未包封的Cur,上层溶液12000 r/min、10 min离心洗涤3 次以去除多余的F68,收集下层纳米粒即得Cur-PLGA-NP。
1.3.2 单因素法筛选制备方法及配方
以制备方法(溶剂挥发法和薄膜分散法),两相混合方式(水相加入有机相中和有机相加入水相中),有机相与水相体积比(1∶1.25、1∶2.5、1∶5、1∶10)、Cur与PLGA质量比(1∶10、1∶15、1∶20)、PLGA质量浓度(10、20、30、40、50 mg/mL)、乳化剂F68质量分数(0.1%、0.2%、0.3%、0.4%、0.5%)为单因素,将Cur的负载率作为指标筛选出最优配方工艺。
1.3.3 Cur-PLGA-NP负载率的测定
1.3.3.1 Cur标准曲线的制作
用分析天平精密称取20 mg Cur,加入乙腈使其充分溶解得到质量浓度为2 mg/mL的Cur溶液,继续用乙腈稀释至质量浓度为0.1、0.2、0.5、1、2、5、10、20、30、40 µg/mL,取200 µL至96 孔板中,用酶标仪在420 nm波长处测定各质量浓度Cur溶液的吸光度,根据测得吸光度制作Cur的标准曲线,并进行线性拟合,得到回归方程。
1.3.3.2 Cur负载率的测定
取冻干后包埋Cur的纳米粒质量W1(mg),溶于一定量的乙腈,按照Cur检测方法计算得出Cur质量W2(mg),根据下式计算负载率:
1.3.4 粒径分布测量
取1 mL Cur-PLGA-NP溶液于粒径杯中,用DLS测定和记录每组样品的粒径和多分散性指数(polymer dispersity index,PDI)。
1.3.5 纳米粒稳定性考察
将Cur-PLGA-NP避光密封保存于4 ℃冰箱中,分别于第1天和第10天取样,测定其粒径和PDI。
1.3.6 Cur-PLGA-NP的Cur体外释放
精密吸取1 mL Cur-PLGA-NP溶液于经过预处理的透析袋(mw=8000~14000 Da)内,两端扎紧,并将其置于含有5%吐温-80的磷酸盐缓冲液(phosphate buffered saline,PBS)中,于37 ℃摇床中,100 r/min恒温振荡,在设定的时间点自释放介质中取出250 µL,并立即补入250 µL同温度的新鲜释放介质,用酶标仪在420 nm波长处测定Cur吸光度,带入Cur的标准曲线中即可计算出Cur的释放量,根据下式计算Cur的累计释放率:
式中:C1、C2、C3…Cn为第1、2、3…n个时间点Cur的质量浓度/(µg/mL);V为第1、2、3…n个时间点所取释放介质的体积/mL;V总为Cur-PLGA-NP溶液和释放介质的总体积之和/mL;M投为总投药量/µg。
1.3.7 BSA-NP和Tf-NP的制备
精密移取一定量的C6标记的PLGA-NP(制备方法同Cur-PLGA-NP,将Cur替换为C6),将其分散于2-(N-吗啉)乙磺酸(0.1 mol/L)缓冲溶液中,加入一定量的N-羟基琥珀酰亚胺和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐,室温下磁力搅拌20 min使纳米粒的羧基充分活化[25]。活化后再12000 r/min离心10 min,弃去上清液,将下层已活化好的纳米粒分散于PBS中,加入一定量的BSA或Tf,室温下搅拌4 h,12000 r/min、10 min离心洗涤3 次,除去未连接的蛋白,收集下层纳米粒,即得所需的BSA或Tf修饰的PLGA-NP(BSA-NP/Tf-NP)。
1.3.8 BSA-NP、Tf-NP的验证
用SDS-PAGE证实BSA或Tf修饰的纳米粒,SDSPAGE具体过程如下:
a)Tirs-甘氨酸电泳缓冲液的配制:用分析天平精密称取3.02 g Tris、18.8 g甘氨酸、1 g SDS,并将其置于1 L的试剂瓶中,向其中加入800 mL超纯水,超声使其完全溶解,最后用超纯水定容至1 L,置于室温下保存。
b)取BSA-NP、Tf-NP溶液各1 mL,12000 r/min多次离心,弃去上清液,使下层纳米粒尽可能残留少的液体。在BSA-NP、Tf-NP、BSA标准品、Tf标准品中加入5×loading buffer,91 ℃加热5 min。
c)按表1配制10%的分离胶和4%的浓缩胶,依次将蛋白标准品10 µL,待测样品加入到上样孔中。60 V、20 min,120 V、1 h条件下电泳,直至蓝色的泳带前沿到分离胶底端停止。切去浓缩胶,保留分离胶。将分离胶放入装有100 mL超纯水的表面皿中,在脱色摇床上摇动5 min,再重复洗涤2 次。将超纯水洗涤后的分离胶放入装有30 mL考马斯亮蓝染色液的表面皿中,在脱色摇床上染色60 min。加入50 mL考马斯亮蓝染色脱色液在脱色摇床上摇动,每次30 min,重复此操作至分离胶背景洗去,直至条带清晰。拍照保存。
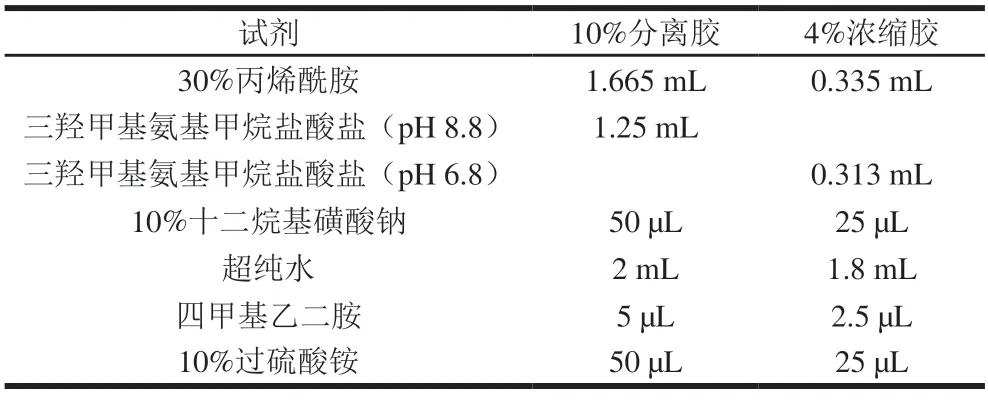
表1 10%分离胶、4%浓缩胶的配制Table 1 Preparation of 10% separating and 4% stacking gels
1.3.9 细胞摄取
纳米粒用C6进行荧光标记后,进行细胞实验,对比两种纳米粒的摄取量。
将长满细胞的25 cm2细胞培养瓶用胰酶消化处理后,取1×105/孔细胞接种于24 孔板中,37 ℃、5% CO2细胞培养箱培养,待细胞汇合度达到80%~90%时,弃去培养液,PBS清洗3 次,每孔加入200 µL用不完全培养液重悬的质量浓度为80 ng/mL的BSA-NP或Tf-NP溶液,继续培养设定时间,摄取结束后,用冰冷的PBS终止摄取并清洗细胞3 次,用胰酶消化处理后,收集细胞悬液1000 r/min离心5 min,弃去上清液,收集下层细胞加入100 µL细胞裂解液,过夜。加入100 µL乙腈,13000 r/min离心20 min,取100 µL上清液用酶标仪在λex=460 nm、λem=530 nm测量C6荧光强度进行分析。
摄取步骤同上,用冰冷的PBS终止摄取并清洗细胞3 次,TRITC Phalloidin对微丝进行染色,Hoechst33342对细胞核进行染色,使用CLSM进行检测。
1.4 数据处理
所有实验均进行3 次重复,采用Excel 2010进行实验数据统计,采用GraphPad Prism软件对实验结果进行分析及作图。
2 结果与分析
2.1 Cur-PLGA-NP的制备方法及配方优化
2.1.1 含量测定方法的建立
经计算,得到Cur-乙腈溶液的质量浓度在0.1~40 µg/mL范围内的线性回归方程A=0.0644c+0.0559(R2=0.9999),线性关系良好。
2.1.2 Cur-PLGA-NP的制备方法及配方筛选
2.1.2.1 制备方法的筛选
溶剂挥发法根据分散相和连续相的不同,分为单乳法和复乳法。单乳法-溶剂挥发法根据制备过程中的乳液类型分为水包油(O/W)型、油包油(O/O)型乳化-溶剂挥发法[26]。O/W型是将活性成分和载体溶解在有机试剂(如乙腈)中,并将其分散在含有乳化剂的水相中,通过机械搅拌或超声分散成O/W型乳液,除去内相溶剂后固化成球[27]。薄膜分散法是将脂溶性活性成分溶于有机试剂中,在烧瓶中旋转蒸发,使其在内壁形成一层薄膜,将水加入到烧瓶中不断搅拌即得纳米粒[28]。溶剂挥发法和薄膜分散法操作简单,对设备要求不高,适用于实验室等场所,因此在本研究中选用这两种方法进行比较。如图1A所示,不同负载质量比时,溶剂挥发法制备的纳米粒负载率均高于薄膜分散法,说明溶剂挥发法优于薄膜分散法。袁佳妮等[29]采用薄膜分散法的负载率为3.9%,单乳化-溶剂挥发法的负载率为6.8%,该研究结果同本实验结果相似,均为溶剂挥发法的负载率高。如图1B所示,油相加入至水相制备的纳米粒负载率均高于水相加入至油相,说明油相加入至水相中的两相混合方式更适用于该体系。这可能是由于利用溶剂挥发法,油相与水相的体积比为1∶2.5时制备得到的乳液类型为O/W型,而油相加入至水相分散性更好[30]。
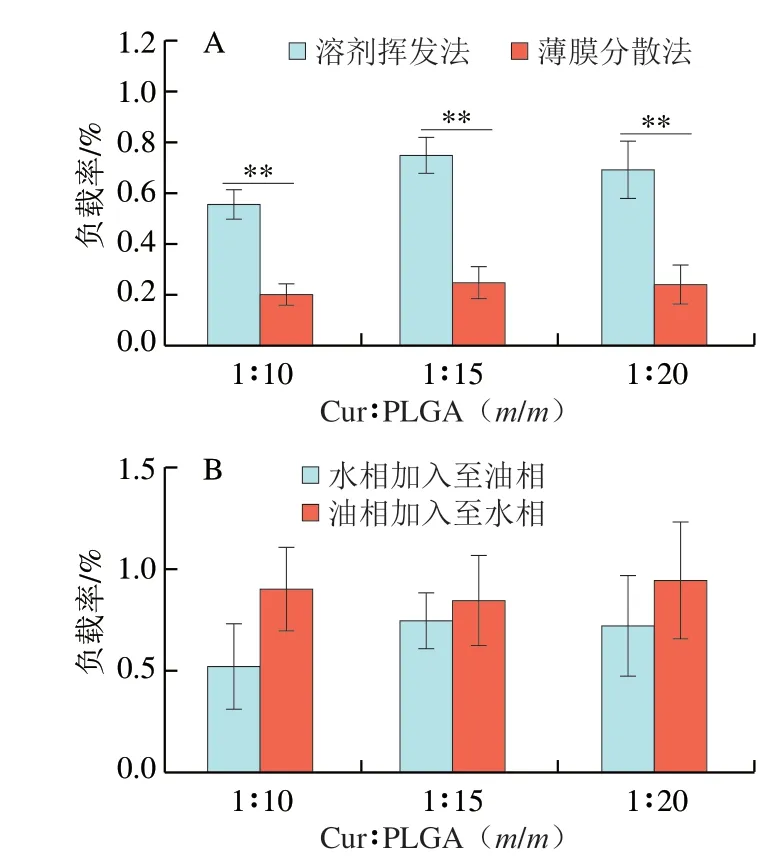
图1 Cur-PLGA-NP制备方法的筛选Fig.1 Screening of Cur-PLGA-NP preparation methods
2.1.2.2 配方的筛选
研究发现油水相比例、负载质量比、乳化剂质量浓度等会影响纳米载体的负载率[31],因此对这几种影响因素进行筛选。如图2A所示,油相和水相体积比为1∶2.5时制备纳米粒的Cur负载率均高于其他比例,说明油相和水相的体积比为1∶2.5的制备比例最优。有研究表明,降低油水相体积比能显著增加纳米粒的负载率,减少突释[32]。因为增大水相的量可达到稀释有机溶剂的效果,从而使有机溶剂以高质量浓度梯度跨过相界面[33]。曾庆晗等[34]发现当油相体积比较低时,姜黄素纳米乳液具有较高的稳定性,因而Cur具有较高的保留率。如图2B所示,Cur与PLGA质量比为1∶15时制备纳米粒的负载率均高于其他比例,说明Cur与PLGA质量比为1∶15的制备比例最优。Zaghloul等[35]发现载体和活性成分的比例对负载率影响较大。提高载体和活性成分的比例,可有效阻止纳米粒制备过程中活性成分向水相的泄漏,从而得到较高的负载率,但载体和活性成分的比例需控制在一定范围内,若活性成分过多则不能完全被载体包埋,从而造成药物损失,降低包封率[33]。如图2C所示,PLGA质量浓度为10 mg/mL时制备的纳米粒负载率均高于其他质量浓度,这可能是由于PLGA质量浓度大于10 mg/mL,溶剂挥发法滴加油相时局部的PLGA质量浓度过大,导致体系不稳定,容易析出[36]。F68是一类高分子非离子型表面活性剂,作为乳化剂降低了混合体系中各组分的表面张力,并在微滴表面形成较坚固的薄膜或由于乳化剂给出的电荷而在微滴表面形成双电层,阻止微滴彼此聚集,而保持均匀的乳状液[37]。如图2D所示,F68质量分数在0.1%~0.5%范围内时各组Cur的负载率差距不大,而质量分数为0.3%时样品的重复性较好。另外,F68的质量分数越大细胞毒性越大[38],因此选择0.3%作为F68的使用质量分数。
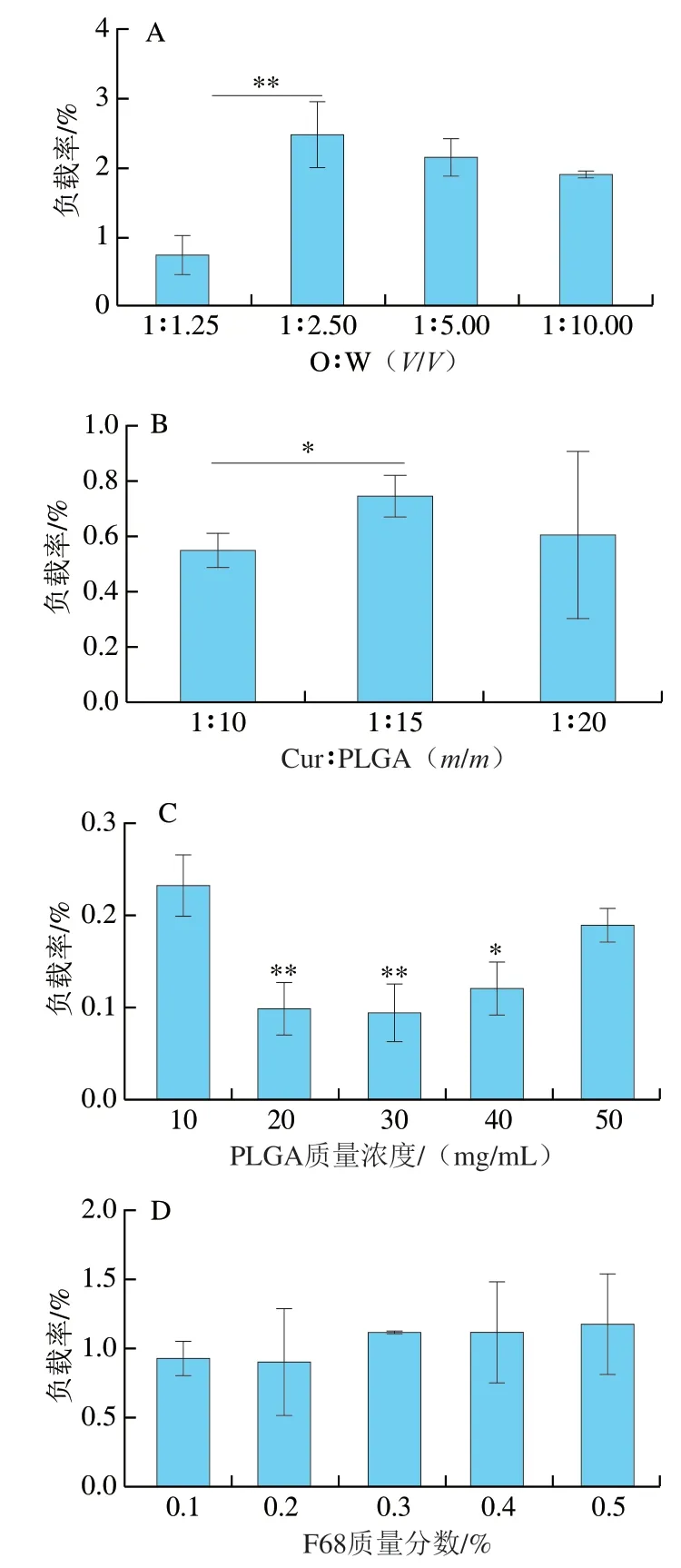
图2 Cur-PLGA-NP制备配方的筛选Fig.2 Optimization of the formulation of Cur-PLGA-NP
综上所述,Cur-PLGA-NP的最优配方为油水体积比为1∶2.5,Cur与PLGA质量比为1∶15,PLGA质量浓度为10 mg/mL,乳化剂F68质量分数为0.3%;制备方法如图3所示,通过溶剂挥发法及油相加入至水相中的两相混合方式制备纳米粒。
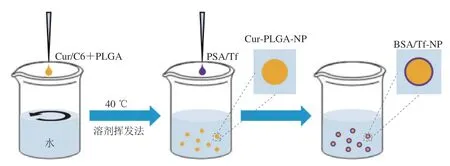
图3 包埋Cur及蛋白修饰的纳米粒制备示意图Fig.3 Schematic preparation of Cur-loaded and protein-modified nanoparticles
2.2 纳米粒的表征
2.2.1 包埋Cur纳米粒的表征
如表2所示,PLGA-NP的粒径在101 nm左右,Cur-PLGA-NP粒径稍有增加,约为103 nm,纳米粒的PDI均小于0.2,分散性较好。Cur-PLGA-NP的负载率约为5.58%,相对于Cur在水中的溶解度(11 µg/L)[39],PLGA-NP的包载提高了Cur在水中的溶解性。

表2 纳米粒的负载率、粒径Table 2 Loading rates and particle sizes of nanoparticles
如图4A所示,PLGA-NP具有淡蓝色乳光,显示出明显的胶体特征。Cur-PLGA-NP呈黄色,均匀分散在水中。纳米载体稳定性对于活性物质的存储、运输及机体吸收利用极其重要,而粒径及PDI是评判纳米载体稳定性的有效方法[40]。对各纳米粒的稳定性进行考察,结果显示PLGA-NP、Cur-PLGA-NP粒径、PDI在10 d内没有显著变化(图4B),说明PLGA-NP、Cur-PLGA-NP在4 ℃条件下10 d内稳定性良好。当活性物质被载体材料包埋时,其溶解度与稳定性可被提高,加上缓释作用,可达到更好的治疗效果[41]。为确定Cur-PLGA-NP的释放效果,以Cur溶液和Cur粗品作为对照,如图4C所示,随着时间的延长,Cur溶液、Cur粗品和Cur-PLGA-NP在模拟肠液中的溶出度逐渐增加。其中,由于Cur溶液中的Cur为分子状态,在1 d之内基本释放完全;而Cur粗品中有Cur结晶,故释放效果极差;Cur-PLGA-NP中的Cur经过纳米粒包埋后不仅提高了其在肠液中的溶出度并且具有一定的缓释效果。Su Ya等[42]研究发现Cur经过莲子蛋白质包埋后在肠道亦具有缓释效果,与本实验结果相似。
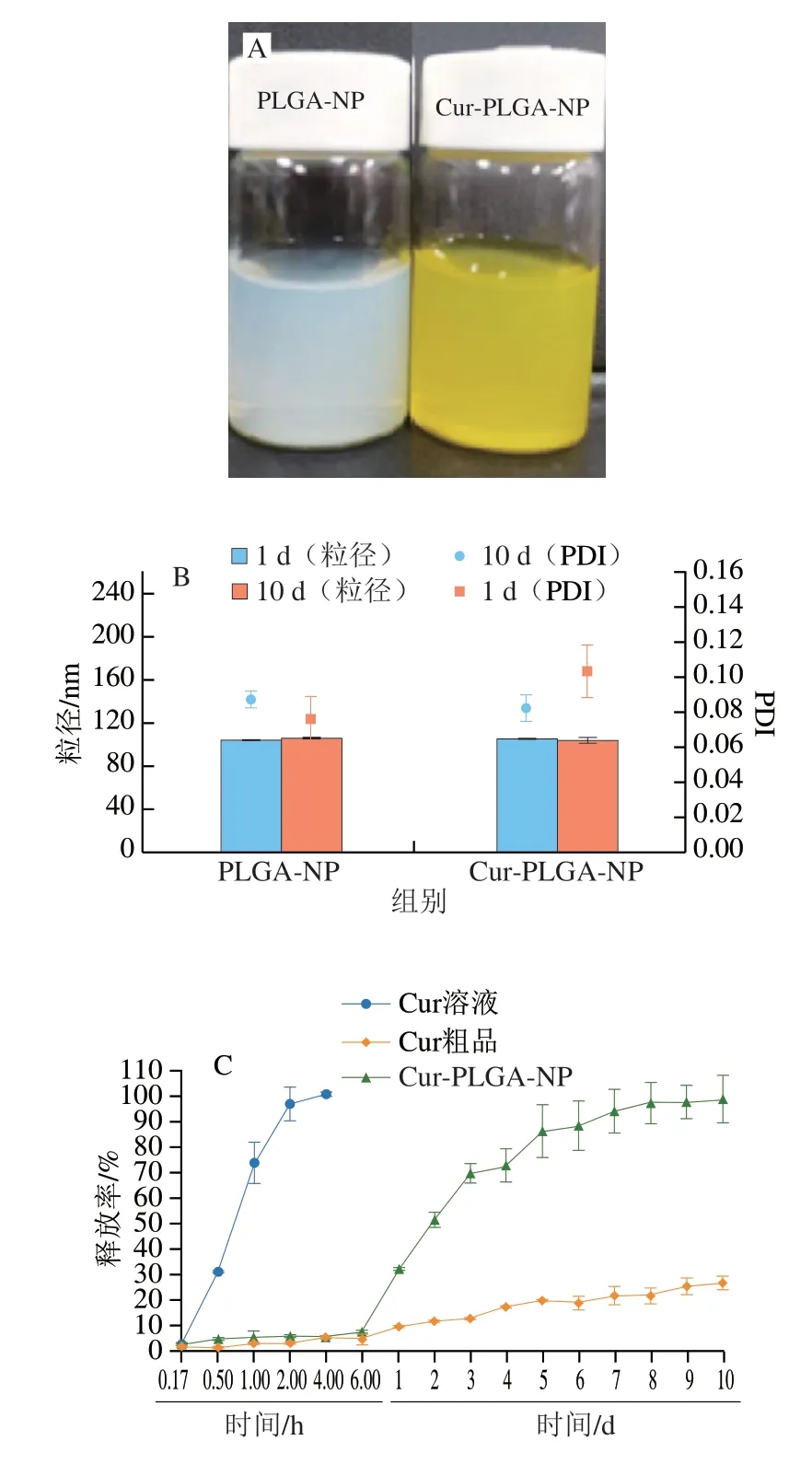
图4 纳米粒的表征Fig.4 Characterization of Cur-loaded nanoparticles
2.2.2 蛋白修饰后纳米粒的表征
SDS-PAGE有浓缩胶和分离胶的不连续系统,样品可以在进入分离胶之前先在浓缩胶上达到相同的初速度和初始值[43],目前主要用于蛋白质的纯度分析、蛋白质分子质量测定、蛋白质质量浓度测定、蛋白质修饰鉴定等方面[44]。蛋白修饰纳米粒的制备方法如图3所示,为验证BSA及Tf在纳米粒表面的修饰效果,利用SDSPAGE对修饰后的纳米粒进行检测。如图5A所示,BSANP和Tf-NP中皆检测到相对应的BSA和Tf条带,说明蛋白已成功修饰于纳米粒表面。粒径大小会影响肠细胞对纳米粒的摄取量,崔亚男等[45]发现在相同的给药质量浓度下,小粒径纳米粒入胞速率快于较大粒径的纳米粒,因此探究了BSA及Tf修饰对纳米粒粒径所带来的影响。如图5B所示,相对于PLGA-NP约为101 nm的粒径(表2),蛋白的修饰使纳米粒粒径明显增加。BSA-NP粒径为(152±3.23)nm,Tf-NP粒径为(159±6.91)nm,两种纳米粒粒径大小及分布相差不大,这在一定程度上排除实验过程中粒径大小带来的干扰。
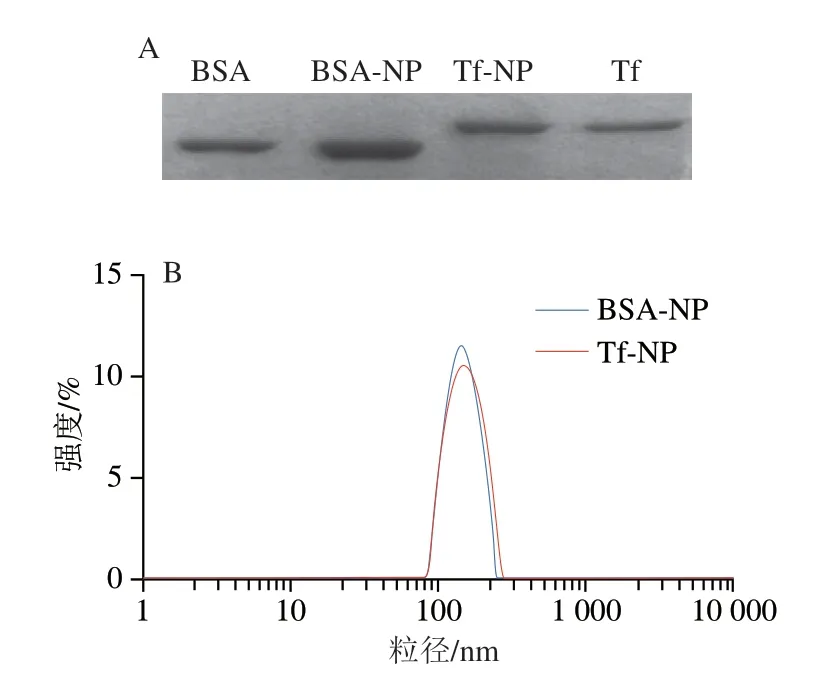
图5 蛋白修饰后纳米粒的表征Fig.5 Characterization of protein-modified nanoparticles
2.3 细胞摄取分析
C6是一种常用的疏水性荧光物质,在合适的激光条件下可检测到荧光信号,检测限低、灵敏度高,常作为疏水性活性物质的模型包载于运载体系中,用于纳米载体的标记[46]。为验证纳米粒的质量浓度与细胞摄取量的关系,选择不同质量浓度的纳米粒分别与细胞共孵育。如图6A所示,HT-29细胞对两种纳米粒的摄取量均随着纳米粒质量浓度的增加而增加,说明细胞摄取量与纳米粒质量浓度呈正相关。文星星等[47]制备的壳聚糖修饰的PLGA-NP细胞摄取时呈现质量浓度依赖性,也得到与本实验相似的结果。为验证Tf的修饰是否可提高肠细胞对纳米粒的摄取量,以BSA-NP作为阴性对照,对Tf-NP及BSA-NP的细胞摄取进行对比,结果显示Tf-NP组的胞内C6荧光强度显著高于BSA-NP组(图6B),说明Tf-NP组的摄取显著高于BSA-NP组,表明Tf的修饰可以提高HT-29细胞对纳米粒的摄取量。Wiley等[48]发现高的Tf修饰密度提高了纳米载体与血脑屏障上皮细胞表面受体的亲和力,增加了纳米载体的入胞量。Yang Dan等[49]发现与BSA修饰的金纳米粒相比,Tf修饰的金纳米在Caco-2细胞中的摄取量更高,大鼠肠道穿透力更强,口服生物利用度更高。这些结果表明Tf的修饰可提高肠细胞对纳米粒的摄取,进而提高活性物质(例如Cur)的吸收。
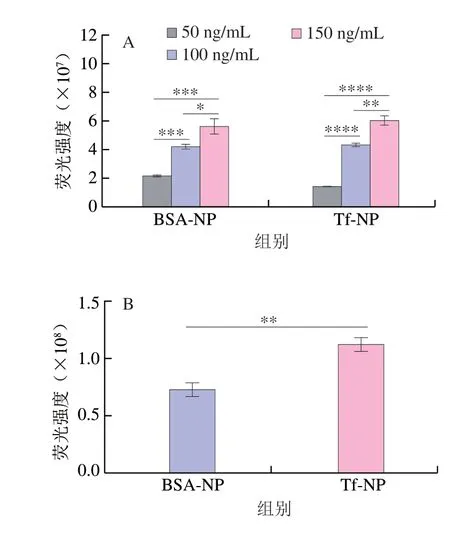
图6 细胞摄取分析Fig.6 Cell uptake of Cur-loaded nanoparticles
如图7所示,与未加入纳米粒的对照组相比,纳米粒组的细胞核、微丝皆无明显变化,说明纳米粒对细胞活性的影响较小,即纳米粒与细胞的生物相容性较好。纳米粒的荧光主要分布在细胞核和微丝之间,说明纳米粒已进入到细胞内且大部分处于细胞质中,与文星星等[47]在倒置荧光显微镜下观察到制备的壳聚糖修饰的PLGANP多分布在核周围的结果相似;与BSA-NP组相比,Tf-NP组荧光强度强于BSA-NP组,说明Tf-NP组摄取量比BSA-NP组多,这与图6B的细胞摄取结果一致,表明主动靶向纳米粒有助于Cur的吸收。
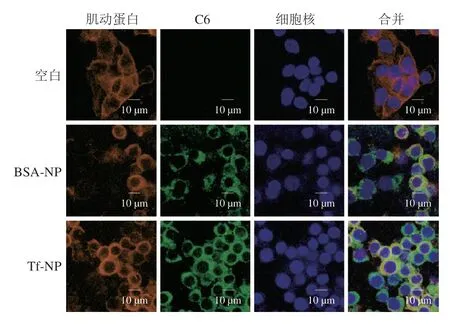
图7 纳米粒与HT-29细胞共孵育12 h后的CLSM图Fig.7 CLSM of Cur-loaded nanoparticles after 12 h incubation with HT-29 cells
3 结论
Cur在水中极低的溶解度大大限制了它的应用,通过单因素法筛选得到了负载率高、稳定性好的包埋姜黄素的PLGA-NP,该体系有效地改善了Cur的水溶性,可使Cur在模拟肠液中完全释放,同时具有良好的缓释效果。通过利用Tf对纳米粒表面进行修饰进一步提高了肠细胞对纳米粒的摄取率。综上所述,Tf修饰PLGA-NP可提高Cur的负载率及吸收效率,这为水溶性差的活性物质运载体系设计提供参考。
