3 种亲水胶对磷酸化鱼糜/蟹肉混合凝胶品质的影响
2023-09-13朱亚军鲁玉凤夏立志刘松昆卢曜昆姜绍通陆剑锋
朱亚军,叶 韬,鲁玉凤,夏立志,刘松昆,卢曜昆,姜绍通,林 琳,陆剑锋
(合肥工业大学食品与生物工程学院,安徽省农产品精深加工重点实验室,农产品生物化工教育部工程研究中心,安徽 合肥 230009)
鱼糜是通过去头、去内脏、切片、去骨、洗涤、脱水、精滤、冷冻保护剂混合后进行冷冻等各种分步工艺生产的精制鱼肌原纤维蛋白,是一种可以直接用于食品加工的中间产品[1]。当加工鱼糜制品时,在碎鱼肉中加入2%~3%的食盐,经绞碎、擂溃或斩拌,能够形成非常黏稠且具可塑性的溶胶状肉糊,即鱼糜。这是因为在食盐和擂溃的机械破坏作用下,促进了肌原纤维的粗丝和细丝的溶解,在溶解过程中其主要成分肌球蛋白和肌动蛋白吸收大量的水分并聚合形成肌动球蛋白的溶胶[2]。除了增强鱼糜产品的风味,在鱼糜加工过程中,盐主要用来提取肌原纤维蛋白,以获得所需的质地和味道。但目前大量科学研究表明,过量食用盐会导致许多健康风险,如高血压、心脏病和其他心血管疾病[3]。如果不添加盐,肌球蛋白重链(myosin heavy chain,MHC)就不可能聚集,因为缺乏肌球蛋白溶解和展开[4]。此外,盐浓度的降低对鱼糜蛋白质的可提取性和溶解性产生不利影响,导致凝胶结构和机械性能较差[5]。
对于低盐鱼糜凝胶产品主要有两种研究思路,一种是挖掘外源添加剂或钠盐替代品,另一种是开发新的加工技术,以弥补低盐对凝胶性能的不良影响。如Tuankriangkrai等[6]报道了改性木薯淀粉(羟丙基磷酸二淀粉)对经过不同冻融循环的大眼鲷(Priacanthus tayenus)鱼肉凝胶的质地和感官特性的改善作用。还有一些研究发现,在适当的加工条件下,添加氨基酸[7]、多糖[8]、油[9]和谷氨酰胺转氨酶[10]可以显著改善低盐鱼糜的凝胶特性和质地。另外据报道,高静水压[11]、微波[12]、超声波[13]、微波与蒸汽结合[14]等技术,以部分取代传统的水浴加热均对鱼糜凝胶的性质有所改善。
蛋白质由氨基酸组成,通过生化或物理方法使氨基酸残基和多肽链发生变化,可以对蛋白质进行改性,从而改变蛋白质的结构和性能[15]。磷酸化可以改变膳食蛋白质的功能特性,如溶解性、热稳定性、乳化特性、起泡特性和凝胶特性[16]。某些肌原纤维蛋白和肌球蛋白特定丝氨酸残基处的磷酸化可能对肌动蛋白解离至关重要,这可能有助于改善肉制品的保水能力、质地和嫩度[17]。分离蛋白的磷酸化可能是一种修饰过程,可以产生带有负电荷侧链的蛋白质。肌原纤维蛋白的磷酸化可以调节肌肉收缩,从而影响肌动球蛋白的解离。Chen Lijuan等[18]发现,肌原纤维蛋白磷酸化可能通过收缩机制和糖酵解影响肉类僵硬度,最终影响肉类产品的嫩度。研究发现,磷酸化蛋白分离物可以通过Zn2+更好地交联,从而产生更大的凝胶破断力和破断距离[19]。化学磷酸化是指用磷酸盐化合物对食品蛋白质进行化学修饰,以获得磷酸化蛋白质。三聚磷酸钠(sodium tripolyphosphate,STP)有较多的负电荷,可提高海鲜、肉类和家禽的持水能力,已被批准作为食品添加剂。研究表明,STP在被用于单角革鲀(Aluterus monoceros)皮肤中明胶的磷酸化中,可以改善明胶的性质[20]。
圆苞车前子壳是一种富含可溶性和不溶性膳食纤维黏性多糖,具有降低胆固醇、通便和提高胰岛素敏感性等功能,目前主要用于药物和药理补充剂中[21]。结冷胶(gellan gum,GG)是一种阴离子微生物多糖,其凝胶形成能力强、组织相容性和复配性较好[22]。魔芋胶(konjac glucomannan,KGM)是一种非离子型高分子杂多糖,具有良好的凝胶性和保水性,由于其在降血糖、降血脂和抗癌等方面的作用而在食品及医药领域应用广泛[23-24]。这3 种多糖亲水胶都被证明对改善鱼糜凝胶特性具有一定积极作用。Singh等[25]研究了圆苞车前子壳粉(psyllium husk powder,PHP)对金线鱼糜凝胶流变学和结构特性的影响,结果表明适当的PHP增加了凝胶的破断力和持水性,诱导形成更紧密的网络结构以改善凝胶性能。Wang Xuejiao等[26]报道了4 种多糖(卡拉胶、高酰基结冷胶、黄原胶、刺槐豆胶)对乳化鱼肠中盐释放和咸度的影响,发现卡拉胶提高了香肠的咸味感知,能够调节质地属性和微观结构促进盐释放,以减少香肠中的盐添加。近年来,尽管已有广泛研究通过添加亲水胶体对鱼糜凝胶的性质进行改善,但鲜有其对于磷酸化鱼糜制品性质的影响分析。根据研究,离子不断包围溶液中的蛋白质和多糖分子,通过静电相互作用或水合效应影响蛋白质和多糖的溶解度、流变学和胶凝特性,而多价离子可同时与多种氧结合,并作为多糖和蛋白质的交联剂[27]。而磷酸化使得鱼糜蛋白质体系的负电荷增加,其是否对蛋白质和多糖亲水胶的相互作用有影响,并且是如何影响的,值得关注,这可为低盐鱼糜制品的开发提供新的思路和解决方案。
1 材料与方法
1.1 材料与试剂
AAA级冷冻鲢鱼鱼糜,含6%蔗糖,20 kg/块,购自井力水产食品有限公司,贮存在-20 ℃条件下不超过2 个月;中华绒螯蟹蟹肉购自于福恩食品科技有限公司。
磷酸化试剂(STP、PHP、GG和KGM)浙江一诺生物科技有限公司;食品级肠衣 大润发超市;异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、罗丹明(Rhodamine)B荧光染色液 索莱宝生物科技有限公司。
1.2 仪器与设备
S2-5斩拌机 广州旭众食品机械有限公司;SU-50型卡扣机 浙江瑞安特丰机械厂;HZ-2两孔数显水浴锅江苏金坛市环宇科学仪器厂;TA-XT物性分析仪 英国Stable Micro System公司;CT15RT高速冷冻离心机 上海天美生化仪器与设备工程有限公司;FA1104N电子分析天平 海民桥精密科学仪器有限公司;Q200差示扫描量热(differential scanning calorimetry,DSC)仪 美国TA公司;Anton Paar MCR旋转流变仪 奥地利安东帕有限公司;A1激光共聚焦显微镜 日本Nikon公司。
1.3 方法
1.3.1 混合凝胶的制备
取适量冷冻鱼糜解冻(4 ℃、12 h)→斩拌(添加1.8%食盐和0.3% STP)至肉糊状→(手动)灌肠→两端卡扣密封→二段水浴加热→冰水冷却→放置过夜(4 ℃)→测定凝胶特性。
对照组的亲水胶添加量为0%,PHP、GG和KGM添加量为0.1%、0.2%、0.3%、0.4%、0.5%。
对STP诱导蛋白质化学磷酸化实验条件的具体研究内容已做单因素试验,鱼糜与蟹肉混合比例的确定根据梁峰等[28]结果确定。
1.3.2 凝胶强度测定
使用TA-XT物性分析仪测定SG和MG样品的破断力(g)和破断距离(cm)。样品切割成直径约为30 mm、高度约为25 mm的圆柱体。测试具体设置和参数如下:鱼糜穿刺模式,P/5S球形探头(直径5 mm),预压缩速率1.0 mm/s,下压缩速率1.5 mm/s,测试速率1.0 mm/s,恢复速率10.0 mm/s,按压距离15 mm,触发类型:自动(g),传感力5.0 g。对每个样品进行6 份测量,删除最大值和最小值后计算平均值。凝胶强度计算如式(1)所示:
凝胶强度=破断力×破断距离(1)
1.3.3 持水性测定
持水性的分析采用离心法进行,该方法基于Liang Feng等[13]的方法,并稍作修改。准确称量约2 mm厚的凝胶样品(1~2 g)(W1),并将其切成两等份,用两层滤纸包裹并转移到50 mL离心管中。每个样品在室温(约24~26 ℃)以8000 r/min离心10 min。离心后,再次称量样品(W2)。每个实验进行3 次平行。根据式(2)计算每个样品的持水性:
1.3.4 动态流变
使用直径25 mm平行板,载物台与平板间的距离为0.1 mm,升温速率2 ℃/min,温度范围10~90 ℃,振荡频率0.1 Hz,应变2%,温度、储能模量(G’)和损耗模量(G”)的数据每30 s记录一次。根据式(3)计算损耗因子(tanδ):
1.3.5 DSC
准确称取约15 mg的混合凝胶放入液体铝坩埚中并密封,保护气味氮气,流速为50 mL/min左右,温度范围为20~90 ℃,升温速率为5 ℃/min,保温5 min。记录热流随温度变化的数据,随后使用TA analysis软件进行分析,得到各个特征峰的变化温度和热焓。
1.3.6 激光共聚焦显微镜
用磷酸盐缓冲液(phosphate buffered saline,PBS)配制含有2 种荧光染料的染色液FITC 0.25 g/L,Rhodamine B 0.025 g/L。每个样品称取0.25 g,装入1.5 mL离心管。每管加入1 mL荧光染料,重悬样品。室温染色10 min,3000 r/min离心5 min,去除上清多余的染色液。加入1 mL PBS重悬,静置10 min,3000 r/min离心5 min,去除上清多余的染色液。如此再重复一次。用Nikon A1激光共聚焦仪器拍照,使用40 倍物镜进行,FITC使用488 nm激发光,Rhodamine B使用561 nm激发光。
1.4 统计分析
使用SPSS 25.0中Duncan模型进行单因素方差分析,用于确定从样本中获得实验数据之间的差异显著性(95%置信范围)。实验数据以表示。
2 结果与分析
2.1 3 种亲水胶对磷酸化低盐MG凝胶强度的影响
不添加STP的磷酸化低盐MG凝胶强度见图1a~c。由图1d可知,随着添加量的增加,PHP处理组凝胶的破断力先增加后下降(P<0.05),添加量为0.1%时,破断力最大。GG处理组凝胶的破断力变化趋势与PHP处理组变化趋势一致,不同的是,在添加0.1%的GG后,混合凝胶破断力的变化值较大。KGM的添加对凝胶破断力的改善效果不明显(P>0.05),在添加量≥0.3%时,凝胶破断力呈下降趋势。由图1e可知,PHP添加量对凝胶的破断距离没有显著影响(P>0.05),GG和KGM处理组的凝胶破断距离均随着添加量的增加而呈下降的趋势,不同的是,GG组凝胶的破断距离在添加量≥0.2%时开始显著降低(P<0.05),而KGM处理组破断距离降低出现在添加量≥0.3%时。由图1f可知,3 种亲水胶均在添加量为0.1%时,磷酸化MG的凝胶强度最佳。在添加量0.1%~0.2%之间,随PHP和GG添加量的增加,凝胶强度显著下降(P<0.05),之后随着添加量的增加,凝胶强度逐渐下降,但下降程度不显著(P>0.05)。不同类型的蛋白质或不同类型的多糖的存在都会影响凝胶网络的性质,其中多糖被认为影响在加热过程中膨胀的蛋白质的热稳定性,蛋白质和多糖之间、各种蛋白质之间以及蛋白质和水之间的相互作用决定了生物聚合物的溶解度、它们形成黏弹性凝胶的能力以及它们在界面上的行为[29]。因此在磷酸化MG中添加适量的多糖可以增强凝胶网络的形成,而在添加量较大时,多糖链的长度超过一定限度后所产生的空间位阻效应不利于蛋白质的聚集[27]。当添加量为0.1%时,PHP、GG、KGM均不同程度地提高了磷酸化MG凝胶强度,GG和KGM增强效果更加显著,这可能是较低添加量的GG和KGM通过氢键与肌原纤维网络发生相互作用,从而加强凝胶基质的胶凝性质。随着添加量的增加,这3 种亲水胶都造成混合凝胶强度下降,其中较高含量的PHP对凝胶强度的不利影响比同含量的GG和KGM小。这可能是3 种亲水胶阻碍磷酸化MG蛋白质链之间的相互作用程度不同,从而造成凝胶性能的差异。另外据Gao Zhiming等[27]报道,不同电荷的离子可以引起多糖构象的转变,而这种构象的转变似乎影响蛋白质/多糖静电络合程度。因此推测蛋白质/多糖静电络合可通过控制多糖的构象转变,从而控制食品的胶凝性质和黏弹性。
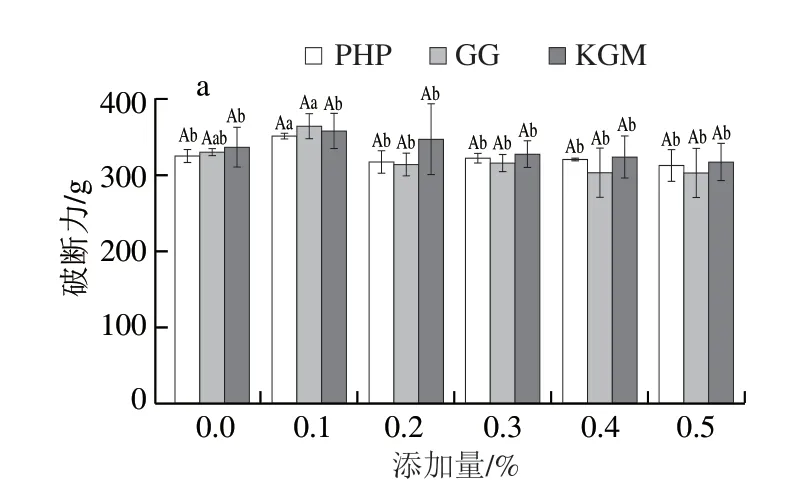
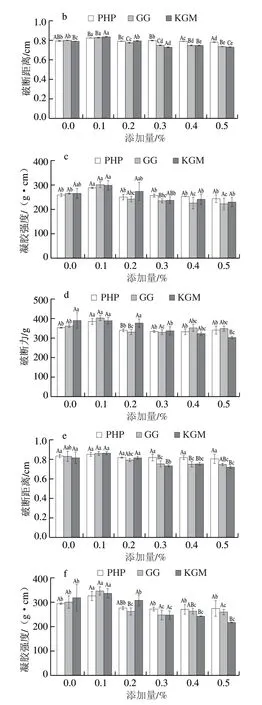
图1 3 种亲水胶添加量对磷酸化低盐鱼糜/蟹肉混合凝胶强度的影响Fig.1 Effect of addition of three hydrophilic colloids on breaking force,deformation and gel strength of phosphorylated low-salt surimicrab meat mixed gels
2.2 3 种亲水胶对磷酸化低盐MG持水性的影响
持水性代表了蛋白质在三维凝胶网络中保持水的能力,并经常用于衡量鱼糜凝胶的品质。如图2所示,在未磷酸化的低盐MG中,PHP、GG和KGM 3 种亲水胶对混合凝胶的持水性无显著影响,但经过磷酸化处理后,同一添加量的PHP、GG和KGM对凝胶持水性逐渐产生显著影响,且亲水胶添加量增加时,这种影响更为明显,推测不同亲水胶添加量可能会造成不同程度的磷酸化水平。GG的添加明显改善了凝胶持水性,虽然随着GG添加量的继续增加,持水性有轻微下降,但相比未添加GG的MG,持水性总体呈增加趋势。这可能是由于GG中含有丰富的亲水性基团,可以在凝胶基质中形成更小的水通道,导致水分子被封锁在蛋白质基质中,从而增强了凝胶的持水性[30]。随着PHP添加量的增加,PHP处理组的持水性不断增加,当添加量达到0.4%时,PHP组的持水性降低,表明PHP在适当水平上决定了凝胶网络的持水能力。随着KGM添加量增加,KGM对混合凝胶持水性有不利影响。持水性的降低可能是因为热诱导凝胶形成后肌原纤维蛋白-多糖系统分离,减弱了肌原纤维蛋白的聚集程度,从而导致持水性的降低[31]。
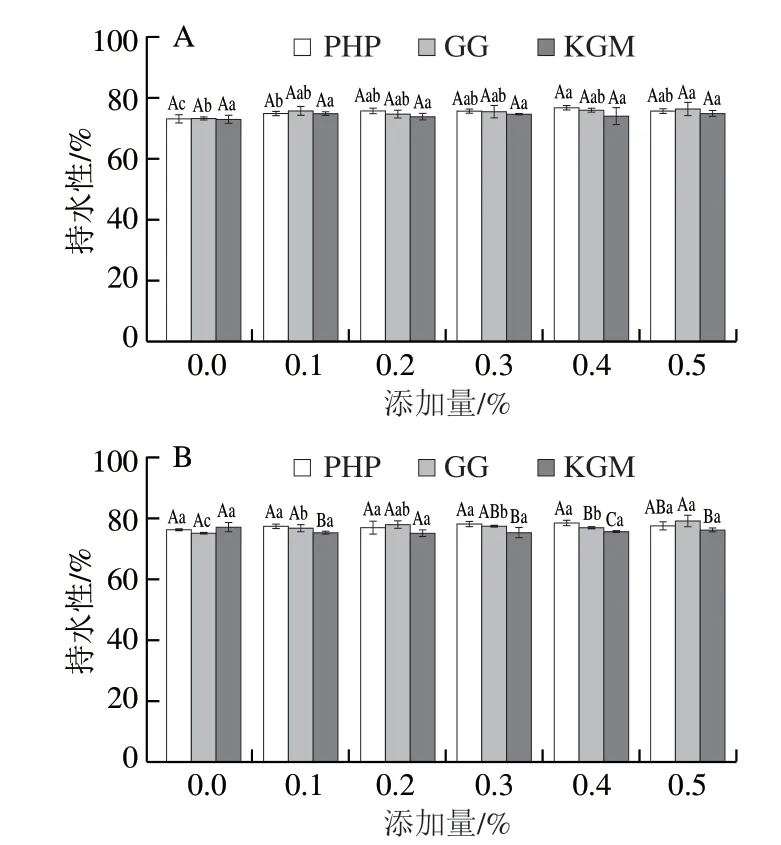
图2 3 种亲水胶添加量对磷酸化低盐鱼糜/蟹肉混合凝胶持水性的影响Fig.2 Effect of addition of three hydrophilic colloids on water-holding capacity of phosphorylated low-salt surimi-crab meat mixed gels
2.3 3 种亲水胶对磷酸化低盐MG黏弹性的影响
动态流变常用于研究鱼糜的热聚集,流变学涉及物质的流动和变形,特别是它们在固体和流体之间的瞬态区域中的行为,G’描述了胶凝体系的弹性特性并代表了凝胶基质的强度,能够反映凝胶的弹性及转变温度[32]。图3表示混合凝胶的动态黏弹性行为变化,温度较低时,PHP、GG和KGM处理组的混合凝胶G’略微下降,接着随温度升高G’持续增加,这表明凝胶基质在更高的非共价作用(例如二硫键和疏水相互作用)下建立了强凝胶网络。Luo Huabin等[33]发现,鱼糜淀粉体系中G’在低温阶段出现增加,此结果与本实验不一致,这可能是磷酸化MG的电负性增加,破坏了蛋白质的静电相互作用,对低温阶段的蛋白质分子聚集有一定的延缓作用[34]。加热过程中G’的增加被认为是肌球蛋白重链和肌动蛋白的变性,表明形成致密且高弹性的蛋白质凝胶,而部分凝胶样品的G’在加热后期出现下降,这可能是氢键形成的初始结构在加热过程中部分破裂或蛋白质网络结构遭到破坏[35]。在本研究中,PHP和GG的添加提高了G’开始降低的温度,这有利于凝胶性质的改善,而当其添加量过多时,多糖自身的凝胶特性或许对混合凝胶蛋白质网络结构有不利作用。因此在流变测定结果的高温阶段,有几组凝胶的G’没有明显降低,但其凝胶特性并没有得到改善。从G”观察各组凝胶所形成网络的黏度特性,G”表现出与G’相似的变化模式,G”始终小于G’,表明在MG体系中,是弹性为主体的凝胶体。
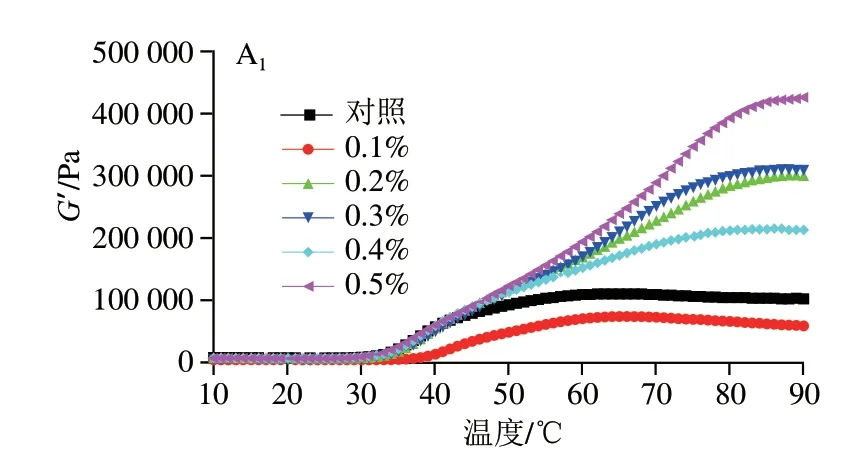
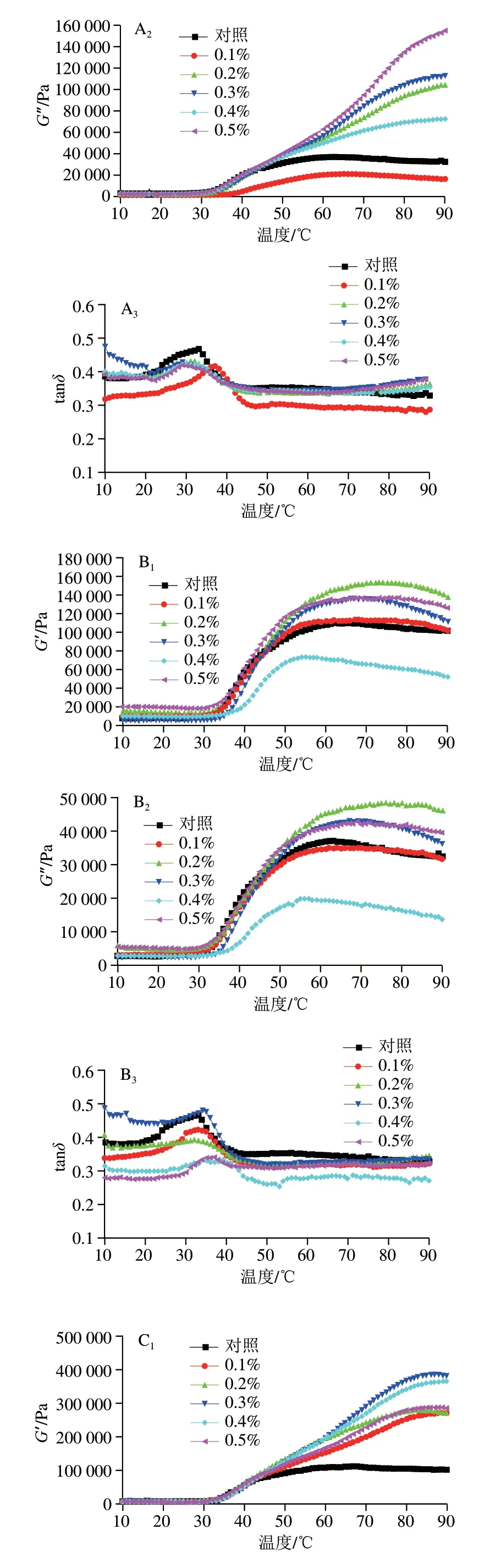
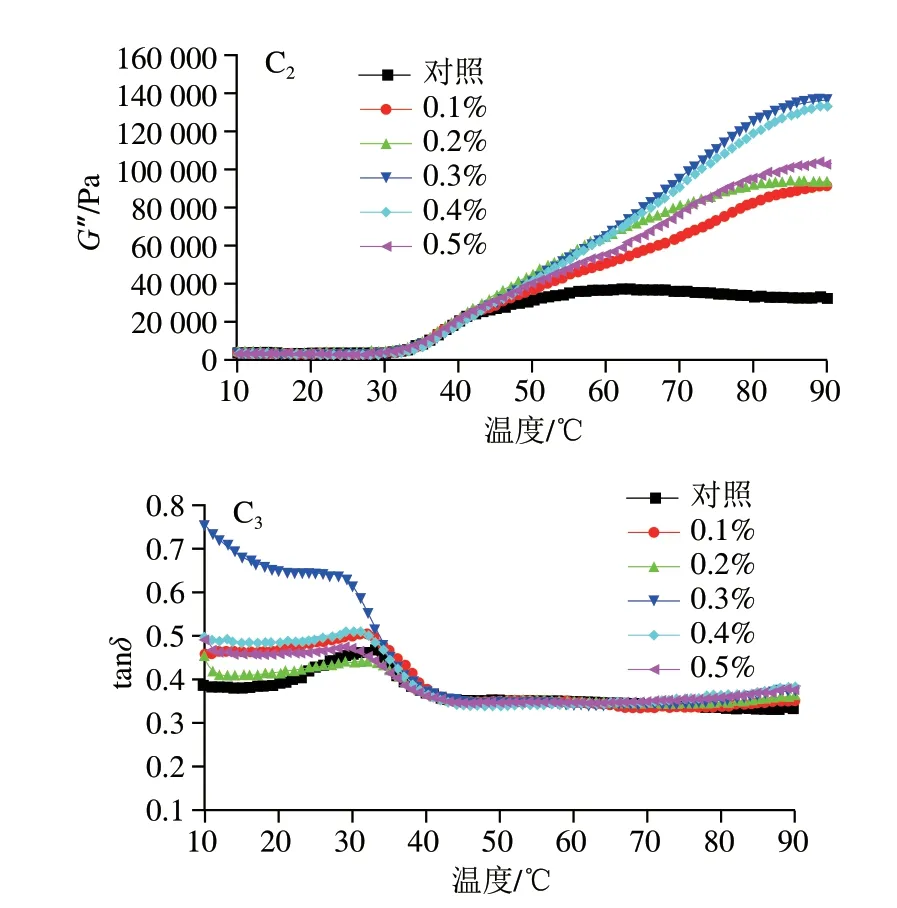
图3 3 种亲水胶添加量对磷酸化低盐鱼糜/蟹肉混合凝胶黏弹性的影响Fig.3 Effects of addition levels of three hydrophilic colloids on viscoelasticity of phosphorylated low-salt surimi-crabmeat mixed gels
为进一步得到不同添加量的3 种亲水胶与磷酸化混合凝胶性质与流变学变化的联系,进行tanδ的计算,反映凝胶的相对黏弹性,纯固体的δ为0°,纯液体为δ为90°[36]。如图3所示,所有处理组的tanδ<1.0且具有相似的变化轨迹,表现为略微降低—增加—降低,表明所有鱼糜在热凝胶化后将经历相同程度的溶胶—凝胶转变。tanδ曲线在30~40 ℃之间有峰,是蛋白质加热后肌球蛋白结构展开增加了溶胶的黏度,当温度约为42 ℃(凝胶凝固阶段)时,由于蛋白质网络形成,分子之间的二硫键和疏水相互作用得到加强,导致刚性和强度增加,流动性减弱,因此tanδ下降。tanδ的变化差异可能是肌原纤维蛋白或干扰胶凝组分浓度和功能的差异,以及与蛋白质将水截留到凝胶网络中的能力有关[37]。PHP添加量为0.1%时,凝胶的tanδ最小,其凝胶弹性最佳,这与前面的凝胶性质测定结果一致。在温度低于42 ℃,GG添加量0.5%的凝胶tanδ最小,在温度高于42 ℃后,添加量0.4%凝胶tanδ最小。从图3可以看出,0.4%和0.5%组的峰较平,而0.1%的峰范围更大,与凝胶性质的结果结合分析,可以推测,0.1% GG和MG溶胶凝胶化阶段充分变性,少量的GG分子热运动因升温加剧,大分子缠结减弱,氢键的断裂充分,从而在后续鱼糕化过程中与鱼糜/蟹肉之间的热聚集效果更好。KGM在加热开始时,对照组的tanδ最小,而在鱼糕化过程中,随着温度升高变化不明显,90 ℃时可以看到对照组和0.1%组的tanδ相差不大且在所有添加量组中最小,这和两者凝胶破断力和破断距离无明显差异的结果一致。
2.4 3 种亲水胶对磷酸化低盐MG蛋白变性的影响
由图4可以看到,在45 ℃和68 ℃附近出现了吸热峰,表明肌球蛋白的头部和尾部以及肌动蛋白相继发生了结构融化或者解折叠的变性,在76 ℃左右出现放热峰,表征了肌动蛋白在此温度下发生了分子聚集行为[38]。
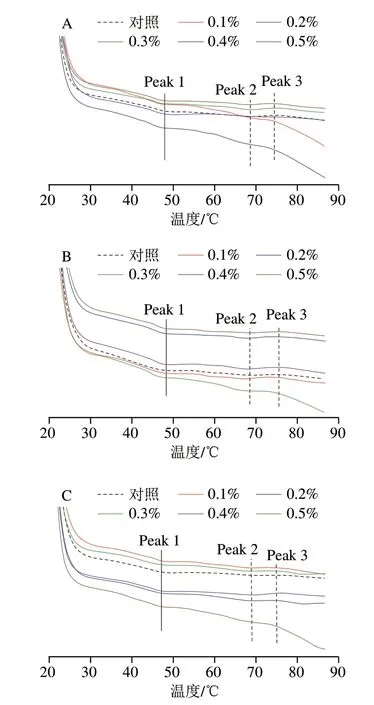
图4 3 种亲水胶添加量对磷酸化低盐鱼糜/蟹肉混合凝胶蛋白变性的影响Fig.4 Effects of addition levels of three hydrophilic colloids on protein denaturation in phosphorylated low-salt surimi-crab meat mixed gels
如表1、2所示,MG的Peak 1中,3 种亲水胶处理组的起始温度变化相似,均比对照组显著增加;PHP处理组的峰值温度随着添加量增加而略增加,温度区间较之对照组明显缩短;添加GG和KGM处理组峰值温度无变化,除了0.4% GG的凝胶,其他添加量组的温度变化区间较之对照组缩短;除了添加0.5% KGM的凝胶,其他添加量组的温度变化区间较之对照组缩短。PHP添加量较少(0.1%~0.2%)和较多(0.5%)时,Peak 1热焓明显减少,GG处理组Peak 1热焓无变化,KGM处理组Peak 1热焓较之对照组明显减少。第1个峰对应于肌球蛋白的吸热转变,转变温度预计是其他作用力导致氢键和蛋白质聚集破裂的迹象,这是打破氢键并逐渐将蛋白质的稳定三维结构展开到其变性结构中所必需的。Zhang Tao等[29]的研究发现脱乙酰化的魔芋葡甘露聚糖改变了阿拉斯加鳕鱼糜的肌动蛋白的内热转变,而对肌球蛋白的吸热转变无影响,这与本研究结果不一致,这可能是由于磷酸化的鱼糜/蟹肉蛋白质静电作用增强,增加了肌球蛋白与亲水胶之间的静电络合作用,增加了蛋白质结构的稳定性,导致转变温度的升高。温度区间的缩短表明,肌球蛋白的转变可以在较短的时间内完成,而焓值减少,表明在添加亲水胶的磷酸化MG体系中,肌球蛋白的变性需要更高的温度和更少的能量,在变性过程中温度将成为主要因素。
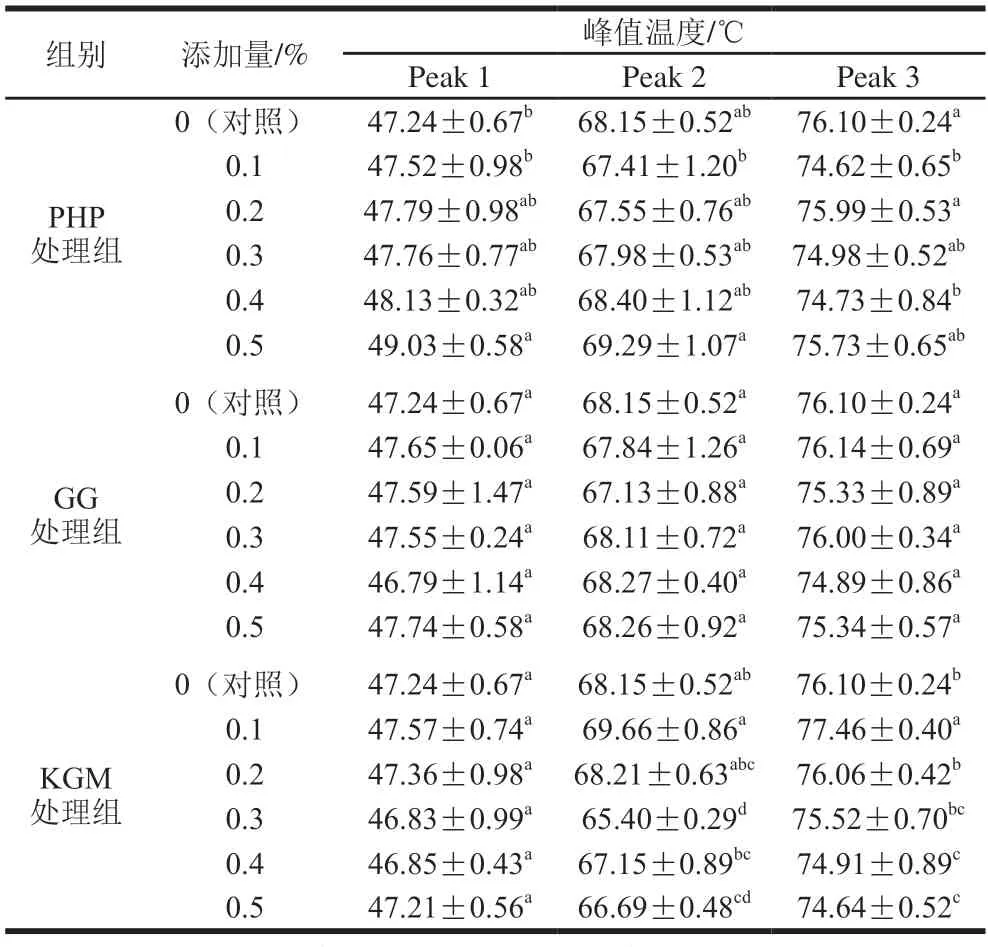
表1 添加PHP、GG和KGM的混合凝胶DSC特征温度Table 1 DSC characteristic temperatures of mixed gels with the addition of PHP,GG or KGM
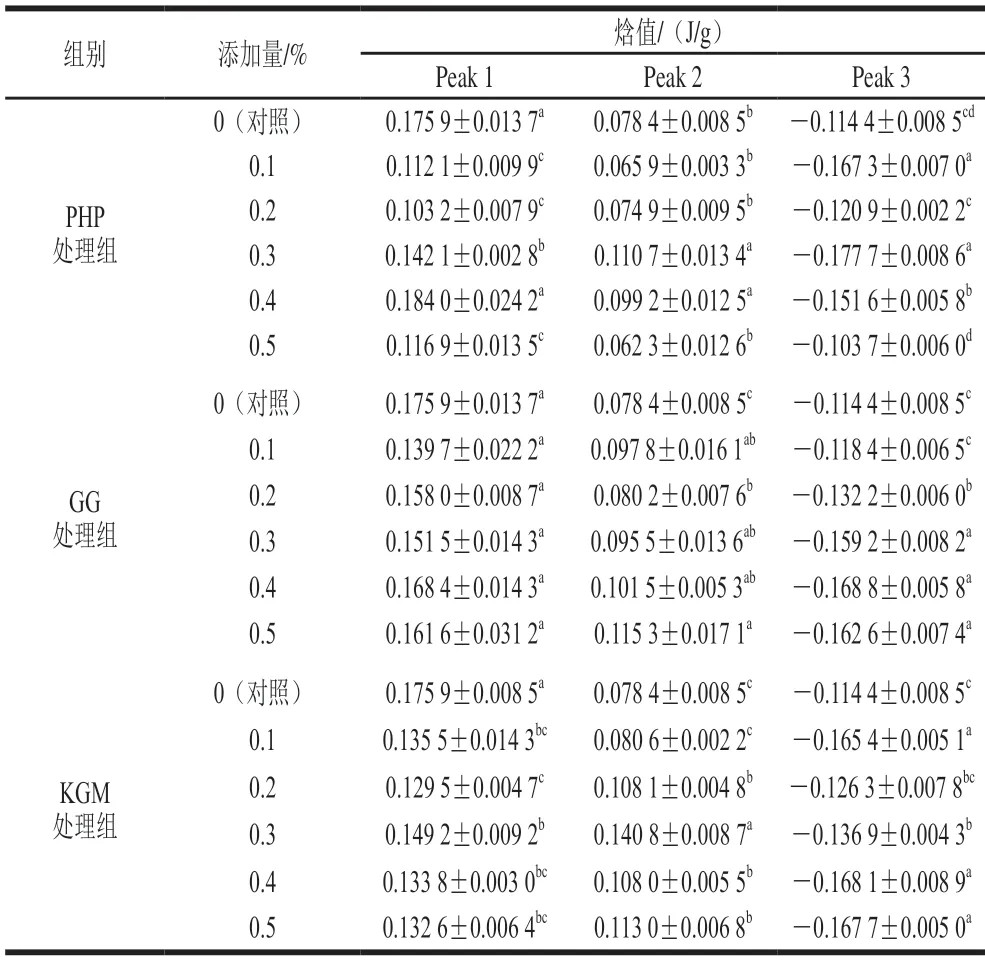
表2 添加PHP、GG和KGM的混合凝胶DSC热焓Table 2 DSC enthalpy of mixed gels with the addition of PHP,GG or KGM
第2个峰对应于肌动蛋白的内热转变,在混合凝胶的Peak 2中,PHP和GG处理组没有明显变化;KGM处理组随添加量增加,峰值温度有所降低,并且温度区间总体呈缩短趋势,在添加量0.1%时显著缩短。随添加量增加,PHP组凝胶的Peak 2的热焓值先增加后减小,GG处理组的Peak 2热焓值较之对照组增加,KGM处理组Peak 2热焓先增加后减小,在添加量0.3%达到最大值。肌动蛋白分子量较小,由之前的研究结果表明[39],肌动蛋白磷酸化水平较高,但在凝胶网络结构形成中参与度较小。因此可以推测,肌动蛋白在低温阶段的聚集程度低,KGM与其相互作用,导致氢键被破坏的转变温度降低和温度区间的缩短。但从焓值来看,PHP和KGM的少量添加增强了MG的蛋白质结构稳定性,GG对热稳定性的改善作用似乎随着添加量的增加而增加,这可能是由于其结构和性质的不同[40]。
第3个峰对应于肌动蛋白的分子聚集行为,在混合凝胶的Peak 3中,3 种亲水胶处理组的起始温度无明显变化;PHP的峰值温度在添加量0.1%时明显降低,并且温度区间无变化;GG组凝胶峰值温度无明显变化,温度区间呈延长趋势,添加量0.2%时最长;KGM的峰值温度先增加后降低,并且在0.1%达到最大,其温度区间无明显变化。PHP处理组Peak 3的变化未发现明显规律,对照组和添加量0.5%组中出现最大值;GG处理组Peak 3热焓值呈降低趋势;KGM处理组 Peak 3热焓在添加量较少(0.1%)和较多(0.4%~0.5%)时达到最大值。PHP的强吸水性可能会破坏维持蛋白质结构的作用力,不利于肌动蛋白聚集形成稳定的结构,导致峰值温度降低和焓值增加;同样,KGM在添加量较少时,也对肌动蛋白聚集存在阻碍。
2.5 DSC特征温度及热焓与MG特性相关性分析
从图5可以看出,每个峰的温度区间和起始温度均显著负相关。Peak 1的热焓和Peak 1和Peak 2温度区间相关,Peak 2和Peak 3的热焓和温度显著相关。Peak 1和Peak 2的热焓显著正相关(P<0.05),Peak 2和Peak 3的热焓显著负相关(P<0.05)。这表明,在3 种亲水胶参与的磷酸化MG中,肌球蛋白和肌动蛋白之间会发生相互作用,并且这种作用有利于增强蛋白质结构的稳定性,肌动蛋白的稳定性影响肌动蛋白分子的聚集,而肌球蛋白的稳定性对肌动蛋白分子聚集行为无显著影响。持水性与Peak 1的峰值温度显著正相关(P<0.05)。一般而言,持水性应与凝胶强度有显著相关性,本实验所得结果与传统鱼糜凝胶出现了差异,这可能是亲水胶的加入一方面增强了凝胶网络的结构,另一方面由于其良好的吸水性抢夺了凝胶网络中的水分。破断力、破断距离和凝胶强度三者显著正相关(P<0.01)。凝胶破断力与Peak 3峰值温度显著正相关(P<0.01);破断距离和凝胶强度与Peak 2和Peak 3的峰值温度显著正相关,与Peak 2的热焓显著负相关,破断距离和Peak 1的峰值温度正相关,表明在更高温度下进行肌球蛋白头部转变和肌动蛋白分子的聚集,将有利于增强凝胶网络结构,而肌动蛋白的稳定可能不利于形成更好的凝胶。
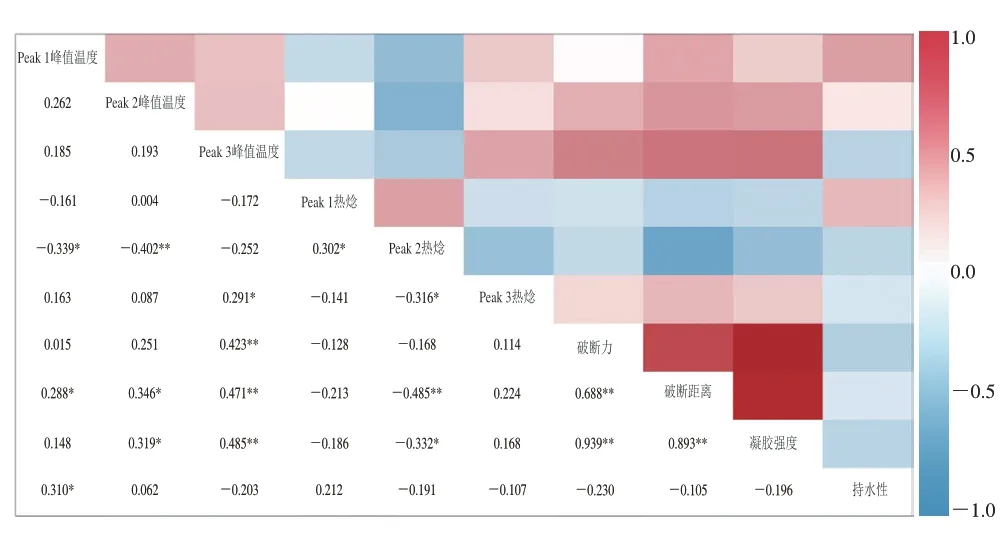
图5 DSC特征温度及热焓与混合凝胶特性相关性分析热图Fig.5 Correlation analysis of DSC characteristic temperatures and enthalpy with properties of mixed gels
2.6 激光共聚焦显微镜的微观结构观察
为进一步获得亲水胶处理的磷酸化MG的形成及其分布行为的微观结构信息,进行激光共聚焦显微镜观察,如图6所示,绿色区域和红色区域分别代表鱼糜/蟹肉蛋白和亲水胶。Weinbreck等[41]提出,凝聚是液体/液体胶体结合产生相分离,导致形成富含胶体的相,称为凝聚物,以及胶体中较差的剩余相。蛋白质和少量亲水胶之间形成的凝聚物,其静电键可以可逆的方式不断断裂和改变,凝聚物相随着时间的推移而缓慢地重新排列扩散,发生凝聚相的重排以形成更均匀的结构[42]。实验观察到,在少量添加PHP时,蛋白质和多糖重叠部分显黄绿色,随着添加量的增加,逐渐出现红色小颗粒;在GG添加量增多时,甚至出现了大片红色连接区;而KGM的添加似乎没有带来聚集的红色部分。红色区域的单独出现表明,在混合凝胶体系中,蛋白质和多糖出现了相分离,当蛋白质和多糖这两种亲水胶体混合时,每种胶体的行为方式与没有另一种亲水胶体时一般不会完全相同。由于在亲水胶体混合过程中的熵增益较低,因此比相容混合物更常观察到相分离。热力学相容的混合物仅在特定条件下存在,例如在非常低的浓度下,或者当两种亲水胶体在化学性质和结构上确实非常相似时[43]。由此看来,PHP和GG在较低浓度下,多糖能和鱼糜/蟹肉蛋白质发生良好的作用,同时表现为机械性能的改善,而在多糖浓度增加后,相分离的发生导致凝胶性能无明显变化,甚至开始下降。在KGM处理组中未观察到蛋白质和多糖的两相分离,其观察结果与凝胶强度测定结果不一致,据Xiong Zhiyu等[7]报道,在草鱼(Ctenopharyngodon idella)鱼糜中添加较高水平的魔芋葡甘聚糖可以显著增加鱼糜凝胶的断裂力和破断距离,改善其持水性能,其最佳添加是1%。KGM不带电荷,属非离子多糖,其受盐的影响很小,和磷酸化鱼糜/蟹肉可能未发生化学相互作用或者在两体系间化学相互作用较弱,从2.1节结果看,低浓度KGM对磷酸化混合凝胶强度无改善作用,而高浓度时,则对凝胶有破坏作用。
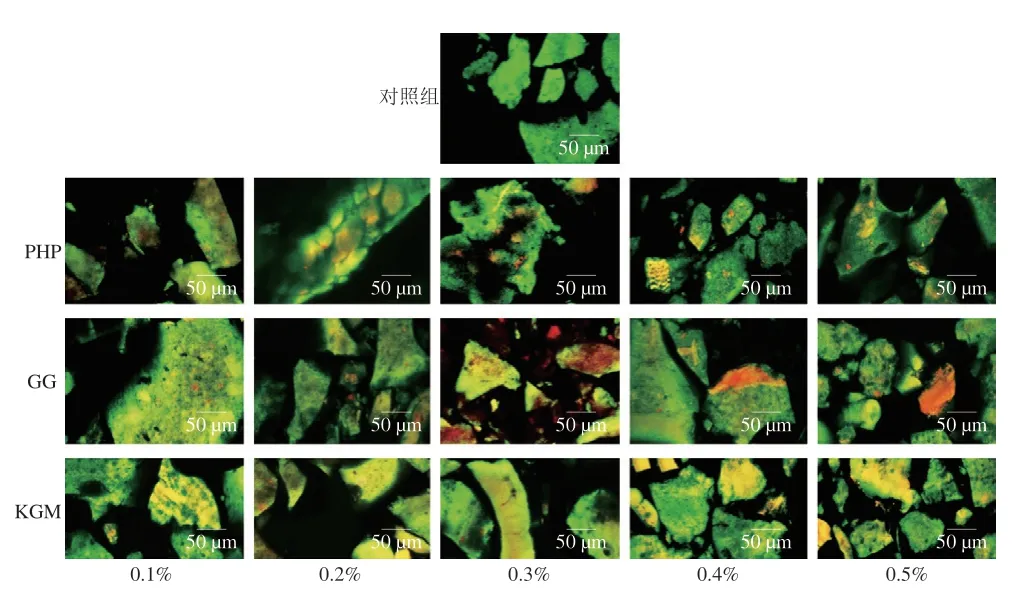
图6 激光共聚焦显微镜微观结构观察Fig.6 Microstructure observation of mixed gels by LSCM
3 结论
PHP、GG和KGM在较低添加量(0.1%)下,多糖能和鱼糜/蟹肉蛋白质发生良好的作用,提高了混合凝胶的破断力和凝胶强度。其中PHP和GG的添加提高了G’开始降低的温度,G”表现出与G’相似的变化模式,表明在鱼糜/蟹肉体系中是弹性为主体的凝胶体。添加亲水胶的磷酸化鱼糜/蟹肉体系中肌球蛋白的变性需要更温度和更少能量,尤其是GG对热稳定性的改善效果更佳,导致肌球蛋白和肌动蛋白之间更容易发生相互作用,有利于增强蛋白质结构的稳定性。GG在适当添加量时持水性较高可能为这一结论提供了支持。KGM在激光共聚焦实验中未观察到相分离,推测KGM可能未与磷酸化混合蛋白质发生化学性相互作用,但适量磷酸盐的加入有利于凝胶性质的改善。相比较PHP和KGM,适当添加量的GG可能更适合作为外源添加剂改善磷酸化低盐鱼糜/蟹肉凝胶的品质。
