凉粉草多糖对鱼肌球蛋白理化性质和结构特征的影响
2023-03-06周昕仪高可安董诗瑜马舒恬陈尚里刘小玲
周昕仪,游 刚,高可安,董诗瑜,马舒恬,陈尚里,刘小玲,*
(1.广西大学轻工与食品工程学院,广西 南宁 530004;2.北部湾大学食品工程学院,广西 钦州 535011)
鱼糜因其味美、方便、营养价值高而广受公众欢迎,近年来市场需求量剧增。为了满足产品多样化及获得更佳的口感,常通过外加添加剂(淀粉、膳食纤维、蛋白质)改善鱼糜凝胶的品质。淀粉[1]和膳食纤维[2]可在蛋白凝胶网络中充当填充剂,使鱼糜凝胶网络的持水性提高;而黄原胶、卡拉胶和魔芋葡甘聚糖[3]等则是通过改变蛋白系统的黏度,在鱼糜制品中起到增稠和黏合的作用。
凉粉草多糖(Mesona chinensisBenth polysaccharide,MCP)是从药食两用的凉粉草中提取的多糖,因其成本低廉易获取,同时又具有凝胶特性和降血脂[4]、抗氧化[5]等生物活性,因此MCP在蛋白基食品中的应用备受关注。现有研究证明,添加MCP能改善猪肉肉糜[6]、鸡肉肌原纤维蛋白[7]、淀粉-鱼糜混合体系[8]的质构及凝胶特性,也有助于提高产品的抗氧化能力。肌球蛋白作为肌肉中含量最高的蛋白质,其与肌肉组织的凝胶性和持水性等均存在密切联系[9],同时肌球蛋白聚集状态受温度影响,40 ℃凝胶化阶段对蛋白凝胶结构有重要意义[10]。前期研究发现[8,11],MCP可改善鱼糜凝胶特性和感官特性,归因于MCP-鱼糜蛋白的相互作用促进鱼糜凝胶化。然而,MCP-鱼肌球蛋白得相互作用机制尚不清晰。
因此,本实验探讨40 ℃凝胶化条件下,不同MCP质量浓度(0~0.10 mg/mL)对肌球蛋白(2 mg/mL)理化特性(电位、粒径、表面疏水性、巯基)、结构特性(红外光谱、圆二色谱)和微观结构的影响。阐明肌球蛋白-MCP的相互作用机制,旨在为MCP在蛋白基食品中的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
金鲳鱼 沃尔玛超市广西南宁明秀西路分店;MCP纯胶粉(食品级) 厦门兴顺祥泰食品有限公司。
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulphate-polyacrylamide gel electrophoresis,SDSPAGE)快速试剂盒 南京碧云天生物技术有限公司;彩虹245广谱蛋白Marker、BAS标准品、考马斯亮蓝G-250、透析袋MD44 北京索莱宝科技有限公司;8-苯胺基-1-萘磺酸铵盐 北京百灵威科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
紫外-可见光分光光度计 德国耶拿分析仪器股份有限公司;Nano-ZS90电位分析仪 英国马尔文仪器有限公司;Infinite M200 Pro酶标仪 奥地利Tecan公司;prepASH 340系列全自动水分灰分测定仪 瑞士普利赛斯公司;RF-5301PC荧光分光光度计 日本Hitachi公司;MOS-450圆二色谱仪 法国Bio-Logic公司;Nicolet iS 10傅里叶变换红外光谱仪 美国Thermo Fisher Scientific公司;DMi8荧光倒置显微镜 德国Leica公司。
1.3 方法
1.3.1 MCP的提取及理化测定
参照Xie Jianhua等[12]的方法制备MCP,稍作修改。将MCP纯胶粉复溶于水,加2%乙酸锌和2%亚铁氰化钾溶液[13],搅拌,静止30 min,去除多糖中的蛋白。9000 r/min离心20 min,上清液中加入无水乙醇稀释至80%(V/V),4 ℃过夜,5000 r/min离心5 min;收集沉淀,复溶、醇沉,5000 r/min离心5 min(重复2 次)。用无水乙醇、丙酮、乙醚洗涤去除小分子杂质[5],透析60 h,冻干制得MCP,用干燥皿保存。
采用苯酚-硫酸法[14]测定多糖含量,硫酸-咔唑法[15]测定糖醛酸含量,考马斯亮蓝法[16]测定蛋白含量,prepASH 340系列全自动水分灰分测定仪测定灰分含量,索氏抽提法[17]测定脂肪含量。
1.3.2 肌球蛋白的提取及理化测定
参考Park等[18]的方法制备肌球蛋白。取金鲳鱼的肌肉制成肉糜,加入10 倍体积的试剂A(含0.1 mol/L氯化钾、20 mmol/L Tris,pH 7.5),12000 r/min均质1 min,反应15 min。8000 r/min离心20 min,取沉淀于3 倍体积的试剂B(含0.45 mol/L氯化钾、0.2 mol/L乙酸镁、1 mmol/L乙二醇双(2-氨基乙基醚)四乙酸、20 mmol/L Tris、5 mmol/Lβ-巯基乙醇,pH 6.8)中反应1 min。加入腺嘌呤核苷三磷酸,使其最终质量浓度为10 mmol/L,反应90 min,10000 r/min离心20 min。取上清液加入3 倍体积的1 mmol/L碳酸氢钾,反应40 min,12000 r/min离心10 min。取沉淀物加入2.5 倍体积的试剂C(含0.5 mol/L氯化钾、20 mmol/L Tris、5 mmol/Lβ-巯基乙醇,pH 7.5),反应10 min。加入3 倍体积的1 mmol/L碳酸氢钾,再加入氯化镁,使其最终质量浓度为10 mmol/L,反应过夜。第2天于8000 r/min离心25 min,得到乳白色肌球蛋白沉淀,实验全程在4 ℃进行。
使用双缩脲方法测定蛋白浓度,SDS-PAGE[19]对肌球蛋白成分进行分析。
1.3.3 混合溶液的制备
用肌球蛋白和不同质量浓度的MCP(0~0.1 mg/mL)制备混合体系,使混合体系中MCP的最终质量浓度为0、0.02、0.04、0.06、0.08、0.10 mg/mL,肌球蛋白质量浓度为2 mg/mL,样品命名为肌球蛋白-MCP-0、肌球蛋白-MCP-0.02、肌球蛋白-MCP-0.04、肌球蛋白-M C P-0.06、肌球蛋白-MCP-0.08、肌球蛋白-MCP-0.10。将样品4 ℃下充分混匀,然后40 ℃水浴30 min,在冰水中快速冷却,4 ℃冰箱中保存待用。未添加MCP的肌球蛋白-MCP-0为对照组。
1.3.4 浊度的测定
参照Weinbreck等[20]的方法,用紫外-可见分光光度计在600 nm波长处测定吸光度。以吸光度代表样品的浊度。以20 mmol/L Tris-HCl(含0.6 mol/L NaCl,pH 7.0)缓冲液为空白组。
1.3.5 Zeta电位测定
将样品置于电位比色皿中,用Nano-ZS90电位分析仪进行测定,测定温度25 ℃,平衡时间1 min。
1.3.6 粒径分布及大小
采用激光粒度仪测定样品的粒径大小及分布情况,测定的相关参数:物质折光率为1.59,介质折射率为1.333。
1.3.7 SDS-PAGE测定
将样品与上样缓冲液混合,置于沸水浴中加热5 min,备用。配制12%分离胶,5%浓缩胶,上样量10 μL,Marker上样量5 μL,上样后先用80 V电压开始电泳,后改用120 V电压,运行1 h。脱色至背景透明,条带呈明显蓝色。
1.3.8 表面疏水性测定
采用Xu Yeye等[21]的方法并作部分修改。用蛋白缓冲液将各样品中蛋白质量浓度稀释为0.1~0.5 mg/mL。取25 μL 8 mmol/L 8-苯胺基-1-萘磺酸铵加入5 mL稀释后的样品中混合均匀,室温避光反应15 min。激发波长380 nm,发射波长475 nm,狭缝宽度5 mm,用荧光分光光度计测定其荧光强度,荧光强度的初始斜率表示疏水指数(S0)。
1.3.9 总巯基含量的测定
参考Wei Li等[22]的方法,稍作修改。移取0.5 mL样品,加入4.5 mL 0.2 mol/L Tris-HCl(含8 mol/L 尿素、2%SDS、10 mmol/L EDTA,pH 6.8)缓冲液,加入0.5 mL 0.1% 5,5’-二硫代双(2-硝基苯甲酸)(含0.1% 5,5’-二硫代双(2-硝基苯甲酸)、0.2 mol/L Tris-HCl,pH 8.0)缓冲液,40 ℃反应25 min,412 nm波长处测定吸光度(A),缓冲液作空白。按式(2)计算总巯基含量:
式中:D为稀释倍数;ε为摩尔消光系数13600 L/(mol·cm);C为蛋白质量浓度/(mg/mL)。
1.3.10 圆二色谱分析
参考Cao Hongwei等[23]的方法,稍作修改。将样品中蛋白质量浓度稀释至0.2 mg/mL,使用圆二色谱仪测定,扫描范围190~250 nm,扫描速率100 nm/min。
1.3.11 红外光谱分析
使用傅里叶变换红外光谱仪测定,扫描范围4000~400 cm-1,分辨率为4 cm-1,扫描24 次。扫描结果用Peakfit 4.12软件去卷积处理。
1.3.12 紫外-可见光色谱分析
使用紫外-可见光分光光度计测定,扫描范围190~600 nm,扫描速率10 nm/s,以0.6 mol/L NaCl-20 mmol/L Tris-HCl(pH 7.0)缓冲液为空白,取250~350 nm波长范围,利用Origin 2021软件对紫外光谱进行二阶导数计算。
1.3.13 荧光色谱分析
将样品中蛋白质量浓度稀释成0.05 mg/mL,使用荧光分光光度计测定,激发波长295 nm,发射波长扫描范围300~500 nm,狭缝宽度5 nm,以缓冲液作空白去除背景。
1.3.14 荧光显微镜观察
向1 mL样品中加入20 μL 0.2 g/100 mL罗丹明B染色剂,染色30 min后置于载玻片上,使用荧光倒置显微镜于5 倍物镜下观察复合物的微观结构。
1.4 数据处理
每个实验重复3 次,使用SPSS 19.0和Microsoft Excel 2019软件进行Duncan法差异显著性分析,采用Origin 2021软件绘图。
2 结果与分析
2.1 金鲳鱼肌球蛋白和纯化的凉粉草多糖的基本理化性质
凉粉草多糖经过纯化后最终基本成分(干基)为:总糖61.86%、糖醛酸46.11%、蛋白质2.77%、脂肪3.86%、灰分18.88%。如图1所示,提取的肌球蛋白主要由135~220 kDa的肌球蛋白重链、35 kDa的原肌球蛋白[24]和17 kDa的肌球蛋白轻链组成。同时,在48 kDa处存在肌动蛋白残留,整体以肌球蛋白为主,不影响实验结果。

图1 金鲳鱼肌球蛋白的SDS-PAGE图谱Fig.1 SDS-PAGE pattern of myosin from golden pomfret
2.2 鱼肌球蛋白-MCP混合体系相图分析
由图2所示,4 ℃条件下,肌球蛋白分散液呈乳白色浑浊液,不同质量浓度MCP分散液均呈澄清透明的棕色溶液;按1.3.3节制备肌球蛋白与MCP混合溶液后,肌球蛋白-MCP-0样品(图2C0)有少量絮凝物,体系整体呈浑浊状态,而其余样品(图2C1~C5)均有大量絮凝物形成,且体系上层澄清、下层有大量沉淀。表明肌球蛋白-肌球蛋白分子间在40 ℃下有少量聚集,而添加MCP后,两者相互作用形成大量絮凝物,且因重力下沉,使混合体系发生结合型相分离。

图2 肌球蛋白(A)、MCP(B)和肌球蛋白-MCP混合体系(C)相图Fig.2 Photographs of myosin solution (A),MCP solution (B) and myosin-MCP mixed system (C)
2.3 MCP对鱼肌球蛋白电位值的影响
由图3可知,在测定范围内,所有样品的Zeta电位值均为负值,表明肌球蛋白表面带负电荷,MCP为阴离子多糖。当MCP质量浓度(0~0.06 mg/mL)较低时,其Zeta电位值无显著变化(P>0.05),而随着MCP质量浓度增加(0.08~0.1 mg/mL),其Zeta电位值显著下降(P<0.05),归因于MCP分子上的—COOH发生去质子化作用生成—COO[25];肌球蛋白-MCP混合体系的Zeta电位值位于未添加组(肌球蛋白-MCP-0)和MCP之间,表明肌球蛋白和MCP之间存在静电相互作用[26]。相较于未添加组,添加低质量浓度MCP(≤0.04 mg/mL)的肌球蛋白-MCP混合体系的Zeta电位值无显著变化(P>0.05),添加较高质量浓度MCP(≥0.06 mg/mL)的肌球蛋白-MCP混合体系的Zeta电位值显著下降(P<0.05)。这是因为低质量浓度MCP所带入的负电荷正好与肌球蛋白表面的正电荷(局部区域)发生电位中和反应,两者通过静电相互吸引力形成可溶性复合物,通过相互作用形成大量絮凝物(图2);继续增加MCP含量,过量的负电荷导致肌球蛋白-MCP混合体系的电位值显著下降,增加两者间的静电排斥力[26]。

图3 MCP和肌球蛋白-MCP混合体系的Zeta电位变化曲线Fig.3 Zeta potential of MCP and myosin-MCP mixed system
2.4 MCP对鱼肌球蛋白表面疏水性的影响
由图4可知,相较于未添加组肌球蛋白-MCP-0,添加MCP可显著降低蛋白质表面疏水性(P<0.05),且随着MCP质量浓度增加而降低;当MCP增加至0.02 mg/mL,蛋白质表面疏水性较未添加组降低约51%,继续增加至0.1 mg/mL,蛋白质表面疏水性较未添加组降低约67%。蛋白在40 ℃凝胶化条件下,肌球蛋白分子头部的疏水基团充分暴露,因此未添加组肌球蛋白-MCP-0获得较高的表面疏水性。MCP显著降低肌球蛋白表面疏水性的原因如下:1)肌球蛋白表面的正电荷(—NH3+)与MCP表面的负电荷间通过静电相互吸引形成肌球蛋白-MCP静电复合物,同时,由于MCP富含亲水性羟基(—OH),增加肌球蛋白-MCP复合物亲水性[26]。2)随着MCP增加,肌球蛋白与MCP之间相互作用形成空间位阻,导致肌球蛋白内部的疏水基团不能充分暴露,进而降低蛋白表面疏水性。
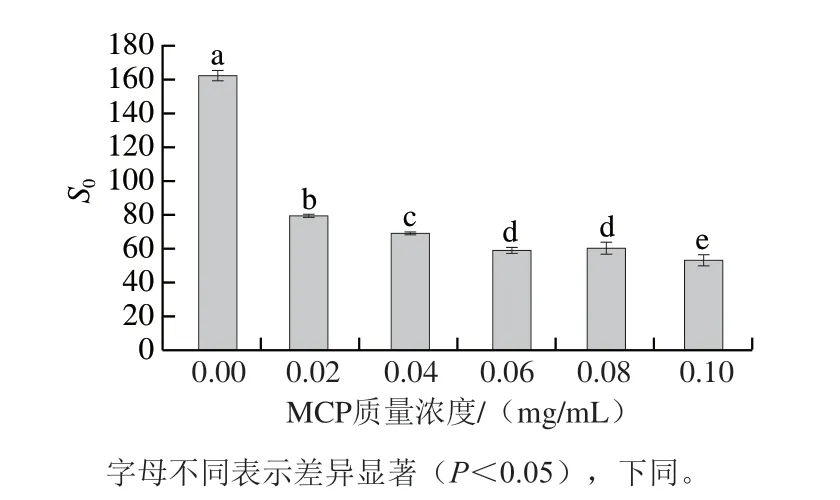
图4 MCP质量浓度对肌球蛋白-MCP混合体系表面疏水性的影响Fig.4 Effects of different MCP concentrations on surface hydrophobicity of myosin-MCP mixture system
2.5 MCP对鱼肌球蛋白浊度的影响
如图5所示,添加组浊度均低于未添加组(肌球蛋白-MCP-0),特别是MCP质量浓度为0.02 mg/mL时,肌球蛋白-MCP混合体系浊度较肌球蛋白-MCP-0降低46%;但在添加组中,肌球蛋白-MCP混合体系浊度随MCP增加而增加,相较于肌球蛋白-MCP-0.02体系的浊度,各肌球蛋白-MCP混合体系(0.04~0.1 mg/mL)浊度分别增加14%、34%、37%、45%。未添加组较高的浊度与其较大的表面疏水性有关(图4),归因于蛋白质分子间疏水相互作用力导致肌球蛋白-肌球蛋白聚集。添加MCP后,两者的相互作用将促进肌球蛋白展开,低质量浓度MCP引入较少负电荷,MCP与肌球蛋白表面正电荷基团(—NH3+)通过静电相互吸引形成可溶性复合物[27],进而减小其浊度;但随着MCP质量浓度的增大,混合体系浊度增加,归因于肌球蛋白与MCP形成静电复合凝聚物,同时,肌球蛋白-MCP电负性增强(图3),诱导分子间产生静电排斥力,促进蛋白分子聚集[28]。
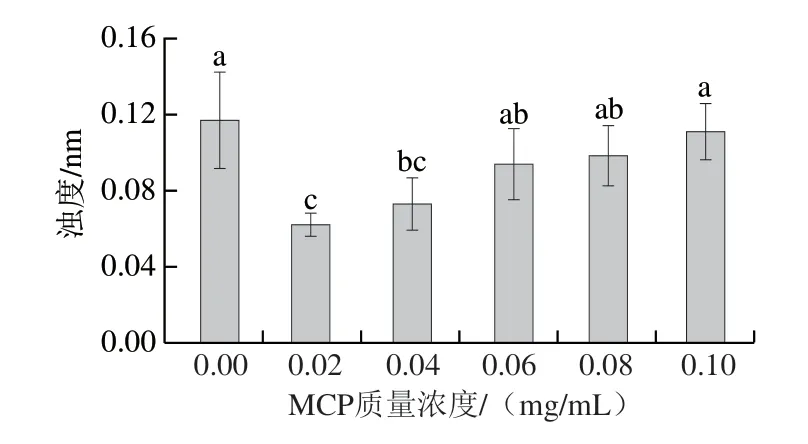
图5 MCP质量浓度对肌球蛋白-MCP混合体系浊度的影响Fig.5 Effects of different MCP concentrations on turbidity of myosin-MCP mixture system
2.6 MCP对鱼肌球蛋白粒径的影响
如图6a所示,所有样品均呈现一个单峰,说明粒径的分布较为集中。未添加组的粒径主要分布在100~200 μm,添加MCP后,粒径的分布变宽,在0~400 μm均有分布,但MCP质量浓度的增加对各添加组粒径分布影响不大。
如图6b所示,添加组平均粒径(D50)(<90 μm)相较于未添加组(124 μm)显著下降(P<0.05),随着MCP质量浓度增加,D50整体呈先减小后增加趋势。MCP质量浓度增加至0.08 mg/mL时,D50最小(51 μm),MCP质量浓度为0.01 mg/mL时,D50显著增加(60 μm)(P<0.05)。未添加组的D50是蛋白分子间疏水相互作用的结果,MCP质量浓度较低时,两者发生静电中和反应形成肌球蛋白-MCP可溶性复合物;MCP质量浓度为0.08 mg/mL时,过量的负电荷将诱导分子间静电斥力,肌球蛋白-MCP复合物的D50显著减小(P<0.05);同时,MCP质量浓度为0.1 mg/mL时,D50增加,归因于混合体系同时存在肌球蛋白-MCP相互作用、肌球蛋白-肌球蛋白相互聚集。因此,在混合体系中,蛋白-多糖相互作用、蛋白-蛋白相互聚集共同影响粒径分布及大小,随着MCP质量浓度增加,其粒径的分布变宽,D50整体减小。

图6 不同MCP质量浓度的肌球蛋白-MCP混合体系的粒径分布(a)及D50(b)Fig.6 Particle size distribution (a) and D50 (b) of myosin-MCP mixed system with different MCP concentrations
2.7 MCP对鱼肌球蛋白总巯基含量的影响
由图7可知,相较于未添加组,添加组总巯基含量整体呈先上升后下降趋势,MCP质量浓度为0.04 mg/mL时,总巯基含量最高(0.33 mol/105g),较未添加组增加6%;MCP质量浓度为0.1 mg/mL时,总巯基含量最低(0.28 mol/105g),较未添加组降低13%。40 ℃凝胶化条件下,肌球蛋白受热伸展,暴露更多分子内部的巯基[29]。加入0.04 mg/mL MCP时,MCP分子的存在还未对肌球蛋白的伸展造成阻碍,因此总巯基含量增加[30];但随着MCP质量浓度再增加,空间位阻效应阻碍了肌球蛋白的伸展,且静电相互排斥力促使肌球蛋白分子间通过二硫键共价结合,导致总巯基含量下降[31]。
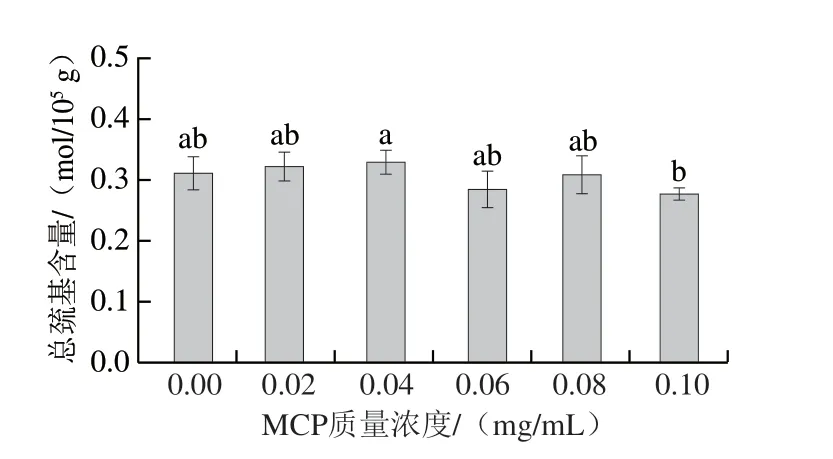
图7 MCP质量浓度对肌球蛋白-MCP混合体系总巯基含量的影响Fig.7 Effects of different MCP concentrations on total sulfhydryl content in myosin-MCP mixture system
2.8 肌球蛋白-MCP混合体系的SDS-PAGE分析
如图8所示,肌球蛋白的组成主要有200~180 kDa范围内的肌球蛋白重链与17 kDa的肌球蛋白轻链,还存在少量48 kDa的肌动蛋白和35 kDa的原肌球蛋白[24]。在还原条件下,肌球蛋白顶部仍有大量肌球蛋白重链,这说明40 ℃凝胶化处理的肌球蛋白分子间交联除了二硫键外,还存在其他共价方式[32];MCP中无蛋白条带,证明MCP中少量的蛋白并不影响两者的相互作用;肌球蛋白-MCP混合体系各条带位置均没有位移,这表明两者的相互作用并没有生成新基团[24]。同时,相较于肌球蛋白,肌球蛋白-MCP混合体系顶部的肌球蛋白重链更多,但肌球蛋白重链条带不随MCP质量浓度变化,这说明经40 ℃凝胶化处理后的蛋白展开,和MCP相互作用形成了新的肌球蛋白-MCP复合物。
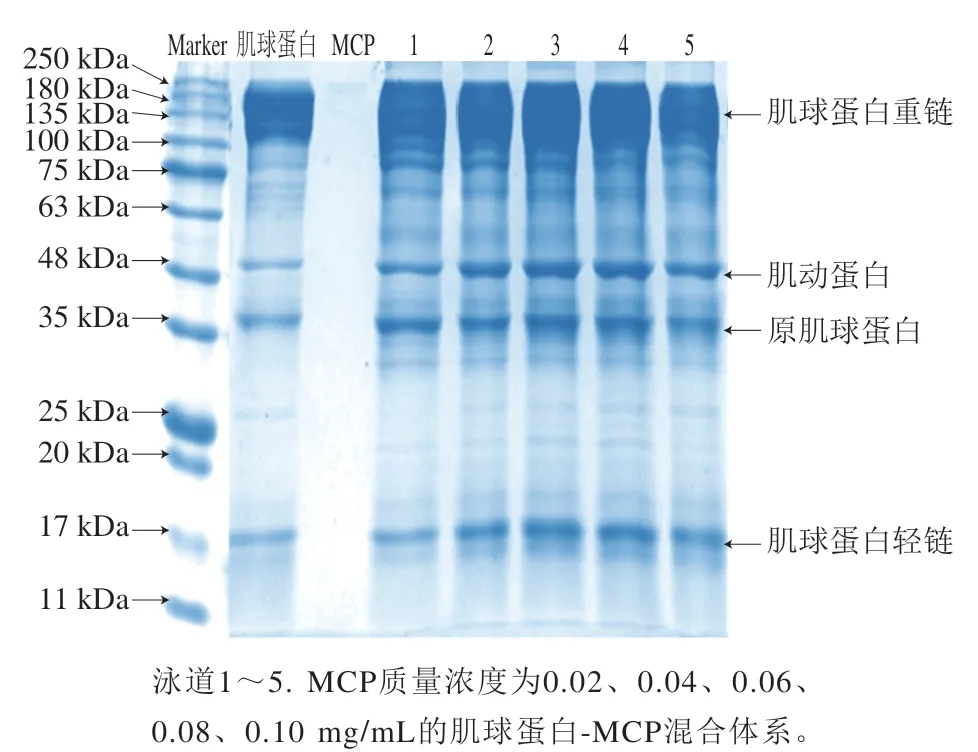
图8 肌球蛋白-MCP混合体系的SDS-PAGE图谱Fig.8 SDS-PAGE pattern of myosin-MCP mixture system
2.9 肌球蛋白-MCP混合体系的紫外光谱分析
如图9a所示,随着MCP质量浓度的增加,在280 nm波长处的吸光度逐渐上升,表明蛋白三级结构发生改变[33]。为进一步区分构象转变的差异,对零阶光谱曲线进行处理得到二阶导数光谱,如图9b所示。260~290 nm波长范围内存在一个负峰,主要由酪氨酸和色氨酸贡献,290~300 nm波长范围内存在正峰,主要由色氨酸贡献[34]。随着MCP质量浓度增加,肌球蛋白-MCP混合体系负峰峰值分别在285、284、283、282、285、286 nm波长处,先蓝移后红移;正峰峰值分别为295、295、295、296、295、294 nm,其峰值先不变,再红移,最后蓝移,两个范围内峰值对应的波长均在MCP添加量为0.06 mg/mL时达到极值。综上所述,当MCP添加量为0~0.06 mg/mL时,蛋白表面的酪氨酸向里包埋,获得更疏水的微环境,而蛋白内部疏水区的色氨酸向外扩展,使其微环境极性增加;当MCP添加量持续增加到0.08~0.1 mg/mL时,两种氨基酸的变化趋势相反。在熊文飞等[35]的研究中,壳聚糖的添加也导致卵白蛋白的色氨酸微环境极性增加。
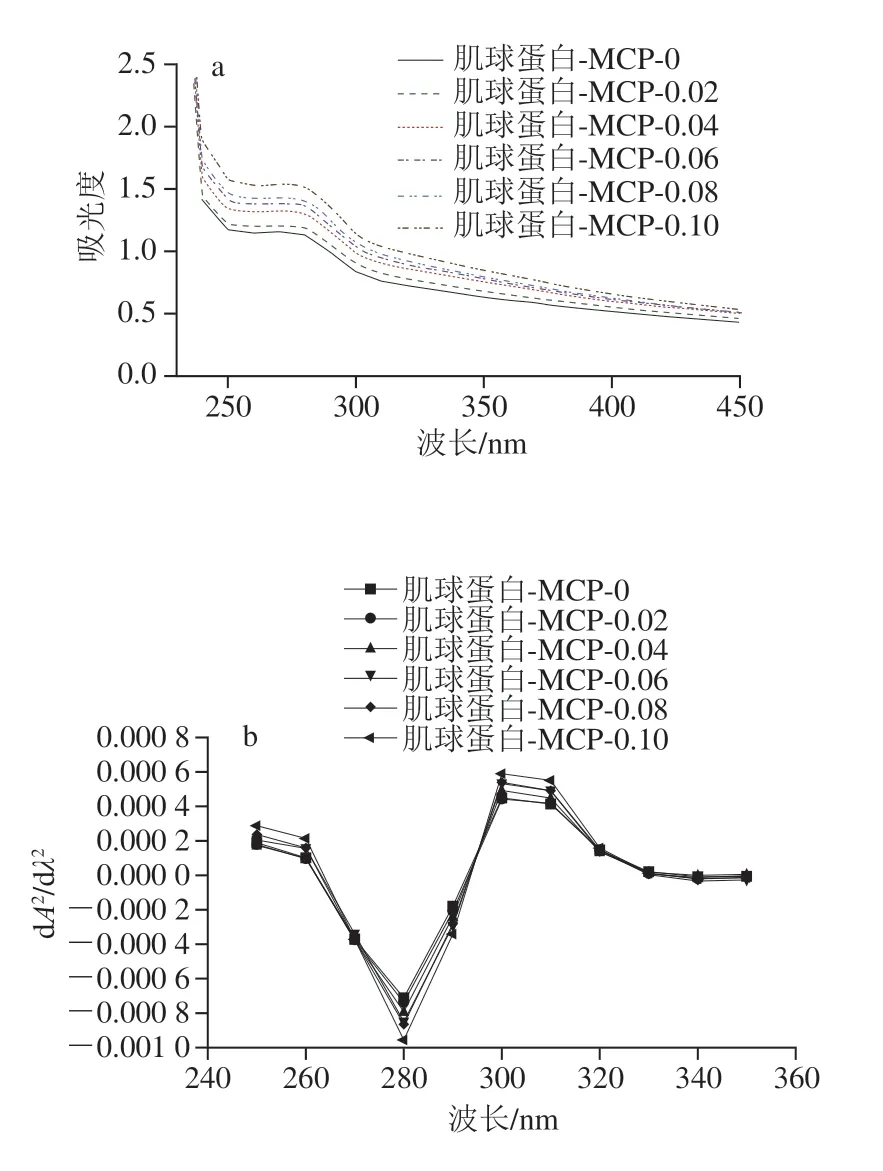
图9 肌球蛋白-MCP混合体系的零阶紫外-可见光谱(a)与二阶导数光谱(b)Fig.9 Zero-order UV-visible spectra (a) and second-order derivative spectra (b) of myosin-MCP mixed system
2.10 MCP对肌球蛋白色氨酸荧光的影响
如图10所示,相较于未添加组,添加组的最大荧光强度明显下降,且随着MCP质量浓度增加,肌球蛋白-MCP混合体系的最大荧光强度逐渐减小。可能是40 ℃凝胶化处理使肌球蛋白分子内部具有疏水性的色氨酸暴露,使其最大荧光强度显著高于添加组,此结果也在疏水性实验(图4)被佐证。
除荧光强度以外,荧光的最大吸收峰位置也值得关注,未添加组峰值位于338 nm波长处,添加组的峰值分别位于338、339、342、339、339 nm波长处。相较于未添加组,MCP质量浓度为0.02 mg/mL时,其对色氨酸微环境影响不大;当MCP质量浓度为0.04~0.1 mg/mL时,出现不同程度的红移,且MCP质量浓度为0.06 mg/mL时,红移程度最大,表明此时色氨酸残基暴露最多。MCP质量浓度为0.08~0.1 mg/mL时,分子间静电排斥力增加导致蛋白结构重新折叠,色氨酸随之向里包埋,微环境疏水性增加。因此,色氨酸光谱(图10)与紫外光谱(图9)的发现基本一致,证明MCP的添加将导致蛋白三级结构改变,影响内部氨基酸残基的微环境。
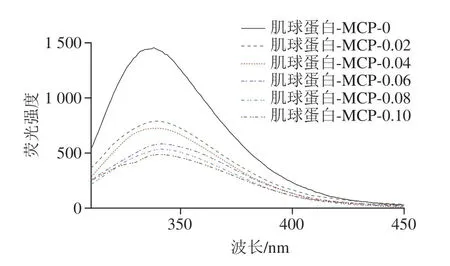
图10 肌球蛋白-MCP混合体系的荧光光谱Fig.10 Fluorescence spectra of myosin-MCP mixed system
2.11 MCP对鱼肌球蛋白二级结构的影响
如图11a所示,未添加组肌球蛋白-MCP-0在208、222 nm波长附近存在明显α-螺旋特征峰,而各添加组208 nm波长处的负峰变平缓,222 nm波长处负峰峰型基本保持一致,表明添加MCP后,α-螺旋结构含量发生变化。如图11b所示,MCP在3400~3200 cm-1波数范围内有一个宽峰,归因于—OH羟基的伸缩振动,在1420、1627 cm-1波数处的吸收峰归因于—COO-对称和不对称的伸缩振动,在1074 cm-1处的吸收峰归因于C—O、C—C、C—O—H的共同作用,这是表征MCP结构的特征吸收峰[36]。未添加组肌球蛋白-MCP-0在1650 cm-1和1540 cm-1波数处存在吸收峰,分别来自蛋白结构的酰胺I带和酰胺II带[37]。当肌球蛋白与MCP相互作用,各肌球蛋白-MCP混合体系的红外光谱峰型基本一致,在3500~3200 cm-1(—OH)波数范围内均出现宽峰,表明与肌球蛋白或MCP相比,肌球蛋白-MCP复合物的氢键增强,这归因于MCP带入了更多的羟基(—OH)[37]。同时,肌球蛋白-MCP复合物中—振动峰(1650 cm-1)与—COO-振动峰(1420、1627 cm-1)逐渐减小,证明肌球蛋白-MCP间发生静电结合反应[25]。
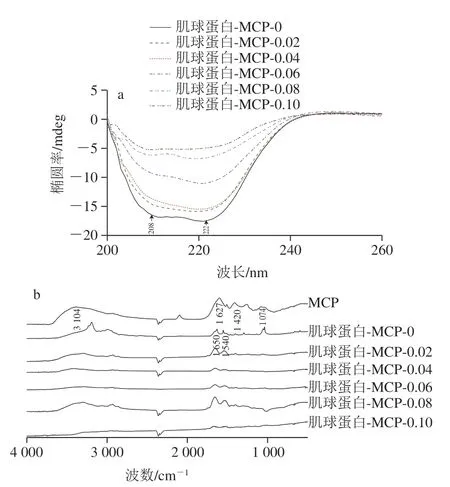
图11 肌球蛋白-MCP混合体系的圆二色谱(a)和红外光谱(b)Fig.11 Circular dichroism (a) and infrared spectra (b) of myosin-MCP mixed system
2.12 MCP对鱼肌球蛋白微观结构的影响
如图12所示,水溶液状态下,同时存在荧光网状结构及荧光点状结构,代表蛋白分子间不同的聚集状态。相较于未添加组肌球蛋白-MCP-0,添加组中黑色视野增加,荧光网状结构的形态改变,同时荧光网络内部的黑色空隙增大。表明MCP的添加,破坏了蛋白间的交联网络,使肌球蛋白-MCP复合物增加,造成形态各异的荧光网状结构。Çakir等[38]的研究中表明,随着卡拉胶质量浓度的增加,乳清分蛋白的连续相逐渐被破坏,结构中存在更多空隙。然而,由图12可知,除了松散的荧光网络结构,也存在紧密的荧光点状结构,通过紫外(图9)和荧光光谱(图10)实验可知,展开的肌球蛋白表面附着大量的疏水基团,这些基团促使蛋白分子相互聚集形成紧密的荧光点状结构。
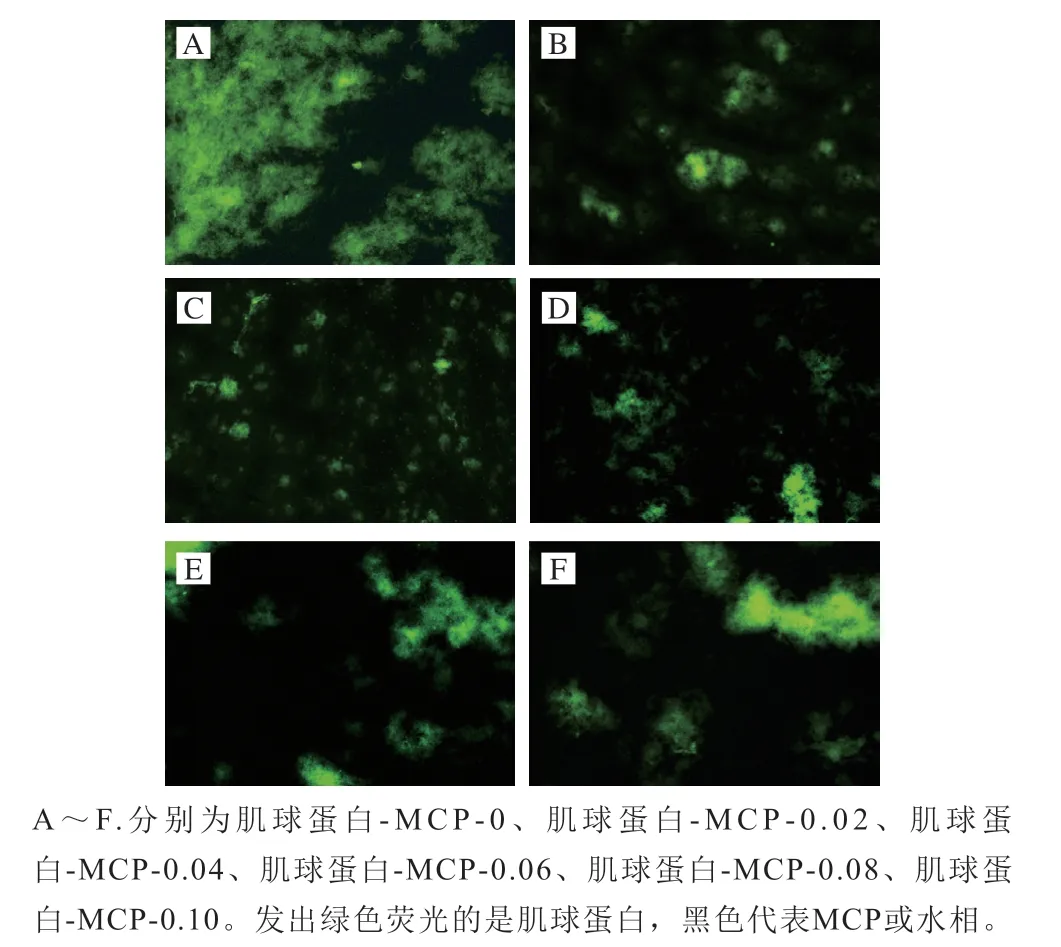
图12 肌球蛋白-MCP混合体系的微观结构变化Fig.12 Microstructure changes of myosin-MCP mixed system
2.13 MCP-肌球蛋白相互作用机制
由图13可知,40 ℃凝胶化条件下,未添加组肌球蛋白-MCP-0中的肌球蛋白分子受热展开,较大的疏水相互作用力促使肌球蛋白分子聚集形成肌球蛋白-肌球蛋白集聚体。肌球蛋白-MCP反应初期,MCP带入少量负电荷与肌球蛋白表面部分区域的正电荷通过弱静电相互作用形成可溶性复合物,例如肌球蛋白-MCP-0.02浊度较未添加组显著下降(P<0.05)(图5)。肌球蛋白-MCP反应中期,随着阴离子多糖MCP增加,将诱导分子间产生静电排斥力,排斥力促使少量肌球蛋白相互靠近,通过二硫键共价交联形成肌球蛋白-肌球蛋白聚集体,例如肌球蛋白-MCP-0.06中,总巯基含量、疏水性、D50均下降,但肌球蛋白-MCP-0.08与肌球蛋白-MCP-0.06的Zeta电位值无显著差异(P>0.05),说明水溶液中存在的静电斥力仍较弱。肌球蛋白-MCP反应后期,MCP质量浓度再增加,因负电荷过剩导致强静电排斥力和因MCP伸展导致空间位阻效应,会促使肌球蛋白-肌球蛋白聚集体增多,如肌球蛋白-MCP-0.10混合体系在荧光显微镜下的绿色荧光团增大。

图13 肌球蛋白MCP混合体系复合物形成机制Fig.13 Mechanism of complex formation in myosin-MCP mixture system
3 结论
分析了40 ℃条件下MCP添加量对肌球蛋白-MCP混合体系的影响。结果表明,不同MCP添加量影响溶液中肌球蛋白与MCP间的相互作用力,从而影响蛋白结构的理化性质及结构特性。低质量浓度的MCP,主要通过静电相互吸引力与肌球蛋白形成肌球蛋白-MCP复合物,高质量浓度的MCP,诱导混合体系产生静电排斥力,促使肌球蛋白-肌球蛋白相互聚集,最终导致混合体系中的整体颗粒从大而集中转变为小而广泛的分布。此外,MCP的添加将诱导肌球蛋白的三级结构展开,导致肌球蛋白疏水基团、巯基、氨基酸残基不同程度地暴露与掩埋。基于此可为MCP在蛋白基食品中的应用提供一定理论参考。
