淫羊藿苷基于GDF-9/Smads对多囊卵巢小鼠排卵的作用
2023-09-13王小洁张云锋张彦敏
王小洁,张云锋,张彦敏
1.邯郸市妇幼保健院中医妇科,邯郸 056000; 2.河北省沧州中西医结合医院中医专家门诊,沧州 061000;3.石家庄市井陉矿区人民医院内科,石家庄 050100
多囊卵巢综合征(polycystic ovarian syndrome, PCOS)发病原因复杂,表现出长期无排卵或稀发排卵的高雄激素特征,严重影响患者的青春期心理、育龄期机体代谢等[1-2]。淫羊藿是我国传统的滋补类中草药,能增强机体性功能和免疫功能,在临床常被用于辅助治疗PCOS[3-4]。淫羊藿苷(icariin, ICA)作为淫羊藿的主要有效成分之一,具有抗氧化、抗癌、抗血管生成和抗炎等多种药理活性[5]。本研究用脱氢表雄酮法建立PCOS小鼠模型,研究ICA对PCOS小鼠排卵障碍和卵泡发育的影响及作用机制。
1 仪器与材料
1.1 仪器
微量移液器(德国Eppendorf公司);HM355S全自动轮转式石蜡切片机(德国MICON医疗技术有限公司);PowerPac电泳仪(美国Bio-Rad公司)。
1.2 试药
脱氢表雄酮(上海恒渡生物科技有限公司);淫羊藿苷(质量分数≥98%,上海吉至生化科技有限公司);雌二醇(estradiol, E2)、睾酮激素(testosterone, T)、促黄体生成激素(luteinizinghor mone, LH)、卵泡刺激素(follicle stimulating hormone, FSH)和抗缪勒管激素(anti-Müllerian hormone, AMH)ELISA试剂盒,均购自武汉华美生物工程有限公司;兔抗小鼠生长分化因子9(growth differentiation factor 9, GDF-9)、骨形成蛋白Ⅱ型受体(bone morphogenetic protein type Ⅱ receptor, BMPR-Ⅱ)、激活素受体样激酶5(activin receptor like kinase 5, ALK5)、Smad蛋白2(Smad protein 2, Smad2)、p-Smad2、p-Smad3、Smad3一抗和辣根过氧化物酶标记的山羊抗兔Ig G,均购自美国Abcam公司。
1.3 动物
雌性C57BL/6小鼠50只,SPF级,4周龄,体质量为(12±1) g,购自上海斯莱克实验动物有限责任公司,许可证号SCXK(沪)2017-0005。
2 方法
2.1 PCOS模型的建立
用阴道组织涂片法连续20 d对50只小鼠阴道细胞涂片进行动情周期观察,随机选择动情周期完整的40只小鼠,于每日上午9点在小鼠颈背部皮下注射60 mg·kg-1脱氢表雄酮(溶于注射用橄榄油0.2 mL),另取10只小鼠作为对照组,于相同时间注射橄榄油0.2 mL,均连续注射21 d[6]。造模7 d起,对小鼠阴道脱落细胞进行阴道细胞涂片,观察动情周期情况,阴道涂片显示无规律性的动情周期表明造模成功[7]。
2.2 干预方法
将40只建模成功的小鼠随机分为模型组及ICA低剂量、中剂量和高剂量组,每组10只。建模成功24 h后,ICA低剂量、中剂量和高剂量组分别按照25、50、75 mg·kg-1腹腔注射ICA 0.5 mL(溶于9 g·L-1氯化钠注射液中)[8],对照组和模型组腹腔注射9 g·L-1氯化钠注射液0.5 mL,每日1次,连续干预2周。
2.3 检测激素水平
末次干预结束后空腹12 h,称定质量,每日用30 mg·kg-1戊巴比妥麻醉,迅速采集小鼠腹主动脉血液5 mL,常温静置20 min后以10 000 r·min-1离心10 min(离心半径为10 cm),取血清样本2 mL,按照ELISA试剂盒说明书进行操作,依次加样、孵育酶标抗体,加底物显色,终止反应,用酶标仪于450 nm处测定各孔吸光度值A,绘制标准曲线,计算待测样品中T、E2、LH、FSH和AMH水平。
2.4 计算脏器指数
取血后将各组小鼠双侧卵巢和子宫完整取出,去除周围脂肪组织,称定质量并记录,计算脏器指数。卵巢指数=卵巢质量(mg)/体质量(g)。子宫指数=子宫湿质量(mg)/体质量(g)。
2.5 观察组织学变化
用生理盐水冲洗卵巢组织,取右侧卵巢组织置于液氮中保存,取左侧卵巢组织置于40 g·L-1多聚甲醛溶液中固定24 h,经脱水和石蜡包埋,制成厚度为4 μm的切片,依次乙醇脱水、二甲苯透明、苏木素染色、盐酸乙醇分化、伊红染色、脱水、透明、中性树胶封片,于显微镜下观察组织形态。每张切片随机选取5个不同视野,计数生长卵泡数量、囊性卵泡数量和黄体数量。
2.6 流式细胞术检测细胞凋亡
取各组2.5项下液氮保存的小鼠部分卵巢组织置于PBS中,显微镜下用镊子挤压卵巢得到颗粒细胞和卵母细胞,静置10 min,去上清,加入1 g·L-1的胰蛋白酶消化15 min,加入M16培养液,静置10 min,去上清,再加入PBS以3 000 r·min-1离心10 min,去上清,用PBS冲洗,加入Binding Buffer结合液400 μL悬浮细胞,调整细胞密度为5×105个·mL-1,加入FITC-Annexin V 5 μL和PI 5 μL ,混匀,避光静置10 min,上样检测细胞凋亡情况。
2.7 检测卵巢组织中相关蛋白水平
取各组2.5项下冷冻保存的小鼠卵巢组织100 mg,置于EP管中,加入RIPA试剂0.6 mL,剪碎匀浆,静置10 min,离心(20 min,4 ℃,8 000 r·min-1,离心半径为10 cm),取上清,用BCA试剂盒蛋白定量,取1∶1样本和上样缓冲液混匀进行SDS-PAGE电泳,100 V电转30 min,转至PVDF膜上,滴加适量封闭液处理2 h(室温),将膜放入GDF-9、BMPR-Ⅱ、ALK5、p-Smad2、p-Smad3、Smad2和Smad3一抗中(均1∶800稀释),4 ℃摇床孵育过夜,TBST洗膜,放入二抗(1∶2 000稀释)中,室温摇床孵育1 h,TBST洗膜,滴加显影液,于暗室曝光、显影,Image J软件分析条带灰度值。
2.8 统计学方法
3 结果
3.1 各组小鼠激素水平的比较
模型组T、LH和AMH的水平较对照组升高,E2、FSH的水平较对照组降低(P<0.05);ICA各剂量组T、LH和AMH的水平较模型组降低,E2、FSH的水平较模型组升高(P<0.05);T、LH和AMH的水平与ICA呈剂量依赖性降低,E2、FSH的水平与ICA呈剂量依赖性升高(P<0.05)。见表1。
表1 各组小鼠激素水平的比较
3.2 各组小鼠脏器指数的比较
模型组的卵巢指数较对照组升高,子宫指数较对照组降低(P<0.05);ICA各剂量组的卵巢指数较模型组降低,子宫指数较模型组升高(P<0.05);卵巢指数与ICA呈剂量依赖性降低,子宫指数与ICA呈剂量依赖性升高(P<0.05)。见表2。
表2 各组小鼠脏器指数比较
3.3 各组小鼠卵巢组织形态学的比较
对照组小鼠卵巢组织可见各时期的卵泡和黄体,有发育良好的生长卵泡且卵泡的颗粒细胞呈多层次。模型组小鼠的卵巢组织中较少见生长卵泡,颗粒细胞层数减少,卵巢囊性卵泡数量和闭锁卵泡数量增加,黄体数量减少;ICA各剂量组小鼠各级卵泡数量增多,卵泡内颗粒细胞层数增加、囊性卵泡数量减少,黄体数量增加。囊性卵泡数量与ICA呈剂量依赖性降低,生长卵泡数量、黄体数量与ICA呈剂量依赖性增加(P<0.05)。见图1、表3。
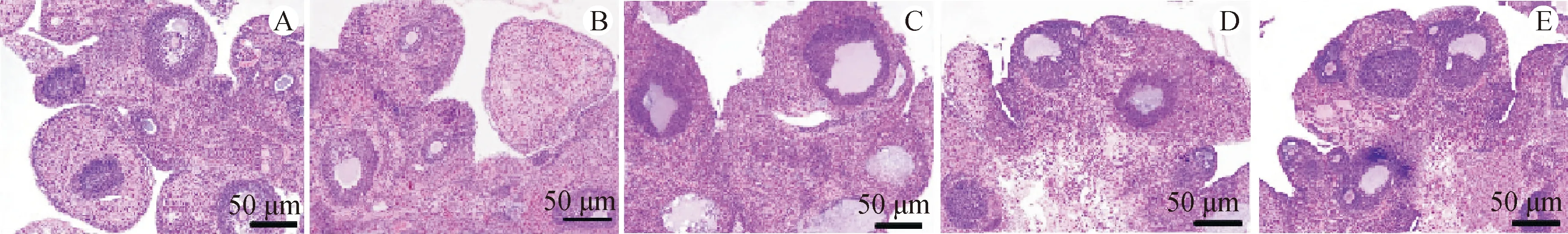
注:A.对照组;B.模型组;C.ICA低剂量组;D.ICA中剂量组;E.ICA高剂量组。
表3 各组小鼠卵巢组织生长卵泡、囊状卵泡和黄体数量比较
3.4 各组小鼠卵泡细胞凋亡率的比较
模型组凋亡率较对照组升高(P<0.05);ICA各剂量组凋亡率较模型组降低(P<0.05);凋亡率与ICA呈剂量依赖性降低(P<0.05),见表4。
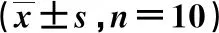
表4 各组小鼠卵母细胞凋亡率的比较
3.5 卵巢组织相关蛋白水平的比较
模型组GDF-9、BMPR-Ⅱ、ALK5、p-Smad2和p-Smad3蛋白的表达水平均较对照组降低(P<0.05);ICA各剂量组GDF-9、BMPR-Ⅱ、ALK5、p-Smad2和p-Smad3蛋白的表达水平较模型组升高(P<0.05);GDF-9、BMPR-Ⅱ、ALK5、p-Smad2和p-Smad3蛋白的表达水平与ICA呈剂量依赖性升高(P<0.05)。见表5、图2。
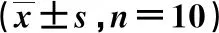
表5 各组小鼠卵巢组织GDF-9、BMPR-Ⅱ、ALK5、p-Smad2和p-Smad3蛋白水平的比较
4 讨论
PCOS是由多种因素调控的具有较高发病率的内分泌和代谢紊乱疾病,由于激素异常分泌,影响下丘脑-垂体-卵巢轴的平衡,使卵泡正常发育或正常排卵受到干扰,从而导致不孕[9-10]。本研究中ICA各剂量组小鼠卵巢指数和囊性卵泡数量较模型组降低,子宫指数、黄体和生长卵泡数量均较模型组升高,表明ICA可促进PCOS小鼠卵泡生长、发育,改善排卵功能。
卵泡的正常发育主要基于下丘脑-垂体-性腺轴调控分泌的性激素共同维持生殖内分泌活动的稳定[11]。AMH是反映卵巢中生长卵泡数量的重要标志物,在PCOS中参与卵泡发育的2个过程,一是可抑制始基卵泡的起始募集,即阻止生长卵泡形成;二是可阻止FSH刺激的卵泡发育,即抑制生长卵泡的发育和优势卵泡的形成[12-13]。优势卵泡在LH和FSH作用下排卵,FSH主要促进颗粒细胞的增生与分化,通过与卵泡表面的FSHR结合促进卵泡生长[14]。本研究中ICA各剂量组T、LH、AMH水平较模型组降低,E2、FSH水平较模型组升高,表明ICA可有效改善PCOS小鼠内分泌代谢,进一步缓解无排卵或稀发排卵。此外,卵泡颗粒细胞在卵泡发育中发挥着重要作用,有研究发现颗粒细胞的凋亡会导致卵泡闭锁,阻碍卵泡发育,抑制排卵[15-16]。本研究中ICA各剂量组凋亡率较模型组降低,表明ICA可抑制颗粒细胞凋亡,促进卵泡细胞正常生长发育。
GDF-9属于卵母细胞特异性生长因子TGF-β家族,主要作用于颗粒细胞的增殖、分化及调亡等过程,颗粒细胞又反馈于卵母细胞营养物质,维持卵母细胞微环境稳定以及卵泡的发育、成熟、排卵及受精过程[17-18]。GDF-9/Smads通路即GDF-9先与细胞膜上的BMPR-Ⅱ结合使其磷酸化后募集ALK5 I型受体形成磷酸化复合物,诱导Smad2/3磷酸化启动信号传导,调控卵泡发育[19]。通过激活GDF-9/Smads通路可促进卵泡生长发育,改善排卵障碍[20]。本研究中ICA各剂量组GDF-9、BMPR-Ⅱ、ALK5、p-Smad2、p-Smad3蛋白表达水平较模型组升高,表明ICA促进卵泡发育成熟、改善PCOS小鼠排卵,其可能与GDF-9/Smads信号通路调控紧密相关。
综上所述,ICA可有效调节PCOS小鼠生殖激素水平、改善内分泌代谢,可能通过调控GDF-9/Smads信号通路促进卵泡发育、成熟,减少卵泡的凋亡,改善排卵,为ICA应用于PCOS的临床治疗提供理论支持。
