动态增强磁共振成像定量参数鉴别诊断肝脏小占位性病变良恶性价值研究*
2023-09-12朱志敏毛卫霞杨延延
朱志敏,李 华,陈 轶,毛卫霞,杨延延
肝脏占位性病变是由于肝组织异常增殖和代谢引起的局部组织病理学改变,是临床常见的需要鉴别的问题[1]。根据性质不同分为良性和恶性占位性病变,两者早期均无临床症状,但恶性病变生长迅速,待确诊时已到中晚期,错过最佳治疗时机[2]。手术是治疗肝癌的最佳手段,越早发现,越早治疗,术后生存率越高[3],故鉴别肝脏良恶性病变性质至关重要。肝穿刺活检是诊断肝脏良恶性肿瘤的良好方法,但具有创伤性。随着医疗技术水平的发展,磁共振成像(magnetic resonance imaging,MRI)已被应用于临床,但MRI平扫难以通过信号强度、病灶形态、大小及毗邻关系进行有效的鉴别诊断,且不能反映肿瘤血供情况,故对肝脏小结节的鉴别能力差[4]。动态增强磁共振成像(dynamic contrast-enhanced MRI,DCE-MRI)可提供血供信息,帮助诊断。DCE-MRI定量参数能反映造影剂在组织内的变化,提示血流灌注和微血管分布情况[5,6]。本研究应用MRI定量参数鉴别肝内占位性病变的性质,取得较好的诊断效果,现将结果报道如下。
1 资料与方法
1.1 一般资料 2020年3月~2022年3月我院收治的肝脏占位性病变患者83例,男性52例,女性31例;年龄为35~74岁,平均年龄为56.2±7.1岁。均经影像学检查发现,纳入患者病灶≤3cm,直径为0.7~3.0 cm,平均为2.2±0.3 cm。排除标准:(1)肝肾功能不全;(2)合并心脑血管疾病;(3)对造影剂过敏;(4)存在精神疾病。本研究经我院医学伦理委员会审核,患者签署知情同意书。
1.2 MRI检查 使用德国Siemens Verio 3.0 T磁共振成像仪。受检者禁食禁饮6~8 h。采取仰卧位,足先进,双手高举。首先,收集5个呼吸周期,检测膈肌位置。然后,使用间歇导航收集膈肌的位置,在膈肌进入采集窗口时采集图像。扫描自膈肌顶部至双肾下极。在行DCE-MRI扫描前,先行T1-Mapping扫描:TR= 3 ms,TE=1.3 ms,矩阵224×160,NEX=0.69,FOV=(40~42) cmX (32.0~33.6) cm,层厚7.5~8.0 mm,层数26层,5组翻转角为2°、5°、8°、12°、15° ;采用吸气-呼气-憋气模式横断位扫描。DCE-MRI参数:TR=3 ms,TE=1.3 ms,矩阵224×160,NEX=0.69,FOV=(40~42) cmX (32.0~33.6) cm,层厚=7.5~8.0 mm,层数26层,FA为15°;平静浅慢呼吸模式轴位扫描55个动态时相;注射造影剂前扫描4个动态阶段作为基线,自第5期动态分期扫描开始,经肘静脉注射钆酸二钠造影剂(Gd-EOB-DTPA)10 ml。在注射结束后,以同样的速度向试管内注射20 ml生理盐水。在扫描结束后,将图像传至西门子Syngo工作站,应用Tissue4D软件处理。首先,应用呼吸运动校正软件校正呼吸伪影,测量T1值,输入造影剂名称,在早期动态增强扫描图像上选择感兴趣区域,获得定量参数:容量转移常数(volume transfer constant,Ktrans)、速率常数(rate constant,Kep)、血管外细胞外容积分数(volume of extravascular extracellular space per unit volume of tissue,Ve)和增强曲线下初始面积(initial area under curve,IAUC)。
2 结果
2.1 典型病灶MRI表现 见图1。
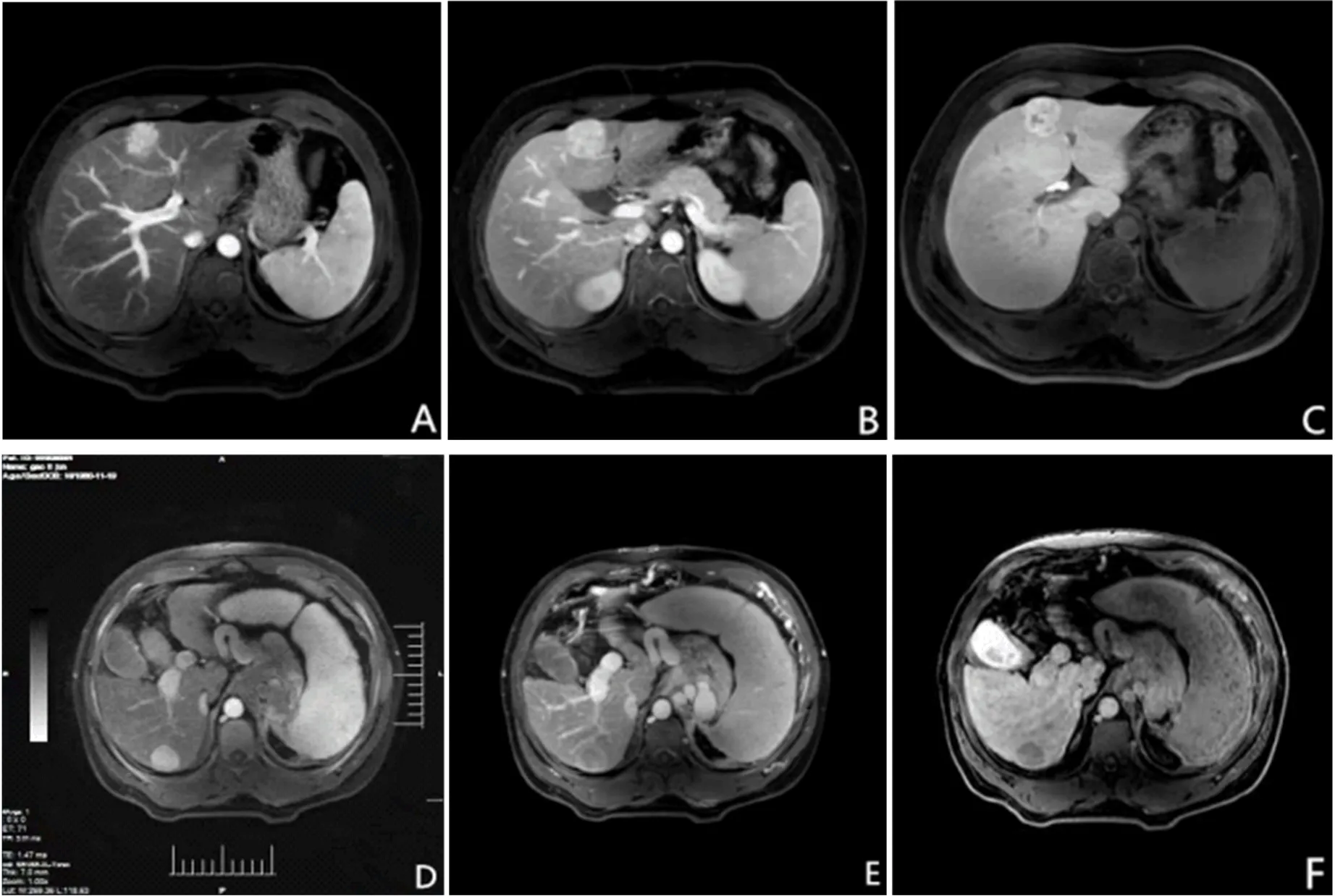
图1 腹部MRI表现A:肝左叶见结节状明显强化灶;B和C:造影剂逐渐退出。病理学检查提示为肝脏局灶性结节性增生;D:肝右后叶见结节状明显强化灶;E和F:造影剂逐渐消退。病理学检查提示为肝细胞癌
2.2良恶性病灶与周围肝组织DCE-MRI定量参数比较 在本组83例肝占位性病变患者中,经手术取得病变及其周围肝组织71例,经穿刺取得12例。病理学检查诊断良性病灶38例(肝硬化结节31例,肝脏局灶性结节性增生7例),恶性病灶45例(肝细胞癌41例,胆管细胞癌4例);良性病灶MRI参数Krans和IAUC显著大于周围肝组织(P<0.05),而Kep和Ve比较无显著性差异(P>0.05);恶性病灶Krans、Kep、Ve和IAUC均显著大于周围肝组织(P<0.05),也显著大于良性病灶(P<0.05,表1)。
表1 良性病灶与周围肝组织DCE-MRI定量参数比较
2.3 MRI参数鉴别肝脏小占位性病变良恶性性质效能分析 经ROC曲线分析显示,采用Krans、Kep、Ve和IAUC联合诊断的效能显著优于各单项参数诊断(P<0.05,表2和图2)。
3 讨论
肝脏占位性恶性病变包括原发性肝癌和转移性肝癌,而良性病变包括肝血管瘤和肝硬化局部结节性增生等。肝脏恶性病变威胁生命健康。据报道显示,肝癌居恶性肿瘤的第五位,死亡率居于第三位[7]。肝癌发病率在近几年呈上升趋势,我国发病人数占全球的55%[8]。手术是首选的治疗方法,但肝癌早期常无明显的临床症状,给诊断带来困难。一旦出现症状时,肿瘤已经进入晚期。因此,早诊断和及时治疗对延长患者生存期、提高生活质量至关重要[9]。
增强CT是临床常用诊断肝脏占位性病变的方法,具有较高的敏感性和特异性,可同时观察到病变不同时期的血供来源及其特征,明确病变与周围组织和血管的关系,但可能存在辐射等缺点[10]。MRI避免了X射线污染,可用于多序列、多向成像,反映组织结构成分分布,但由于直径≤3 cm病灶易出现漏诊和误诊,给诊断带来麻烦[11]。随着MRI设备的改进,扫描速度提高,可进行多相和薄层扫描,为肝脏肿瘤的诊断提供了重要的依据[12]。DCE-MRI是MRI成像技术,可量化造影剂在病变部位对血流动力学的影响,为肿瘤微血管生成和通透性提供血流动力学信息。组织病理学检查可发现肿瘤新生血管网没有正常的血管结构,基底膜不完整,血管外间隙大,使肿瘤组织毛细血管通透性增加,对比剂外漏速度增加,处于高血供状态[13-15]。同时,基于时间-信号强度曲线,MRI利用药代动力学模型剖析曲线趋势,最常用的是Tofts双室药代动力学模型,提高了肿瘤与正常组织的对比度,有利于病灶的检出[13-15]。Tofts 双室药代动力学参数包括Krans、Kep、Ve和IAUC,其中Krans和Kep可反映肿瘤的血浆流量、毛细血管渗透性情况和病变血管生成能力;Ve可反映血管外细胞外间隙容积和血管通透性;IAUC可反映造影剂进入肿瘤比率和总量[16,17]。本研究结果显示,恶性病灶Krans、Kep、Ve和IAUC分别为(0.4±0.2)min-1、(0.9±0.3)min-1、(0.5±0.2)和(37.2±7.1),显著大于肿瘤周围肝组织或良性病灶,与有关研究结果[18]一致,提示为应用这些指标鉴别诊断提供了可能。正常肝组织主要由门静脉供血,肝动脉供血仅占25%,血管分布规律,细胞结构致密,而肝癌新生血管多,成熟度较差,渗透至血管外间隙对比剂能较快回流血管内间隙。因此,MR检测的肝细胞癌病灶Krans、Kep、Ve和IAUC显著大于正常肝组织。肝脏恶性病变的血流量较大,血管生成能力越强。恶性肿瘤细胞生长过快,可产生大量的新生血管,且血管壁薄弱,血管璧内皮细胞间隙较大,基底膜疏散,通透性增高,使造影剂从新生血管内部扩散到组织间隙的速度和再进入血管的速度加快,故病灶Krans、Kep、Ve和IAUC均显著增大。良性病变新生血管少,内皮细胞生长完整,通透性高,对比剂转运速度较慢,可导致病灶Krans、Kep、Ve和IAUC变化相对较小,与周围肝组织差异较小[19,20]。经ROC曲线分析显示,应用MRI检测参数Krans诊断≤3 cm的肝脏占位性病变良恶性的AUC为0.784,其灵敏度为82.0%,特异度为70.3,其他三个参数的诊断效能也相差不多,而应用这四个参数联合诊断的AUC为0.920,其灵敏度为95.0%,特异度为78.5%,提示联合多种参数对鉴别肝内小的占位性结节的性质有很大的实际用途。
综上所述,使用DCE-MRI定量参数 Krans、Kep、Ve和IAUC联合可有效鉴别诊断小的肝脏占位性病变的性质,对临床正确处理有很大的帮助。由于肝细胞癌往往发生于有肝硬化背景的肝病患者,而肝硬化本身可能发生肝细胞再生而产生结节性病变,为临床诊断提出了难题。这时,血生化、血清和免疫学指标往往也难以及时提供有鉴别意义的变化,穿刺检查受到一定的制约,就给临床决策提出了挑战。影像学检查技术的不断进步为早期诊断小肝癌提供了可能的手段,在这方面还需要积累更多的资料,以期获得更为精准的诊断方法,而DCE-MRI检查大有深入研究的必要。