聚乙二醇干扰素α-2a治疗HBeAg阳性慢性乙型肝炎患者3年随访研究
2023-09-12王一卓张崴琪
王一卓,张崴琪,李 红
慢性乙型肝炎(chronic hepatitis B,CHB)是一种慢性传染性疾病,由乙型肝炎病毒(hepatitis B virus,HBV)持续复制和体内免疫应答导致的疾病[1]。临床上,治疗策略主要是尽可能抑制病毒复制或者增强机体免疫应答功能,使机体能够自主清除病毒,减少肝纤维化和肝细胞癌的发生。因此,抗病毒治疗是关键[2]。聚乙二醇干扰素α-2a(pegylated interferon α-2a,peg-IFN α-2a)是α-2a干扰素与单甲氧基聚乙二醇结合的产物,可与肝细胞表面特异性受体结合,刺激酶的表达,抑制病毒复制和促进巨噬细胞吞噬病毒,达到清除病毒的作用,已成为治疗血清HBeAg阳性的CHB患者的一线药物之一[3]。有文献表明,在欧美等地区,在完成48周标准疗程治疗的CHB患者,仍有64%不能达到HBeAg血清学转换,而延长疗程可以改善治疗应答率[4]。本研究应用peg-IFN α-2a连续治疗血清HBeAg阳性的CHB患者至少48~72周,并随访3年,现将结果报道如下。
1 资料与方法
1.1 一般资料 2017年3月~2018年3月我院收治的初治HBeAg阳性CHB患者72例,男41例,女31例;年龄为18~44岁,平均年龄为(28.1±3.8)岁。符合中华医学会肝病学分会修订的《慢性乙型肝炎防治指南(2015年版)》[5]的诊断标准,HBeAg阳性>6个月。排除标准:(1)肝硬化、药物性肝损伤;(2)对治疗药物过敏。根据是否延长治疗,将72例患者分为A组33例和B组39例,分别接受peg-IFN α-2a治疗48周和72周。两组性别、年龄等一般资料比较差异均无统计学意义(P>0.05,表1),具有可比性。本研究获得我院医学伦理委员会批准,患者及其家属签署知情同意书。

表1 两组基线资料比较
1.2 治疗方法 给予所有患者peg-IFNα-2a(上海罗氏制药有限公司,国药准字:J20160077)180 μg皮下注射,1次/w。在治疗48 w时,对于出现部分应答,即血清HBV DNA低于1×105copies/mL,但未出现HBeAg血清学转换者,根据其意向、耐受性和是否延长治疗,分为A组33例(不延长)和B组39例(延长至72 w)。在治疗结束后,随访3年。在整个治疗过程中,给予所有患者多烯磷酸酯酰胆碱等护肝类药物辅助治疗。
1.3 指标检测 采用化学发光法检测血清HBsAg和HBeAg水平(博阳生物科技上海有限公司);采用实时荧光定量PCR法检测血清HBV DNA水平(上海科华生物工程股份有限公司,仪器为Applied Biosystems公司提供的7700型实时荧光定量PCR仪);使用科华Polaris c2000全自动生化分析仪检测血清ALT水平(上海科华生物工程股份有限公司);使用无锡海斯凯尔医学技术有限公司提供的FibroTouch肝脏瞬时弹性成像仪行肝脏硬度检测(liver stiffness measurement,LSM)。
2 结果
2.1 两组临床疗效比较 在治疗72 w、随访2年和随访3年时,B组HBsAg消失率、HBeAg消失率、HBeAg血清转换、HBV DNA转阴率和ALT复常率均显著高于A组(P<0.05,表2、表3)。

表2 两组治疗结束时临床疗效(%)比较

表3 两组随访时临床疗效(%)比较
2.2 两组LSM变化比较 在治疗72周时,B组LSM显著低于A组(P<0.05,表4)。
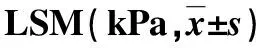
表4 两组比较
2.3 影响HBeAg血清学转换的Logistics回归分析 在随访结束时,本组CHB患者发生HBeAg血清学转换52例,未发生HBeAg血清学转换20例;应答与未应答组年龄、治疗疗程和基线HBeAg水平存在显著性差异(P<0.05,表5);经多因素Logistics回归分析显示它们均是HBeAg血清转换的独立影响因素(P<0.05,表6)。
表5 两组年龄、疗程和血清HBeAg水平比较
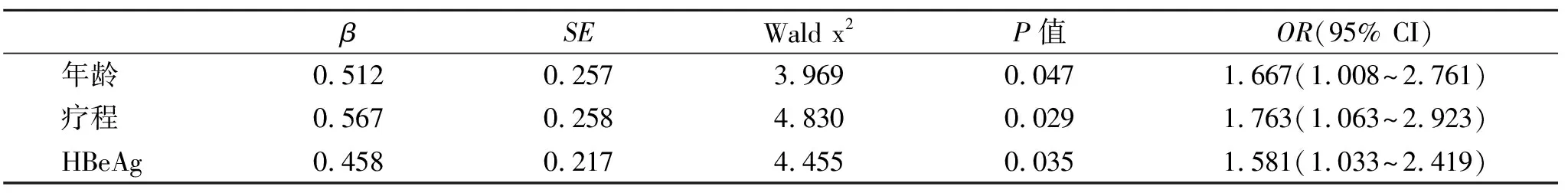
表6 影响HBeAg血清学转换的Logistics回归分析
3 讨论
CHB是一个全球性的重大公共卫生问题。据世界卫生组织统计,全球约有2.6亿人感染过HBV。及时有效的管理CHB患者可防止疾病发展为肝硬化或肝癌[6-8]。在HBeAg阳性的情况下,HBV可大量复制,难以及时被机体清除,可在肝细胞内反复感染,刺激免疫系统长期攻击感染的肝细胞,引起细胞溶解性炎症反应,最终导致肝损伤[9]。因此,治疗HBV感染的主要目的应是防止HBV持续复制[10]。peg-IFN α-2a为α-2a与单甲氧基聚乙二醇结合产物,具有免疫调节和抗病毒作用,疗效明显,治愈率高,病毒应答高,是目前临床上推荐的一线治疗方案[11]。peg-IFN α-2a的标准疗程为48周,但有研究表明,延长peg-IFN α-2a治疗疗程的患者,其HBeAg转换可以在治疗停止后发生,仍然可在长时间内抑制HBV DNA复制和肝脏炎症反应,改善患者预后和生存状况[12,13]。因此,适当延长peg-IFN α-2a治疗疗程将有助于提高临床疗效。本研究结果显示,在治疗72周和随访2年时,B组HBsAg消失率、HBeAg消失率、HBeAg血清转换、HBV DNA转阴率、ALT复常率均显著高于A组,提示对于在正常疗程结束时治疗效果不理想患者,延长治疗疗程可以作为一种新选择。B组患者体内血药浓度维持时间持久,生物利用度更高,有效增强了机体调节免疫功能,从而提高应答率[14,15]。在停止peg-IFN α-2a治疗后,一些CHB患者可能再次出现病情反复,这是需要重新选择抗病毒治疗方法,以维持疗效。
HBV感染是诱发肝纤维化及肝硬化的重要因素。通过抑制HBV复制可有效减少患者肝硬化和肝癌发生风险[16,17]。本研究结果显示,在治疗72周时,B组LSM值为(7.0±0.9)kPa,显著低于A组的(7.5±0.8)kPa,提示B组可以持续改善肝纤维化。我们认为:①peg-IFN α-2a可诱导前列腺素E2的释放,抑制胶原的合成[18];②peg-IFN α-2a可抑制病毒复制、抑制I型胶原A2(COLIA2)启动子活化,诱导激活的肝星状细胞凋亡[19];③peg-IFN α-2a可以提高机体内金属蛋白酶活性,促进细胞外基质降解,从而预防和治疗肝纤维化[20]。B组延长治疗作用时间更长,故肝纤维化指标改善幅度也大于A组。在停止peg-IFN α-2a后,本组随访2年和3年后,上述指标仍显著低于治疗前和治疗48周,但两组间变化差异不再明显,这可能与经过peg-IFN α-2a治疗后以及后续的抗病药物治疗,肝纤维化程度得到了有效控制,各指标变化趋于稳定有关。本研究结果显示,两组间不良反应发生率差异比较无统计学意义,表明延长peg-IFN α-2a疗程至72周的安全性仍然良好。
有研究指出,CHB患者血清HBeAg定量水平和年龄等诸多因素有助于预测peg-IFN α-2a抗病毒疗效。本文以年龄、peg-IFN α-2a治疗疗程和基线HBeAg水平为变量进行Logistics回归分析,结果显示,年龄、peg-IFN α-2a治疗疗程和基线HBeAg水平均为影响HBeAg血清学转换的独立因素,也从另一角度证明了对于48周标准治疗结束但尚未产生应答的患者,延长疗程将使这部分患者继续获益。然而,若无限延长peg-IFN α-2a治疗时间,治疗成本将不断增加。因此,确定延长α-干扰素抗病毒治疗的最佳终点又获得最大的临床疗效将十分重要。
综上所述,延长peg-IFN α-2a治疗CHB患者的疗程可改善临床疗效,安全性良好,能提高患者抗肝纤维化的能力。但纳入患者的标准和排除标准时什么?多长时间的抗病毒疗程将有益于提高疗效以及检测血清HBeAg的方法、试剂标准化和水平选择都可能最终影响抗病毒应答效果,这些都需要临床进行精心设计和观察随访,才能给出较为科学的结论。