壳寡糖抑制辣椒疫霉的生长发育和侵染
2023-09-11翟新羽黄太萍冯国荣陈意刘洋靳晶豪陈孝仁
翟新羽 黄太萍 冯国荣 陈意 刘洋 靳晶豪 陈孝仁

摘要:色菌界的疫霉菌所引发的作物疫病是农业生产上的毁灭性病害,严重威胁粮食安全和农业可持续发展。为探明壳寡糖是否可用于作物疫病的绿色防控,分析壳寡糖对辣椒疫霉的抑菌活性及作用机制。在壳寡糖终浓度为0、10、30、50、100、300、500 mg/L的PDA平板上接种辣椒疫霉、恶疫霉、瓜类疫霉、寄生疫霉和荔枝霜疫霉,测定菌丝生长情况;在壳寡糖终浓度为0、10、30、50、100 mg/L的10% V8培养液中培养辣椒疫霉菌丝,观察菌丝形态变化;添加0、10、30、50、100 mg/L壳寡糖,观察对辣椒疫霉游动孢子囊的产生,以及游动孢子释放、游动和萌发的影响;对本氏烟喷施浓度为0、10、30、50、100、1 000 mg/L的壳寡糖后接种辣椒疫霉,观察病害发生情况。结果表明,壳寡糖能直接抑制辣椒疫霉和其他4种卵菌(恶疫霉、瓜类疫霉、寄生疫霉和荔枝霜疫霉)的菌丝生长,但抑菌效果在种间存在差异,当浓度为100 mg/L时对辣椒疫霉的生长抑制率达到了52.50%。自50 mg/L浓度起,壳寡糖对辣椒疫霉的菌丝形态,游动孢子囊形成,以及游动孢子的释放、游动和萌发均有强烈的抑制作用,当浓度升高时抑制效果更加显著。经 1 000 mg/L 壳寡糖喷施处理过的本氏烟叶片上产生的病斑面积明显小于对照叶片,显示壳寡糖可以保护本氏烟免遭辣椒疫霉的侵染。本研究综合表明,壳寡糖可抑制辣椒疫霉的营养生长、生长发育和侵染致病,具有防控作物疫病的生防潜力。
关键词:壳寡糖;辣椒疫霉;卵菌;本氏烟;生物防治;绿色防控
中图分类号:S436.418.1+9 文献标志码:A
文章编号:1002-S432.11302(2023)13-0106-06
基金项目:国家自然科学基金(编号:32272477、32102154、31871907);江苏省农业科技自主创新资金[编号:CX(20)3125];广东省植物保护新技术重点实验室开放基金(编号:植重2021-04);江苏省大学生创新创业训练计划(编号:202211117153Y);扬州大学优秀青年骨干教师培养对象项目;扬州大学高端人才支持计划(拔尖人才成长计划)。
作者简介:翟新羽(1999―),女,江苏淮安人,硕士研究生,从事植物真菌病害研究,E-mail:1643755033@qq.com;共同第一作者:黄太萍(2001―),女,陕西安康人,从事植物病害研究,E-mail:hhhhtp1029@163.com。
通信作者:陈孝仁,博士,教授,主要从事植物真菌病害研究。E-mail:xrchen@yzu.edu.cn。
色菌界(Chromista)的卵菌(Oomycetes)是一群重要的植物病原菌,严重危害农业的安全生产[1]。其中,疫霉属(Phytophthora spp.)含有100多种重要病原菌,例如引起马铃薯晚疫病的致病疫霉(P. infestans)和引起大豆根腐病的大豆疫霉(P. sojae)[2];辣椒疫霉(P. capsici)侵染危害茄科、葫芦科和豆类等上百种农作物,每年给全世界蔬菜生产造成的损失高达10亿美元[3]。目前,应用最为广泛而高效的卵菌病害防控方法是施用化学农药。但随着化学农药的长期大量使用,病原菌抗药性、农药残留、环境污染等问题日益严重,不利于现代农业的可持续发展和生态文明建设,亟需开发出新型产品供农业生产选择使用。
壳寡糖(chito-oligosaccharides)是降解壳聚糖得到的一类低聚糖,由2~10个氨基葡萄糖通过 β-1,4-糖苷键连接而成[4]。壳寡糖主要来源于真菌以及虾、蟹、贝类等甲壳动物的壳[5]。由于其自然来源广泛、可自然降解、水溶性好、易吸收,并且具有广谱抗菌性且对人畜环境无毒等优点,在农业生产上具有广泛的研究和应用价值[6]。Kendra等研究发现,浓度为4 mg/L、聚合度为7的壳寡糖能够抑制豌豆根腐病病菌(Fusarium solani)在培养液中的生长发育[7]。徐俊光测定了多种物质对病原真菌的抑菌活性,发现壳寡糖对几种病原菌具有直接抑菌效果,其中对辣椒疫霉(P. capsici)的抑菌活性最高[8]。尹恒等研究发现,50 μg/g壳寡糖处理 1 d 后拟南芥抗烟草花叶病毒(TMV)侵染的能力显著提高,植物表现出体内TMV外壳蛋白含量明显减少、抗性基因PR1上调表达以及水杨酸途径被激活[9]。此外,还有大量研究表明,壳寡糖能够提高小麦、油菜、大豆、黄瓜、番茄、烟草等多种作物的抗病能力[10-13]。
目前,國内外研究者对壳寡糖的抑菌作用和诱导植物抗病性做了深入的研究。但由于壳寡糖的聚合度不一,关于其抑制疫霉等病原卵菌的作用机制也不明确。因此,笔者于2020年在扬州大学植病系作物疫病防控实验室探究壳寡糖对辣椒疫霉(P. capsici)等几种病原卵菌的抗菌活性和作用机制,并分析壳寡糖保护本氏烟免遭辣椒疫霉侵染的防治效果,以期为作物疫病绿色防控提供新的思路和方法。
1 材料与方法
1.1 供试药剂
壳寡糖[分子式为(C12H24N2O9)n,分子量≤2 000]购自上海麦克林生化科技有限公司(货号C875644),利用无菌水将其配制成50 mg/mL的母液。
97%甲霜灵原药由江苏宝灵化工股份有限公司提供。先用少量丙酮溶解甲霜灵,后加入0.1%吐温-80水溶液配成5 mg/mL的母液。
1.2 供试菌株
本研究中使用到的菌株及其来源见表1。菌株均接种在10% V8固体平板上,置于25 ℃电热恒温箱中黑暗培养5~8 d。
1.3 供试植物
本氏烟(Nicotiana benthamiana)移栽于含有无菌土的塑料钵中,置于22~25 ℃、16 h/8 h光暗交替温室培养,生长4~6周后使用。
1.4 培养基
1.4.1 PDA培养基
将马铃薯去皮切成薄片,称取200 g;加入1 000 mL去离子水,煮沸;用纱布过滤掉马铃薯渣块,滤液中加入20 g葡萄糖和18 g琼脂,再加去离子水定容至1 000 mL,混匀后分装到锥形瓶中;用高压蒸汽灭菌(121 ℃、20 min,下同)后待用。
1.4.2 10% V8培养基
量取100 mL的V8汁(美国Campbell Soup Company),加入0.2 g CaCO3、16 g琼脂(液体培养基不加琼脂),加去离子水定容至 1 000 mL,用高压蒸汽灭菌后待用。
1.5 抑菌测定
以下各项测定中每个处理均设3组重复,试验重复2次。用SPSS软件分析处理间差异显著性。
1.5.1 菌丝生长测定
将壳寡糖加入到已融化并冷却至50 ℃左右的PDA培养基中,充分混匀后倒入培养皿(直径为90 mm)中,每皿定量15 mL,形成壳寡糖终浓度分别为0(阴性对照)、10、30、50、100 mg/L 。以添加甲霜灵(浓度为5 mg/L)的培养平板为阳性对照。用直径为5 mm的打孔器在新鲜培养的辣椒疫霉菌落边缘打取菌丝块,用接种针将菌丝块接种到平板中间(菌丝面向下),用封口膜封好后倒置于25 ℃恒温培养箱内培养。6 d后拍照,用十字交叉法测量菌落直径,计算菌落生长抑制率:
菌落生长抑制率=阴性对照菌落直径-处理菌落直径阴性对照菌落直径×100%。
同法,测量壳寡糖对恶疫霉、瓜类疫霉、寄生疫霉以及荔枝霜疫霉菌丝生长的抑制作用,其终浓度为30、100、300、500 mg/L。
1.5.2 生长发育测定
1.5.2.1 菌丝形态
将5块菌丝块移入培养皿中,倒入15 mL 10% V8培养液,同时加入壳寡糖母液使其终浓度分别为10、30、50、100 mg/L,以不加壳寡糖的培养皿为阴性对照,而加入甲霜灵(浓度为 5 mg/L)的培养皿作为阳性对照。培养皿置于 25 ℃ 黑暗培养3 d,等待菌丝丛形成。取少量菌丝制成玻片,在BX53显微镜(日本奥林巴斯公司)下观察菌丝的形态。
1.5.2.2 游动孢子囊的形成
将5块菌丝块移入培养皿中,倒入15 mL 10% V8培养液,置于 25 ℃ 黑暗培养3 d。弃去培养液,加入15 mL灭菌水重新浸没菌丝丛,继续培养,之后每隔12 h换1次水,共换3次。每次换灭菌水时加入壳寡糖母液,使其终浓度分別为10、30、50、100 mg/L。以不加壳寡糖为对照。在显微镜下观察比较含与不含壳寡糖条件下游动孢子囊形成的差异,并计数显微镜同一个视野下游动孢子囊的数量。
1.5.2.3 游动孢子的释放
按照“1.5.2.2”节中的方法培养形成菌丝丛,换水时不加壳寡糖,诱导菌丝丛形成游动孢子囊。往培养皿中加入壳寡糖母液,使之终浓度分别为10、30、50、100 mg/L,以不加壳寡糖为阴性对照。处理1~2 h后,置于4 ℃冰箱10~15 min、25 ℃恒温箱10~30 min,冷热刺激游动孢子囊释放游动孢子。在显微镜下观察游动孢子的释放,计数同一个视野下的游动孢子囊释放率和游动孢子浓度。
1.5.2.4 游动孢子的游动
按照“1.5.2.3”节中方法获得辣椒疫霉的游动孢子悬浮液,此过程均不加壳寡糖。往游动孢子悬浮液中加入壳寡糖,使之分别形成10、30、50、100 mg/L的终浓度,立即在显微镜下观察游动孢子的运动状态并将其录制下来。
1.5.2.5 游动孢子的萌发
按照“1.5.2.3”节中方法获得辣椒疫霉的游动孢子悬浮液,整个过程均不加壳寡糖。吸取2 mL悬浮液,置入15 mL离心管中,在涡旋振荡器上振荡使游动孢子的鞭毛脱落成为休止孢。依“1.5.2.4”节中方法加入壳寡糖(终浓度分别为10、30、50、100 mg/L),置于25 ℃孵育。1~2 h 后,在BX53显微镜下观察游动孢子的萌发情况,利用软件CellSens Dimension测量芽管的长度。
1.6 壳寡糖喷施试验
1.6.1 喷施处理
配制10、30、50、100、1 000 mg/L的壳寡糖溶液,并在溶液中加入5‰的吐温-20。利用喷壶对培养4~6周的本氏烟进行整株喷雾处理(每株喷施5 mL壳寡糖溶液),对照植株喷施等量无菌水。24 h后再次喷雾处理1次。
1.6.2 本氏烟接种
按照前法,获得辣椒疫霉的游动孢子悬浮液,整个过程均不加壳寡糖;涡旋振荡获得休止孢,利用血球计数板计数孢子数量,计算出游动孢子的浓度(1×105孢子/mL)。
将游动孢子悬浮液接种在壳寡糖处理24 h后的离体本氏烟叶片,主叶脉两侧分别接种20 μL,叶片置于25 ℃孵育。接种后36~72 h持续观察本氏烟的病斑扩展情况,在B-100AP手持式紫外灯(美国UVP公司)下拍照,并用台盼蓝对叶片进行染色。试验共6个处理,每个处理设12组重复,试验重复3次。
1.6.3 台盼蓝染色
称取0.015 g台盼蓝置于烧杯中,依次加入10 mL乳酸、10 mL苯酚、10 mL甘油、10 mL无菌水、40 mL乙醇,将烧杯放入沸水中孵育10~15 min使台盼蓝充分溶解,制备染色液。室温静置6~8 h后,把本氏烟叶片放入染色液中染色6~8 h。用2.5 g/mL三氯乙醛水合物脱色叶片 2~3次,然后进行观察并拍照。
2 结果与分析
2.1 壳寡糖抑制辣椒疫霉和其他卵菌的营养生长
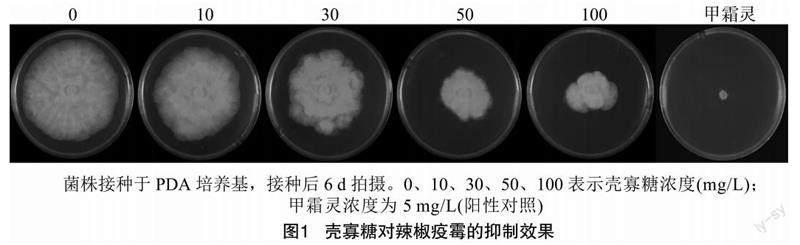
为测定壳寡糖对辣椒疫霉菌丝生长的影响,将后者接种到含10、30、50、100 mg/L壳寡糖浓度梯度的PDA平板上,计算壳寡糖对菌落生长的抑制率。结果(图1、表2)表明,壳寡糖对辣椒疫霉菌丝生长有直接抑制作用,并且抑菌活性与其浓度呈正相关。当壳寡糖浓度为10 mg/L时,辣椒疫霉的菌落直径与对照相比差异并不明显,菌落生长抑制率仅为4.99%;当壳寡糖浓度达到30 mg/L时菌落直径明显小于对照,菌落生长抑制率上升了2.5倍;浓度升高壳寡糖的抑制作用进一步加强,当浓度为 100 mg/L 时抑制率达到了52.50%。在测试浓度范围内,壳寡糖的抑制作用弱于甲霜灵。
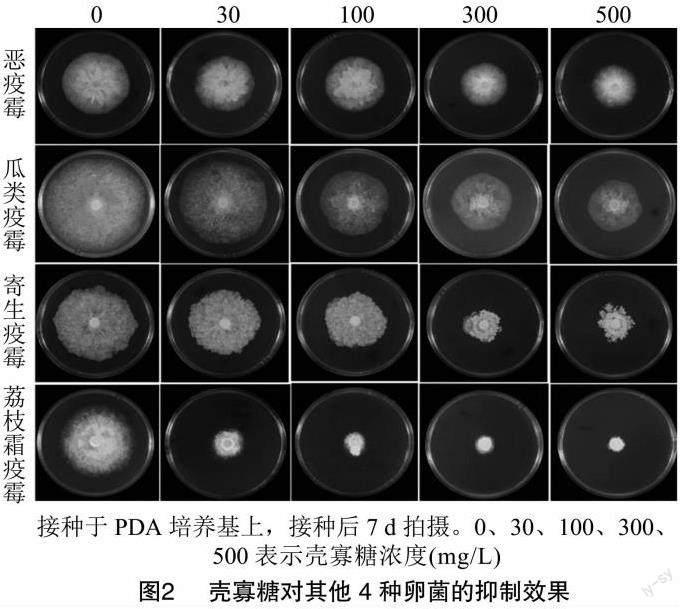
鉴于壳寡糖对辣椒疫霉生长的抑制作用,本研究同时将恶疫霉、瓜类疫霉、寄生疫霉和荔枝霜疫霉接种到含壳寡糖(浓度梯度为30、100、300、500 mg/L)的PDA平板上,并计算它对菌落生长的抑制率。结果(图2、表2)表明,荔枝霜疫霉對壳寡糖的敏感性最高,壳寡糖浓度为100 mg/L时抑制率达到了63.79%;壳寡糖对恶疫霉、瓜类疫霉、寄生疫霉也有较好的抑菌活性,在接种后7 d时 500 mg/L 的抑制率分别达到29.33%、34.29%、52.85%。上述结果说明,壳寡糖能够抑制疫霉菌和荔枝霜疫霉的生长,但抑菌效果在种间存在差异。
2.2 壳寡糖影响辣椒疫霉的生长发育
2.2.1 影响菌丝的形态
为分析壳寡糖对辣椒疫霉菌丝生长的影响,将其添加到菌丝培养液中,结果表明壳寡糖处理后导致辣椒疫霉菌丝形态发生了明显的变化:对照菌丝正常舒展,形态规则;壳寡糖处理过的菌丝分枝变多,形态出现扭曲、膨胀等畸变 类似甲霜灵处理过的菌丝形态。10、30 mg/的壳寡糖处理时菌丝形态变化不明显,当壳寡糖浓度为50 mg/L时菌丝形态变化明显,浓度高达 100 mg/L 时则加剧了菌丝畸变(图3)。
2.2.2 影响游动孢子囊的形成
本研究发现,不同浓度的壳寡糖处理会影响辣椒疫霉游动孢子囊的形成。由图4可知,在较低浓度的壳寡糖(10、30 mg/L)处理时,辣椒疫霉游动孢子囊的数量与对照相比,出现明显减少;当壳寡糖浓度为50 mg/L时,游动孢子囊数量显著下降;壳寡糖浓度到达 100 mg/L 时,菌丝上只形成很少的游动孢子囊,壳寡糖几乎完全抑制了游动孢子囊的产生。统计分析不同壳寡糖浓度下游动孢子囊的数量,结果表明处理间存在显著差异(图5)。
2.2.3 影响游动孢子的释放
本研究发现,壳寡糖处理能抑制辣椒疫霉游动孢子的释放。由图6、图7-A 可知,在空白对照中,80%左右的游动孢子囊已经放空,当壳寡糖添加后,游动孢子囊的释放逐渐受到影响。当壳寡糖的浓度为10 mg/L时,游动孢子囊的释放率与空白对照相比差异不显著;当壳寡糖浓度升高到 50 mg/L 时,游动孢子的释放受到明显的抑制;浓度为100 mg/L时游动孢子囊的释放抑制率达到了90%。测定游动孢子的浓度,统计分析结果(图7-B)也进一步佐证了这个结论。
2.2.4 影响游动孢子的游动
本研究发现,10、30、50、100 mg/L壳寡糖对辣椒疫霉游动孢子的游动均有强烈的抑制作用。在显微镜下观察,发现无壳寡糖时,游动孢子的游动行为正常;当添加了壳寡糖后大多数游动孢子迅速休止,在低浓度(10 mg/L)时就有明显的休止现象(相关录像可与通讯作者联系索取)。
2.2.5 影响游动孢子的萌发
本研究发现,壳寡糖可抑制辣椒疫霉游动孢子的萌发并可导致孢子破裂(图8)。在显微镜下观察 发现在不含壳寡糖的对照中,大部分孢子正常萌发;在壳寡糖处理后,约30%的孢子没有萌发,35%的孢子萌发但芽管整体短于对照,还有35%的孢子发生了裂解并释放出内含物,并且随着时间的延长,裂解的孢子数量不断增加;随着壳寡糖浓度的增加,孢子裂解情况逐渐加重,当壳寡糖浓度为100 mg/L时,孢子全部裂解。
2.3 壳寡糖保护本氏烟免遭辣椒疫霉的侵染
鉴于壳寡糖对辣椒疫霉具有直接的抑制作用,本研究分析壳寡糖是否可以用于植物疫病的防控。用不同浓度的壳寡糖喷施本氏烟植株,再接种辣椒疫霉游动孢子悬浮液。结果(图9)表明,经 1 000 mg/L 壳寡糖喷施处理过的本氏烟叶片上产生的病斑面积明显小于对照叶片,显示壳寡糖可以保护本氏烟免遭辣椒疫霉的侵染。但用10、30、50、100 mg/L浓度的壳寡糖处理本氏烟,发现叶片病斑面积与对照无显著差异,这表明壳寡糖对本氏烟的保护效果可能依赖于逐渐增高的浓度。
3 讨论
壳寡糖具有无毒害、不污染环境,兼有药效和肥效的双重生物调节功能特点,备受研究者关注,也在农业生产上得到了一定的应用[14]。研究表明,壳寡糖具有直接抑菌和诱导植物抗病性的双重作用[6,15]。然而,壳寡糖抑菌抗病的机制尚不十分清楚,尤其是对作物病原卵菌的抑制效果和机制尚不明确。
本研究利用不同浓度的壳寡糖处理5种常见卵菌,结果表明壳寡糖能直接抑制辣椒疫霉、恶疫霉、瓜类疫霉、寄生疫霉和荔枝霜疫霉的菌丝生长。为进一步探究壳寡糖对卵菌的抑菌机制,以辣椒疫霉为例,本研究探讨了壳寡糖对其不同生长发育阶段的影响。结果表明,壳寡糖对辣椒疫霉的菌丝形态,游动孢子囊的形成与释放,游动孢子的游动和萌发均有显著的影响和抑制作用;当壳寡糖浓度为 50 mg/L 时,抑制效果就较为显著,并且抑制作用与其浓度呈正相关;而且,壳寡糖还可以保护植物免遭辣椒疫霉的侵染。类似地,雷菲等发现,叶面喷施壳寡糖可防控樱桃番茄晚疫病的发生[16]。结果表明,壳寡糖对作物疫病的防控方式之一是通过直接抑制病原菌的生长发育发挥作用。
本研究发现,喷施低于1 000 mg/L的壳寡糖未能有效保护本氏烟免遭辣椒疫霉的侵染。这说明壳寡糖发挥抑菌作用需要高浓度,也可能是低浓度壳寡糖未能有效诱导植物产生抗病性。实际上壳寡糖在应用中还存在较多的局限性,比如提纯成本高、诱抗效果不稳定以及诱导抗性具有迟滞性、抗病强度有限,针对不同植物、不同病原菌的最佳处理浓度、抗性持续时间也可能不一样等[17]。此外,多个因素也影响着壳寡糖的防治效果,包括壳寡糖的纯度、分子量、脱乙酰度等[8]。
壳寡糖具有来源广、抗病谱广、对环境无污染等优点,在作物病害防控方面具有广阔的应用前景[4,14,17]。如果能够解决实践中存在的上述问题,将有助于壳寡糖用于作物卵菌病害的绿色防控。
参考文献:
[1]Beakes G W,Glockling S L,Sekimoto S. The evolutionary phylogeny of the oomycete “fungi”[J]. Protoplasma,2012,249(1):3-19.
[2]Erwin D C,Ribeiro O K. Phytophthora diseases worldwide[M]. St. Paul:the American Phytopathological Society,1996.
[3]Lamour K H,Stam R,Jupe J,et al. The oomycete broad-host-range pathogen Phytophthora capsici[J]. Molecular Plant Pathology,2012,13(4):329-337.
[4]Kim S K,Rajapakse N. Enzymatic production and biological activities of chitosan oligosaccharides (COS):a review[J]. Carbohydrate Polymers,2005,62(4):357-368.
[5]余勁聪,何舒雅,林克明. 海洋寡糖诱导植物抗逆性的研究进展[J]. 中国农业科技导报,2016,18(4):44-51.
[6]刘幸海,李正名,王宝雷. 具有农业生物活性壳寡糖的研究进展[J]. 农药学学报,2006,8(1):1-7.
[7]Kendra D F,Hadwiger L A. Characterization of the smallest chitosan oligomer that is maximally antifungal to Fusarium solani and elicits pisatin formation in Pisum sativum[J]. Experimental Mycology,1984,8(3):276-281.
[8]徐俊光. 壳寡糖对植物病原真菌的抑菌活性及其机理的初步研究[J]. 大连:中国科学院研究生院(大连化学物理研究所),2007.
[9]尹 恒,贾晓晨,王文霞. 寡糖免疫诱导剂制备及其作用机制研究[C]//陈万权. 绿色生态可持续发展与植物保护-中国植物保护学会第十二次全国会员代表大会暨学术年会论文集. 长沙:中国植物保护学会,2017:254.
[10]赵小明. 壳寡糖诱导植物抗病性及其诱抗机理的初步研究[D]. 大连:中国科学院研究生院(大连化学物理研究所),2006.
[11]丁振中,雷 鹏,张 超,等. 低温胁迫下壳寡糖对油菜苗生长的影响[J]. 乡村科技,2020,11(31):80-82.
[12]陈维维. 四种植物免疫剂诱导烟草抗病虫害效应的研究[D]. 合肥:安徽农业大学,2019.
[13]陈芊如,丁蓬勃,胡希好,等. 外源壳寡糖对低温胁迫条件下烟草幼苗的保护作用[J]. 江苏农业科学,2022,50(1):80-85.[HJ2mm]
[14]Verlee A,Mincke C V,Stevens C. Recent developments in antibacterial and antifungal chitosan and its derivatives[J]. Carbohydrate Polymers,2017,164:268-283.
[15]Hadwiger L A,Ogawa T,Kuyama H. Chitosan polymer sizes effective in inducing phytoalexin accumulation and fungal suppression are verified with synthesized oligomers[J]. Molecular Plant-Microbe Interactions,1994,7(4):531-533.
[16]雷 菲,张冬明,谭 皓,等. 叶面喷施壳寡糖对樱桃番茄产质量及晚疫病防控效果的影响[J]. 贵州农业科学,2019,47(9):74-77.
[17]邱 驰,李宝聚,石延霞,等. 寡糖类物质诱导黄瓜对霜霉病的抗性[J]. 中国生物防治,2005,21(1):57-59.
