转HaNAC基因棉花的分子鉴定及遗传稳定性分析
2023-09-11冯翠珍郭亚萍郑巨云郑凯陈全家陈琴曲延英
冯翠珍 郭亚萍 郑巨云 郑凯 陈全家 陈琴 曲延英


摘要:棉花是世界上重要的经济作物之一。为创制和改良棉花抗旱新品种提供种质资源及遗传育种研究提供理论依据,通过染色体步移技术明确外源基因在棉花染色体上的插入位点、序列及染色体信息,研究了转梭梭HaNAC基因的棉花材料对干旱胁迫的响应能力,确定了HaNAC基因的物理位置,鉴定了其遗传稳定性。研究结果如下:(1)本研究对转HaNAC38转录因子基因棉花材料进行了分子鉴定,通过PCR扩增、电泳检测及测序证实了转基因植株中分别存在标记基因和目的基因序列。应用半定量PCR,证明了HaNAC38基因在棉花受干旱胁迫后表达量上调。这些结果说明转HaNAC38基因T6代棉花植株的遗传稳定性。(2)通过标记基因的初步筛选获得阳性植株后,对转基因棉花进行外源基因的检测鉴定,利用获得的序列设计染色体步移引物,通过巢式PCR方法获得转HaNAC38基因棉花的 T-DNA 序列在基因组中的插入位置,结果定位到棉花基因组A11染色体第26 202 323 bp处。根据已知的棉花基因组信息,通过鉴定,共筛选转HaNAC38基因的棉花材料5个株系,为创制和改良棉花抗旱新品种提供了亲本材料。
关键词:棉花;转基因;HaNAC38基因;染色体步移;分子鉴定
中图分类号:S562.032 文献标志码:A
文章编号:1002-1302(2023)15-0029-06
基金项目:新疆维吾尔自治区重大科技专项(编号:2021A02001-4)。
作者简介:冯翠珍(1996—),女,山东菏泽人,硕士,研究方向为作物分子遗传育种。E-mail:1953857188@qq.com。
通信作者:曲延英,博士,教授,博士生导师,研究方向为棉花遗传育种及改良,E-mail:xjyyq5322@126.com;陈 琴,博士,副教授,硕士生导师,研究方向为棉花抗逆分子育种,E-mail:cqq0777@163.com。
近年来,随着干旱土地面积的扩大与气候影响,作物由于干旱的影响而产生不同程度的减产和品质的下降[1]。基因工程和植物转化通过在作物中导入有益的外源基因或沉默内源基因的表达,在作物改良中发挥了关键作用。由于性状的复杂性,与除草剂、昆虫和抗病等性状相比,具有非生物抗逆性的作物较少被商业化。为了推进转基因棉花的商业化进程,丰富抗旱性种质资源,开展抗旱性研究对于我国棉花产业发展具有重要的社会效益、生态环境作用及巨大的经济效益[2]。
NAC(NAM,ATAF,CUC1)转录因子家族是较大的转录因子家族之一,在植物中广泛存在。它可以调控目标基因的转录过程,识别和结合启动子中的相关核苷酸序列,在植物生长发育、胁迫和信号转导中发挥着作用[3]。从梭梭中克隆出NAC转录因子基因并进行一定功能分析具有重要意义。HaNAC38转录因子基因含有NAC家族的A、B、C、D、E保守结构域,读码框长879 bp,编码292个氨基酸[3],研究发现其在干旱胁迫条件下表达量较高,发挥重要的调控作用。
酵母单杂交技术证明了GhNAC79基因参与干旱调控通路并发挥正调控作用[4];研究表明,HaNAC2、HaNAC3基因提高了烟草对模拟干旱、高温胁迫的抵抗能力[5];有试验证实了HaNAC3转录因子基因可以提高植物在干旱条件下的生存能力[6];有试验结果表明,HaNAC3基因主要通过改变烟草根部代谢来抵御干旱胁迫[7];有研究通过启动子克隆和分析指出HaNAC38含有20个TATA-box启动子元件[8],且具有高转录水平的顺式元件 5′UTR Py-rich stretch,通过转录组测序分析,HaNAC38基因的表达量显著高于梭梭的其他NAC基因。因此认为HaNAC38受到干旱胁迫诱导表达,响应梭梭应答干旱胁迫的过程。
研究指出,外源基因在转基因后代中整合到受体植物基因组中并稳定表达是稳定遗传的主要標准[8],以及持续表现出其目标性状。转基因植物在后续生产中具有实用价值的关键是目标性状在后代中稳定地遗传和表达。明确转基因棉花的遗传稳定性和抗旱性可为抗旱种质资源的进一步应用提供依据[9]。本研究通过染色体步移对转基因棉花材料转HaNAC38基因插入序列位置鉴定及检测方法进行初步探究,为研究外源基因整合到染色体位置对表型的影响提供理论基础,以期为抗逆转基因棉花的更好发展提供材料来源。
1 材料与方法
1.1 试验材料
转基因棉花材料为笔者所在课题组前期获得的转梭梭HaNAC38基因的T6代株系与受体材料D5,其他转基因对照品种转NHX基因等材料均由笔者所在试验室保存。供试材料于2021年春季正常播种于新疆塔城地区沙湾市144团新疆农业大学棉花育种基地转基因区。采用人工点播模式进行播种,1膜3行,株距为10 cm。
植物组织RNA快速提取试剂盒与DH5α大肠感受态购自天根生化科技(北京)有限公司,染色体步移试剂盒购自宝生物工程(大连)有限公司。引物的合成由北京博迈德基因技术有限公司完成,测序由生工生物工程(上海)股份有限公司完成,其他试剂购自国内外各厂家均为国产或进口分析纯。
1.2 试验方法与步骤
1.2.1 植株基因组DNA的提取
在棉花3叶期从转HaNAC38株系中随机选6株,挂牌标记,取幼叶分别放入2 mL离心管中,装入硅胶使其干燥,以十六烷基三甲基溴化铵(CTAB)改良法提取叶片基因组DNA。从棉花叶片中获得的基因组 DNA 进一步纯化后用于交错式热不对称(TAIL)-PCR[10],利用超微量分光光度计法检测DNA质量和浓度,将DNA稀释成50~100 ng/μL备用。
1.2.2 转基因棉花植株标记基因的PCR检测
以改造后的pCAMBIA1304载体上的标记基因NPTII序列为基础设计引物,进行标记基因PCR检测[11],PCR反应体系为:含模板DNA 1 μL、上下游引物各1 μL、普通mix 12.5 μL、最后用灭菌双蒸水补足 25 μL。PCR反应条件为:94 ℃预变性5 min;90 ℃ 30 s,60 ℃ 30 s,72 ℃ 40 s为1个循环,进行35个循环;72 ℃延伸10 min;最后4 ℃保温。将显示阳性条带的植株进行下一步目的基因的PCR检测。
1.2.3 转基因棉花目的基因的PCR检测
以目的基因设计特异性引物,将标记基因显示阳性条带的植株,进行目的基因PCR检测,将PCR产物进行琼脂糖凝胶电泳,将显示阳性条带的植株用染色体步移技术进行T-DNA插入位置鉴定。
1.2.4 染色体步移(巢式PCR)扩增检测
特异性引物设计见图1(以获取 5′序列为例)。
根据已知序列区域设计特异性引物(引物序列见表1),本研究经过多轮筛选得出染色体步移试剂盒内随机引物AP3的扩增效果较好。
本试验使用染色体步移试剂盒中的AP3作为兼并引物,以外源基因为已知片段设计引物,命名为SP1、SP2、SP3,巢式反应体系见表2,PCR扩增过程见表3。
1.2.5 PCR产物的克隆与测序
利用琼脂糖凝胶回收试剂盒回收PCR产物,将回收的PCR产物用过线性化载体试剂盒(pEASY-T5 Zero Cloning Kit)进行连接和转化并涂抹于含卡那霉素的LB固体培养基上,37 ℃过夜培养。挑取菌落进行PCR检测,阳性菌落送生工生物工程(上海)股份有限公司测序,将测序结果与参考序列比对,根据测序结果设计特异性引物,对试验结果进行验证。
1.2.6 植物组织总RNA的提取
当棉花幼苗处于3叶期时进行干旱处理,用电子秤测定土样和幼苗总质量,确定样品含水量,使其自然干旱。鲜质量含水量=(mf-md)/mf×100%。其中,mf代表鲜质量,g;md代表干质量,g。当含水量每下降20%时取样,分别取含水量为80%、60%、40%、20%的新鲜叶片组织并做好标记。用锡箔纸包裹放于液氮罐中,在液氮中取出样品,通过试剂盒进行RNA提取。
1.2.7 反转录cDNA
通过琼脂糖凝胶电泳确认提取的植物基因组RNA的完整性,同时利用超微量分光光度计法测定其质量和浓度。按照测定的RNA浓度,选择合适的量做反转录试验。反转录体系见表4。
1.2.8 半定量PCR
半定量PCR是介于定量和定性之间的一种判定基因是否差异表达的方式。在控制其他变量相同的情况下,比较电泳条带亮度,对基因表达量的情况进行判断。半定量PCR反应体系为:含模板DNA 1 μL、半定量引物1 μL、普通mix 12.5 μL、最后用ddH2O补足至25 μL。反应程序为:94 ℃预变性5 min;90 ℃ 30 s,60 ℃ 30 s,72 ℃ 40 s,25个循环;72 ℃延伸 10 min;最后放 4 ℃ 冰箱保存。
2 结果与分析
2.1 转基因植株标记基因PCR检测结果
试验从种植的转HaNAC38基因的T6代1个株系中随机抽检6株材料,提取材料嫩叶基因组DNA,用标记基因NPT[QX(Y15]Ⅱ[QX)]的引物对其进行PCR扩增,扩增结果显示阳性对照和转基因株系均扩增出795 bp片段,转基因植株阴性对照无条带(图2)。PCR产物测序结果见图3,除序列两端外,其他序列均与NPT[QX(Y15]Ⅱ[QX)]序列比对结果完全相同。通过电泳及测序结果可以看出,所选取的6株转基因单株均为阳性植株。
2.2 转基因植株目的基因PCR检测结果
用目的基因引物对其进行PCR扩增,电泳结果(图4)显示转基因植株能扩增出目标条带,转基因阴性植株无条带。PCR产物的测序结果与目的基因HaNAC38的部分序列相似性为100%(图5)。通过电泳和测序结果验证了外源基因仍存在于转基因植株。
2.3 染色體步移(巢式PCR)扩增检测
通过目的基因HaNAC38序列设计染色体步移特异性引物,通过巢式PCR扩增T-DNA与基因组DNA连接的片段以确定外源DNA插入的边界[12-13]。取上述各步PCR反应液8 μL进行1%琼脂糖凝胶电泳,结果(图6)显示,所取转HaNAC38基因植株在3轮PCR反应中均扩增出条带。将第3轮PCR扩增出的条带回收并测序,结果如图7所示。对载体序列以及测序结果进一步比对发现, 上区段的序列与棉花基因组序列具有100%的同源性。NCBI比对序列定位到棉花基因组A11染色体上第 26 202 323 bp 处(图8)。
根据测序结果设计特异性引物,对试验结果进行验证。
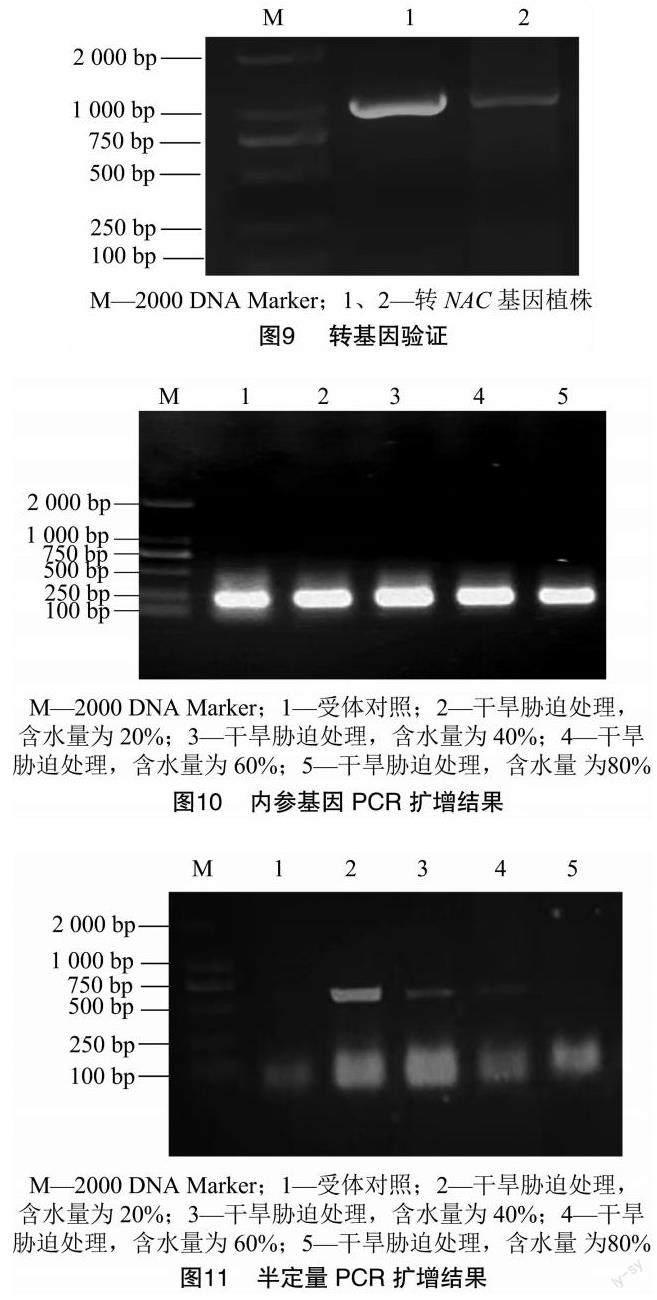
测序结果表明外源基因HaNAC38整合在棉花基因组中, 其与载体都位于棉花A11染色体上,确定了其精确插入位点,但其插入位点的侧翼序列的功能研究还没有相关的解释[14-17]。验证扩增结果(图9)显示,转基因阳性植株扩增出了条带。经验证,预期结果正确。
2.4 半定量PCR检测结果
提取转HaNAC38基因材料T6代植株总RNA,反转录为cDNA,做半定量PCR检测试验,其中内参基因为棉花内源基因UBQ7。由图10可以看出,内参基因的扩增条带在不同旱胁迫处理中亮度基本一致。由图11可以看出,由于旱胁迫处理含水量的不同,目的基因的条带亮度明暗强弱有所变化。由半定量PCR扩增结果可以看出,随着干旱胁迫处理时间的延长,含水量越低,条带越亮,目的基因的表达量增强,由此初步判断目的基因在抗旱表达中发挥了作用[18-19]。
3 讨论与结论
染色体步移过程中,由于简并引物具有随机性,为达试验目的,本试验设计多对简并引物才扩增到阳性结果。这也是前人对于染色体步移扩增特点的印证[20]。半定量PCR不但可以比较不同基因表达量的高低,也可以比较相同基因在不同材料中表达量的高低。本试验要验证HaNAC38基因是否受到干旱胁迫的影响,控制其他变量相同,改变模板(经过干旱胁迫处理材料的cDNA),看HaNAC38基因表达是否有变化,即相同基因在不同模板下的半定量PCR。
研究表明,外源基因在转基因后代植株中大多数能稳定遗传,但也有一些外源基因遗传是不规则的,可能是由外源基因拷贝数不同和整合方式所引起的,甚至会导致基因沉默或基因丢失等[21]。通过试验结果可以推断,外源基因与棉花基因组的整合遵循一定的整合模式,有选择地切割或插入某些序列,但这些序列是随机插入的。这与前人的研究结论[22]相一致。本研究证明染色体步移技术可以作为转基因棉花插入位置检测有效方法。
前人的研究证明梭梭HaNAC38基因在抗旱中发挥着重要作用[23],但关于转HaNAC38基因后代植株的遗传稳定性却鲜有研究。为验证转基因植株的遗传稳定性,对转基因高代植株中外源基因的遗传、表达稳定性进行分析,本研究对转HaNAC38基因棉花材料进行了分子鉴定,通过PCR扩增、电泳检测及测序证实了T6代转基因植株中存在标记基因PCR、目的基因PCR。又通过染色体步移检测T-DNA插入到转基因植株染色体的具体位置。同时应用半定量PCR[24-28],证明了HaNAC38基因在棉花受干旱胁迫后表达量上调。这些结果说明了转HaNAC38基因T6代棉花的遗传稳定性。[JP+1]以上研究结果为转基因材料进一步应用提供了理论依据,转HaNAC38基因棉花丰富了抗旱棉花的种质资源,为转基因抗旱棉花新品种的培育奠定了基础[29]。
参考文献:
[1]刘 超,朱彦卓,代文俊,等. 转基因棉花抗逆性研究进展[J]. 湖南农业科学,2014(15):32-35.
[2]刘晨曦,吴孔明. 转基因棉花的研发现状与发展策略[J]. 植物保护,2011,37(6):11-17,26.
[3]劉 豪,张振清,陶 顺,等. 梭梭NAC转录因子HaNAC38、HaNAC42克隆及表达分析[J]. 基因组学与应用生物学,2018,37(5):2013-2020.
[4]郭亚宁. NAC转录因子在陆地棉叶片衰老中的作用[D]. 杨凌:西北农林科技大学,2017:1-19.
[5]刘 豪. 与抗逆相关的梭梭NAC转录因子表达模式和功能分析[D]. 乌鲁木齐:新疆农业大学,2017:1-26.
[6]韩聚东. 梭梭NAC转录因子家族基因的克隆和HaNAC3基因的功能分析[D]. 乌鲁木齐:新疆农业大学,2016:1-20.
[7]伍 霞. 梭梭HaNAC2/3/42基因抗逆分子机制研究[D]. 乌鲁木齐:新疆农业大学,2021:1-29.
[8]韩庆梅,孙 石,侯文胜,等. 高蛋氨酸转基因大豆的鉴定和遗传稳定性分析[J]. 中国油料作物学报,2015,37(6):789-796.
[9]申贤坤. 几个转基因抗旱棉花材料的分子鉴定和遗传稳定性分析[D]. 武汉:华中农业大学,2020.
[10]王春连,陈乐天,曾超珍,等. 利用基因组文库加速Xa23基因定位的染色体步移[J]. 中国水稻科学,2006,20(4):355-360.
[11]陈志贤,范云六,李淑君,等. 利用农杆菌介导法转移tfdA基因获得可遗传的抗2,4-D棉株[J]. 中国农业科学,1994,27(2):31-37.
[12]张丽雯,张永娟,陈 恒. 转基因棉花研发及商业化发展态势[J]. 生物产业技术,2016(5):52-61.
[13]刘传亮,田瑞平,孔德培,等. 棉花规模化转基因技术体系构建及其应用[J]. 中国农业科学,2014,47(21):4183-4197.
[14]曹燕燕,廖平安,葛昌斌,等. 转rolB基因棉花抗旱性研究[J]. 湖南农业科学,2012(15):1-2,5.
[15]吕素莲. 转betA和TsVP基因提高棉花耐盐、抗旱性的研究[D].济南:山东大学,2007.
[16]王晓东. 转基因小麦抗旱性生理生化及农艺性状鉴定[D]. 杨凌:西北农林科技大学,2016:7-48.
[17]闫建俊,白云凤,左静静,等. 转基因马铃薯外源基因插入位点分析及检测方法的建立[J]. 分子植物育种,2020,18(16):5361-5366.
[18]游 朝,晁朝霞,姚正培,等. 转MvNHX1和MvP5CS基因棉花耐盐抗旱性比较与育种价值分析[J]. 棉花学报,2015,27(3):198-207.
[19]易小平,谭燕华,彭存智,等. 转基因作物安全评价的检测技术[J]. 热带生物学报,2015,6(1):98-104.
[20]康 丹,方小艳,游腾飞,等. 染色体步移技术克隆已知序列侧翼启动子的研究进展[J]. 农业生物技术学报,2013,21(3):355-366.
[21]赵才美,黄兴奇,殷富有,等. 水稻NAC转录因子家族的研究进展[J]. 植物科学学报,2020,38(2):278-287.
[22]段晓亮,许兰杰,刘志勇,等. 转基因小麦外源基因插入位点初步分析及检测方法的建立[J]. 粮油食品科技,2014,22(4):76-81.
[23]姜子焱.梭梭HaNAC38、HaNAC42启动子克隆和转录因子特性分析[D]. 乌鲁木齐:新疆农业大学,2018:3-37.
[24]涂松林,施爱民. 我国转基因棉花研究与应用进展[J]. 江西棉花,2001,23(1):9-13.
[25]陈秀兰,张玉忠,张 军. 棉花分子育种研究进展[J]. 棉花学报,1997,9(1):5-8.
[26]王瑞芳,胡银松,高文蕊,等. 植物NAC转录因子家族在抗逆响应中的功能[J]. 植物生理学报,2014,50(10):1494-1500.
[27]王志霞.转基因棉花研究进展[J]. 江苏农业学报,2003,19(2):74.
[28]林 清,彭于发,吴 红,等. 转基因作物及产品检测技术研究进展[J]. 西南农业学报,2009,22(2):513-517.
[29]王淑君,曲延英,倪志勇,等. 转CarNAC1基因可提高棉花的抗旱性[J]. 干旱地区农业研究,2018,36(4):272-281.
