蝴蝶兰建兰花叶病毒和齿兰环斑病毒的实时荧光定量PCR检测
2023-09-11宋起萱浦艳飞余蓉培瞿素萍杨春梅吴丽芳汪国鲜阮继伟
宋起萱 浦艳飞 余蓉培 瞿素萍 杨春梅 吴丽芳 汪国鲜 阮继伟
摘要:建兰花叶病毒(Cymbidium mosaic virus,简称CymMV)和齿兰环斑病毒(Odontoglossum ringspot virus,简称ORSV)是蝴蝶兰生产中的主要病毒病害,建立稳定、灵敏的检测体系是进行病毒早期检测和脱毒技术研究的前提。本研究首先对CymMV和ORSV 的外壳蛋白(coat protein,简称CP)基因片段进行克隆和序列比对,随后设计特异性引物,分别构建2种病毒的RT-qPCR(real time quantitative PCR,简称RT-qPC)检测体系,并对云南地区20份样品进行检测。研究结果显示,CymMV和ORSV CP基因序列与其他地区分离物中这2种病毒的核苷酸序列相似性分别为97.92%~98.66%和99.12%~99.56%,其CP基因序列具有保守性。CymMV和ORSV在RT-qPCR体系中最低检出浓度分别为30.9、35.0 copies/μL,灵敏度较RT-PCR(reverse transcription polymerase chain reaction,简称 RT-PCR)提高10倍。利用RT-qPCR体系对20份温室样品进行检测,CymMV阳性率为100%,ORSV阳性率为90%,阳性率均高于RT-PCR检测结果。本研究构建的CymMV和ORSV RT-qPCR检测体系将为蝴蝶兰病毒病早期监测和脱毒种苗的培育奠定基础。
关键词:蝴蝶兰;建兰花叶病毒;齿兰环斑病毒;实时荧光定量PCR;病毒检测
中图分类号:S436.8+1 文献标志码:A
文章编号:1002-1302(2023)15-0021-08
基金项目:云南省重大科技专项计划(编号:202102AE090052);云南大学专业学位研究生实践创新基金(编号:ZC-22222419)。
作者简介:宋起萱(1999—),女,四川攀枝花人,硕士研究生,研究方向为观赏植物研究。E-mail:songqixuan0218@126.com。
通信作者:余蓉培,博士,副研究员,研究方向为观赏植物研究,E-mail:yrongpei@126.com;瞿素萍,硕士,研究员,研究方向为花卉组培繁育,E-mail:qsp@yaas.org.cn。
蝴蝶兰(Phalaenopsis spp.)是一种原产于热带亚热带地区的附生兰科植物,形态高雅、花期较长,是世界重要的花卉种类之一[1-2]。商品销售的蝴蝶兰多采用组织培养方法繁殖,长期无性繁殖使得病毒积累严重。目前,能够感染兰花的病毒有50多种,其中,建兰花叶病毒(Cymbidium mosaic virus,简称CymMV)和齿兰环斑病毒(Odontoglossum ringspot virus,简称ORSV)是兰花中感染较为严重和普遍的2种病毒[3-4]。蝴蝶兰植株感染CymMV和ORSV后,叶片分别会出现黄色环斑和条纹花斑,花朵出现褪色,使观赏价值极大降低,造成巨大经济损失,严重制约了我国蝴蝶兰产业的发展[5]。因此,亟待建立快速准确的CymMV和ORSV检测体系,为蝴蝶兰带病毒植株的早期鉴定以及种苗脫毒体系的构建提供可靠的技术保障。
CymMV和ORSV是正义单链RNA病毒[(+)ssRNA][3]。CymMV隶属于线形病毒科(Flexiviridae)马铃薯X病毒属(Potexvirus),病毒粒体由外壳蛋白和正义单链RNA基因组组成,基因组全长6.3 kb,包含5个开放阅读框(ORF),ORF5编码24 ku外壳蛋白[6-8]。ORSV隶属于烟草花叶病毒属(Tobamovirus),直杆状颗粒,病毒粒体分散在细胞质内呈晶格排列,基因组全长6 618 bp,具有5个ORF,ORF5编码18 ku外壳蛋白[3,9-10]。
目前,CymMV和ORSV的检测方法主要有电镜法、血清学方法和分子生物学方法[11-12]。其中,分子生物学方法是从核酸水平来检测病毒,可以进行大批量的样品检测,具有灵敏度高、特异性强、检测速度快、操作简便等优点[11]。实时荧光定量PCR(real time quantitative polymerase chain reaction,简称RT-qPCR)是分子生物学检测法中一种高效、稳定、准确的检测技术,它是在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程,最终通过标准曲线可对未知模板进行准确定量分析[13]。灵敏度是RT-PCR(reverse transcription polymerase chain reaction,简称RT-PCR)的10~1 000 倍[14-17]。该技术在蔬菜、花卉、果树等园艺植物病毒检测中有广泛应用[18-21]。但目前对于蝴蝶兰CymMV和ORSV的RT-qPCR检测方法尚缺乏深入报道。
本研究分别对CymMV和ORSV外壳蛋白(coat protein,简称CP)编码基因设计特异性引物,克隆CP基因片段序列,构建CymMV和ORSV质粒标准品,进而分别建立CymMV和ORSV的RT-qPCR检测体系,并应用于云南温室栽培蝴蝶兰的CymMV和ORSV检测。该体系将为蝴蝶兰规模化生产中CymMV和ORSV准确高效检测提供技术支撑。
1 材料与方法
1.1 植物材料
使用云南省农业科学研究院花卉研究所九溪基地保存的CymMV和ORSV感病植株作为植物材料,于2022年3月在云南省花卉育种重点实验室进行CymMV和ORSV的外壳蛋白基因片段克隆。用于检测的温室植株亦种植于云南省农业科学院花卉研究所九溪基地。
1.2 总RNA提取与反转录
使用艾德莱生物的多糖多酚复杂植物RNA快速提取试剂盒进行蝴蝶兰叶片总RNA提取。用ND2000-超微量紫外可见光分光光度计测定RNA浓度、D260 nm/280 nm,用1%琼脂糖凝胶电泳检测所提RNA的完整性。
使用PrimeScript IV 1st strand cDNA Synthesis Mix试剂盒(TaKaRa)对RNA进行反转录,在RNase Free管中加入2 μL模板RNA、2 μL Primescript IV cDNA synthesis Mix、6 μL ddH2O配制混合液。混合液在42 ℃孵育20 min后,70 ℃孵育15 min,得到cDNA溶液保存于-20 ℃冰箱中,可用于PCR和RT-qPCR。
1.3 CymMV和ORSV的CP基因片段克隆与序列分析
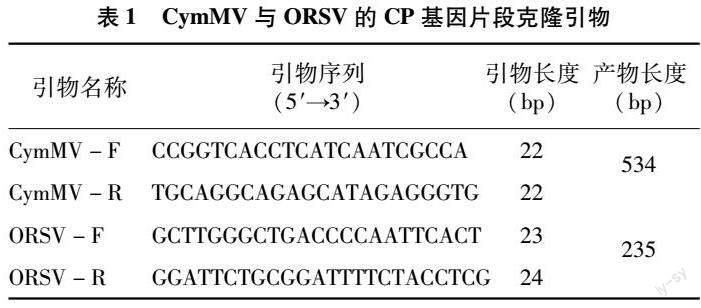
在NCBI上查找CymMV和ORSV的CP基因序列,使用NCBI的Primer-BLAST设计引物(表1),并由北京擎科生物科技有限公司进行引物合成。以感染CymMV和ORSV植株的cDNA为模板,使用诺唯赞Green Taq Mix试剂盒和表1中的引物对CP基因片段克隆。反应体系如下:0.5 μL模板cDNA,上、下游引物(10 μmol/L) 各0.5 μL,5 μL Green Taq Mix,3.5 μL ddH2O。反應条件为:95 ℃预变性3 min;95 ℃ 变性15 s,57 ℃退火15 s,72 ℃延伸 1 min,进行35个循环;最后 72 ℃延伸5 min。PCR产物用1%琼脂糖凝胶电泳进行检测。测序结果使用DNAMAN软件进行序列分析。
1.4 质粒标准品制备
将CymMV和ORSV的CP基因片段克隆得到的PCR产物使用全式金公司的Easy Pure Quick Gel Extration Kit进行切胶回收并纯化。将回收纯化后的产物与pEASY-T3 Cloning Kit进行载体连接,随后转化到Trans1-T1 Phage Resistant感受态细胞中,37 ℃、200 r/min培养1 h后,将菌液均匀涂于含有50 mg/L氨苄青霉素LB平板上,37 ℃倒置培养12 h,随后挑取单菌落于50 mg/L氨苄青霉素LB液体培养基中扩大培养。将得到的菌液进行PCR,产物用1%琼脂糖凝胶电泳检测鉴定,选取条带明亮且正确的菌液送至北京擎科生物科技有限公司进行测序。
选择测序结果正确的菌液,使用全式金公司Easy Pure Plasmid MiniPrep Kit分别提取质粒,并放置于-20 ℃保存,将其作为CymMV和ORSV质粒标准品使用。运用公式C=A×10-9×B-1×6.02×1023(A为质粒浓度,ng/μL;B为质粒DNA分子量;C为质粒标准品浓度,copies/μL;6.02×1023 为摩尔分子数)计算出CymMV和ORSV质粒标准品浓度分别为 3.09×1011、3.50×1011 copies/μL。
1.5 CymMV和ORSV实时荧光定量PCR检测体系的构建
1.5.1 引物设计
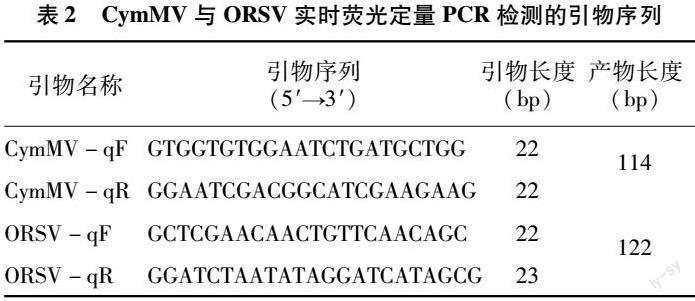
根据CymMV和ORSV的CP基因克隆片段测序结果,使用NCBI上的Primer-BLAST分别设计RT-qPCR引物(表2),引物由北京擎科生物科技有限公司进行合成。
1.5.2 RT-qPCR反应体系构建
采用TaKaRa公司的TB Green Premix Ex TaqTMⅡ(Tli RNaseH Plus)进行RT-qPCR,反应体系为:2.0 μL模板cDNA,上、下游引物各1.0 μL,12.5 μL TB Green Premix Ex TaqⅡ,8.5 μL ddH2O。反应条件为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环;95 ℃ 10 s。熔解曲线分析温度范围为65~95 ℃。反应在CF-X96荧光定量PCR仪上进行。
1.5.3 建立标准曲线
将 CymMV与ORSV质粒标准品用TaKaRa的EASY Dilution稀释液按10倍梯度逐级稀释,形成终浓度为105~109 copies/μL的5个梯度,分别进行RT-qPCR反应,每个浓度梯度设置3次重复,并根据结果计算得到标准曲线。
1.5.4 灵敏度检测
按10倍梯度对 CymMV与ORSV质粒标准品进行稀释,终浓度分别为3.09×100~3.09×109 copies/μL和3.50×100~3.50×109 copies/μL,随后以稀释后各梯度质粒标准品为模板,分别对2种病毒进行RT-PCR和 RT-qPCR检测,比较2种方法的灵敏度。RT-PCR检测所用的引物和反应体系参照“1.3”节中CymMV和ORSV的CP基因片段克隆方法。
1.6 温室样品检测
对种植于云南省农业科学院花卉研究所九溪基地的LL29、初恋、大辣椒和蓝宝石等4个蝴蝶兰品种,每个品种5株,共20份样品,分别提取叶片总RNA,采用RT-PCR和RT-qPCR体系进行CymMV和ORSV病毒检测。
2 结果与分析
2.1 CymMV、ORSV的CP基因片段克隆及序列分析
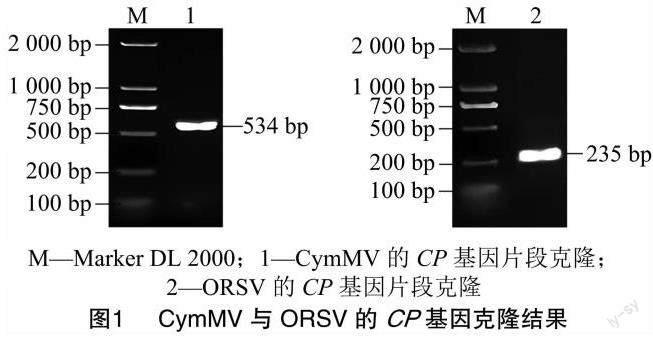
本研究以感染CymMV和ORSV蝴蝶兰植株的cDNA为模板,使用表1中引物分别对CymMV和ORSV的CP基因片段进行克隆,所使用的引物特异性较好,获得了目的片段条带(图1)。经测序获得 534 bp CymMV的CP基因片段序列,以及235 bp ORSV的CP基因片段序列。
利用DNAMAN软件对克隆到的CymMV CP基因片段序列进行分析,结果(图2)显示,本研究CymMV的CP基因片段序列与已登录的CymMV 的CP基因相应序列(GenBank:U62963.1)有12个核苷酸差异,1个氨基酸差异,核苷酸相似性为98.21%,氨基酸相似性为99.55%,表明克隆出的目的条带正确。与其他地区分离物中CymMV的CP基因(巴西GenBank:KX960737.1;河南GenBank:KU873000;云南GenBank:AM055640.2;西藏GenBank:KP137368.1)进行比对分析, 结果显示,本研究CymMV CP基因片段序列与上述地区分离物中CymMV CP基因序列核苷酸相似性为97.92%~98.66%,氨基酸相似性为95.52%~99.55%,表明来自不同地区分离物中的CymMV CP基因序列存在保守性。
本研究克隆获得的ORSV CP基因片段序列与已登录的ORSV的CP基因相应序列(GenBank:AJ606105.1)有7个核苷酸差异,5个氨基酸差异,核苷酸相似性为98.53%,氨基酸相似性为96.84%,表明克隆出的目的条带正确(图3)。与广州(GenBank:KF836079.1)、印度(GenBank:MN027919.1)、贵州(GenBank:KF225471.1)、台湾(GenBank:AF455274.1)等其他地区分离物中的ORSV CP基因相应序列的核苷酸相似性为99.12%~99.56%,氨基酸相似性为98.73%~99.37%,表明来自不同地区分离物中的ORSV CP基因序列存在保守性。
2.2 RT-qPCR标准曲线的建立
本研究首先对RT-qPCR引物特异性进行分析,结果表明,表1中引物用于蝴蝶兰CymMV和ORSV CP基因序列RT-qPCR检测时,熔解曲线为单一峰,引物特异性较好(图4-A、图4-B)。
质粒标准品以10倍梯度逐级稀释后,CymMV选取3.09×105~3.09×109 copies/μL等5個浓度的质粒标准品为模板,ORSV选取3.50×105~3.50×109 copies/μL等5个浓度的质粒标准品为模板,分别建立RT-qPCR标准曲线。结果表明,2种病毒质粒模板浓度的对数值与循环定量(Cq)值呈现良好的线性关系,CymMV的标准曲线为y=-3.459x+43.98,r2=0.999,扩增效率(E)为94.6%(图5-A);ORSV的标准曲线为y=-3.427x+48.42,r2=0.984 1,扩增效率为95.8%(图5-B),其中,y均为Cq值,x为模板浓度(C)的对数值(lgC=x)。该标准曲线可用于后期病毒浓度的计算。
2.3 RT-qPCR和RT-PCR灵敏度的比较
将母液浓度为3.09×1011 copies/μL的CymMV质粒标准品和3.50×1011 copies/μL的ORSV质粒标准品分别按10倍等比稀释,以终浓度为3.09×100~3.09×109 copies/μL的CymMV质粒标准品和3.50×100~3.50×109 copies/μL的ORSV质粒标准品为模板,进行实时荧光定量PCR检测和普通RT-PCR检测。[JP+1]结果如图6、 图7所示, RT-PCR能检测出的CymMV和ORSV最低浓度分别为 3.09×102、3.50×102 copies/μL;RT-qPCR能检测出的CymMV和ORSV最低浓度分别为3.09×10、3.50×10 copies/μL。实时荧光定量PCR比普通PCR检测的灵敏度提高10倍。
2.4 蝴蝶兰温室栽培植株CymMV及ORSV检测
同时采用RT-PCR和RT-qPCR 2种方法对LL29、初恋、大辣椒和蓝宝石等4个蝴蝶兰品种进行CymMV与ORSV检测,检测结果如表3所示,2种检测方法对病毒检测的灵敏度存在差异。对20份样本的RT-PCR结果显示,15份样品携带CymMV,6份样品携带ORSV,阳性率分别为75%和30%。RT-qPCR结果则显示,20份样品均携带CymMV,阳性率为100%,病毒含量在3.75×101~1.47×1011 copies/μL之间;18份样品携带ORSV,阳性率为90%,病毒含量在9.79×102~8.16×108 copies/μL 之间,蓝宝石中有2株不携带OSRV。总体上看,RT-qPCR检测的灵敏性更高。
尽管温室栽培的蝴蝶兰样品普遍携带CymMV与ORSV,但是从病毒拷贝数来看,不同的品种携带病毒的情况不同,大辣椒和蓝宝石携带CymMV与ORSV的情况较轻,而初恋携带病毒的情况较为严重,且CymMV和ORSV复合感染的情况较为严重。
3 讨论与结论
本研究从蝴蝶兰感病植株中克隆得到CymMV和ORSV的CP基因片段。测序后将所得CymMV CP基因序列与其他地区CymMV分离物CP基因序列进行比对,得到核苷酸序列与氨基酸序列相似性分别为97.92%~98.66%和95.52%~99.55%。与此相似,CymMV广东分离物与30个其他地区的CymMV分离物比对,核苷酸序列与氨基酸序列相似性分别为89.73%~98.66%和97.31%~100.00%[22]。Rao等通过多序列比较,发现89个CymMV CP序列核苷酸与氨基酸相似性分别为84.6%~100.00%和89.5%~100.00%[23],本研究结果与之相似。本研究中ORSV CP基因片段测序后与其他地区ORSV分离物序列进行对比,得到核苷酸序列与氨基酸序列相似性分别为99.12%~99.56%和98.73%~99.37%。与此相似,ORSV广东分离物与37个其他地区的ORSV分离物比对,核苷酸序列与氨基酸序列相似性分别为96.65%~100.00%和93.67%~100.00%[22]。吴伟文等所得ORSV江苏分离物与141个其他地区ORSV分离物CP基因核苷酸序列相似性在94%以上[24],本研究结果与之相似。由此可见,CymMV和ORSV的CP基因核苷酸序列及编码蛋白氨基酸序列在来自不同地区的分离物间存在保守性,这2种病毒的CP基因片段可作为模板,构建稳定的病毒检测体系,用于检测不同地区的蝴蝶兰植株。
灵敏度是影响病毒早期诊断的关键因素[25]。本研究构建的RT-qPCR检测体系能检测出CymMV和ORSV的最低浓度分别为3.09×10、3.50×10 copies/μL。与此相似,溧芳等在使用 RT-qPCR 对河南蝴蝶兰的检测中,可检测出CymMV最低浓度为2.66×10 copies/μL[26]。宋蒙等在百合中使用RT-qPCR检测车前草花叶病毒(Plantago asiatica mosaic virus,简称PlAMV),可检出最低浓度为 1.3×10 copies/μL[27],本研究结果与之类似,检测下限均处于10 copies/μL数量级。然而,Eun等以Taq Man探针为检测体系中的荧光指示剂,使用RT-qPCR对兰科植物中CymMV和ORSV进行检测,可检测出CymMV和ORSV最低为104 copies[28],本研究结果与之存在差异,这可能是检测体系中所用荧光指示剂不同导致的。在本研究中,RT-qPCR对CymMV和ORSV检测的灵敏性较RT-PCR提高10倍,这与使用RT-PCR和 RT-qPCR 检测西瓜种子中黄瓜绿斑驳花叶病毒(cucumber green mottle mosaic virus,CGMMV)的灵敏度比较结果[14]相同。然而,使用RT-qPCR对百合中PlAMV检测灵敏度较RT-PCR高100倍[27],灵敏性略高于本研究,这可能是因为本研究的RT-PCR扩增效率较高。
CymMV和ORSV是兰科植物病毒中危害最严重的2种病毒,且二者经常复合侵染兰科植物[29-30]。本研究对20份云南地区温室栽培的蝴蝶兰样品进行检测,CymMV阳性率为100%,ORSV阳性率为90%,2种病毒复合感染阳性率为90%,蝴蝶兰携带病毒较多,复合感染的情况较为普遍。与此相似,柳爱春等采用酶联免疫吸附剂测定(ELISA)检测法对浙江地区蝴蝶兰进行检测,CymMV阳性率为70%,ORSV病毒阳性率为60%,2种病毒复合感染率为56.7%,表明这2种病毒对浙江省蝴蝶兰侵染率较高[31]。与本研究不同,谢林娜等采用ELISA检测法对来自广东、江苏省大型蝴蝶兰生产基地的45个蝴蝶兰样品进行检测发现CymMV阳性率为20.0%,ORSV病毒阳性率为71.1%,2种病毒复合感染阳性率为17.8%[32]。周国辉等采用双重RT-PCR对广东顺德153份兰花样品进行检测,CymMV阳性率为49.7%,ORSV病毒阳性率为34.0%,2种病毒复合感染率为1.3%[33]。本研究结果与上述研究存在差异,这可能与不同地区蝴蝶兰品种和栽培环境差异以及检测方法灵敏度不同有关。
综上所述,蝴蝶兰受CymMV和ORSV危害较为普遍,未来需进一步开展种苗脱毒技术研究以此推动蝴蝶兰产业健康发展。
参考文献:
[1]梁 芳,邓祖丽颖,许申平,等. 蝴蝶兰2种病毒的同步检测及其CP融合反义表达载体构建[J]. 西南农业学报,2018,31(8):1622-1627.
[2]Chien K W,Agrawal D C,Tsay H S,et al. Elimination of mixed ‘Odontoglossum ringspot and ‘Cymbidium mosaic viruses from Phalaenopsis hybrid ‘V3 through shoot-tip culture and protocorm-like body selection[J]. Crop Protection,2015,67:1-6.
[3]Pai H,Jean W H,Lee Y S,et al. Genome-wide analysis of small RNAs from Odontoglossum ringspot virus and Cymbidium mosaic virus synergistically infecting Phalaenopsis[J]. Molecular Plant Pathology,2020,21(2):188-205.
[4]Lee C H,Zheng Y X,Jan F J. The orchid-infecting viruses found in the 21st century[M]//Orchid biotechnology Ⅲ. New Jersey:World Scientific,2017:145-164.
[5]Kim S M,Choi S H. Simultaneous detection of Cymbidium mosaic virus and Odontoglossum ringspot virus in orchids using multiplex RT-PCR[J]. Virus Genes,2015,51(3):417-422.
[6]Kondo H,Takemoto S,Maruyama K,et al. Cymbidium chlorotic mosaic virus,a new sobemovirus isolated from a spring orchid (Cymbidium goeringii) in Japan[J]. Archives of Virology,2015,160(8):2099-2104.
[7]Wong S M,Mahtani P H,Lee K C,et al. Cymbidium mosaic potexvirus RNA:complete nucleotide sequence and phylogenetic analysis[J]. Archives of Virology,1997,142(2):383-391.
[8]Voinnet O,Lederer C,Baulcombe D C. A viral movement protein prevents spread of the gene silencing signal in Nicotiana benthamiana[J]. Cell,2000,103(1):157-167.
[9]明艷林,郑国华. 齿兰环斑病毒的研究进展[C]//陈海如.第三次全国植物病毒和病毒防治学术研讨会论文集. 云南昆明:中国植物病理学会,2003:158-162.
[10]Ryu K H,Park W M. Nucleotide sequence analysis of a cDNA clone encoding the 34K movement protein gene of odontoglossum ringspot virus,ORSV-Cy,the Korean isolate[J]. Plant Molecular Biology,1994,26(3):995-999.
[11]刘沛然,王四清. 建兰花叶病毒及齿兰环斑病毒的检测方法[J]. 热带作物学报,2009,30(1):99-103.
[12]涂小云,董小艳,郭春梅,等. 多重RT-PCR检测蝴蝶兰3种病毒CymMV、ORSV和CMV[J]. 江苏农业科学,2017,45(5):91-93.
[13]Yin J L,Shackel N A,Zekry A,et al. Real-time reverse transcriptase-polymerase chain reaction (RT-PCR) for measurement of cytokine and growth factor mRNA expression with fluorogenic probes or SYBR Green I[J]. Immunology and Cell Biology,2001,79(3):213-221.
[14]刘 美,王毓洪,彭 斌,等. 黄瓜绿斑驳花叶病毒实时荧光定量PCR检测体系的建立[J]. 植物保护学报,2022,49(4):1063-1070.
[15]王艳娇,崔甜甜,黄爱军,等. 柑橘脉突病毒实时荧光定量RT-PCR检测体系的建立与应用[J]. 园艺学报,2016,43(8):1613-1620.
[16]王 丽,王振东,乔 奇,等. 甘薯褪绿矮化病毒西非株系实时荧光定量PCR检测方法的建立及应用[J]. 植物病理学报,2014,44(5):461-468.
[17]高艳玲,范国权,程胜群,等. 苜蓿花叶病毒RT-PCR和RT-qPCR检测技术体系的建立与应用[J]. 植物保护学报,2022,49(2):515-527.
[18]Al Rwahnih M,Osman F,Sudarshana M,et al. Detection of Grapevine leafroll-associated virus 7 using real time qRT-PCR and conventional RT-PCR[J]. Journal of Virological Methods,2012,179(2):383-389.
[19]Shabrangy A,Roustan V,Reipert S,et al. Using RT-qPCR,proteomics,and microscopy to unravel the spatio-temporal expression and subcellular localization of hordoindolines across development in barley endosperm[J]. Frontiers in Plant Science,2018,9:775.
[20]Elmahdy E M,Shaheen M N F,Mahmoud L H I,et al. Detection of norovirus and hepatitis a virus in strawberry and green leafy vegetables by using RT-qPCR in Egypt[J]. Food and Environmental Virology,2022,14(2):178-189.
[21]Vazquez-Iglesias I,McGreig S,Pufal H,et al. A novel high-throughput sequencing approach reveals the presence of a new virus infecting Rosa:rosa ilarvirus-1 (RIV-1)[J]. Journal of Virological Methods,2022,300:114417.
[22]任 锐,魏永路,朱根发,等. 广东省国兰病毒病害调查及CymMV和ORSV基于cp基因的系统进化分析[J]. 植物保护学报,2020,47(2):372-383.
[23]Rao X Q,Li Y,Sun J,et al. Genetic diversities of Cymbidium mosaic virus and Odontoglossum ringspot virus isolates based on the coat protein genes from orchids in Guangdong Province,China[J]. Journal of Phytopathology,2015,163(4):324-329.
[24]吴伟文,贺 振,刘 娴,等. 江苏省建兰齿兰环斑病毒的鉴定和遗传多样性分析[J]. 植物保护学报,2019,46(4):745-753.
[25]Pallás V,Más P,Sánchez-Navarro J A. Detection of plant RNA viruses by nonisotopic dot-blot hybridization[M]//Foster G D,Taylor S C.Plant Virology Protocds. New Jersey:Humana Press,1998:461-468.
[26]梁 芳,张 燕,王若斓,等. 建兰花叶病毒SYBR GreenⅠ实时荧光定量PCR检测方法的建立[J]. 江西农业大学学报,2017,39(3):572-580.
[27]宋 蒙,徐雷锋,曹雨薇,等. 百合中车前草花叶病毒的实时荧光定量PCR检测[J]. 园艺学报,2021,48(12):2497-2505.
[28]Eun A J C,Seoh M L,Wong S M. Simultaneous quantitation of two orchid viruses by the TaqMan real-time RT-PCR[J]. Journal of Virological Methods,2000,87(1/2):151-160.
[29]Jensen D D. Virus diseases of orchids in the Netherlands[J]. Netherlands Journal of Plant Pathology,1970,76(3):135-139.
[30]Zettler F W,Ko N J,Wisler G C,et al. Viruses of orchids and their control[J]. Plant Disease,1990,74(9):621-626.
[31]柳爱春,刘 超,赵 芸,等. 利用ELISA检测两种兰花病毒的研究[J]. 浙江农业学报,2009,21(2):91-95.
[32]谢林娜,苏梦芸,朱明明,等. 不同品种蝴蝶兰2种病毒的ELISA检测及其症状表现[J]. 江苏农业科学,2017,45(3):80-83.
[33]周國辉,陈晓琴,李梅辉,等. 广东地区两种兰花病毒病害的分子鉴定及检测[J]. 中国病毒学,2004,19(2)149-152.
