等温多自配引发扩增技术快速检测学校餐饮中三种食源性致病菌
2023-09-10陈万胜张庆发刘智勇
焦 强,陈万胜,周 楠,张庆发,刘智勇,
(1.河南省食品检验研究院,国家市场监管重点实验室(食品安全快速检测与智慧监管技术),河南郑州 450000;2.广州迪澳生物科技有限公司,广东广州 510507)
感染食源性致病微生物导致食物中毒是目前食品安全的主要问题[1-2],食源性致病菌能利用肉制品、乳制品、蛋制品等媒介进行人体的消化系统,通过释放致病因子引起机体中毒[3]。据世界卫生组织统计,全世界每年有约10%的人因食源性致病微生物而引起中毒,其中主要的致病微生物为沙门氏菌、大肠埃希氏菌O157:H7/NM 和单核细胞增生李斯特氏菌[4]。我国的食源性疾病情况也较为严重,在食源性中毒事件中有70%~80%是由沙门氏菌污染引起的[5],而学校食堂的食源性疾病也屡见不鲜,其直接影响了全校师生的身体健康[6]。目前大部分学校对食品检验缺乏配套的快检实验室,只有少数学校配备快检实验室,但也只是对消耗量大、操作较容易、成本较低廉的蔬菜农药残留项目进行检测,对使用量较大的生鲜肉类、植物油及微生物等,由于操作较复杂、耗时长、设备试剂较昂贵等原因,基本不进行检测[7]。一旦有学生发生呕吐、腹泻或其他疑似食物中毒的病症,难以及时发现问题。因此,急需建立一种快速、灵敏、高效、准确地鉴别学校餐饮中食源性致病菌的方法。
等温多自配引发扩增技术(IMSA)是一种新型的分子生物学技术,该技术的特点是针对靶基因序列设计了6 条特异性引物:一对茎引物和两对杂交嵌套引物,能识别靶基因上7 个位点,在等温(60~65 ℃)条件下进行核酸扩增,可产生多倍数的能自我配对继而引发循环扩增的特殊核甘酸结构[8-9]。乐振窃等[10]使用IMSA 技术检测转基因豆奶中外源基因成分,其灵敏度和特异性优于FQ-PCR 法,但引物设计复杂、产物结核复杂,难以进行后续的回收克隆鉴定。Liu 等[11]利用IMSA 技术建立检测产肠毒素大肠杆菌Ⅱ型不耐热肠毒素(LT-Ⅱ)的体系,可快速检测LT-Ⅱ,与LAMP 和CPA 法相比,具有检测范围更广、检测限更低、耗时更短和特异性更好等优点,但扩增结果需要通过观察副产物焦磷酸镁白色沉淀进行结果判定,易受主观因素影响。王琪等[12]使用IMSA 技术建立检测食品中肠出血性大肠杆菌O157:H7 的方法,可在11~12 h 内得到准确的检测结果,但检测的目标致病菌只有一种,无法进行多种食源性致病菌的分析,应用范围有限。
本研究在扩增体系中加入一种荧光染料SYTO-9,可以实现设备自动判读结果,实时监控靶基因的扩增情况,避免主观因素影响。选择沙门氏菌的invA基因、大肠埃希氏菌O157:H7/NM 的rfbE基因和单核细胞增生李斯特氏菌的prfA基因设计特异性引物,建立食源性致病菌的IMSA 检测方法,并将该方法应用到食品样本的检测中,为学校餐饮快速检测食源性致病菌提供有力的技术支持。
1 材料与方法
1.1 材料与仪器
鼠伤寒肠道沙门氏菌等15 株菌种 ATCC 菌种保藏管理中心(表1);凉拌牛肉等74 例食品样本河南省中小学等学校食堂及周边餐饮店;细菌基因组DNA 快速提取试剂盒 广州迪澳生物科技有限公司;荧光染料SYTO-9、Bst聚合酶、buffer 纽英伦生物技术(北京)有限公司;缓冲蛋白胨水、改良EC 肉汤、李氏增菌肉汤LB 等培养基 北京陆桥技术股份有限公司。
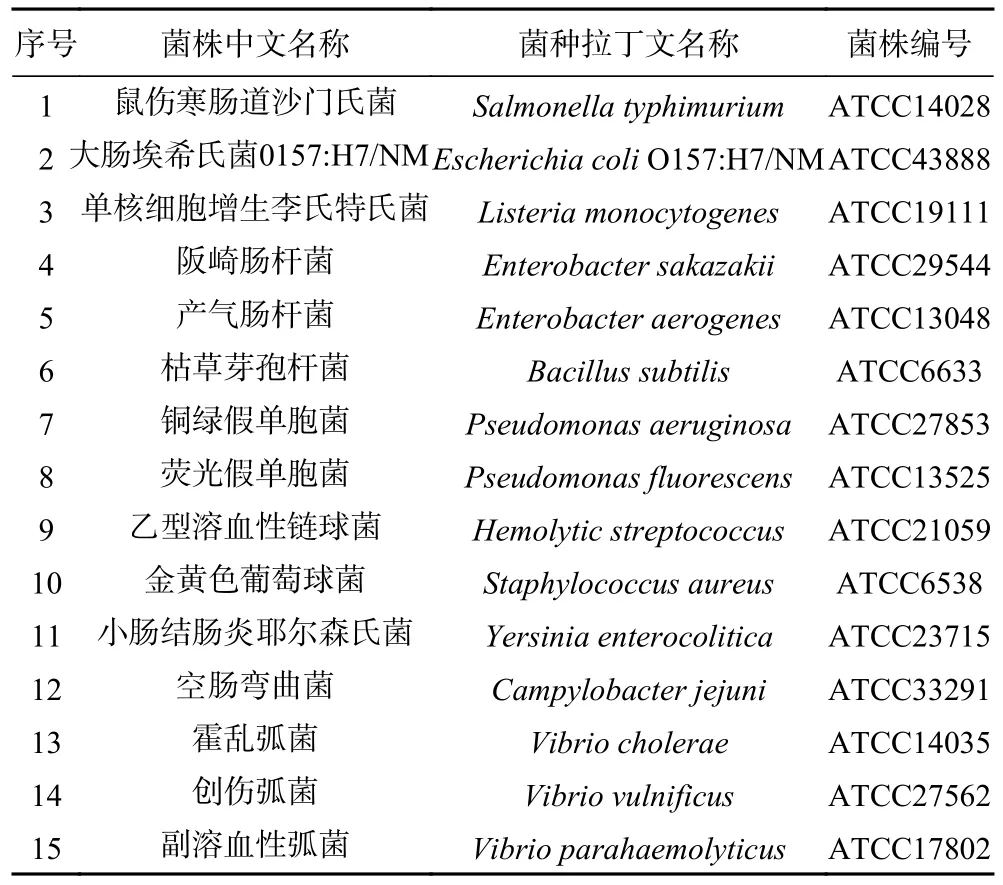
表1 菌株信息Table 1 Strains information
Deaou-308C 恒温扩增荧光检测仪 广州迪澳生物科技有限公司;HT-400B 电热恒温培养箱 江苏新春兰科学仪器有限公司。
1.2 实验方法
1.2.1 引物的设计与合成 根据GenBank 公布的沙门氏菌invA基因(登陆号:EU348365.1)、大肠埃希氏菌O157:H7/NMrfbE基因(登陆号:S83460.1)、单核细胞增生李氏特氏菌prfA基因(登陆号:LC00 6211.1)中的保守序列,利用Primer Explorer V4 在线软件设计之后手动修饰成IMSA 引物(表2),由生工生物工程(上海)股份有限公司合成。

表2 引物序列Table 2 Primer sequence
1.2.2 样本预增菌处理 在无菌条件下,称取25 g(mL)食品样本,置于盛有225 mL 培养基的无菌均质袋中,以1000 r/min 均质2~3 min,转至500 mL 锥形瓶内,于30±1 ℃或36±1 ℃内培养。
1.2.3 增菌液DNA 提取 取待用的增菌液,10000×g离心2 min 后弃上清液,沉淀中加入100 μL 细菌DNA 提取液,涡旋混匀后,100 ℃处理10~15 min,10000×g 离心2 min,吸取上清液至新的EP 管内,即为DNA 模板。
1.2.4 IMSA 扩增反应 配制反应体系:10×Thermo-Pol 缓冲液2.5 μL,10 mmol/L dNTPs 4 μL,5 mol/L甜菜碱5 μL,150 mol/L 硫酸镁1 μL,8U Bst 聚合酶1 μL,10 μmol/L DsF/DsR 0.5 μL,20 μmol/L SteF/SteR 1 μL,40 μmol/L FIT/RIT 1 μL,DNA 模板2 μL,补超纯水至25 μL。将配制好的反应体系混合后,放入恒温扩增荧光检测仪Deaou-308C 中,反应条件为63 ℃ 45 min。
1.2.5 菌液灵敏度实验 将培养后的菌液10 倍梯度稀释至10-9,选择3 个适宜稀释度菌液,取100 μL进行平板计数,每组设置2 个重复。同时各稀释度菌液取1 mL 进行DNA 提取,并进行菌液灵敏度IMSA 检测,用灭菌的去离子水作为阴性对照。根据检测结果分析三种食源性致病菌IMSA 方法的灵敏度。
1.2.6 特异性实验 复壮15 株菌种,各取1 mL 培养液进行DNA 提取,并进行特异性IMSA 检测,用灭菌的去离子水作为阴性对照。根据检测结果分析三种食源性致病菌IMSA 方法的特异性。
1.2.7 样本的最短增菌时间和最低含菌量检出限确定实验 在无菌条件下,将经培养法和IMSA 检测过沙门氏菌为阴性的凉拌牛肉,分别称取25 g 加入225 mL 的缓冲蛋白胨水、改良EC 肉汤以及李氏增菌肉汤LB 中,然后将经平板计数确定浓度为2.14×103CFU/mL 的鼠伤寒肠道沙门氏菌、2.79×103CFU/mL 的大肠埃希氏菌O157:H7/NM 和3.62×103CFU/mL 的单核细胞增生李斯特氏菌的纯菌菌液10 倍梯度稀释后,各取1 mL 加入到对应的培养基中。鼠伤寒肠道沙门氏菌于36±1 ℃培养4、6、8 h,大肠埃希氏菌O157:H7/NM 于36±1 ℃培养6、8、10 h,单核细胞增生李斯特氏菌于30±1 ℃培养6、8、10 h。各时间点取1 mL 增菌液进行DNA 提取,并进行IMSA 检测,用灭菌的去离子水作为阴性对照。根据检测结果分析三种食源性致病菌IMSA 方法的最短增菌时间和最低含菌量检出限。
1.2.8 食品样本检测实验 在无菌条件下,将74 份食品样本分别称取25 g(mL)加入225 mL 的缓冲蛋白胨水、改良EC 肉汤以及李氏增菌肉汤LB 中,缓冲蛋白胨水的样本于36±1 ℃培养6 h,改良EC 肉汤的样本于36±1 ℃培养8 h,李氏增菌肉汤LB 的样本于30±1 ℃培养8 h。培养结束后各取1 mL 培养液提取DNA,进行IMSA 检测;同时,按照国标培养法GB 4789.4-2016、GB4789.30-2016 和GB4789.36-2016 分别对74 例样本进行沙门氏菌、单核细胞增生李斯特氏菌以及大肠埃希氏菌O157:H7/NM 检测。根据检测结果分析比较三种食源性致病菌IMSA 方法与国标培养法的一致性。
1.3 数据处理
食品样本IMSA 检测和国标培养法实验各重复2 次,得到的检测结果按表3 定性方法的性能指标进行统计分析。
2 结果与分析
2.1 菌液灵敏度实验
经过平板计数确定,鼠伤寒肠道沙门氏菌的纯培养液浓度为2.14×109CFU/mL,大肠埃希氏菌O157:H7/NM 的纯培养液浓度为2.79×109CFU/mL,单核细胞增生李斯特氏菌的纯培养液浓度为3.62×109CFU/mL。经过10 倍梯度稀释后,对各浓度稀释液进行IMSA 检测,结果如图1 所示。建立的沙门氏菌、大肠埃希氏菌O157:H7/NM、单核细胞增生李斯特氏菌IMSA 检测方法的纯菌液灵敏度分别为2.14×103、2.79×103、3.62×103CFU/mL。
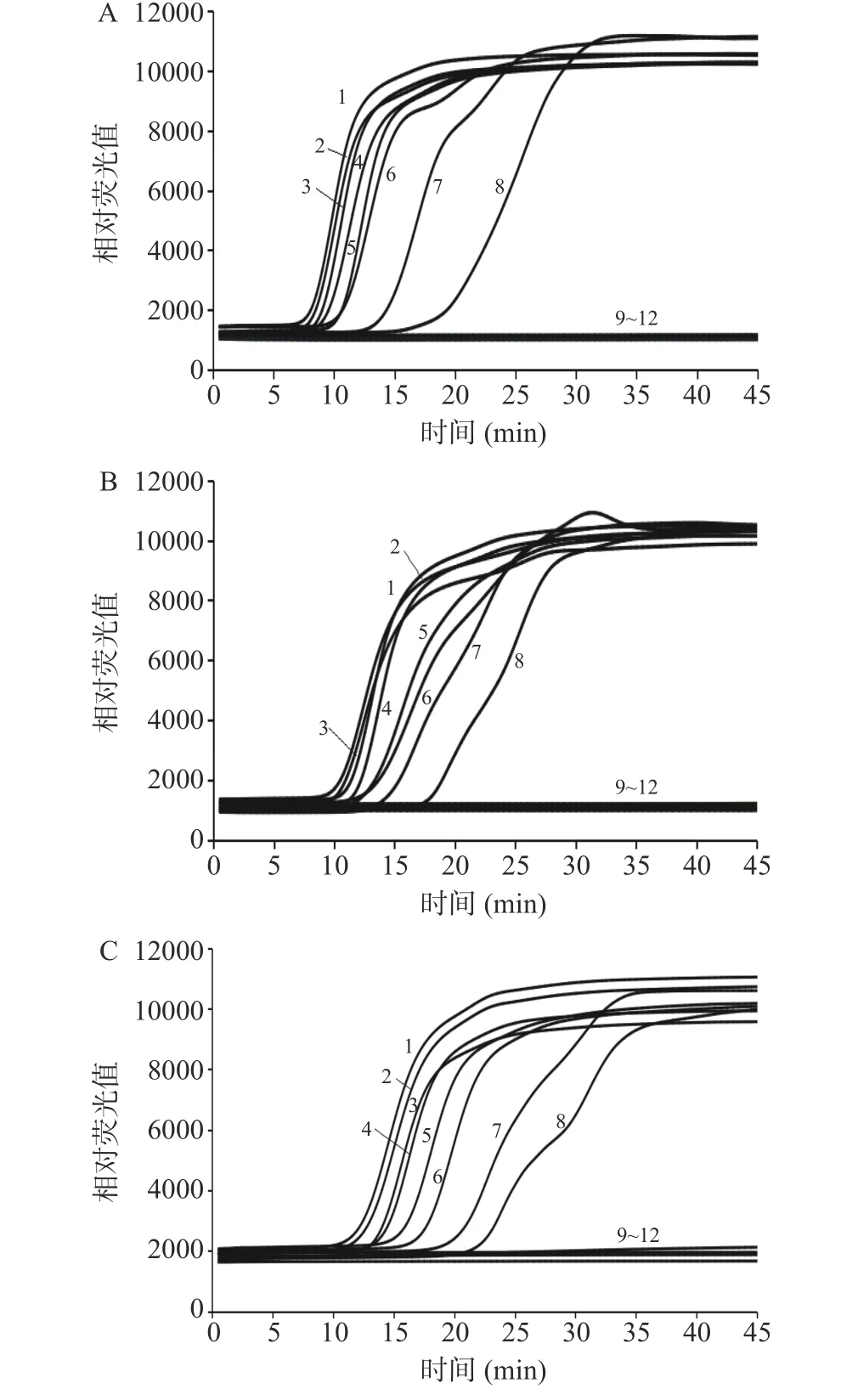
图1 3 种菌液灵敏度Fig.1 Sensitivity of three bacterial solutions
2.2 特异性实验
对15 株菌种的纯培养液进行IMSA 检测,结果如图2 所示。建立的沙门氏菌、大肠埃希氏菌O157:H7/NM、单核细胞增生李斯特氏菌IMSA 检测方法均只对本身所属的菌株存在特异性的扩增曲线,其他菌株均无扩增曲线,特异性达到100%。
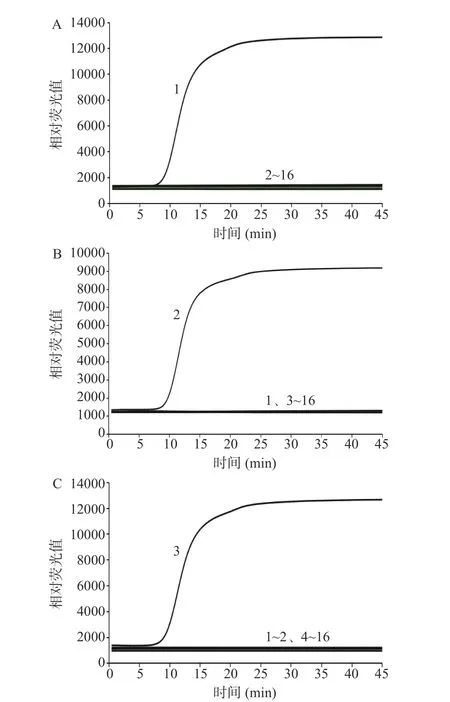
图2 IMSA 检测3 种菌株的特异性Fig.2 Specificity of IMSA to detect three bacterial
2.3 样本的最短增菌时间和最低含菌量检出限确定实验
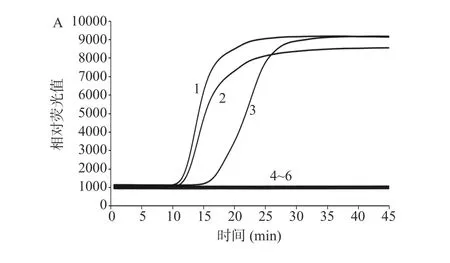
建立的IMSA 方法检测沙门氏菌结果如图3 所示,增菌时间不少于6 h 时,人工污染浓度为2.14×100CFU/mL 以上的样本均能稳定检出鼠伤寒肠道沙门氏菌,人工污染浓度为2.14×10-1CFU/mL 的样本延长培养时间依然无法检出鼠伤寒肠道沙门氏菌。由此可知,建立的IMSA 方法检测沙门氏菌的最短增菌时间为6 h,最低含菌量检出限为2.14×100CFU/25 g。建立的IMSA 方法检测大肠埃希氏菌O157:H7/NM 结果如图4 所示,最短增菌时间为8 h,最低含菌量检出限为2.79×100CFU/25 g。建立的IMSA 方法检测单核细胞增生李斯特氏菌结果如图5 所示,最短增菌时间为8 h,最低含菌量检出限为3.62×100CFU/25 g。
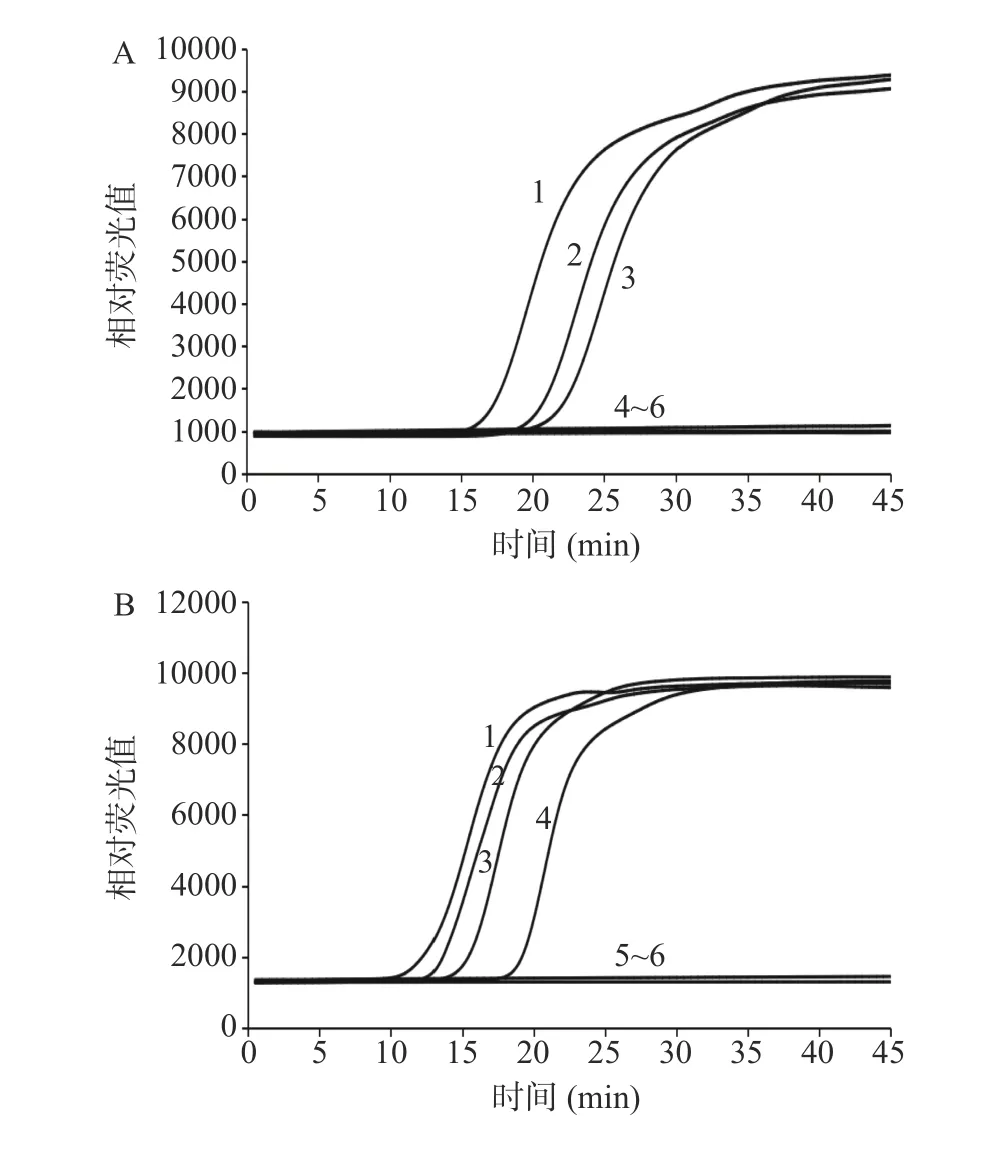
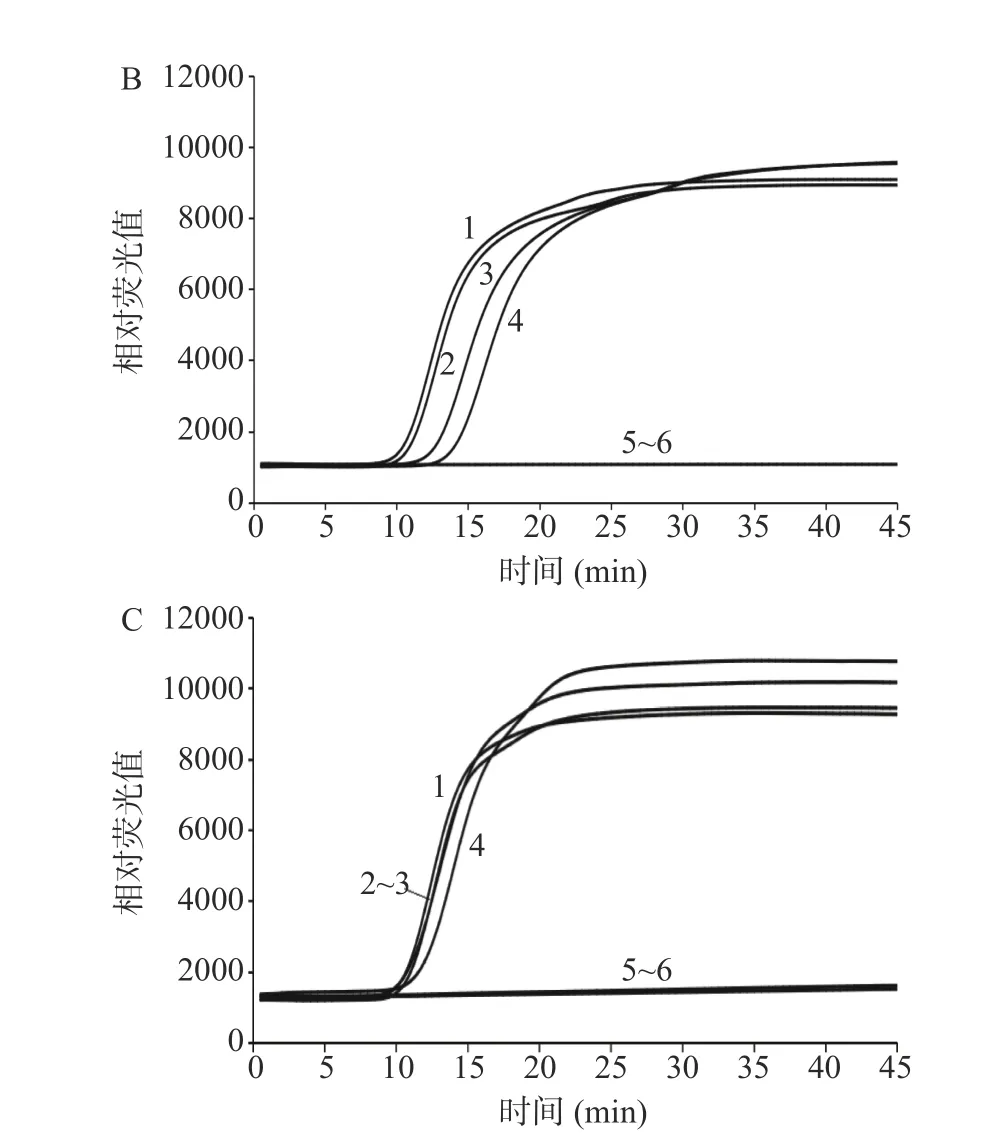
图3 人工污染鼠伤寒肠道沙门氏菌培养4 h(A)、6 h(B)、8 h(C)IMSA 检测结果Fig.3 IMSA test results of artificially contaminated Salmonella typhimurium cultured for 4 h (A), 6 h (B), 8 h (C)

图4 人工污染大肠埃希氏菌O157:H7/NM 培养6 h(A)、8 h(B)、10 h(C)IMSA 检测结果Fig.4 IMSA test results of artificially contaminated Escherichia coli O157:H7/NM cultured for 6 h (A), 8 h (B), 10 h (C)

图5 人工污染单核细胞增生李斯特氏菌培养6 h(A)、8 h(B)、10 h(C)IMSA 检测结果Fig.5 IMSA test results of artificially contaminated Listeria monocytogenes cultured for 6 h (A), 8 h (B), 10 h (C)
2.4 食品样本检测实验
对74 份食品样本进行IMSA 和国标培养法检测,结果如表4 所示。其中4 份样本利用建立的IMSA 方法检出沙门氏菌,与国标培养法的检测结果一致;3 份样本检出大肠埃希氏菌O157:H7/NM,与国标培养法的检测结果一致;1 份样本检出单核细胞增生李斯特氏菌,与国标培养法的检测结果一致。由此可见,IMSA 方法与国标培养法的一致性高达100%,说明建立的IMSA 方法对于检测食品样本中沙门氏菌、大肠埃希氏菌O157:H7/NM 和单核细胞增生李斯特氏菌具有很好的效果。
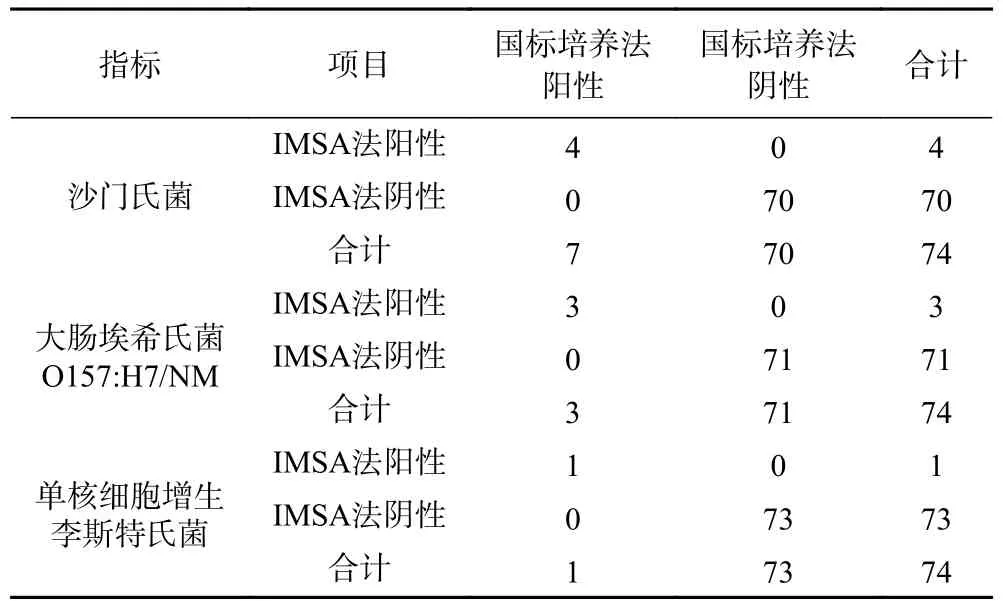
表4 两种方法检测结果统计分析Table 4 Statistical analysis table of test results of two methods
3 讨论与结论
IMSA 技术的一大难点是引物设计复杂,IMSA引物由一对茎引物和两对杂交嵌套引物组成,有别于FQ-PCR 引物,因此靶基因序列需要较长的高度保守序列。沙门氏菌毒力岛SPI 在其对宿主细胞的粘附、侵袭等致病过程中起着重要的作用[13]。而inv基因位于SPI-1 上,最早由Galan 等人提出,包括invA、invB、invC等多个基因,其中invA基因通过参与细菌侵入宿主并启动感染,从而影响沙门氏菌致病力[14]。invA在沙门氏菌中具有高度保守性,常常被用作分子生物学的检测中[15]。出血性大肠杆菌的主要血清型为大肠埃希氏菌O157:H7/NM,可导致出血性结肠炎等严重性疾病,具有感染剂量小和感染症状反应剧烈等特点[16]。而O157 抗原编码基因rfbE 在大肠埃希氏菌O157:H7/NM 中具有很高的种特异性,常用于分子生物学检测[17]。在单核细胞增生李斯特菌中,起到调控绝大多数毒力基因转录表达的蛋白因子是PrfA 蛋白[18],而编码PrfA 蛋白的prfA基因自然成了许多学者研究的对象。综上,本研究选择invA、rfbE和prfA基因的高度保守序列设计IMSA引物进行检测,菌液灵敏度检测结果分别为2.14×103、2.79×103和3.62×103CFU/mL,特异性达到100%。
目前食源性致病菌的检测方法以国家标准GB4789 为主,一般分为预增菌、选择性增菌、分离培养、生化鉴定等多个步骤[19]。现今培养法检测技术已成熟,检测结果准确可靠,有商品化的检测试剂,一定程度上能减少工作量。但检测时长依然需要3~6 d、操作繁琐、耗时费力,不能满足现今快速的检测要求,是其最大的弊端[20]。免疫学检测方法近年来也常被用到检测微生物、疾病的诊断中,主要有酶联免疫技术、免疫荧光检测技术、免疫磁珠分离技术和蛋白芯片技术等[21]。免疫学检测方法是运用抗原和抗体间能够相互特异性识别,并牢固结合的原理,该方法具有特异性好、敏感度高、检测时间短等优势[22]。但其缺点也比较明显,反应过程易受环境因素以及酶的纯度等因素影响,重复性和稳定性欠缺,容易造成漏检和假阳性[23]。分子生物学检测方法是利用核酸具有的特异性,检测是否含有特异性的基因片段[24]。目前用于食源性致病菌检测的分子生物学技术有聚合酶链式反应技术、实时荧光PCR 技术、等温扩增技术、基因芯片技术等[21]。IMSA 技术是一种新型的等温扩增技术,该技术具有快速、高效、灵敏、准确等特点,已被广泛应用于微生物、医疗检测等领域[25-26]。本研究建立的IMSA 检测方法可在12 h 内完成三种食源性致病菌的检测,与国标培养法相比,大大缩短了检测时间,且结果一致性高达100%。
学校食品安全问题是食安重点关注的问题,它不仅关系到师生的身体健康和生命安全,同时也关系到社会的和谐稳定。但是目前大部分学校未配备食源性致病菌快速检测实验室,只有发生食物中毒时才会对留样食品进行检测,无法及时监控食品加工过程中的问题。而本研究建立的沙门氏菌、大肠埃希氏菌O157:H7/NM 和单核细胞增生李斯特氏菌IMSA快速检测技术,具有灵敏度高、特异性强、操作简单、成本低等优点,可以在短时间内完成食品中致病菌的检测,非常适合学校餐饮食源性致病菌的快速检测,具有很好的实用价值和前景。
尽管建立的IMSA 检测方法对三种食源性致病菌有很好的检测效果,但该方法依然有不足之处:第一,三种食源性致病菌的检测需要分三次进行,无法做到在同一管内完成检测。第二,引物设计复杂,扩增产物复杂,不便于后续产物的鉴定工作。
