荔枝核提取物干预非酒精性脂肪肝病的网络药理学分析及验证
2023-09-10张亚硕阿如娜马鑫彦庞宗然鲁碧楠
张亚硕,阿如娜,马鑫彦,庞宗然,鲁碧楠
(中央民族大学药学院,北京 100081)
非酒精性脂肪性肝病(Non-Alcoholic Fatty Liver Disease,NAFLD)是指除外由酒精和其他对肝脏有明确损害致病因素所引起的,以脂肪在肝细胞内过度沉积为主要病变特征的临床病理综合征[1]。与肥胖、脂代谢紊乱、糖尿病等多种代谢性疾病有紧密关联[2]。近年来,NAFLD 发病率逐年攀升,2019 年的一项Meta 分析显示[3],在全球NAFLD 患病率中亚洲NAFLD 总体患病率为30%,中国大陆NAFLD 患病率也接近30%。NAFLD 是肥胖和T2DM 常见的并发症,极大的增加了这些慢性代谢性疾病的复杂性,并导致患者食欲不振,体能减弱,腹部会出现胀痛,对患者的生活质量产生了严重的不利影响[4-7]。目前针对NAFLD 多采用饮食调理、加强锻炼、减肥手术治疗代谢状态、抗氧化保肝药等手段,达到了一定的干预作用。然而,对于NAFLD 的治疗,目前还没有美国食品和药物管理局批准上市的特效药。所以对于NAFLD 的发病机制全面并且不断的深化研究以及开发治疗NAFLD 新药物至关重要。以中医药为基础开发抗非酒精性脂肪肝药物具有辨证论治和多成分、多靶点、多途径的治疗优势和特色。
荔枝核别名荔仁,形状大致为圆形或长圆形,其表面光滑亮泽,颜色呈棕色或棕红色。是我国民间常用的药食两用植物,具有理气、祛寒、止痛等功效。荔枝核的药理研究表明其具有三大作用包括抗氧化、降血糖、保肝[8]。已有实验证实荔枝核具有抑制乙肝病毒,抗肝纤维化,抗肝损伤等保肝作用[9]。有动物实验证实,对于肝炎模型动物,肝组织及血清超氧化物歧化酶(SOD),荔枝核具有提高其活力的作用,以及降低丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)活性的作用,使肝细胞免受肝类疾病损伤,从而实现治疗肝损伤作用[8]。已有实验证实,用给非酒精性脂肪性肝病大鼠模型灌胃荔枝核提取物,可使治疗组大鼠肝脏的脂肪变性、炎症和坏死改善,并显著降低丙氨酸转氨酶、天冬氨酸转氨酶、甘油三酯、低密度脂蛋白胆固醇[10]。但到目前为止,尚不明确荔枝核延缓非酒精性脂肪性肝病的药效物质基础和作用机制。
网络药理学通过计算机技术检索各类数据库信息,收集与有效化合物、疾病有关靶点,筛选并预测出最佳靶点及通路[11]。将网络药理学用于中药药效物质和作用机理的研究,因为中药的特点包括多成分、多靶点、多途径、整体调控等,所以中药结合网络药理学会成为中药研究的新方法[12]。本研究通过网络药理学的方法,探究预测荔枝核治疗非酒精性脂肪肝的作用机制,并通过功能和通路富集分析得到荔枝核治疗非酒精性脂肪肝的的相关信号通路和靶点,最后通过实验和分子对接进行验证,为荔枝核提取物在防治NAFLD 的应用和开发方面提供了实验依据。
1 材料与方法
1.1 材料与仪器
C57BL/6 雄性小鼠 SPF 级,8 周龄,(20±2 g),60 只,本研究动物实验伦理经中央民族大学生物与医学伦理审查委员会审批通过,审查号为:ECMUC-2021002A0。所有动物实验符合《实验动物饲养管理和使用指南》要求;荔枝核 北京同仁堂提供,中央民族大学药学院临床中药学教研室鉴定为无患子科植物荔枝(Litchi chinensisSonn.)的干燥种子;盐酸二甲双胍片 华润双鹤药业股份有限公司;小鼠血清生化指标试剂盒 南京建成生物科技有限公司;4%多聚甲醛固定液 Biosharp 公司;HFD 饲料(D12492,60%脂肪供能比)/LFD 饲料(D12450J,10%脂肪供能比) 斯贝福生物技术有限公司。
正置白光拍照显微镜 Nikon 公司;RNA 提取液 Servicebio 公司;荧光定量PCR 仪 Bio-rad 公司;冷冻干燥机 北京科德远扬科技有限公司。
1.2 实验方法
1.2.1 筛选荔枝核活性成分 有相关文献研究表明,荔枝核具有很多药效成分,其药理作用研究表明有保肝作用[8]。通过TCMSP(https://old.tcmsp-e.com/tcmsp.php)数据库以“荔枝核”为关键词,收集荔枝核化学组成成分,按照化学成分的药动学参数[吸收、分布、代谢及排泄(ADME)]进行其活性成分筛选,将口服生物利用度(oral bioavailability,OB)≥20%、类药性(druglikeness,DL)≥0.1[13]作为筛选条件。
1.2.2 荔枝核活性成分靶点预测 在TCMSP 上筛选出的荔枝核的活性成分通过Uniprot(https://www.uniprot.org/)网站将蛋白质名称转化为Gene Symbol,将“Homo sapiens”设定为物种类型,得到靶点名称并去重[14],筛选药物靶点。
1.2.3 非酒精性脂肪性肝病靶点获取 通过两个数据平台GeneCards(https://www.genecards.org/)和 OMIM(https://omim.org/),以“non-alcoholic fatty liver disease”“NAFLD”等为检索关键词,获取 NAFLD 靶点;借助UniProt(https://www.uniprot.org/)数据库,将“Homo sapiens”设定为物种类型,得到靶点名称并去重,建立疾病靶点库。
1.2.4 关键靶点获取 分别将荔枝核活性成分靶点和非酒精性脂肪性肝病靶点输入在线平台(https://bioinformatics.psb.ugent.be/webtools/Venn/)制作靶点韦恩图,获取关键靶点。
1.2.5 构建成分-作用靶点网络 将药物和疾病的交集基因导入在线平台STRING(https://cn.string-db.org/)[15],设定物种类型为“Homo sapiens”,可信度值设为0.4,即可得到PPI 互作网络图。
1.2.6 关键靶点富集分析 利用数据库,输入疾病与靶点的交集基因,进行生物富集分析和GO 分析以及KEGG 分析,以“Homo sapiens”为物种的设定类型,P<0.05 认为具有显著差异,并将结果可视化。
1.2.7 “成分-靶点-通路-疾病”网络图建立 利用Cytoscape3.9 软件平台获取“成分-靶点-通路-疾病”网络图。
1.2.8 荔枝核乙醇提取物制备 荔枝核种子经过破壁机粉碎后,放入烧瓶中加入75%的乙醇,以荔枝核与乙醇质量为1:20 的比例进行回流提取有效成分,每次回流提取2.5 h,回流两次,合并药液,合并两次得到的药液用冷冻干燥机干燥制得粉末,粉末加入等比例的水制成低、中、高浓度剂量放入冰箱中冷藏备用。
1.2.9 实验动物及模型建立 动物每天进食进水,22 ℃设为饲养环境的保持温度,饲养环境的保持湿度为50%~60%,一天分别光照12 h,黑暗时间12 h。先适应性饲养一周实验动物,然后开始建立DIO(饮食诱导的肥胖)小鼠模型,实验组给予HFD 饲料喂养(D12492,60%脂肪供能比),对照组饲以LFD 饲料(D12450J,10%脂肪供能比),共18 周。
1.2.10 分组及给药 将DIO 小鼠随机分为六组,每组10 只,分别为模型组(model),二甲双胍阳性对照组(MET),荔枝核提高剂量组(LZH-H),荔枝核中剂量组(LZH-M),荔枝核低剂量组(LZH-L),另选取10 只相同周龄的LFD 小鼠作为空白组(control)。设置低、中、高给药剂量分别为65、260、 1040 mg·kg-1,每日一次。模型组与空白组:每日给予相同容积的溶媒(蒸馏水)。每个组将10 mg·kg-1设定为给药量,连续给药6 周。
1.2.11 HE 染色 小鼠肝脏取材后对小鼠肝脏组织切片成相同大小进行HE 染色,观察各组肝脏空泡化程度和脂肪油滴量。
1.2.12 试剂盒检测小鼠血清ALT、AST、TG、TC含量 小鼠处死后,取血清于高速离心机4500 r/min,10 min,静置取上层,用血清生化仪进行分析。
1.2.13 荧光定量PCR 小鼠肝脏取材后各组取3 只小鼠肝脏研磨,分别提取各组RNA,取100 mg组织,加入到匀浆管中研磨,12000 r/min 离心10 min取上清,加入250 μL 三氯甲烷,颠倒离心管15 s,充分混匀,静置3 min,4 ℃下12000 r/min 离心10 min,将400 μL 上清转移到新的离心管加入0.8 倍体积的异丙醇混匀,-20 ℃放置15 min。4 ℃下12000 r/min离心10 min,管底的白色沉淀即为RNA。加入15 μL Water Nuclease-Free 溶解RNA,55 ℃孵育5 min,使用Nanodrop 2000 检测RNA 浓度及纯度,并将浓度稀释到200 ng/μL,然后配制逆转录反应体系,分别加入5 × Reaction Buffer 4 μL,Oligo (dT)18 Primer(100 μmol/L)0.5 μL,Random Hexamer primer (100μmol/L) 0.5 μL,Servicebio®RT Enzyme Mix 1 μL,提取的RNA×10 μL,最后再加入RNase free water使反应体系到20 μL 进行反转录,取0.2 ml PCR 管,配制反应体系,加入2×qPCR Mix 7.5 μL,2.5 μmol/L基因引物(上游+下游)1.5 μL,反转录产物(cDNA)2.0 μL,Water Nuclease-Free 4.0 μL 进行PCR 扩增,每个反转录产物配制3 管分别在95 ℃,30 s 预变性,95 ℃,15 s 及65 ℃→95 ℃变性。60 ℃,30 s 退火/延伸共40 个循环,每升温0.5 ℃,采集一次荧光信号,用ΔΔCT 法处理结果,得出数据。
1.3 数据处理
统计分析使用SPSS19.0 软件,每组实验数据重复测量三次,方差分析用x¯±s 表示,采用单因素方差分析(one-way ANOVA)进行组间多重比较,数据都保留两位有效数字,绘图软件用GraphPad Prism 8.0.1 软件。
2 结果与分析
2.1 荔枝核乙醇提取物组分及靶点
通过TCMSP 数据库,当条件设定为OB≥20%、DL≥0.1 时,筛选得到21 个荔枝核成分,其中18 个有效成分和358 个靶点基因。荔枝核提取物有效成分见表1,其余不符合筛选条件的为荔枝核提取物其他成分,见表2。

表1 荔枝核提取物有效成分Table 1 Litchi kernel active ingredients

表2 荔枝核提取物其他成分Table 2 Other components of lychee kernel extract
2.2 疾病靶点预测与筛选
如图1,疾病靶点通过两个数据平台GeneCards和OMIM 预测得到,得到623 个与非酒精性脂肪性肝病有关的疾病靶点,通过韦恩图取交集得到52 个疾病与药物交集基因(见表3)。

图1 药物与疾病靶点交集图Fig.1 Intersection of drug and disease target

表3 52 个交集基因Table 3 52 intersecting genes
2.3 荔枝核蛋白互作(PPI)网络分析
将荔枝核与非酒精性脂肪性肝病得到的交集靶点基因上传至STRING 数据库,以Homo sapiens 为物种类型,进行分析,以中等置信度>0.4 为筛选条件[16],下载其tsv 格式的数据表格,将表格导入Cytoscape3.9.0 软件中,利用cytoNCA 插件,依据介数中心数根据节点之间路径通过的边数或者边权重的大小进行排序。结果见图2,其中INS、TNF、HSP90AA1、PPARG、PPARA 为关联最为密切的基因靶点。
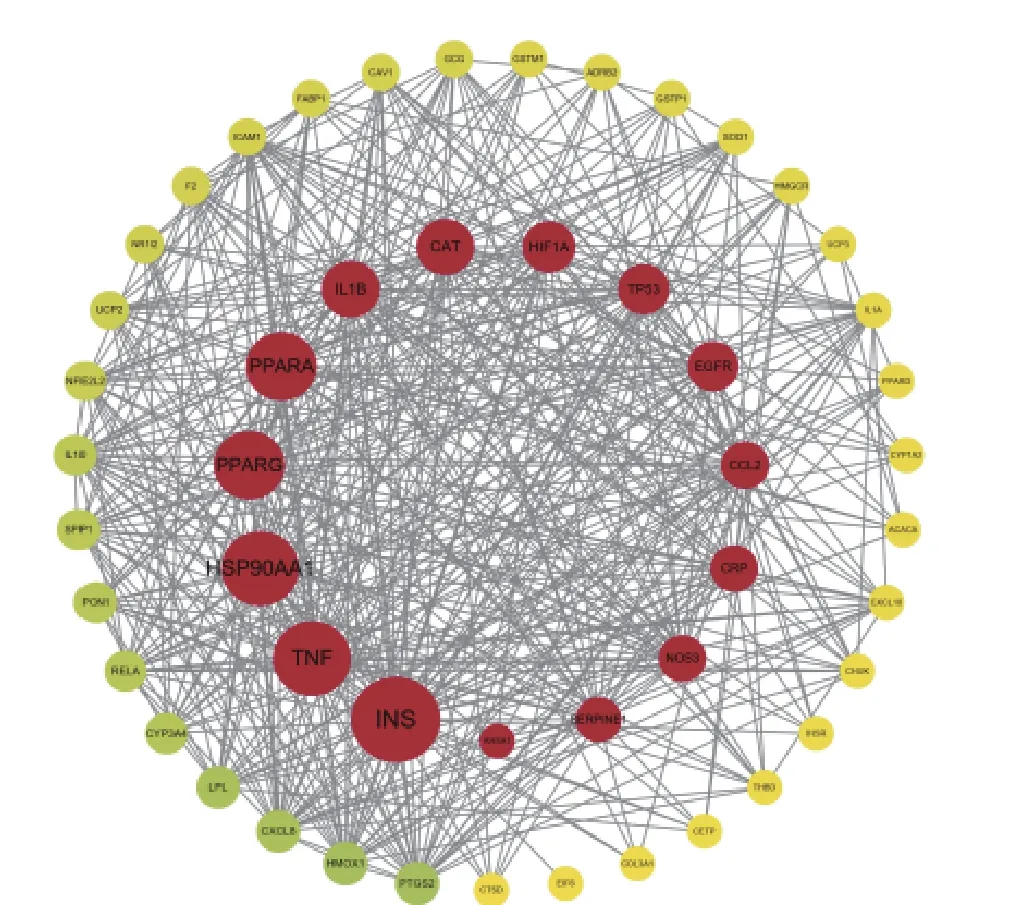
图2 荔枝核蛋白互作网络图Fig.2 Litchi nucleoprotein interaction network diagram
2.4 GO 和KEGG 富集分析
对荔枝核治疗NAFLD 的潜在的52 个靶点通过metascape 数据库进行GO 富集分析,结果显示(如图3)GO 功能富集分析中得到生物过程(BP)条目484 条,细胞组成(CC)条目7 条,分子功能(MF)条目 74 条,GO 富集分析可得22 个差异基因参与的生物过程主要是氧化应激的过程(response to oxidative stress)(P<0.01),细胞组分主要是膜微区(membrane microdomain)、脂筏(membrane raft)(P<0.01),分子功能主要为蛋白酶结合(P<0.01);

图3 GO 荔枝核治疗NAFLD 疾病的主要靶点的GO 富集分析结果Fig.3 GO enrichment analysis results of the main targets of GO litchi nucleus in the treatment of NAFLD disease
KEGG 通路富集筛选取前20 条信号通路(P<0.05),结果显示(如图4)涉及癌症通路(pathways in cancer)、动脉粥样硬化通路(Fluid shear stress and atherosclerosis)、糖尿病并发症的信号通路(AGERAGE signaling pathway in diabetic complications)、氧化应激通路(Chemical carcinogenesis-reactive oxygen species)等,通过微生信网站将结果可视化。

图4 KEGG 富集分析结果Fig.4 Results of KEGG enrichment analysis
2.5 “成分-靶点-通路-疾病”网络图构建及分析
通过Cytoscape 3.9.0 软件构建“成分-靶点-通路-疾病”四部分联系网络图,结果显示(如图5)Excel“荔枝核成分-靶点”“靶点-作用通路”“疾病-作用通路”的列表,将其导入 Cytoscape3.9.0 中构建网络。按“介数中心数”值调节节点在网络中的大小。18 个有效成分中,与通路直接作用的成分有5 个,分别是EIC、亚油酸甲酯(METHYL LINOLEATE)、β-广藿烯(β-patchoulene)、谷甾醇(sitogluside)、钴烯(copaene)等,也充分说明荔枝核是多成分-多靶点在NAFLD 中发挥作用。
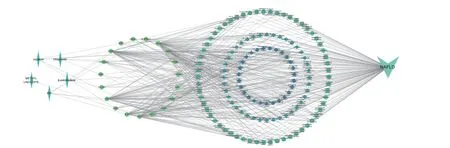
图5 “成分-靶点-通路-疾病”相互作用网络图Fig.5 "Component-target-pathway-disease" interaction network diagram
2.6 分子对接结果
如图6,根据PPI 互作网络分析的靶点结果,对互作关系最密切的五个靶点做了分子对接验证,我们得到以下结果:化合物和靶点蛋白存在很好的结合作用。且五个对接结果的结合能均小于-3.8 kJ/mol,具体结合能见表4,据结合模式可以很清晰的看到化合物与蛋白口袋相结合的氨基酸残基,如:LZH 与INS、HSP90AA1、PPARA、PPARG 结合的活性氨基酸残基有ALA-14、ASN-106、GLN-277、TYR-119、GLU-314 等。

图6 LZH 与INS、TNF、HSP90AA1、PPARG、PPARA 结合Fig.6 LZH is combined with INS, TNF, HSP90AA1, PPARG, PPARA

表4 分子对接结合能Table 4 Molecular docking binding energy
2.7 荔枝核提取物对小鼠肝脏脂肪病变的影响
如图7 所示,正常组(CON)小鼠的肝细胞排列有序,厚薄均匀且富含弹性的结缔组织构成了正常组的肝细胞,肝小叶中央为中央静脉,肝细胞和肝血窦在其周围以放射状形状排布,肝细胞排列规则、整齐,肝窦无明显扩张或挤压;未见明显炎症改变(如图中方框圈出区域)。模型组(MOD)小鼠中央静脉、汇管区周围及肝实质内均可见大量的肝细胞呈气球样变,细胞肿胀,胞质疏松淡染,多见胞质呈空泡状,多见肝细胞脂肪变性,可以看到,胞质内有数量不等的圆形空泡(如图中方框圈出区域)。荔枝核提取物介入治疗后,给药组低中高剂量组中肝脏组织结构均得到改善,肝细胞排列有序,组织结构清晰,脂质液泡不明显,接近于对照组(如图中方框圈出区域),意味着荔枝核提取物可以减少肝脏组织中的脂肪沉积并改善肝脏组织结构。
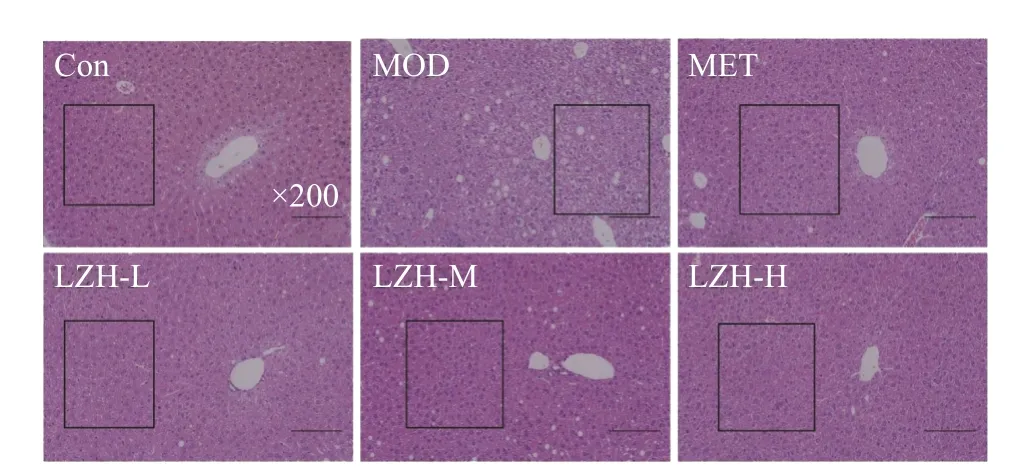
图7 小鼠肝脏HE 染色结果(200×)Fig.7 Results of HE staining of mouse liver (200×)
2.8 荔枝核提取物对小鼠血清转氨酶和脂代谢的影响
如图8 与对照组相比,谷丙转氨酶(ALT)和谷草转氨酶(AST)的活性在模型组中显著升高,经荔枝核提取物干预后有所降低,说明荔枝核提取物对NAFLD 小鼠肝功能保护具有良好效果。

图8 小鼠血清转氨酶AST、ALT 的变化Fig.8 Changes of serum aminotransferase AST and ALT in mice
如图9 与模型组相比,荔枝核提取物可以明显降低小鼠血清胆固醇(TC)(图9A)、甘油三酯(TG)(图9B)和低密度脂蛋白(LDLC)(图9C)含量及提高高密度脂(HDLC)(图9D)蛋白含量,这一结果说明荔枝核提取物有明显改善NAFLD 小鼠血脂代谢紊乱的作用。
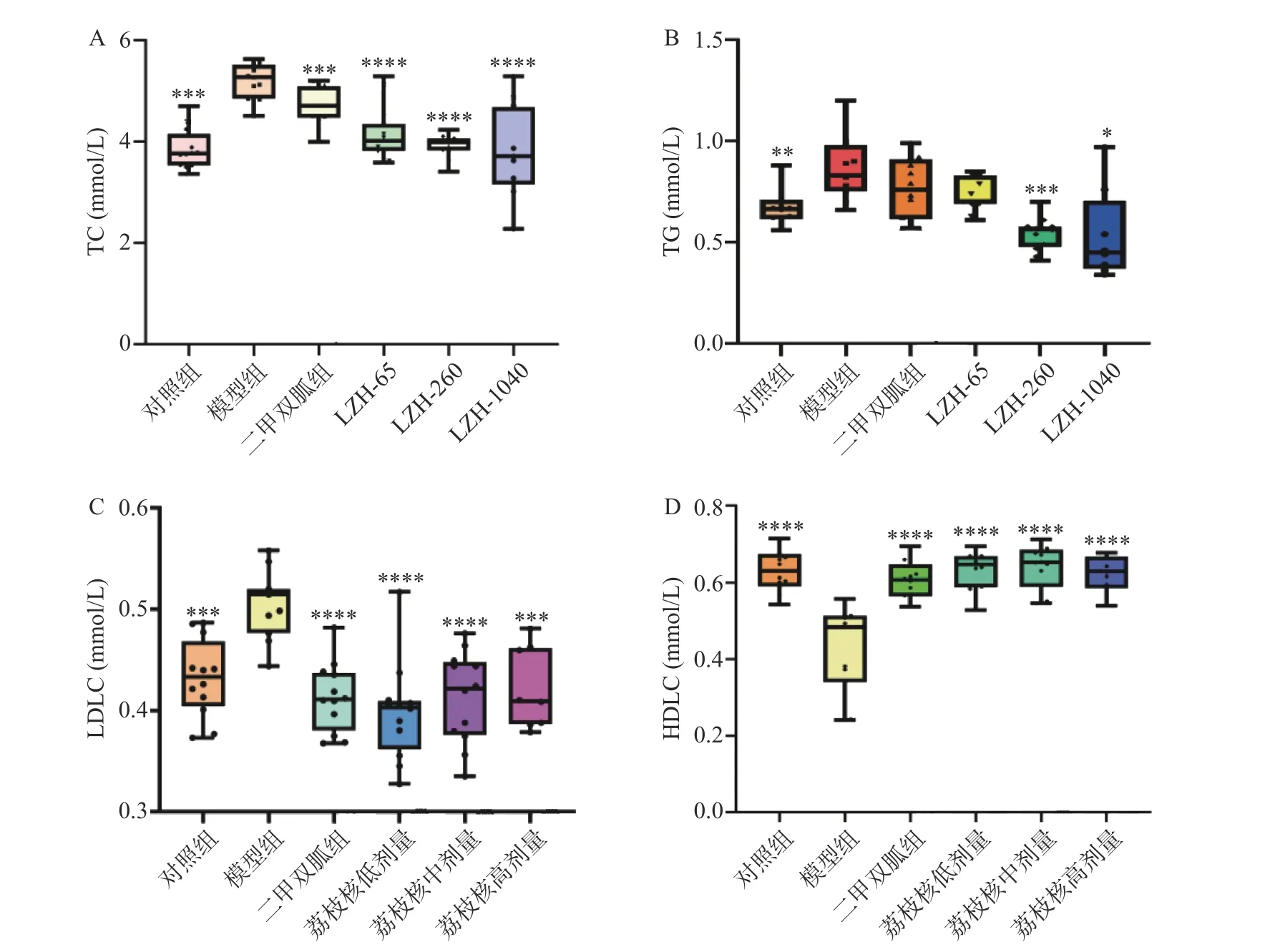
图9 小鼠脂代谢变化Fig.9 Changes in lipid metabolism in mice
2.9 荧光定量PCR 实验验证

分别对各组取3 只样本对其进行PCR 操作,同时选用PPI 互作网络得到的关系最密切的前三个基因做目的基因。由图10 可知,与模型组相比,荔枝核提取物对INS(A)基因表达影响不大,INS 基因表达倍数基本相同;与模型组相比,荔枝核提取物高剂量组有降低主要调控炎症反应的肿瘤坏死因子TNF(B)基因的表达的趋势,由于样本量较少,统计学差异并不明显;与模型组相比,荔枝核提取物高剂量组有降低热休克蛋白HSP90AA1(C)基因表达的趋势,而低、中剂量组则对HSP90AA1 表达基本无影响,由于样本量较少,统计学差异并不明显。这一结果说明荔枝核提取物可能是通过调控TNF、HSP90AA1 基因表达来发挥治疗NAFLD 的作用。后续将加大样本量再次对TNF 和HSP90AA1 的基因表达进行验证。

图10 荧光定量INS、TNF、HSP90AA1 基因表达Fig.10 Fluorescence quantitative expression of INS, TNF, HSP90AA1 genes
3 讨论与结论
非酒精性脂肪性肝病(NAFLD)主要是肝细胞内脂肪过度沉积为主,包括肝脏脂肪合成。病因包括饮食、代谢、遗传、肠道微生态及炎症等引起的以肝脏损伤为主要表现的代谢综合征。因此本研究通过网络药理学预测的与代谢相关的通路以及炎症通路符合实际情况。
PPI 核心靶点INS、TNF、HSP90AA1、PPARG、PPARA 等化合物可能是荔枝核提取物治疗非酒精性脂肪性肝病的关键成分。INS 基因编码胰岛素,胰岛素是一种肽激素,主要调节碳水化合物和脂质代谢[17]。TNF 基因包括TNF-α,其主要控制着炎症发展过程,是一种主要的促炎因子,参与包括炎症、增殖、凋亡和浸润与转移等多种生物学效应[18]。国外研究提示,口服亚油酸和双歧杆菌患者肝脏及脂肪组织中不饱和脂肪酸含量明显增多,炎症细胞因子TNF-α及干扰素γ含量下降[19]。说明TNF 与可能与脂肪的合成有相互关系。
GO 富集分析结果表明,荔枝核提取物治疗非酒精性脂肪肝的机制主要涉及氧化应激反应、小分子代谢过程等生物学过程。研究发现,氧化应激是NAFLD 疾病中从SFL 进展到NASH 过程中对肝脏一个非常重要的打击因素,可引起活性氧产物(ROS)的产生增多、线粒体结构功能紊乱等。有研究表明,使用一些抗氧化剂可通过减少氧化应激,对肝脏脂肪变性产生预防和治疗作用。抑制氧化应激可能是荔枝核提取物改善小鼠非酒精性脂肪肝的重要机制。
KEGG 富集分析说明,荔枝核提取物的主要活性成分可能是通过介导癌症通路、动脉粥样硬化通路、糖尿病并发症的信号通路、氧化应激通路等途径治疗非酒精性脂肪肝。 荔枝核提取物治疗或许可以作用于PNNS,增强神经元活性和突触可塑性。荔枝核提取物可能通过心血管相关机制改善认知行为[18]。
分子对接结果表明,荔枝核提取物含有多个供受体,荔枝核提取物能够与 INS、TNF、 HSP90AA1、PPARG、PPARA 靶点蛋白的氨基酸的活性基团形成较强氢键相互作用,与口袋的疏水性残基形成疏水相互作用,共轭相互作用等,从而促进小分子与蛋白位点的结合,该结果验证了网络药理学筛选结果, 荔枝核提取物与INS、TNF、HSP90AA1、PPARG、PPARA 蛋白靶点匹配好,是潜在的有治疗活性的化合物。
由实验结果分析可得,荔枝核提取物高剂量组给药对小鼠肝脏效果良好,小鼠肝脏肝细胞排列规则,脂肪变性和炎症改变并不明显。给药干预后,血清甘油三酯和胆固醇的相关指标也有所降低,转氨酶的活性也有所降低,说明荔枝核提取物能够很好的预防非酒精性脂肪性肝病。
根据荧光定量PCR 验证结果可得,由图10A可知,各组INS 基因表达相似,各组均无显著性差异,给药组对小鼠INS 基因的表达并不起作用,这与我们前期做的动物实验荔枝核提取物对小鼠降糖效果并不明显的实验结果如出一辙,说明荔枝核提取物对INS 基因的表达调控作用影响不大;由图10B 可得,二甲双胍阳性药使TNF 基因表达降低,肿瘤坏死因子TNF 主要调控体内的炎症、免疫反应,病理条件下,TNF 基因的过多表达会引起一系列的炎症,导致机体细胞发生凋亡、坏死等,图中结果可以看出给药组低中高剂量组也能使TNF 基因表达降低,说明荔枝核提取物能够降低炎症因子的表达,荔枝核提取物可能是通过缓解炎症反应来发挥治疗非酒精性脂肪性肝病的作用,不过统计学差异不大(P>0.05),实验数据量少,存在一定的局限性;由图10C 可得,热休克蛋白HSP90AA1 基因表达在模型组中表达量较高,HSP90AA1 其具有高度保守性,具有包括细胞保护、抗凋亡和免疫调节等多种生物学功能,给药低中剂量组对HSP90AA1 的基因表达影响不大,但是阳性药组却可以降低HSP90AA1 的基因表达,本实验具有一定的局限性,并且HSP90AA1 基因在肝脏方面的文献报道较少,荔枝核药物对NAFLD 疾病的治疗作用在HSP90AA1 基因表达上尚不明确,有待进一步研究。
本实验运用网络药理学,预测了荔枝核提取物治疗非酒精性脂肪性肝病的活性成分与重要靶点,然后用STRING 数据库对荔枝核有效成分与NAFLD疾病靶点做互作网络分析,并进一步采用分子对接对互作网络关系密切的五个靶点进行验证,以及动物体外实验对荔枝核提取物的药效进行了进一步探索,初步明确了荔枝核提取物的主要活性成分可能是多靶点、多途径抑制脂质从头合成和氧化应激从而发挥抗脂肪肝作用,为后续荔枝核提取物的抗非酒精性脂肪性肝病分子机制作用的深入研究思路提供了一定方向。
