QuEChERS-超高效液相色谱-三重四极杆串联质谱法测定水果制品和肉酱中10 种四环素类抗生素
2023-09-10唐会鑫杨莉丽
谷 悦,唐会鑫,李 朔,马 玲,王 可,, ,杨莉丽
(1.河北师范大学化学与材料科学学院,河北石家庄 050024;2.石家庄市疾病预防控制中心,石家庄市化学毒物检测及风险预警技术创新中心,河北石家庄 050011)
四环素类抗生素是由放线菌产生,具有抑菌作用,是治疗和控制传染病的最重要的广谱抗生素之一,对肺炎球菌、衣原体和支原体等有防治作用[1-2]。其不仅可在畜禽养殖业中用于防治肠道感染和促生长[3],还可在水果种植业中用于防治丛枝病和黄龙病[4-5],以提高动物源性食品和水果的产量和品质。细菌核糖体的30S 亚基和四环素类抗生素的特异性结合会破坏细菌肽链和蛋白质的生成,从而达到灭菌的目的[6-7]。这类抗生素因其成本低、抗菌范围广和高效等特点被广泛应用[8],但其在生物体内的代谢水平有限,大部分未经代谢就被排出体外,重新进入环境[9]。而四环素类抗生素结构稳定、不易分解,因此会污染环境,并且以食物链为传播途径威胁人类健康[10]。其长期蓄积摄入到人体后,会对牙齿、肝脏、肾脏等造成损害,还易引起人体溶血性贫血和产生耐药性[11-12]。在动物肌肉组织和牛奶中,欧盟限定四环素类抗生素残留量小于0.1 mg/kg[13]。我国GB 31650-2019 标准限定了在牛肉等动物源性食品中强力霉素限量是0.1~0.6 mg/kg,四环素、土霉素、金霉素的总限量为0.1~1.2 mg/kg。
免疫分析法[14-15]、高效液相色谱法[16-18]、液相色谱-串联质谱法(LC-MS/MS)[19-22]等是检测四环素类抗生素的主要方法。但是在食品基质中免疫分析法特异性较差,液相色谱方法消耗大量试剂,当前常采用LC-MS/MS 对兽药残留进行检测,该方法具有灵敏、准确度好等优点。目前四环素类抗生素残留检测多为其中一种或几种,且多集中在环境[23-26]和动物源性食品(鸡蛋、牛奶等)[27-30]等样品中,尚未有测定水果制品和肉酱中10 种四环素类抗生素残留的报道。此外,检测食品中四环素类抗生素残留多采用液液萃取和固相萃取等前处理方法,而QuEChERS法相对使用较少。QuEChERS 法具有快速、简单及试验成本低等特点,与在兽药残留检测中的应用相比,其在农药残留检测中的应用更为广泛且日益成熟。由于检测兽药残留的样品基质更为复杂,需要对传统QuEChERS 方法进行改进和优化,以达到适用于兽药残留检测的目的。因此,对于水果制品和肉酱,本文拟通过优化QuEChERS 前处理技术(提取剂种类、净化剂种类和用量等)确定最佳前处理条件,并结合UPLC-MS/MS 建立10 种四环素类抗生素残留的检测方法,为水果制品和肉酱中四环素类抗生素的监测提供技术支撑。
1 材料与方法
1.1 材料与仪器
二甲胺四环素(Minocycline)、差向四环素(4-Epitetracycline hydrochloride)、差向土霉素(4-Epioxytetracycline)、去甲基金霉素(Demeclocycline hydrochloride)、差向金霉素(4-Epichlorotetracycline)、甲烯土霉素(Methacyclinebase) 纯度≥82.0%,天津Alta 公司;土霉素(Oxytetracycline)、四环素(Tetracycline)、金霉素(Chlortetracycline)、强力霉素(Doxycycline) 纯度≥94.6%,德国Dr.Ehrenstorfer.GmbH公司;甲酸(色谱纯)、N-丙基乙二胺(PSA,40~60 μm)色谱纯,美国Dikma 公司;甲醇 色谱纯,美国Fisher 公司;乙腈 色谱纯,美国Sigma公司;十八烷基硅烷(C18,40~50 μm) 美国Welch公司;氯化钠分析纯,天津永大化学试剂有限公司;草莓罐头、橘子罐头、黄桃罐头、苹果酱、蓝莓酱、草莓酱、牛肉酱、鸡肉酱和猪肉酱 购自当地超市。
AB SCIEX Exion 超高效液相色谱仪,AB TRIPLE QUAD 5500 三重四级杆串联质谱仪,配有电喷雾离子源(ESI)及MultiQuant 数据处理系统 美国AB SCIEX 公司;VXMNAL 涡旋振荡器 美国OHAUS 公司;EVAP-12 氮吹仪 美国Organomation 公司;KQ5200DE 超声清洗器 昆山市超声仪器有限公司;CR21N 高速冷冻离心机 日本Hitachi 公司;Milli-Q 超纯水机 美国Millipore 公司。
1.2 实验方法
1.2.1 标准溶液的配制 称取适量四环素类抗生素标准品,用甲醇配制成1.0 mg/mL 单标储备液,储存于冰箱(-20 ℃)。取适量上述溶液,甲醇稀释成1.0 mg/L混合溶液。取适量1.0 mg/L 混合溶液,分别用草莓酱和牛肉酱的空白基质提取液配制浓度为0.1、0.2、0.5、1、2、5、10、20、50、100 μg/L 的系列标准溶液。
1.2.2 样品前处理 水果制品:准确称取2.0 g(精确至0.01 g)草莓酱,放入50 mL 聚丙烯塑料离心管中,加入3 mL 纯水、15 mL 0.2%甲酸乙腈,涡旋后超声10 min,再加入0.5 g NaCl,振荡后以8000 r/min 在25 ℃下离心5 min。移取2 mL 上清液至盛有30 mg PSA 的15 mL 聚丙烯塑料离心管中,涡旋混匀30 s,以8000 r/min 离心5 min。取0.5 mL 上清液,加水稀释至1 mL 后混匀,经0.20 μm 滤膜过滤,供UPLCMS/MS 测定。
肉酱:准确称取2.0 g(精确至0.01 g)牛肉酱,放入50 mL 聚丙烯塑料离心管中,加入3 mL 纯水、15 mL 0.2%甲酸乙腈,涡旋后超声10 min,再加入0.5 g NaCl,振荡后以8000 r/min 在4℃下离心5 min。移取2 mL 上清液至盛有100 mg C18的15 mL 聚丙烯塑料离心管中,涡旋混匀30 s,以8000 r/min 离心5 min。取0.5 mL 上清液,加水稀释至1 mL 后混匀,经0.20 μm 滤膜过滤,供UPLC-MS/MS 测定。
1.2.3 液相色谱条件 ZORBAX SB-Aq 色谱柱(2.1 mm×150 mm,3.5 μm);柱温:40 ℃;流速:0.3 mL/min;进样量:2 μL;0.4%甲酸水溶液为流动相A,甲醇为流动相B;梯度洗脱程序:0~2.0 min,26% B;2.0~2.1 min,26%~40% B;2.1~3.0 min,40% B;3.0~3.1 min,40%~80% B;3.1~4.0 min,80% B;4.0~4.1 min,80%~26% B;4.1~8.0 min,26% B。
1.2.4 质谱条件 离子源:电喷雾电离源(ESI);扫描方式:正离子扫描;监测模式:多反应监测(MRM);离子源温度:550 ℃;离子源电压:5500 V;气帘气(N2):40 psi;喷雾气(N2):55 psi;辅助气(N2):55 psi。10 种四环素类抗生素的详细质谱参数见表1。

表1 10 种四环素类抗生素的质谱参数Table 1 Mass spectrometric parameters of 10 tetracycline antibiotics
1.3 数据处理
采集数据使用分析软件1.6.3,数据处理使用MultiQuant 3.0.2 并建立标准曲线。计算回收率用Microsoft Excel 97-2003 软件,计算后采用Origin 2018 软件分析。
2 结果与分析
2.1 质谱条件优化
四环素类抗生素的结构中富含N、O 原子,其更易结合H+,因此在ESI 正离子模式进行检测。10 种四环素类化合物的单标标准溶液均为50 ng/mL,以7 μL/min 采用针泵连续进样的方式将其注入离子源。首先在Q1 MS 模式扫描得到10 种目标化合物的母离子,然后在Product Ion(MS2)模式进行子离子全扫描,选择出两个响应较强的碎片离子为定性离子,其中响应值更高的为定量离子。将各目标化合物的母离子和相对应的两个碎片离子组成离子对,在MRM 模式下优化去簇电压(DP)和碰撞能(CE),结果见表1。
2.2 色谱条件优化
2.2.1 色谱柱选择 选择ZORBAX Eclispse XDBC18(4.6 mm×50 mm,1.8 μm)、ZORBAX SB-Aq(2.1 mm×150 mm,3.5 μm)、Poroshell 120 EC-C18(2.1 mm×100 mm,2.7 μm)进行比较。实验表明,使用ZORBAX Eclispse XDB-C18色谱柱对10 种目标化合物进行分离时,分离度较差,二甲胺四环素响应值低、峰形宽且拖尾严重(见图1);使用Poroshell 120 EC-C18色谱柱进行分离时,由于四环素与差向四环素母离子和定量子离子相同,峰形叠加,在定量分析时会产生相互干扰,从而导致结果不准确,且强力霉素的基线偏高(见图2);而在ZORBAX SB-Aq色谱柱上,10 种四环素类抗生素可以在较短的时间内获得较好的分离度且峰形较好(见图3)。因此,选择ZORBAX SB-Aq 色谱柱分离10 种四环素类抗生素。

图1 10 种四环素类抗生素在ZORBAX Eclispse XDBC18 色谱柱上的提取离子流色谱图(50 μg/L)Fig.1 Extracted ion chromatograms of 10 tetracycline antibiotics on a ZORBAX Eclispse XDB-C18 column (50 μg/L)

图2 10 种四环素类抗生素在Poroshell 120 EC-C18 色谱柱上的提取离子流色谱图(50 μg/L)Fig.2 Extracted ion chromatograms of 10 tetracycline antibiotics on a Poroshell 120 EC-C18 column (50 μg/L)
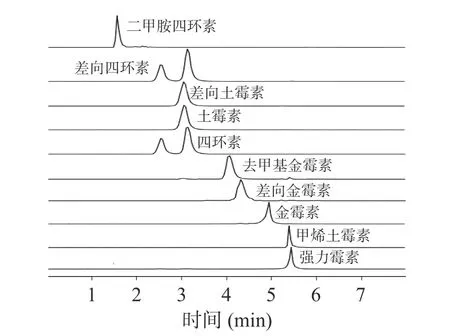
图3 10 种四环素类抗生素在ZORBAX SB-Aq 色谱柱上的提取离子流色谱图(50 μg/L)Fig.3 Extracted ion chromatograms of 10 tetracycline antibiotics on a ZORBAX SB-Aq column (50 μg/L)
2.2.2 流动相优化 实验发现,选择乙腈为有机相时,各目标化合物存在峰形较宽且分离度较差现象,故选用甲醇。另以纯水、0.4%甲酸水、2 mmol/L 乙酸铵水溶液(含0.4%甲酸,v/v)为水相进行比较。当水相为纯水时,金霉素和甲烯土霉素峰形宽且基线偏高(见图4);随着甲酸的加入,峰形尖锐且对称;而乙酸铵的引入使得除二甲胺四环素外其他9 种目标化合物的响应均有所降低,最终选择0.4%甲酸水溶液/甲醇为流动相。对梯度洗脱程序进一步优化后,10 种目标化合物的总离子流图如图5 所示。
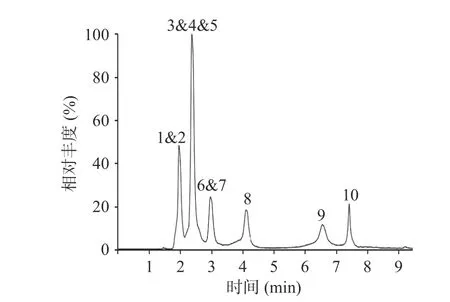
图4 10 种四环素类抗生素在流动相为纯水/甲醇中的总离子流图(50 μg/L)Fig.4 Total ion chromatograms of 10 tetracycline antibiotics using water/methanol as mobile phase (50 μg/L)
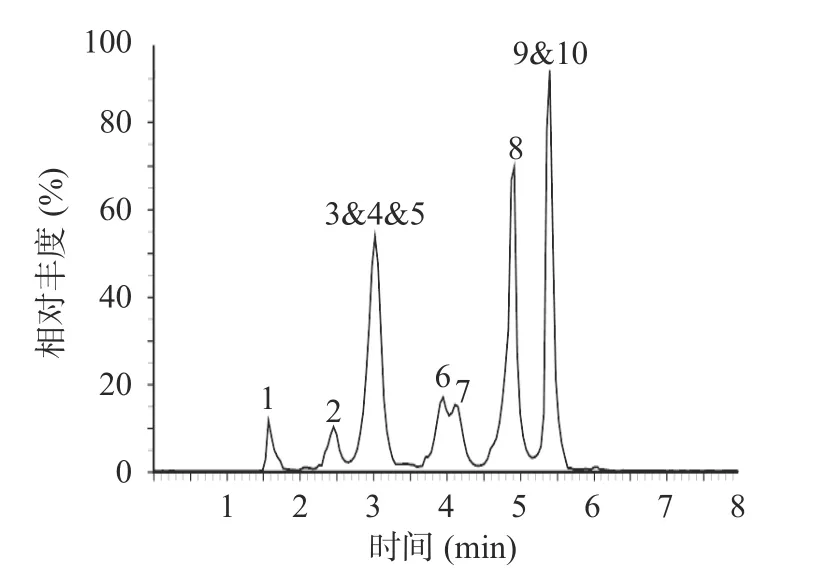
图5 10 种四环素类抗生素的总离子流图(50 μg/L)Fig.5 Total ion chromatograms of 10 tetracycline antibiotics(50 μg/L)
2.3 前处理方法优化
2.3.1 提取剂的选择 提取剂的选择要求是尽可能萃取目标化合物,并减少对杂质的提取。乙酸乙酯和乙腈是常用的提取剂,并且酸化乙腈对许多分析物具有良好的萃取效率,因此实验以草莓酱为基质,比较了乙酸乙酯、乙腈和0.3%甲酸乙腈对10 种四环素类抗生素的提取效率(见图6)。用乙酸乙酯提取时,10 种四环素类抗生素的回收率均在50%以下;而乙腈为提取溶剂时,10 种四环素类抗生素的回收率整体升高,说明含有极性基团的四环素类抗生素更易溶于强极性的乙腈中[29]。在乙腈中加入0.3%甲酸后,10 种四环素类抗生素的回收率进一步提高,在33.1%~112.5%之间。进一步对甲酸用量进行优化,实验分别考察了0.1%、0.2%、0.3%、0.4%和0.5%甲酸乙腈对10 种四环素类抗生素的回收率的影响(见表2)。甲酸用量从0.1%提高到0.2%时,10 种四环素类抗生素的回收率均有所升高,在68.2%~99.5%之间。当进一步增加甲酸的用量时,二甲胺四环素、四环素、去甲基金霉素和金霉素的回收率均呈现不同程度降低,其余6 种目标化合物的回收率变化不大。这可能是由于在弱酸性条件下,二甲胺四环素、四环素、去甲基金霉素和金霉素比较稳定,随着酸度的增大,会使得稳定性降低,易发生降解[31]。综合上述分析,本实验选择0.2%甲酸乙腈作为最终提取剂。

表2 含不同量甲酸的乙腈对10 种四环素类抗生素回收率的影响Table 2 Effect of acetonitrile containing different amounts of formic acid on the recoveries of 10 tetracycline antibiotics
2.3.2 净化剂的优化 QuEChERS 常用净化剂有PSA、C18等,在去除糖类、脂肪酸等杂质时常用PSA,去除脂类则多用C18[32]。分别在草莓酱和牛肉酱中比较了使用PSA、C18、无水Na2SO4作净化剂对回收率的影响。实验结果表明,对于草莓酱样品,分别以C18和无水Na2SO4作净化剂时,二甲胺四环素的回收率均低于45%,而以PSA 作净化剂时效果更好,10 种四环素类抗生素的回收率均在70%以上(见图7);对PSA 用量进一步优化,本文比较了10、30、60、100 和150 mg PSA 对草莓酱的净化效果。结果显示,随着PSA 用量的增加,10 种四环素类抗生素的回收率呈现先增加后降低的趋势,说明PSA 用量增大可能会增加对抗生素的吸附量,从而导致回收率降低。在PSA 用量为30 mg 时,10 种四环素类抗生素均能达到较好的回收率,在74.7%~110.2%之间(见图8)。对于牛肉酱基质,以PSA 为净化剂时,差向土霉素、土霉素和差向金霉素的回收率均低于56%,二甲胺四环素的回收率仅62.8%;使用无水Na2SO4净化时,差向土霉素、土霉素、差向金霉素和二甲胺四环素的回收率在59.0%~63.4%之间;而用C18作净化剂时,二甲胺四环素回收率可达76%,另外差向土霉素、土霉素和差向金霉素的回收率也略有升高,其他6 种目标化合物的回收率在74.8%~88.5%之间,10 种目标化合物的整体回收率更好(见图9);同样对C18用量进行优化,实验比较了10、30、60、100和150 mg C18对牛肉酱的净化效果。实验结果显示,C18用量为100 mg 时,对10 种四环素类抗生素整体净化效果最佳,回收率在70.0%~90.4%之间(见图10)。因此,本实验在水果制品中选择30 mg PSA作为净化剂,在肉酱基质中选择100 mg C18作为净化剂。
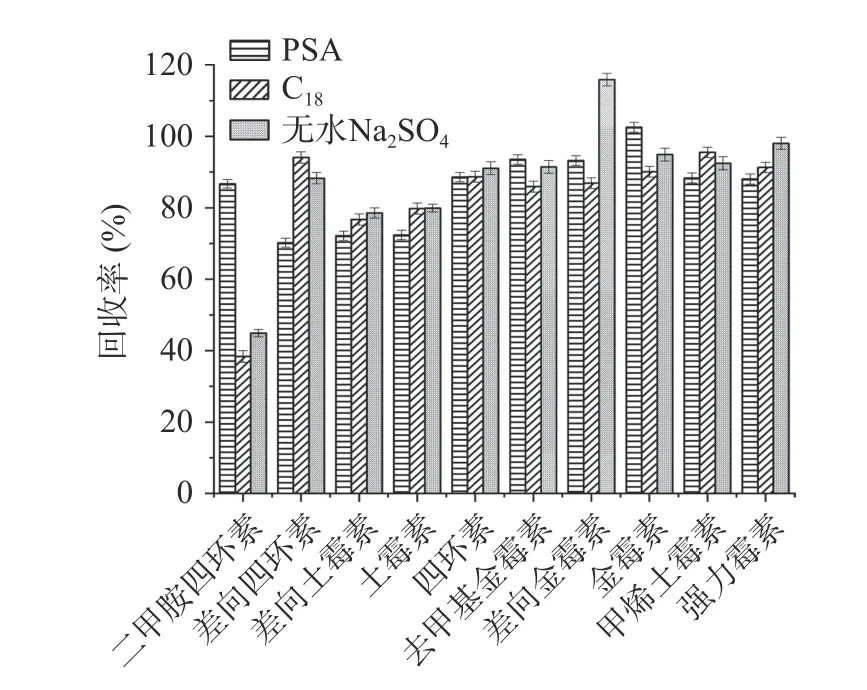
图7 草莓酱中不同净化剂对10 种四环素类抗生素回收率的影响Fig.7 Effect of different adsorbents on the recoveries of 10 tetracycline antibiotics in strawberry jam
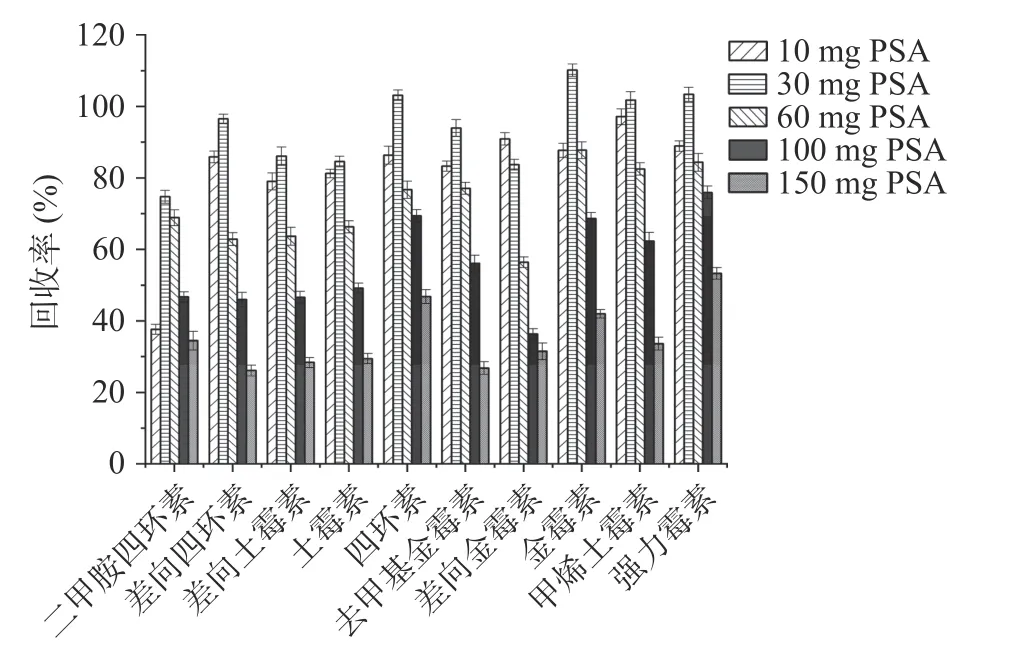
图8 草莓酱中PSA 用量对10 种四环素类抗生素回收率的影响Fig.8 Effect of PSA dosages on the recoveries of 10 tetracycline antibiotics in strawberry jam
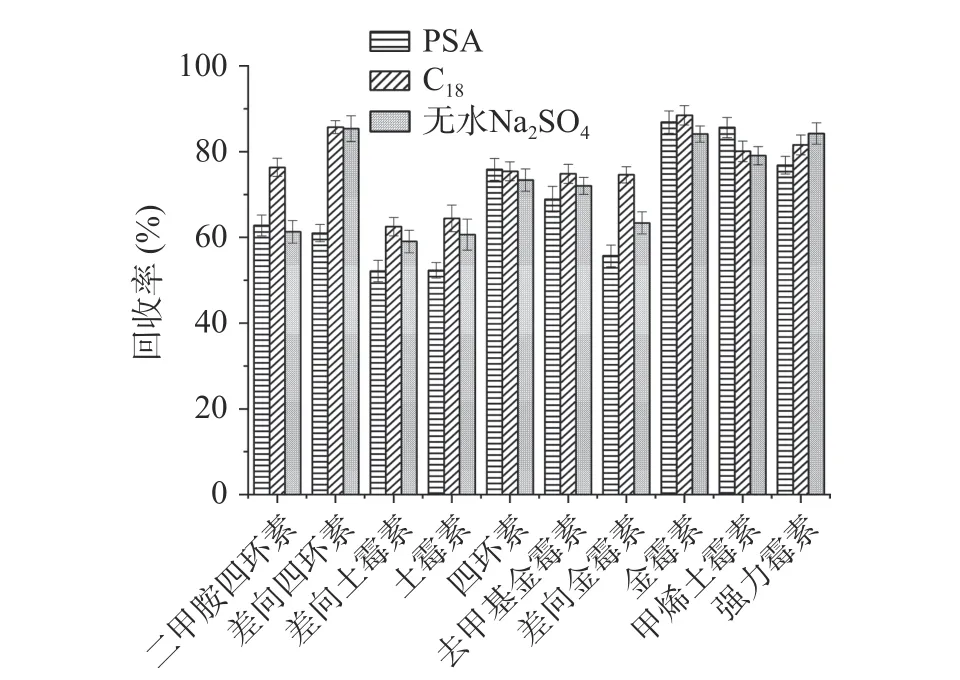
图9 牛肉酱中不同净化剂对10 种四环素类抗生素回收率的影响Fig.9 Effect of different adsorbents on the recoveries of 10 tetracycline antibiotics in beef sauce
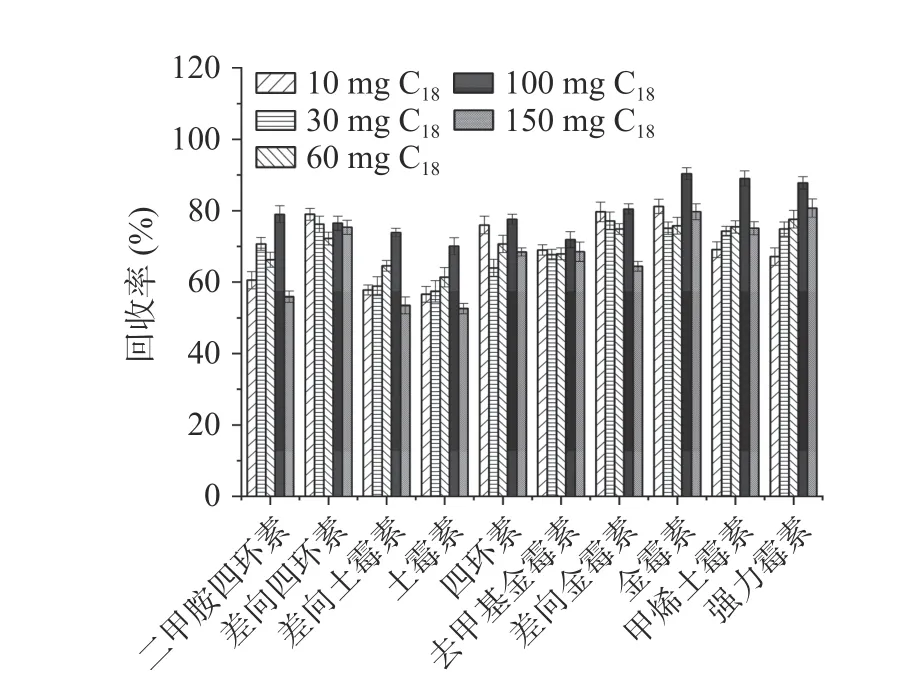
图10 牛肉酱中C18 用量对10 种四环素类抗生素回收率的影响Fig.10 Effect of C18 dosages on the recoveries of 10 tetracycline antibiotics in beef sauce
2.4 方法学考察
2.4.1 基质效应 基质效应(Matrix effect,ME)=空白基质标准曲线的斜率/溶剂标准曲线的斜率×100%[33],当ME<80%表示基质抑制,其>120%则基质增强,而ME 在80.0%~120.0%之间时,可忽略基质效应。10 种四环素类抗生素的基质效应结果见表3,从表3 可以看出,对于草莓酱,二甲胺四环素的ME 值为278.7%,有基质增强,其它9 种四环素类抗生素的ME 值在100.0%~112.6%之间,基质效应可忽略;在牛肉酱中,二甲胺四环素、差向四环素、土霉素和差向金霉素的ME 值在121.3%~224.6%之间,具有基质增强作用,而其它6 种目标化合物的ME值在110.0%~116.8%之间,可忽略。因此,为保证检测结果的准确性,本实验分别采用草莓酱和牛肉酱的空白基质标准曲线进行外标法定量检测。
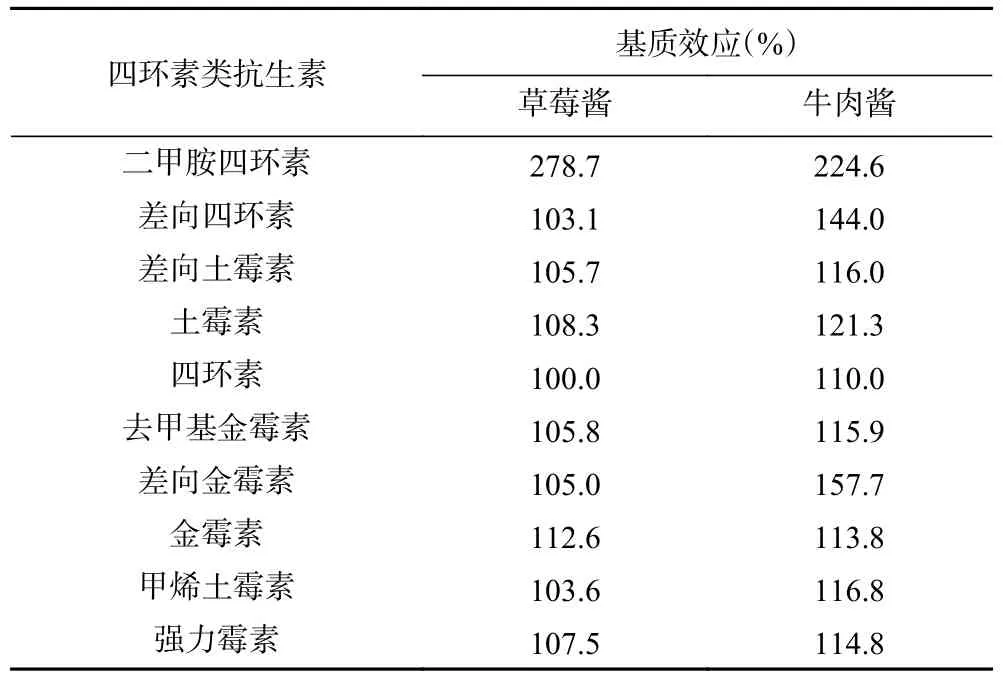
表3 10 种四环素类抗生素的基质效应Table 3 Matrix effects of 10 tetracycline antibiotics
2.4.2 标准曲线、检出限和定量限 按照1.2.1 配制浓度为0.1、0.2、0.5、1、2、5、10、20、50、100 μg/L的基质标准溶液进行测定,以各目标化合物的质量浓度(X,μg/L)为横坐标,相应定量离子的峰面积(Y)为纵坐标绘制标准曲线,得到线性回归方程及相关系数(r)。结果表明,10 种四环素类抗生素在各自浓度范围内线性良好,相关系数(r)均在0.999 以上。分别以3 倍信噪比(S/N=3)和10 倍信噪比(S/N=10)计算得到各目标化合物的检出限(LOD)和定量限(LOQ),结果见表4 和表5。
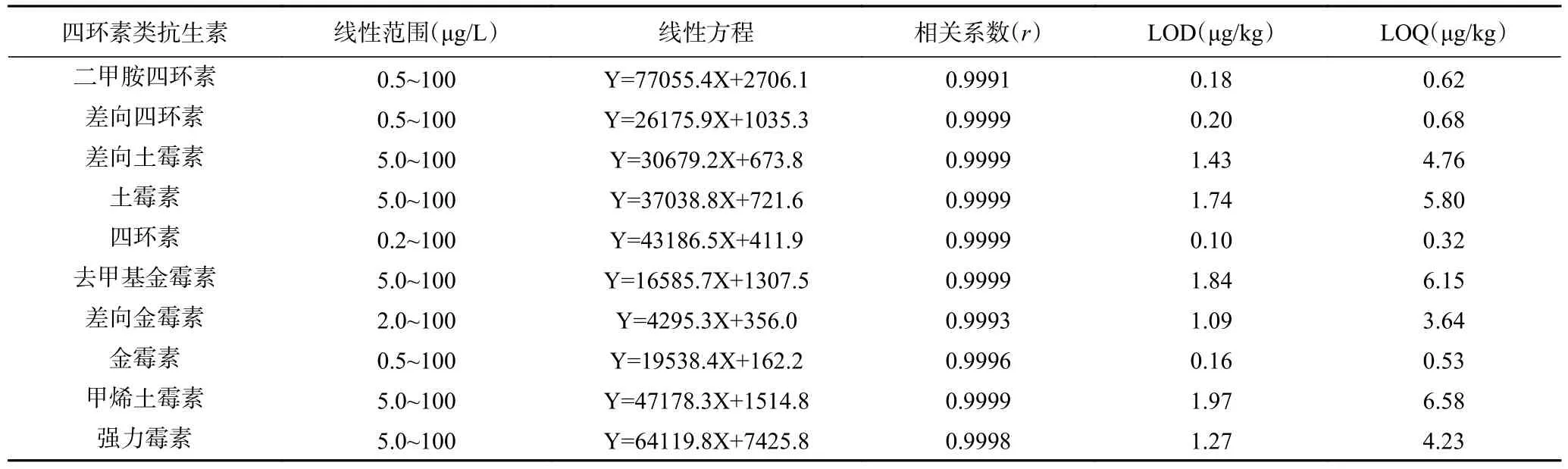
表4 草莓酱中10 种四环素类抗生素的线性范围、线性回归方程、相关系数、检出限和定量限Table 4 Linear ranges, regression equations, correlation coefficients, limits of detection and limits of quantification of 10 tetracycline antibiotics in strawberry jam
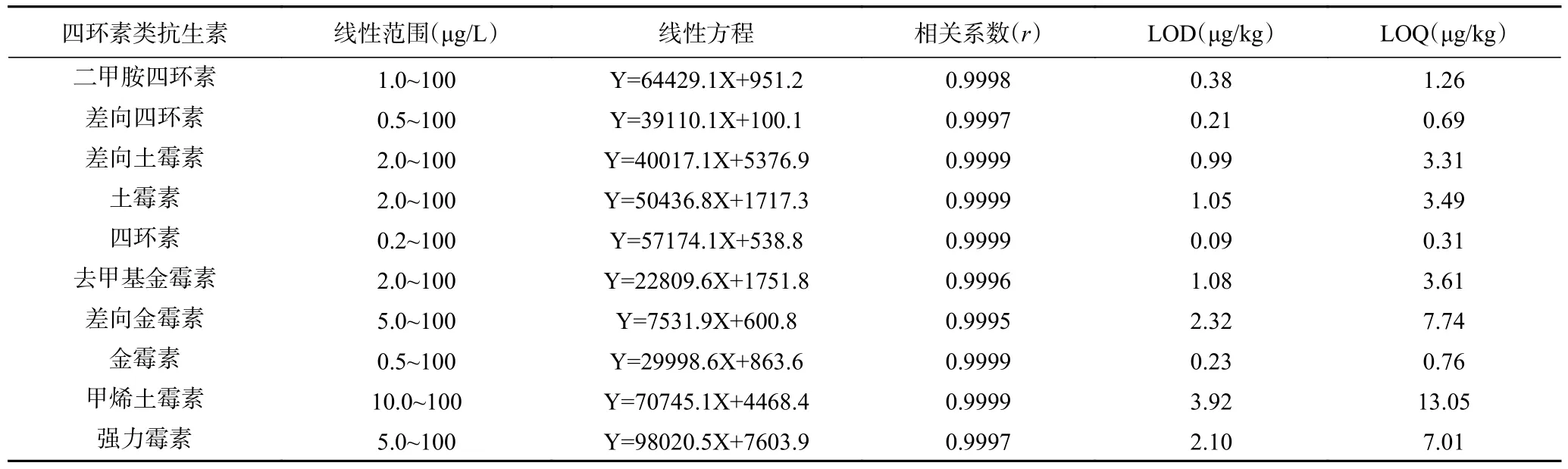
表5 牛肉酱中10 种四环素类抗生素的线性范围、线性回归方程、相关系数、检出限和定量限Table 5 Linear ranges, regression equations, correlation coefficients, limits of detection and limits of quantification of 10 tetracycline antibiotics in beef sauce
2.4.3 加标回收率和精密度 在草莓酱和牛肉酱空白基质样品中分别添加低、中、高三个不同加标水平的四环素类抗生素,前处理步骤按1.2.2 进行,结果见表6。10 种四环素类抗生素的平均回收率为70.0%~101.0%,相对标准偏差(RSD)为1.0%~10.3%,精密度和准确度良好,适用于水果制品和肉酱中10 种四环素类抗生素的残留检测。
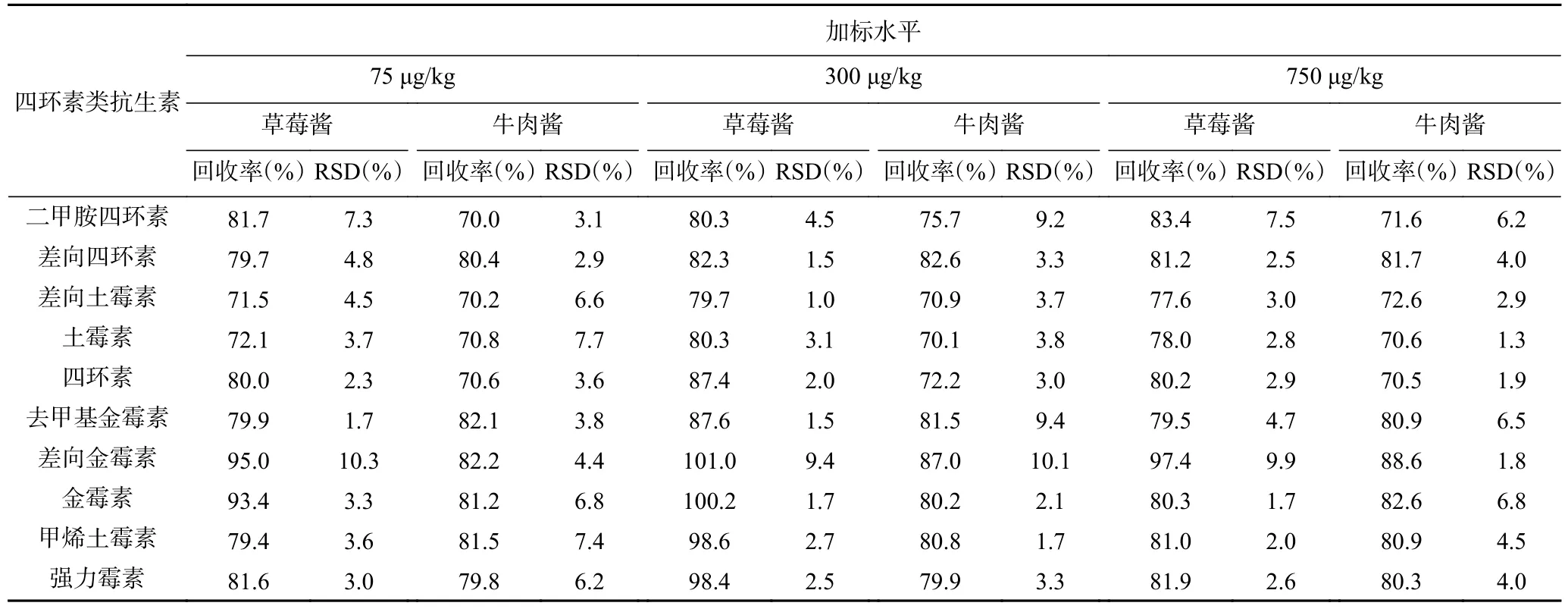
表6 10 种四环素类抗生素的加标回收率及相对标准偏差(n=7)Table 6 Spiked recoveries and RSDs of 10 tetracycline antibiotics (n=7)
2.5 实际样品测定
采用本实验优化好的前处理方法对市售的18份水果制品(其中包括3 份草莓罐头、2 份橘子罐头、5 份黄桃罐头、2 份苹果酱、3 份蓝莓酱和3 份草莓酱)和10 份肉酱(包括5 份牛肉酱、3 份鸡肉酱和2 份猪肉酱)样品进行检测,10 种四环素类抗生素的检测结果均低于方法的检出限。
3 结论
使用0.2%甲酸乙腈提取,结合分散固相萃取净化,本研究建立了水果制品和肉酱中10 种四环素类抗生素的UPLC-MS/MS 检测方法。实验结果显示,10 种四环素类抗生素在各自线性范围内具有良好的线性关系(r>0.999),在75、300 和750 μg/kg 三个不同加标水平下的平均回收率为70.0%~101.0%,相对标准偏差为1.0%~10.3%。该方法灵敏度高、准确度好,适用于水果制品及肉酱中10 种四环素类抗生素的同步快速检测,进一步完善了四环素类抗生素监测体系。
