动物蛋白源免疫调节肽的研究进展
2023-09-10梁泳仪白卫东肖更生曾晓房
梁泳仪,王 宏,白卫东,肖更生,曾晓房
(仲恺农业工程学院,广东省岭南特色食品科学与技术重点实验室,农业农村部岭南特色食品绿色加工与智能制造重点实验室,轻工食品学院,广东广州 510225)
免疫调节肽是一类具有免疫调节作用的生物活性肽,其作用包括但不限于促进/抑制淋巴细胞分化成熟、调节巨噬细胞的吞噬功能、转移免疫信息、调节细胞分泌因子等[1-2]。免疫调节肽在某些情形下可以刺激先天和适应性免疫系统的细胞,增强免疫反应,为宿主提供抵抗感染的能力[3],而也有报道表明它们可以抑制免疫反应,从而抑制过敏和炎症[4]。
研究表明,天然来源的免疫调节肽安全可靠、有效且成本较低[5]。20 世纪80 年代以来,免疫调节肽逐渐成为热门研究,主要集中在提取工艺、结构鉴定和作用机理等。免疫调节肽的来源较为广泛,涵盖了动物源以及植物源等。其中以动物蛋白源的免疫调节肽占据了重要的地位,因为这类免疫调节肽具有极高的可食用安全性、良好的营养等特性以及广阔的发展前景。到目前为止,研究人员已从动物源蛋白中鉴定出许多具有免疫活性的肽段,如鸡胸骨软骨中的P3-2-4肽段,鲍鱼内脏中的AVPP 肽段等[6]。目前用于制备动物蛋白源免疫调节肽的原材料主要来自禽蛋、海洋动物、乳蛋白、哺乳动物、昆虫以及其他动物等。此外,免疫调节多肽可能还具有其它活性,如:抗炎、抑菌、抗癌等[7]。
研究者在动物蛋白源免疫调节肽的提取纯化、鉴定和表征、结构和功能等方面开展了大量研究,其免疫机制的相关研究相对分散、仍不明确[8]。因此,本文对动物蛋白源免疫调节肽的构效关系、免疫作用机制和不同动物蛋白源免疫调节肽的研究进展进行了综述。
1 免疫调节肽的构效关系及作用机制
1.1 免疫调节肽的构效关系
免疫调节肽的活性与其结构有着密不可分的关系,其中,氨基酸组成、末端氨基酸、链长、总分子质量、排列顺序、疏水性和空间结构等都会影响其生物活性[9]。
疏水性氨基酸能增强多肽的免疫调节活性,可能是通过增强了肽和细胞膜之间的相互作用来调节下游信号通路[10-14]。多数免疫调节肽含有疏水性氨基酸,如Li 等[13]从家蚕蛹蛋白水解物中分离出免疫调节肽DHAV,在这个多肽氨基酸序列中,一半的氨基酸是疏水性氨基酸(Ala 和Val)。何小庆[12]从波纹巴菲蛤中筛选得到的二肽TL 中含有疏水性氨基酸色氨酸(Trp)和亮氨酸(Leu)。此外,Cao 等[15]解析鸡胸骨软骨II 型胶原中的免疫调节肽P3-2-4结构发现,氨基酸组成中带有较多的谷氨酸、精氨酸,亦对免疫调节活性起着重要的作用。在肽的N 端或C 端区域内富含精氨酸的多肽,还可以与T 细胞膜进行受体识别,进而使T 细胞产生淋巴因子[16],起到免疫调节的作用。
带电荷的肽类似于趋化因子,可以结合免疫细胞的受体,激活免疫反应[17]。研究发现,肽段在相同pH 条件下,阴离子肽和阳离子肽对不同组分电荷的影响不同。负电荷部分对诱导型一氧化氮合酶(iNOS)活性的促进作用与动物蛋白水解产物相同,而正电荷部分对iNOS 的免疫调节作用较小[18-19]。Abachi-Hokmabadinazhad[18]在pH 为3 的实验条件下,利用电渗析-超滤法(EDUF)分离出大西洋鲭鱼免疫调节肽(pH3 EDUF),发现该多肽的负电荷部分具有最显著的免疫调节作用。此外,Lebetwa 等[20]发现酪蛋白肽(CPPIII)的负电荷部分还具有抗病毒活性。而正电荷部分可通过与阴离子细菌膜的静电相互作用,导致细菌死亡[21],进而对免疫系统有调节作用。
分子质量是与免疫调节活性相关的重要参数之一[22]。大多数免疫调节肽的分子质量小于2 ku[23-26],主要原因是分子量较小的肽(2~10 个残基)溶解性更好,并能与酶活性位点有效协调,还能够通过肠道屏障,并直接影响体循环中免疫细胞[27]。例如,Narayanasamy 等[24]从蟹腿肌肉中分离的低分子量肽,序列为LGLGAAVL(713.456 Da),可抑制COX-2 的表达,从而得知该多肽具有潜在的免疫调节活性。牦牛骨水解物中含有高比例的低分子量免疫调节肽YBHs(<2000 Da),可使血清总蛋白和白蛋白浓度升高,证明YBHs 能减缓环磷酰胺(CTX)诱导免疫抑制小鼠的免疫功能下降[26]。
随着生物信息学的发展,根据上述多肽的结构特征预测其是否具有免疫调节活性与其在生物体内吸收、分布、代谢、排泄等生理性质[28]。如利用PeptideCutter、ProtParam、Blast 和BIOPEP-UWM 等分析平台对已知蛋白序列进行模拟酶切[2,29]。综上,大部分具有免疫调节作用的动物蛋白源肽由2~10 个氨基酸组成,且具有疏水性。虽然不同来源的免疫调节肽的结构或活性都存在差异,但是仍然为新型免疫调节肽的发掘与活性研究提供了指导意义。
1.2 免疫调节肽的作用机制
1.2.1 免疫调节肽对先天性免疫的影响 大量研究表明,先天免疫是非特异性的,主要通过机体的天然屏障、生理学防御、细胞或炎症因子提供第一道防御[30]。而巨噬细胞、树突状细胞和自然杀伤细胞是为先天免疫系统发挥作用的主要细胞群[31]。
巨噬细胞由血液中循环的单核细胞祖细胞经血管壁迁移到组织后分化而成[32],主要作用是吞噬病原体和死亡或垂死的细胞。不同的细胞因子还可激活巨噬细胞,使其分化为M1 和M2 两种表型[33]。研究发现,醋蛋中的三种免疫组分(SVE、FVE 和VVE)可诱导人单核细胞(U-937)分化成M1 表型的巨噬细胞[34]。Gu 等[35]从岩鲷中合成了多肽BO18,BO18能增强巨噬细胞的呼吸爆发能力。从青蛤提取的多肽SCSP 能增强巨噬细胞的吞噬能力[36]。Szmyt等[37]人工合成的蛋黄肽可激活巨噬细胞并使其分泌TNF-α。不仅如此,免疫调节肽还能促使巨噬细胞迁移,如Hu 等[38]从水蛭中分离得到了序列为EAGSAKELEGDPVAG 的寡肽,发现水蛭肽激活c-Junn-末端激酶(JNK)抑制剂和p38 丝裂原活化蛋白激酶(p38 MAPK)抑制剂,从而降低了巨噬细胞的抗迁移能力。冯挺等[39]提取的蜂毒肽可增强单核巨噬细胞的吞噬功能,以实现对肿瘤细胞的杀伤作用。但当免疫反应过度激活时,马蝇唾液腺中的HA 可以抑制几个单核-巨噬细胞表面标记物(CD115,IRF-8,pu1 和EGR-1)的mRNA 水平,从而降低巨噬细胞的过度激活[40]。
树突状(DC)细胞是机体功能最强的专职抗原递呈细胞,通过激活初始T 淋巴细胞调控并维持免疫应答的中心环节[41-42]。研究发现,多肽LL-37 可在体外诱导DC,进而显著上调吞噬细胞的吞噬能力,并释放相关免疫因子[43]。Kim 等[44]发现了中华稻蝗的免疫组分(命名为Ocs-P),Ocs-P 能诱导DC 的表型改变,刺激辅助T 细胞(Th 细胞)和细胞毒性T 细胞(Tc 细胞)产生。
自然杀伤细胞又称为NK 细胞,是机体重要的先天免疫细胞。NK 细胞是具有抗肿瘤、抗病毒和免疫调节作用的免疫细胞,但是在某些情况下参与超敏反应和自身免疫性疾病的发生[45]。从牦牛骨中提取的多肽YBHs 可通过增加NK 细胞活力来调节小鼠的细胞免疫功能[26]。不仅如此,王敏等[46]研究鲍鱼水解肽(AHP)对小鼠NK 细胞的影响,发现阴性对照的NK 细胞活性为32.92%±5.81%,低中高剂量的NK 细胞活性分别为(38.58%±6.33%、42.34%±6.47%和45.69%±7.38%),证明AHP 能显著提高NK 细胞活性,使NK 细胞对T 淋巴细胞的应答性增强,从而提高机体的免疫功能。
1.2.2 免疫调节肽对适应性免疫的影响 当先天性免疫中的细胞无法迅速应对病原体侵袭时,适应性免疫系统将被激活[47]。适应性免疫,可分为细胞免疫和抗体介导的体液免疫[48-49]。巨噬细胞分泌细胞因子进行免疫调节,属于体液免疫的一种。当细胞受到刺激或损伤时,细胞会释放细胞因子,从而影响细胞生长、活化、炎症、免疫、组织修复或组织纤维化[34]。免疫调节肽不仅可以通过产生促炎细胞因子激活巨噬细胞,如青蛤中的多肽SCSP[36];同时还通过释放抗炎细胞因子抑制巨噬细胞的过度激活,如马蝇中的HA[40]。具体来说,Li 等[14]发现的牡蛎多肽DNSIAMESMK(P1)和LLQLGSGR(P2)和He 等[50]发现的鸭蛋卵清酶解物PH,均能诱导巨噬细胞产生一氧化氮(NO)、肿瘤坏死因子α(tumor necrosis factorα,TNF-α)和白细胞介素-6(interleukin-6,IL-6)。类似的,牡蛎寡肽[51]可诱导RAW264.7 巨噬细胞TNF-α和IL-6 的产生,在免疫反应中发挥关键作用。Adams等[52]发现发酵乳中某β-酪蛋白源的多肽可诱导巨噬细胞产生IL-8 和IL-1β。欧洲鳗鲡中的EP[53]可增加巨噬细胞中iNOS 的mRNA 水平、蛋白水平,进而使iNOS 产生NO。Sutthiwanjampa 等[4]发现在文蛤酶解组分BVH 浓度分别为0.5、1、5 mg/mL 的情况下,可刺激包括TNF-α、IL-1β、IL-10、IL-12 在内的其他细胞因子mRNA 表达。但是过度的免疫反应会导致炎症。免疫细胞不受控制地产生促炎细胞因子(如NO、PGE2、TNF-α[54]、IL-1β和IL-6[25,55])会导致组织损伤和免疫功能丧失[19]。Wang 等[56]从白鳞鱼鲨鱼中分离复合肽(SCP),得知SCP 抑制血清中TNF-α、IL-6、IL-8 和NO 的水平,在脂多糖(LPS)刺激的小鼠中表现出明显的抗炎活性。
同时巨噬细胞或DC 细胞将抗原传递给B 淋巴细胞与T 淋巴细胞,可进入细胞免疫阶段[49]。B 细胞和T 细胞均在适应性免疫中发挥着重要的作用。B 细胞主要分布在淋巴结和脾脏中。当B 细胞受到特异性抗原刺激时,通过同型转换机制能够分化成为浆细胞,浆细胞可产生抗体,主要包括免疫球蛋白A(IgA)、IgG 和IgE[32]。Li 团队[57]发现阿拉斯加鳕鱼肽APP 可增强IgA+B 细胞的最终分化,促进浆细胞分泌,增加IgA 含量,从而提高机体免疫。然而,IgE 的过量会导致过敏反应。IgE 与两个主要高亲和力受体(FcεRI 和FcεRII)结合,这种相互作用导致了致敏状态,使肥大细胞会释放化学介质[32],从而刺激记忆B 和T 细胞反应,放大2 型辅助型T 细胞(Th2)和IgE 反应[58-59]。Th2 细胞会分泌IL-4、IL-5 和IL-13[32]。而口服酪蛋白磷酸肽(P-CPP)[60]可减轻IgE 介导的过敏反应,发挥免疫调节作用。
大多数T 细胞可根据其表面分化抗原簇(CD)分子的表达分为CD4+或CD8+两个亚群[61]。CD4+T 细胞的功能主要是传递抗原信息,并辅助其他免疫细胞进行免疫活动[62]。CD8+T 细胞可以杀死被病毒感染的细胞或有可能导致癌症的突变细胞[61]。由蜂毒、蛇蛉中提取的免疫调节肽可刺激CD4+T 细胞和CD8+T 细胞产生γ干扰素(IFN-γ)[39,44]。
1.2.3 免疫调节肽参与免疫调节作用的其他作用机理 免疫调节肽不仅能够通过细胞免疫和体液免疫来平衡免疫功能,还通过胞内外信号转导途径来完成免疫反应[2]。研究表明,免疫调节肽发挥作用主要与核因子激活的B 细胞的κ-轻链增强(NF-κB)通路和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路有关[19]。He 等[50]发现鸭蛋卵清蛋白酶解物PH 能通过与Toll 样受体(TLR)2 和TLR4 相互作用,激活NF-κB 和MAPK 通路;Sutthiwanjampa团队[4]发现文蛤水解组分BVH 通过刺激巨噬细胞活化,使磷脂酰肌醇-3 激酶(PI3K)激活蛋白激酶B(Akt)参与调节MAPKs(p38、ERK 和JNK),进而刺激各种细胞因子(TNF-α、iNOS 等)的产生;Hall等[63]发现蟋蟀蛋白水解物CPHD 通过抑制NF-κB mRNA 水平的激活发挥抗炎作用。此外,Yao 等[53]发现欧洲鳗鲡中的多肽EP 可诱导IκB(NF-κB 的抑制剂)磷酸化,从而导致巨噬细胞中p65、p38、JNK和ERK 磷酸化增加。
Feng 等[64]在鸟类中枢体液免疫器官法氏囊(BF)中分离到了一种多肽(BSP-I),通过增强凋亡诱导因子Bax 蛋白表达,增加抗肿瘤蛋白p53 的表达导致细胞凋亡,诱导细胞产生IFN-γ和IL-4,从而抑制肿瘤细胞增殖。Ji 等[65]纯化了从以色列暗褐中分离到蝎毒肽Smp76,发现其激活干扰素调节因子3(IRF3)磷酸化,上调β干扰素(IFN-β)的表达,增强I 型干扰素(IFN)反应从而抑制病毒感染。此外,冯挺等[39]发现蜂毒肽能激活磷脂酶A2(PLA2),且肽段与PLA2 与肿瘤细胞相互作用后,可水解肿瘤细胞膜Band-3 蛋白,即具有抗癌作用。
综上所述,免疫调节肽可通过多种路径发挥作用(图1)。由于机体的整体免疫调节能力是多种因素综合作用的结果[23],不同动物蛋白来源的免疫调节肽往往表现出不同的作用,如激活免疫细胞的功能,促进各种细胞因子的分泌等。这些免疫调节肽究竟是如何发挥作用的分子机制,其构效关系值得进一步探索。
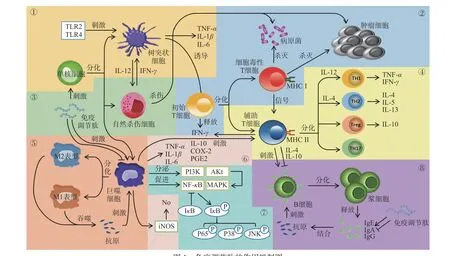
图1 免疫调节肽的作用机制图Fig.1 Mechanism of immunomodulatory peptides
2 不同动物蛋白源的免疫调节肽
2.1 禽及禽蛋类来源的免疫调节肽
禽类多肽具有免疫调节作用,可能有助于刺激机体免疫反应和预防微生物感染[66],在食品工业和医学治疗中发挥重要作用。Yu 等[67]发现5%鸡肌肉酶解肽可使大鼠脾脏有较高比例的巨噬细胞、树突状细胞及较低比例的抗原呈递细胞,进而表现对幼龄健康大鼠有免疫调节作用。此外,研究人员发现羽毛、骨头等家禽的副产物中也可以得到相应的免疫调节肽,不仅可以提高这些副产物的附加值,还可以有效缓解副产物的环境污染。Sukaboon 团队[22]从鸡羽毛粉水解物中鉴定了一种序列为SNPSVAGVR(885.97 u)的多肽,该多肽降低了脂多糖诱导的RAW 264.7 细胞中促炎细胞因子iNOS、TNF-α、COX-2和IL-6 的基因表达。Cao 等[15]从鸡胸骨软骨II 型胶原(CII)中分离免疫调节肽,发现P3-2-4组分(RGQ LGPM)促进淋巴细胞增殖活性最高(85.54%),与人白细胞抗原DRB1(HLA-DRB1)分子的结合能力最好,也是一种有较高免疫状态的多肽。
禽蛋类免疫调节肽具有巨大的研究潜力[15]。鸡蛋可以降低44%~61%的大鼠结肠损伤,对预防和治疗肠道损伤具有一定的治疗价值[68]。不仅如此,鸡蛋中免疫调节肽还具有抗癌作用,可诱导癌细胞凋亡,预防DNA 损伤,降低癌细胞的侵袭能力,并在各种癌细胞株中表现出细胞毒性和抗诱变活性[9]。而且,鸡蛋多肽可以调节细胞因子(TNF-α、IL-1β、IL-6、IL-8、IL-10 和IL-12)的产生,并影响多种细胞系中炎症介质(NO、PGE2、iNOS、COX-2)的产生[69]。就蛋类的不同部位而言,大部分卵黄多肽,都可促进细胞因子和NO 的分泌,因此可以作为治疗免疫紊乱的天然活性物质[69]。Szmyt 等[37]利用优化后的大肠杆菌人工合成了蛋黄肽复合物,产率约为1.1 mg/L,其免疫活性可与天然蛋黄肽复合物相媲美。该多肽通过刺激TNF-α和IL-10 的产生和诱导NO 表达而具有免疫调节活性。此外,由卵转铁蛋白衍生的Ile-Arg-Trp 和Ile-Gln-Trp 可以通过调节结肠内微生物组成来改善肠道健康,缓解结肠炎症[70]。卵转铁蛋白衍生肽在食品工业中作为抗微生物补充剂,在医药工业中作为抗癌、抗病毒和金属补充剂具有很大的潜力。现已有大量研究证实蛋源多肽具有调节免疫的功能,相比之下对禽类的免疫活性组分的研究较少;因此研究禽类免疫调节肽的结构与活性之间的关系显得尤为重要。
2.2 海洋动物来源的免疫调节肽
海洋动物有着丰富的蛋白质(10%~47% w/w)[6],通过酶解和细菌发酵生成的多肽具有多种功能和生物活性,包括抗氧化、降血压、增强免疫力、抗炎和神经保护作用等[8,25]。目前为止,研究人员对鳕鱼、海藻、牡蛎和贻贝类等来源的免疫调节肽研究较多,这些免疫调节肽均显示出广泛的调节免疫功能。阿拉斯加鳕鱼肽(APP)中纯化得到两个具有较高免疫活性的肽段,分别是Gly-Val-Ile-Lys 和Ala-Cys-Asn-Gly-Arg,可保护环磷酰胺(Cy)引起的肠道屏障破坏[57]。Yao 等[53]从欧洲鳗鲡中分离得到了诱导NO 活性最强的Fr-1-1,可以激活巨噬细胞,进而提高免疫力。Narayanasamy 等[24]从蟹腿肌肉中分离了一种低分子量肽CL。用MTT 法测定在CL 刺激下LPS 诱导RAW264.7 细胞的细胞活力,在CL 浓度为50 μg/mL 时,最大细胞活力为81.2%±0.98%,证明CL 可刺激巨噬细胞的激活。Sutthiwanjampa等[4]研究文蛤酶解组分BVH 的免疫调节活性,发现在BVH 浓度在0.5~5 mg/mL 范围内,可通过激活PI3K/Akt 和NF-κB 通路刺激RAW 264.7 细胞,从而刺激NO 以及其他细胞因子的产生,发挥免疫调节活性。青蛤水解产物中纯化得到的免疫调节肽SCSP 可以通过激活NF-κB 信号通路刺激巨噬细胞活性[8]。Rathnapala 等[70]研究发现加州海螺的毒素肽可促进T 淋巴细胞增殖和Th1、Th2、Th17 和Treg细胞的分化。与此同时,海产品在加工过程中会产生大量的副产物,如鱼皮、鱼骨、鱼头和内脏。这些副产物通常会丢弃或降级生产饲料。因此利用低成本的海洋动物副产物开发免疫调节肽等活性成分,用于功能食品、保健品以医药和化妆品,可提高附加值[8],在功能性食品和营养食品行业具有潜在的应用前景[21]。Chataigner 等[71]利用海洋副产物作为原料进行酶解。研究发现,酶解液降低了促炎细胞因子IL-6、IL-1β和TNF-α的mRNA 表达量,因此该酶解液可作为一种潜在预防和抵消神经炎症的保健品来源。类似地,鲍鱼内脏蛋白肽AVPP 可以从细胞免疫、体液免疫、非特异性免疫、免疫器官等多方面调节小鼠免疫功能[46,72]。海洋动物拥有独特的生活环境,蛋白含量丰富,且蛋白质氨基酸组成不同于陆生动物,目前已从蛤类等甲壳类软体动物、海洋鱼类等海洋动物蛋白中提取得到免疫调节肽,但是仍然有很多具有潜力的海洋动物及其加工过程中副产物资源未得到充分开发利用,值得进一步挖掘。
2.3 乳蛋白来源的免疫调节肽
乳是一种优质蛋白质来源,乳蛋白来源的物质大都具有免疫调节能力,包括牛αs1-酪蛋白、牛αs2-酪蛋白、牛β-酪蛋白、乳清蛋白及其多肽[73],能促进淋巴细胞增殖、激活巨噬细胞、刺激抗体合成和细胞因子表达[74]。Zabłocka 等[75]从羊或牛的初乳中提取了富含脯氨酸的多肽复合物(PRP),该多肽可诱导细胞因子的分泌和外周血白细胞的增殖。而由驴乳蛋白提取的免疫调节肽能够促进脾淋巴细胞增殖,增强巨噬细胞的吞噬作用以及促进免疫球蛋白的合成,从而增强免疫系统对病原菌的抵抗能力[76]。
乳蛋白包括乳清蛋白和酪蛋白。研究人员用胃蛋白酶和胰酶体外消化获得初乳乳清蛋白水解物(CWP),处理MDA-MB-231 细胞,该细胞早期凋亡率由10.82%提高至21.85%,血液单核细胞吞噬活性显著增强了20%,该结果证实了CWP 可增强免疫细胞增殖和活化,有治疗癌症等慢性疾病方面的潜力[77]。酪蛋白的初级结构含有若干具有生物活性的氨基酸序列[78]。Lebetwa 等[60]通过给OVA 致敏小鼠灌食含0.05%酪蛋白水解物P-CPP 的饲料,6 周后发现P-CPP 可以使血清中总IgE 抗体水平降低12%(P<0.05),使脾脏中T 卵泡辅助细胞(Tfh)的数量由7.1%±0.5%增加至9.7%±0.6%,这表明CPP 的磷酸化可以缓解过敏原特异性IgE 调节的致敏反应。
酪蛋白来源的多肽还可以通过微生物发酵获得[78]。Adams 等[52]发现利用LAB 菌株发酵酪蛋白而产生的多肽可以诱导IL-10 和NO 产生。类似地,用保加利亚乳杆菌PrtB92059水解酪蛋白发现其水解产物(包含β-CN)具有免疫调节活性[79]。而费氏丙酸杆菌CIRM-BIA 129 发酵乳制品产生的多肽可以保护免疫调节蛋白不被消化蛋白分解,以调节肠道免疫系统[80]。由奶牛和牦牛奶制成的乳山奶酪和奶扎奶酪可鉴定出309 和225 个肽段,其中45%的肽段具有免疫调节特性[81]。乳蛋白是最早用于制备免疫调节肽重要的蛋白来源之一,即便已经开展了大量的科学研究,但在产业发展上仍然任重而道远。
2.4 哺乳动物来源的免疫调节肽
猪、牛、羊等常见哺乳动物的肉制品大都直接食用。近年来一些药用哺乳动物来源的免疫活性肽得到研究人员关注,如养殖鹿源蛋白。汪涛[82]从鹿皮中通过液质联用(HPLC-MS)鉴定出8 个具有较高免疫活性的氨基酸序列。而张凯月则从鹿胎中经分离鉴定出9 种鹿胎寡肽[83],为进一步研究鹿来源多肽的免疫机制奠定基础。此外,肉制品加工过程中的副产物通过制备高附加值的免疫调节肽等活性物质,不仅提高了产品的利用率,同时也改善了环境。Gao等[26]利用牦牛骨水解物(YBHs)进行灌胃小鼠后,发现其白细胞、免疫球蛋白(lgA、lgG)、细胞因子(IL-1β、IL-6 和TNF-α)浓度及免疫细胞(脾脏淋巴细胞、NK 细胞)均有升高,表明YBHs 可通过增加先天免疫和适应性免疫来预防或改善免疫抑制,并可能对肠道菌群具有潜在的益生作用。现阶段为了生产哺乳动物源的免疫调节肽,通常选择其肌肉作为蛋白质来源。实际生产过程中利用皮肤、骨骼和血液等加工副产品作为免疫调节肽的制备来源,提高产品附加值,将具有更大的经济效益和研究价值。
2.5 昆虫类来源的免疫调节肽
昆虫多肽是昆虫蛋白经诱导产生的具有多种生物活性的小分子物质[84],部分具有免疫活性。例如,家蚕体内富含甘氨酸的免疫调节肽(BMGlvA2),BMGlvA2 可以有效减少小鼠脾的损伤、坏死以及脾脏内淋巴细胞和巨噬细胞的数量,还可以显著降低炎症小鼠体内的炎性细胞因子IL-1β、IL-6 和TNF-α的表达,从而进行免疫调节[85]。孙瑞坤[86]从方格星虫蛋白中鉴定了2 种具有免疫调节作用的氨基酸序列,分别为Phe-Lys(FK)和Phe-Gln(FQ),这两种多肽均可增强小鼠细胞免疫功能、体液免疫功能、巨噬细胞功能和NK 细胞活性。蜂蛹多肽处理小鼠巨噬细胞RAW264.7,可通过激活MAPK 信号通路从而增强其免疫活性[87]。Ji 等[65]从以色列暗褐蝎中分离到蝎毒肽Smp76,该多肽对登革热病毒(DENV)和塞卡病毒(ZIKV)有明显的抑制作用,具有独特的机制,涉及I 型干扰素反应,可以作为一种增强宿主固有免疫的替代治疗。考虑到安全性,这些昆虫来源的免疫调节肽仍需要更深入的实验进行验证。
2.6 其他动物来源的免疫调节肽
在两栖动物中,研究员发现从青蛙皮肤提取的多肽具有抗菌和免疫调节活性[88]。在林蛙油肽OR 中发现了具有免疫增强功能的多肽,主要体现在OR 可显著增强肝巨噬细胞的吞噬能力和自然杀伤细胞活性;然而OR 对淋巴细胞增殖、腹膜巨噬细胞吞噬能力和免疫器官指标影响较小[89]。此外,王洁[90]发现林蛙骨肉小肽可以促进RAW264.7 细胞分泌TNF-α和IL-2,进而具有增强免疫的作用。尽管如此,这些新型免疫调节肽仍需要通过临床试验进行验证,以期为拓展动物资源高值化利用及开发新型免疫调节剂提供理论基础。
从动物蛋白水解物中分离鉴定出的免疫调节肽如表1 所示。

表1 动物蛋白源免疫调节肽的来源、功能、机制列表Table 1 Source, function and mechanism of food protein-derived immunomodulatory peptides
3 展望
由于具有安全、高效、成本较低等优势,动物蛋白源免疫调节肽受到广大科研人员的关注。免疫调节肽可以通过与代谢物的直接相互作用、改变酶的活性或基因表达、改变溶解度和促进微生物细胞膜穿孔等多种方式发挥其生物活性;但动物蛋白源免疫调节肽的开发仍然有较大的空间。目前制备动物蛋白源免疫调节肽的主流方法是酶解法,因其酶切位点的随机性和不确定性,导致工业化生产分离纯化免疫调节肽的成本增加;免疫调节肽在分子结构与生物功能关系的研究上仍处于基础阶段,明确免疫调节肽的关键作用位点和机制依旧任重道远;此外,从动物蛋白中提取的免疫调节肽,其免疫活性大多在细胞或动物模型中得以证实,缺乏更多临床研究的依据,从而阻碍了人类营养健康产品开发的进程。
综上,未来动物蛋白源免疫调节肽的研究可从以下几点出发:a.在传统提取工艺的基础上创新、优化纯化免疫调节肽的技术;b.继续深入探究这些免疫调节肽的分子作用机制,分析其构效关系,同时开发简便有效的免疫活性评价方法,这可以为未来免疫调节肽的研究提供便利;c.在临床研究上,须对免疫调节肽进行活性检测和安全性评估,进一步明确其吸收、迁移、靶向和胃肠道稳定性等相关问题,以便更好地用于功能食品、医药领域。
