海洋寡糖酶法制备研究进展
2023-09-10杨子祥李金梦宋琨燕葛风茹鄢烽黄冰冰张梦岩巫小丹刘玉环郑洪立南昌大学食品学院江西南昌330047
杨子祥,李金梦,宋琨燕,葛风茹,鄢烽,黄冰冰,张梦岩,巫小丹,刘玉环,郑洪立(南昌大学食品学院,江西南昌 330047)
海洋占地球总面积约71%,海洋占地球全部水资源的97%,海洋中生物资源丰富,种类繁多。海洋多糖是海洋生物资源中最主要的组成成分之一。由于海洋高盐、高渗透压、低温、低光照、寡营养、氧胁迫的特殊环境,形成了结构新颖和功能独特的海洋多糖[1]。近年来,随着人们对海洋资源的研究不断深入,发现海洋多糖具有调节免疫、降血糖、抗病毒、抗肿瘤等多种生理活性,这使其越来越广泛地应用于食品、医药、化妆品等领域[2]。然而,由于海洋多糖分子量大、结构复杂,导致了海洋多糖溶解性能差,严重限制了其应用[3]。
海洋寡糖,也叫海洋低聚糖,是海洋多糖经过各种方法(物理法、化学法、酶法等)降解得到的直链或支链低度聚合糖,通常由2~10 个单糖单元组成。较海洋多糖,海洋寡糖具有溶解性能好、生理活性高、更具多样性等优势,是二十一世纪糖类研究的热点。由于海洋寡糖原料海洋多糖结构和组成的多样性,外加海洋寡糖有不同的制备方法,故海洋寡糖结构和生理活性更具多样性[4]。海洋寡糖具有抑制肿瘤、抗氧化、免疫调节等生理活性,安全无毒,溶解性能好,广泛应用于食品、农业、医药等领域[5]。海洋寡糖具有糖醇类似的功能性甜味,且热量较低,可用作食品甜味剂。此外,海洋寡糖难以被人体消化,可满足糖尿病患者的需要。海洋寡糖是一种新型益生元,具有改善肠道微环境的作用[6]。海洋寡糖因具有促进植物生长、增强植物抗逆性、防治病害等作用,被广泛应用到农业生产中。海洋寡糖可以通过刺激和激活宿主细胞的免疫功能,增强机体对肿瘤细胞生长的调控,从而实现抗肿瘤的作用[7]。
海洋寡糖的生物活性主要与其分子结构相关,分子结构主要受海洋多糖的种类、海洋寡糖制备方法、制备海洋寡糖的酶等因素影响,而制备结构新颖、聚合度明确的海洋寡糖,对于海洋寡糖的应用具有重要意义。本文综述了海洋多糖、海洋多糖酶法制备海洋寡糖和酶的催化机制,介绍了褐藻胶、壳聚糖和黄原胶三种主要的海洋多糖及褐藻胶裂解酶、壳聚糖酶和黄原胶降解酶的作用机制,并指出其存在的问题及今后的研究重点,以期为海洋寡糖制备及其应用提供理论依据。
1 海洋多糖
海洋多糖种类繁多(表1),包括海藻多糖、海洋动物多糖和海洋微生物多糖等[8]。海藻多糖是广泛存在于海带、马尾藻、昆布等植物中的天然活性多糖,多具有高粘度或凝固能力。海洋动物多糖是指海洋动物(虾、贝类、螃蟹、鲨鱼、海参等)中的多聚糖及酸性粘多糖,主要包括壳聚糖、糖胺聚糖、硫酸软骨素等。海洋微生物多糖是指海洋中的微生物代谢的多糖,分为胞外多糖、胞壁多糖和胞内多糖。我国海洋多糖资源丰富,已广泛应用于各领域,如褐藻胶作为增稠剂、分散剂、乳化剂等应用于工业生产中[9]。随着越来越多海洋多糖资源的发掘以及海洋生物技术的发展,如利用工程细菌发酵生产海洋多糖,将不断丰富海洋多糖资源。众多的海洋多糖为海洋寡糖的制备提供了丰富的原料资源[10]。生产寡糖较多的海洋多糖原料有黄原胶、壳聚糖、琼脂、卡拉胶、褐藻胶、岩藻聚糖等。我国是世界最大的褐藻胶(海藻酸钠)生产国[11],壳聚糖是地球上年产量仅次于纤维素的天然高分子化合物[12],黄原胶是目前世界上生产规模最大的微生物多糖[13],故本文选取褐藻胶、壳聚糖和黄原胶为代表性海藻多糖、海洋动物多糖和海洋微生物多糖进行研究。

表1 海洋多糖Table 1 Marine polysaccharides
1.1 褐藻胶
褐藻胶又叫褐藻酸,分子量介于20~250 kDa 之间[20]。褐藻胶是广泛存在于海带、巨藻、马尾藻等褐藻细胞壁和细胞质间的一种海藻多糖,在天然状态下主要以游离酸、一价盐和二价盐的形式存在。β-D-甘露糖醛酸(M)和α-L-古洛糖醛酸(G)以1→4 糖苷键构成线性多糖即为褐藻胶[20]。以上线性多糖有均聚甘露糖醛酸(PM)、均聚古罗糖醛酸(PG)和杂聚物(PMG)三种排列方式[21](图1)。这两种糖醛酸的比例因褐藻种类的不同而有很大差异,这种结构的多样性可能是由于褐藻对环境或生理条件的功能适应性[23]。早在1881 年,英国的化学家Stanford 首次在褐藻中发现并成功分离出褐藻胶[24]。目前市售的褐藻酸钠(又叫海藻酸钠)是以海带等为原料,采用稀碱溶液提取法制备得到。褐藻酸钠具有抗氧化性、抑菌性、抗肿瘤、降胆固醇等生理活性,用作食品添加剂、医学领域的支架材料、农药化肥增效剂等[25-27]。褐藻中褐藻胶的含量最高可达藻体干重的40%[28]。褐藻胶为亲水性分子,褐藻酸与碱金属离子生成褐藻酸盐,易溶于水。褐藻胶的溶解性受PM、PG 和PMG的排列方式、M/G 的比例、溶液离子强度、pH 等的影响[21,23]。褐藻胶为酸不溶性,在pH 低于3 时,会转变为褐藻酸而析出[23]。

图1 褐藻胶的结构式[22]Fig.1 Structural formula of alginate[22]
1.2 壳聚糖
壳聚糖是一种广泛存在于虾、螃蟹、贝壳等海洋节肢动物的甲壳以及海洋软体动物的壳和骨骼中的海洋动物多糖,纯天然有机大分子,是甲壳素脱去乙酰基而成。壳聚糖也是目前大自然中发现的独一无二带正电荷的大分子碱性多糖[29]。它的基本糖单元为氨基葡萄糖或乙酰氨基葡萄糖(图2),起连接作用的键为β-1,4-糖苷键。壳聚糖的单体为β-(1→4)-2-氨基-2-脱氧b-d-葡聚糖和β-(1→4)-2-乙酰氨基-2-脱氧-b-d-葡聚糖,分子量介于10~1 000 kDa 之间;壳聚糖溶于稀酸,不溶于水和有机溶剂;壳聚糖在稀酸中的溶解性与其脱乙酰度呈正相关[30]。它的表面含有大量的氨基、羟基等活性基团,可以发生烷基化、酰基化、羧基化等多种化学反应,能与碳水化合物等阴离子或高分子化合物形成具有不同性能的壳聚糖衍生物。壳聚糖有免疫调节[31]、防治高血压[32]、抗肿瘤[33]等生理活性,可自然降解,已在食品、医疗等领域产业化应用。

图2 壳聚糖的结构式[30]Fig.2 Structural formula of chitosan[30]
1.3 黄原胶
黄原胶,又称为黄胶、汉生胶。它是海洋微生物代谢的一种水溶性胞外多糖。黄原胶分子(图3)是由D-葡萄糖、D-甘露糖和D-葡糖醛酸组成。以上三种成分按2:2:1 组成相对分子量在1000 kDa 以上的天然有机高分子化合物[19]。黄原胶一级结构含葡糖基主链和三糖单位的侧链,葡糖基主链与纤维素主链结构相同,即β-1,4-糖苷键连接两分子D-葡萄糖;1 分子D-葡糖醛酸和2 分子D-甘露糖在侧链中交替排列,与主链相连的甘露糖在C-6 处被乙酰化,丙酮酸部分替代侧链末端的甘露糖,并以缩醛形式连接在4-和6-位置;其二级结构为双螺旋结构,在氢键作用下,侧链反向缠绕主链而形成;其三级结构为螺旋复合体,在共价键的作用下,由二级结构基础上形成,正因这种特殊的化学结构,使黄原胶溶液具有良好的耐盐性、耐酸耐碱性、协同凝胶特性、独特的流变性等[13]。因此,黄原胶作为增稠剂、稳定剂等在食品工业、医药行业等大范围使用。黄原胶是目前世界上生产规模最大的微生物多糖[13]。
2 酶法制备海洋寡糖
海洋寡糖的制备方法主要有化学法、物理法和生物酶法(表2)。化学法是通过化学催化剂如草酸、过氧化氢、氢氧化钠等催化海洋多糖生成寡糖的方法,化学法应用广泛,操作简便,是一种成熟的方法。但它存在化学催化剂污染环境、反应条件剧烈、副产物量大等缺点[34-36]。物理法(微波辐射、紫外线照射、高温高压等)操作简便、不需要催化剂,但存在降解效率低下、海洋寡糖得率低等问题[37-39]。生物酶法条件温和、酶专一性强、海洋寡糖得率高、不产生副产物、环境友好,是制备海洋寡糖的有效方法[40-42]。早期生物酶法制备海洋寡糖以游离酶法为主,目前生物酶法制备海洋寡糖主要采用固定化酶法。游离酶法和固定化酶法通常均采用单一酶,而不是复合酶[40-46]。当前酶法制备得到的海洋寡糖主要有:壳寡糖[6]、褐藻胶寡糖[7,9,35]、卡拉胶寡糖、黄原胶寡糖、琼胶寡糖等[42]。

表2 海洋寡糖制备方法Table 2 The preparation methods of marine oligosaccharides
2.1 游离酶法制备海洋寡糖
游离酶法制备海洋寡糖是以海洋多糖为原料。海洋多糖种类众多,而酶催化具有高度专一性,故制备海洋寡糖的酶种类众多;包括一类是降解特定的海洋多糖如褐藻胶裂解酶、壳聚糖酶、黄原胶降解酶、卡拉胶酶、琼胶酶等,另一类降解非特定的海洋多糖,如:淀粉酶、纤维素酶、果胶酶、木聚糖酶、甘露糖酶等,以上酶主要来自微生物。酶法制备海洋寡糖始于上世纪50 年代中后期,其目的主要是为了研究海洋寡糖的结构与构效关系以开发药物和功能性制品。经过多年的发展,利用游离酶制备海洋寡糖已经取得了显著进展;特别在新酶的发现、酶结构、性质与功能的解析、酶的改造、酶催化条件的优化等方面做了大量的研究[40-41,47]。
不同酶作用于不同的海洋多糖,其反应条件和产物不同。Falkeborg 等[27]利用β-褐藻胶裂解酶催化5%褐藻酸钠,反应条件:酶用量5%、温度35 ℃、pH7.0、酶解时间48 h,产物为聚合度不大于4 的寡糖。季珂等[48]以壳聚糖酶催化1%壳聚糖,反应条件:酶用量120 U/g、温度50 ℃、pH6.0、酶解时间4 h,制备得到的寡糖聚合度不大于4。谷金芸等[49]以黄原胶降解酶催化2 mg/mL 的黄原胶,酶解条件:酶用量1 mg/mL、温度45 ℃、pH8.0、酶解时间2 min,得到了黄原胶寡糖聚合度为7~18。同一酶,但不同类型,催化产物也不相同。β-褐藻胶裂解酶和双功能褐藻胶裂解酶AlySY08 制备得到的寡糖聚合度不同。Li 等[50]利用双功能褐藻胶裂解酶AlySY08 催化0.3%褐藻胶,酶解条件:酶用量21.5 U/mg、温度40 ℃、pH7.6、酶解时间8 h,所制备的寡糖聚合度不大于5,寡糖得率超过80%。
游离酶法虽然降解效率高、可制得低分子量的海洋寡糖,但存在酶无法重复利用、易失活以及在均相催化中与底物/产物难以分离等缺点,导致其生产成本提高,使游离酶法制备海洋寡糖在工业生产中严重受到限制[40-43]。
2.2 固定化酶法制备海洋寡糖
固定化酶技术是指使用物理或化学方法将游离酶限定在一定空间内或完全束缚在某种特定的载体上,但仍能保持酶活性的一种生物技术[51]。与游离酶相比,固定化酶对不良环境耐受性更强,同时具有重复利用性、储存稳定性和操作稳定性等优点[46,52]。酶的固定化方法多种多样,主要有吸附法、包埋法、交联法和共价结合法(表3)。吸附法是指将酶分子吸附在纤维素、二氧化硅、活性炭、氧化铝等载体表面从而实现固定化的方法;吸附法成本低、操作简便,但固定化效率低[53]。包埋法是指将酶分子包裹在载体材料中从而实现固定化的方法,常以海藻酸钠、琼脂等为载体材料[54]。酶通过戊二醛、京尼平等试剂交联载体,从而达到固定化的方法称为交联法,交联法常与吸附法联用,提高酶的固定化效率及稳定性,但在交联过程中反应剧烈,使得酶的活性降低,需要不断探索更加温和的固定化工艺来减少酶活损失[55]。共价结合法是指酶分子中的非必需侧链基团(氨基、羧基和巯基等)与载体中的功能基团(环氧基、羟基、羧基等)通过共价键结合,使酶分子固定在载体上的方法[56]。

表3 固定化酶制备方法Table 3 The preparation methods of immobilized enzyme
与游离酶相比,通过与其他载体材料结合,提高了固定化酶的稳定性,且易与底物/产物分离,实现了酶的重复利用,极大地降低了生产成本,因此,固定化酶技术在工业生产中应用前景广阔,从而引发了国内外学者对多糖降解酶固定化的探讨。Jiang 等[57]用四氧化三铁纳米磁性材料为载体,固定化了褐藻胶裂解酶AlgL17,此固定化酶重复使用5 次后,仍能保持最大酶活的70%;利用其催化5 mg/mL 的褐藻胶,得到了聚合度不大于4 的褐藻寡糖。研究人员以戊二醛-琼脂糖固定化了壳聚糖酶,固定化酶重复使用25 次后,仍能保持最大酶活的40%;利用该固定化酶催化20 mg/mL 的壳聚糖,得到的寡糖聚合度不大于20[58]。我国科学家已成功实现了纳米SiO2材料固定化几丁质酶,固定化酶的活力是未固定化酶的70%;该固定化酶可用于催化真菌多糖几丁质产生几丁寡糖[59]。但固定化往往存在降低酶活力,固定化酶只适用于小分子底物等问题;这些问题极大地限制了固定化酶的应用。
固定化酶法展现出很好的应用前景。反应器是固定化酶法制备海洋寡糖的重要载体。反应器可以为固定化酶法制备海洋寡糖提供其所需的最佳催化条件。反应器的设计需要考虑温度、pH、搅拌等参数的控制,还需要考虑物质和能量传递、能耗等因素[62]。目前反应器的运行模式主要有批式、分批补料及连续式。反应器主要有搅拌罐式反应器、膜式反应器、固定床式反应器和流动床式反应器[63]。反应器已经成为固定化酶法制备海洋寡糖效率的关键设备,已受到越来越多的关注。
3 多糖降解酶及其催化机制
目前,酶法制备海洋寡糖的关键是高效多糖降解酶的发掘。近年来,研究者们已经从海洋软体动物、海洋细菌和真菌、土壤细菌和真菌等微生物中分离纯化出多种多糖降解酶,用于海洋寡糖的制备[64]。同时利用色谱法、结晶法、X 射线衍射法、生物信息学方法等,结合突变技术、共结晶技术、基因工程技术等[23,27-28],解析了多糖降解酶结构和功能,初步揭示其催化机制。由于不同海洋多糖其结构和组成存在较大差异,需要采用不同多糖降解酶;此外,由于多糖降解酶来源、酶的组成、酶的分子量、酶的结构等相差很大,故不同多糖降解酶的催化机制差异显著。在多糖降解酶的活性中心、酶的分子修饰、海洋多糖降解模式与产物生成特点之间规律等方面缺乏深入研究,多糖降解酶的催化机制目前尚未完全阐明,需要进一步研究。本文综述了三种多糖降解酶来源、分类及其催化机制。
3.1 褐藻胶裂解酶及其催化机制
褐藻胶裂解酶是特异性降解褐藻胶的一类酶的总称,其种类繁多、分布广泛。自1984 年Hensen 从土壤和海洋中分离出的枯草芽孢杆菌JBH2 中发现褐藻胶裂解酶以来,50 多种褐藻胶裂解酶已经被分离出来,它们主要来源于腐烂的褐藻、海洋软体动物消化液、海洋和土壤微生物中[65]。褐藻胶裂解酶分子量一般不大于1000 kDa[66]。Wang 等[67]从腐烂海带中分离得到海洋弧菌Vibriosp. YWA,通过硫酸铵沉淀、柱层析等组合方法从该菌发酵液中分离纯化得到特异性水解1,4-β-D-聚甘露糖醛酸的褐藻胶裂解酶,其分子量约为62.5 kDa;最适pH 和温度分别为7.0 和 25 ℃;EDTA 和Zn2+增强该酶的活性,而Ba2+抑制它的活性。褐藻胶裂解酶可以分成不同类型,按酶作用底物来划分,可以分成三类:1,4-β-D-聚甘露糖醛酸(Poly M)裂解酶(EC 42.2.3);1,4-α-L-聚古罗糖醛酸(Poly G)裂解酶(EC 4.2.2.11)以及Poly M 和Poly G 均可降解的双功能酶。按酶作用位点来划分,可以分成内切酶和外切酶。大部分褐藻胶裂解酶为内切酶[66],其酶切位点如图4 所示。
褐藻胶裂解酶的催化机制目前认为主要是在酶β-消除作用下,使褐藻胶中起连接作用的糖苷键断裂,生成寡糖。酶使两个残基之间1,4-O-糖苷键断裂,同时在C4 和C5 之间产生双键,在产物的非还原性末端形成不饱和糖醛酸,得到一连串各种长度的寡糖[68]。Gacesa[69]认为褐藻胶裂解酶降解过程分三步进行:首先,底物上的羧基通过形成盐桥被中和;其次,C5 位的质子被提取,形成稳定的烯醇阴离子中间体;最后,C4 和C5 之间从羧基得到电子,并形成不饱和双键,从而使1,4-O-糖苷键断裂,完成β消除反应。综上,尽管对部分褐藻胶裂解酶的结构和催化机制进行了研究,由于不同来源的褐藻胶裂解酶降解褐藻胶的机制和制备寡糖的结构不同,仍然有大部分的酶作用机制需要进一步去研究。
3.2 壳聚糖酶及其催化机制
壳聚糖酶是催化壳聚糖的酶。它主要存在于真菌和细菌细胞中,此外,壳聚糖酶也存在一些植物中,分子量介于20~60 kDa 之间[70]。1973 年,Monaghan等[71]首次从土壤微生物中发现了壳聚糖酶,并提出:壳聚糖酶是一种特异性降解壳聚糖的新型酶,对于胶态几丁质基本不能水解,但可催化几丁质生成壳聚糖。根据壳聚糖酶的作用位点的不同,可以分为内切型壳聚糖酶和外切型壳聚糖酶[72]。目前所发现的壳聚糖酶大多为内切型壳聚糖酶,而对于外切型壳聚糖酶的报道相对较少。
基于氨基酸序列的不同,壳聚糖酶可以分为GH3、GH5、GH7、GH8、GH46、GH75 和GH80 七种[73]。其中,已经破解GH46、GH75、G8 和GH80壳聚糖酶的结构。GH46 壳聚糖酶主要分离自杆菌属和链霉菌属的细菌,其催化机制和蛋白质结构已被广泛研究。GH75 壳聚糖酶主要来源于真菌。壳聚糖酶GH46、GH75 和GH80 只能水解壳聚糖,是壳聚糖的专一性水解酶,而其他家族的壳聚糖酶往往具有其他酶活性如纤维素酶和糖基转移酶等[74]。根据酶底物特异性的不同,可以将壳聚糖酶分为四个不同的类型:Ⅰ类壳聚糖酶(切割GlcN-GlcN 和GlcNACGlcN 糖苷键)、Ⅱ类壳聚糖酶(水解GlcN-GlcN 糖苷键)、Ⅲ类壳聚糖酶(切割GlcN-GlcN 和GlcNGlcNAC 糖苷键)以及Ⅳ类壳聚糖酶(裂解以上三种糖苷键)[75]。
催化机制因不同壳聚糖酶而异,基于酶解产物还原端异头碳结构的差异,通常有保持异头构型的“retaining”机制(图5a)和形成倒立异头构型“inverting”机制(图5b);“retaining”通过两步置换机制催化水解,有两个关键氨基酸残基参与反应,其中一个氨基酸残基作为亲核基团,另一个作为广义酸/碱;相反,“inverting”遵循一步、单一的置换机制,也有两个关键氨基酸参与反应,其中一个作为广义碱使水分子极化以产生更强的亲核基团来攻击异头碳,而另一个则作为广义酸使糖苷氧质子化以加速反应[70]。x 射线结构表明:在壳聚糖酶的催化过程中,Glu22 和Asp40 有着重要作用。总之,尽管近几年在个别家族的壳聚糖酶催化机制方面取得了一定的研究成果,但壳聚糖酶属于多个糖苷水解酶家族,大部分家族的壳聚糖酶结构和催化机制研究甚少。

图5 壳聚糖酶催化机制[70]Fig.5 Catalytic mechanism of chitosanase[70]
3.3 黄原胶降解酶及其催化机制
黄原胶降解酶是指能够降解黄原胶的酶的统称。由于黄原胶独特的双螺旋结构和侧链基团产生的位阻,其不易被酶降解,需要在多种酶的协同下才能被彻底水解,因此,黄原胶降解酶是由多种酶组成的混合酶系,分子量介于10~100 kDa 之间;黄原胶降解酶由黄原胶主链修饰酶和黄原胶侧链修饰酶组成[76]。黄原胶主链修饰酶作用于其主链,主要有β-D-葡聚糖酶和β-D-葡聚糖苷酶;黄原胶侧链修饰酶是可以攻击黄原胶分子中所有侧链连接的混合酶系,包括黄原胶裂解酶、α-D-甘露糖苷酶和不饱和葡糖醛酸水解酶;其中,β-D-葡聚糖酶和黄原胶裂解酶属于胞外酶,β-D-葡聚糖苷酶、α-D-甘露糖苷酶和不饱和葡糖醛酸水解酶属于胞内酶[77]。
黄原胶在上述五种酶的参与下才能彻底水解,Nankai 等[78]详细报道了由芽孢杆菌Bacillussp. strain GL 1 产生的这五种酶降解黄原胶的过程(图6)。首先,芽孢杆菌细胞外的黄原胶裂解酶攻击黄原胶侧链分子中丙酮酸化的甘露糖基和葡糖醛酸残基之间的糖苷键,从而除去丙酮酸化的甘露糖;其次,无末端的黄原胶主链在胞外酶β-D-葡聚糖酶的催化下生成四元糖,后经糖转运途径被转运到细胞内,在细胞内被β-D-葡聚糖苷酶转化为三元糖(不饱和葡萄糖醛酸-乙酰甘露糖-葡萄糖);再次,不饱和葡糖醛酸水解酶水解三元糖,生成葡萄糖醛酸和双糖甘露糖-葡萄糖;最后,双糖被α-D-甘露糖苷酶分解成葡萄糖和甘露糖[78]。总之,利用黄原胶降解酶催化黄原胶制备寡糖的作用机制研究仍然十分匮乏,同时无法实现黄原胶相关降解酶的获取,且生成寡糖的含量有限,很难实现黄原胶寡糖的工业化生产。
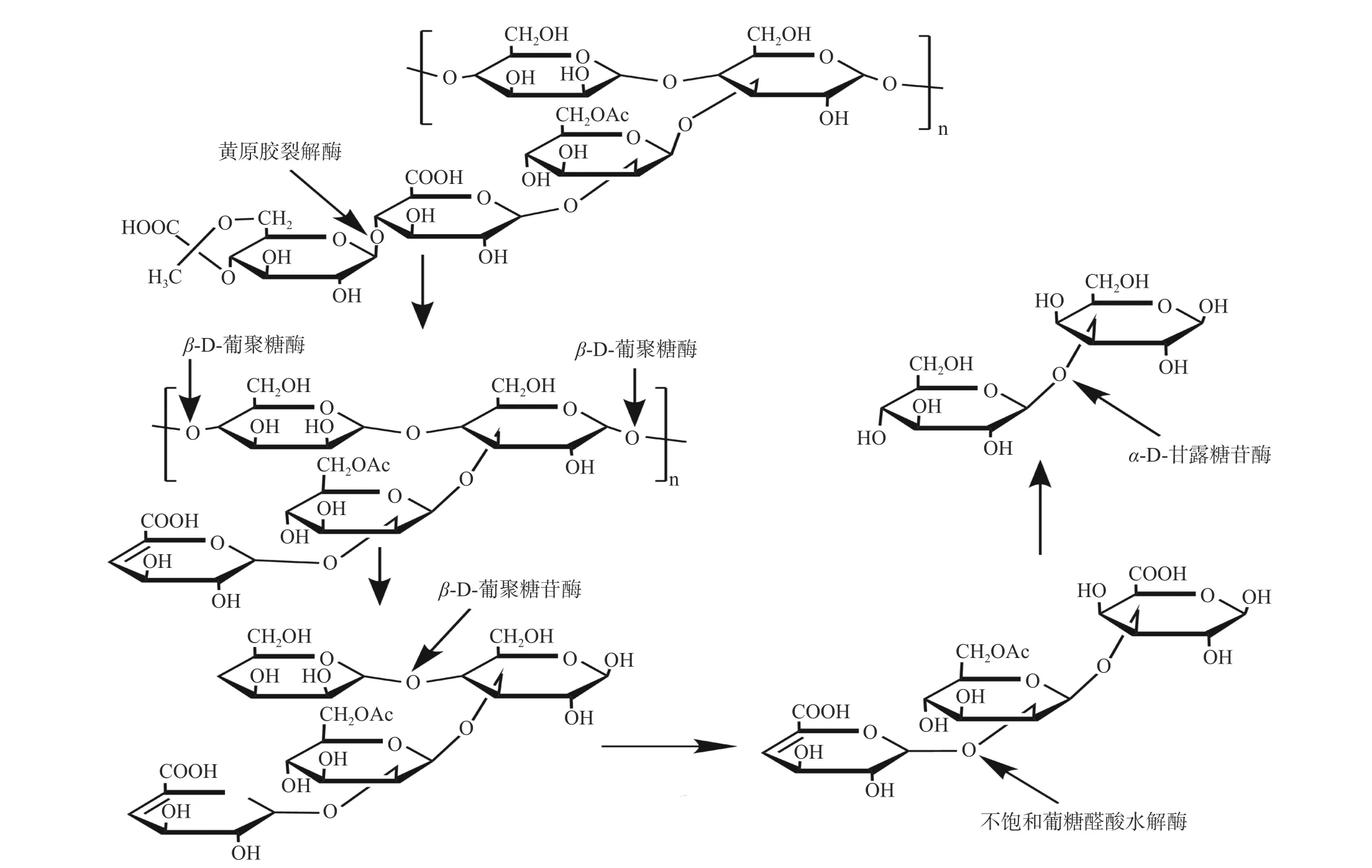
图6 黄原胶降解途径[78]Fig.6 Degradation pathway of xanthan gum[78]
4 总结与展望
海洋寡糖种类繁多、来源广泛,具有抗肿瘤、抗氧化、抗凝血和抗炎等生理活性,在医药、化妆品、食品、农业等领域发挥着越来越重要的作用,有着广阔的发展前景。目前,海洋寡糖生物酶法制备具有反应条件温和、绿色环保、降解率高等优势,因此,高效优质的海洋寡糖酶法制备工艺开发是当前的主流发展方向。随着科学技术和酶工程的不断发展,很多新型酶进入人们的视野。其中,纳米酶是有催化作用的纳米材料。纳米酶很稳定、价格低廉和易于工业化放大等优点,引起了人们的广泛关注[79]。迄今为止,已发现具有氧化还原酶、水解酶、裂合酶和异构酶四种催化类型的纳米酶[80]。纳米酶的发现成为未来酶法制备海洋寡糖的发展方向。
随着酶工程和基因工程的不断发展,酶法制备海洋寡糖未来发展方向有如下四个方面:不断发掘催化效率高的酶资源,包括新技术得以应用于酶的分子修饰和改造,获得高效的酶资源。通过基因工程获得更多优质的酶,并实现优质酶的产业化。从自然界中发现新的酶;完善酶促反应的技术路线,实现高浓度底物的高效降解,提高生产效率、降低生产成本;构建基于固定化酶的高效反应器,包括搅拌罐式反应器、固定床式反应器、流动床式反应器和膜式反应器,实现海洋寡糖的连续化生产。同时加强对新型固定化酶技术及载体的探讨,提高固定化酶活性,降低生产成本;阐明海洋寡糖制备过程中酶的作用和调控机制,提升酶的催化效率,强化酶的调控。随着科学技术的不断发展和研究人员的不断探索,将会促进海洋多糖资源的集约开发和海洋寡糖的商业化生产。
