基于理化指标和MiSeq 高通量测序技术红曲品质及微生物类群的解析
2023-09-10郑巳芳程驰新笑龙树瑺王玉荣田龙新
郑巳芳,程驰新笑,龙树瑺,王玉荣,田龙新,郭 壮,
(1.湖北文理学院,湖北省食品配料工程技术研究中心,湖北襄阳 441053;2.湖北文理学院,襄阳市酱香型白酒固态发酵企校联合创新中心,湖北襄阳 441053)
红曲,又名丹曲或赤曲[1],其制作原料主要为大米和红曲霉,经过红曲霉发酵后的大米变成红曲米,被用来酿造红曲黄酒或红曲米醋[2]。随着红曲及其副产物的功能特性不断被发现,红曲行业也逐渐得到了国内外学者的广泛关注。有研究表明,红曲色素具有抗氧化性和抗菌性等多种功能特性,也因此被作为食品添加剂被广泛应用于食品加工业中[3]。此外,更多的研究关注于红曲黄酒发酵过程中的微生物群落演替亦或是风味物质变化。有研究表明红曲黄酒在发酵过程中,游离氨基酸、有机酸以及关键挥发性化合物含量有明显增加[4]。Huang 等[5]对福建武夷红曲黄酒酿造过程中的微生物和挥发性化合物进行了解析,发现葡糖酸醋杆菌属(Gluconacetobacter)、乳酸杆菌属(Lactobacillus)、毕赤酵母属(Pichia)和威克汉姆酵母属(Wickerhamomyces)等为产生挥发性化合物的核心菌群。Huang 等[6]和Liu 等[7]的研究表明不同类型的红曲(黑武夷红曲、红武夷红曲和古田红曲)其微生物群落间具有显著差异,并且相较于其它类型的黄酒,古田红曲酿造的黄酒在发酵过程中氨基酸总量增加较慢[6]。上述研究结果表明,红曲对于红曲黄酒品质的塑造至关重要,且不同红曲酿造出的红曲黄酒在品质上存在一定差异。此外,目前有关红曲源菌株资源挖掘方面的研究更多集中在霉菌和酵母菌上,然而有研究表明酒曲中可能蕴含着部分具有增香特性的芽孢杆菌[8],还有研究显示部分乳酸菌能促进黄酒酿造过程中酵母菌的增长,对黄酒品质的提升亦有一定作用[9]。因而红曲中的乳酸菌和芽孢杆菌资源亦值得被挖掘。
目前,我国生产红曲的主要产区在福建省,该地区生产红曲的历史已有上千年,生产技术和产品质量均处于行业领先水平[1]。由于红曲黄酒在国内外的流行度逐渐增加,我国其它地区亦开始生产红曲。然而目前针对我国其它地区生产的红曲研究较少,且缺少相关国家质量标准体系,其品质和蕴含的微生物类群也了解尚少。MiSeq 高通量测序技术作为第二代测序技术,能够以相对较低的成本产生大量序列,与其他方法相比,增加了微生物群落分析的测序深度,同时降低了实验成本,在解析茯砖红茶[10]和酸汤[11]等传统发酵食品微生物类群的研究中具有广泛应用。
本研究在对其理化指标和发酵特性进行测定的基础上,进一步采用MiSeq 高通量测序技术对其微生物类群进行了全面扫描,并结合纯培养技术对其中的芽孢杆菌和乳酸菌进行了鉴定保藏,以期为后续红曲品质的提升提供一定的理论参考依据,并丰富纯种发酵菌株资源。
1 材料与方法
1.1 材料与仪器
红曲样品 采集自山东省某制曲公司;DNeasy mericon Food Kit DNA 基因组提取试剂盒 德国QIAGEN 公司;正反/向引物338F/806R、正/反向引物ITS3F/ITS4R 和正/反向引物27F/1495R 上海桑尼生物科技有限公司;Axygen 清洁试剂盒 康宁生命科学吴江有限公司;PCR 扩增所用缓冲液、dNTP和rTaq DNA 聚合酶 宝生物工程(大连)有限公司;Illumina MiSeq 测序试剂盒v3 美国Illumina 公司;营养琼脂和MRS 培养基 北京奥博星生物技术有限责任公司。
SH-10A 水分测定仪 上海力辰仪器科技有限公司;KBF1700 高温箱式炉 南京南大仪器厂;PHS-3C 数显台式酸度计 上海越平科学仪器有限公司;K1100 全自动定氮仪 济南海能仪器股份有限公司;VSA 动态水蒸汽吸附分析仪 美国AquaLAB公司;DG250 型厌氧工作站 英国Don Whitley 公司;Vetiri 梯度基因扩增仪 美国AB 公司;MiSeq PE300 高通量测序平台 美国Illumina 公司;R930机架式服务器 美国Dell 公司。
1.2 实验方法
1.2.1 样品采集 于2021 年10 月从山东某制曲公司红曲制作车间采集同一批次红曲样品3 份,编号为SQ1~SQ3。红曲以籼米为原料,经过浸米、蒸饭、摊凉、接种红曲母、室内培菌、加温发酵和烘干等十多道工序制作而成,整个制作周期历时18 d。样品采集时已在库房中常温储存了1 个月左右。
1.2.2 红曲理化特性指标测定 红曲的灰分、酸度、氨基酸态氮、淀粉和蛋白质含量等理化指标均参照轻工行业标准QB/T 4257-2011《酿酒大曲通用分析方法》提供的测定方法进行测定[12],红曲水分活度使用水蒸汽吸附分析仪进行测定,水分含量使用水分测定仪进行测定,所有指标测定均进行3 次重复实验。
1.2.3 红曲发酵特性指标测定 红曲的糖化力和酯化力均参照轻工行业标准QB/T 5188-2017《酿造红曲》中的方法进行测定[13],发酵力、酒化力和液化力等生化指标均参照轻工行业标准QB/T 4257-2011《酿酒大曲通用分析方法》提供的测定方法进行测定[12],所有指标测定均进行3 次重复实验。
1.2.4 红曲细菌和真菌多样性解析 使用DNeasy mericon Food Kit DNA 试剂盒提取红曲的宏基因组DNA,参照郭壮等[14]的方法使用引物338F/806R 对细菌16S rRNA V3~V4区进行扩增,参照王智耀等[15]的方法使用引物ITS3F/ITS4R 对真菌ITS2 区进行扩增,扩增产物寄至上海美吉生物医药科技有限公司完成高通量测序(表1)。参照郭壮等[14]的方法对测序返回的序列进行质控,基于QIIME(v1.95)平台采用UCLUST 两步法对有效序列分别按照100%和97%相似度划分操作分类单元OTU(Operational taxonomic units,OTU)[16],并进行嵌合体检查。基于RDP[17]、Greengenes[18]和SILVA[19]数据库对细菌类群进行物种注释,基于UNITE(v7.2)数据库对真菌类群进行物种注释[20]。
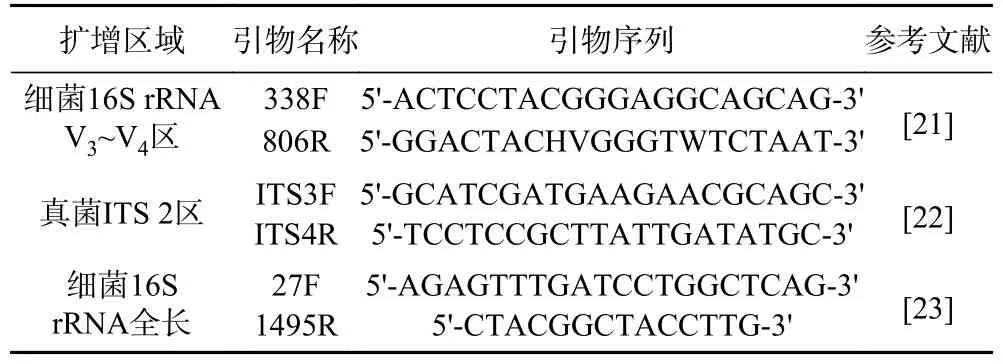
表1 引物序列信息Table 1 Primer sequence information
1.2.5 乳酸菌和芽孢杆菌的分离鉴定 使用生理盐水对红曲进行倍比稀释,取10-4~10-6稀释液涂布于含有1% CaCO3的MRS 平板中,于厌氧工作站37 ℃培养48 h,对其乳酸菌进行分离。使用生理盐水首先对红曲稀释10 倍后,于85 ℃加热15 min,继而继续进行倍比稀释,取10-3~10-5稀释液涂布于营养琼脂平板中,于28 ℃生化培养箱培养3 d,对其芽孢杆菌进行分离。后续单菌落的挑取、纯化、保藏和鉴定步骤均参照洋洋等[24]的方法。
1.3 数据处理
采用Origin 2021 软件绘制柱形图,并使用SPSS 25 软件进行差异显著性检验;采用R(v4.1.1)软件中的“ggplot2”和“reshape2”包绘制气泡图;采用SAS(v9.4)软件计算优势菌群与生化指标的相关性系数及显著性,并使用Catyscape(v3.7.2)软件绘制相关性网络图;采用MEGA(v7.0)和R(v4.1.1)软件构建系统发育树。
2 结果与分析
2.1 红曲的理化特性指标分析
本研究首先对3 份红曲样品的理化指标进行了分析,其理化指标结果见图1。
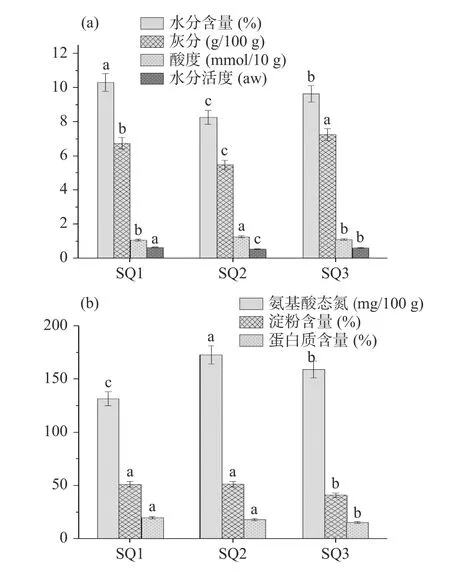
图1 红曲的理化指标分析Fig.1 Analysis of physicochemical indexes of Hong Qu
由图1(a)可知,红曲的水分含量在8.27%~10.30%之间,灰分含量在5.47~7.25 g/100 g 之间,酸度在1.0~1.3 mmol/10 g 之间,水分活度在0.544~0.648 aw 之间。由图1(b)可知,红曲的氨基酸态氮含量在131.65~172.76 mg/100 g 之间;淀粉含量在40.9%~51.1%之间,蛋白质含量在15.38%~19.78%之间。方差分析结果显示,3 份样品的各项理化指标间均存在显著性差异。标准QB/T 5188-2017《酿造红曲》中规定酿造红曲的水分含量不得高于12%[16]。王俏等[25]在解析酒曲理化性能的研究中指出,酒曲中的酸度主要来源于乳酸菌和醋酸菌等微生物代谢碳水化合物产生的乳酸和醋酸等,还有部分来源于脂肪和蛋白质降解产生的脂肪酸和氨基酸等。由此可见,三个红曲样品其水分含量均符合标准,此外曲中还可能蕴含了部分产酸微生物。作为酒曲中主要的氮源物质,适宜含量的氨基酸态氮不仅有利于促进酒曲中功能菌株的生长繁殖,而且与酒曲的生香能力呈正相关[26]。通过对低温、中温和高温大曲组份进行研究,李祖明等发现3 类大曲的淀粉含量在45%~68%之间,蛋白质含量在14%~20%之间,高温大曲的氨基酸态氮含量在280~445 mg/100 g 之间[26-27]。由此可见,较之大曲而言,红曲的淀粉和蛋白质含量与其无明显差异,但其氨基酸态氮含量要明显低于大曲,因而其生香能力可能略低于大曲。
2.2 红曲的发酵特性指标分析
酒曲的生化性能主要包括了糖化力、酯化力、发酵力、液化力和酒化力,它们分别代表了酒曲的糖化能力、产乙酸乙酯能力、产二氧化碳能力、出酒率和产酒精的能力,红曲样品的发酵特性结果如图2 所示。
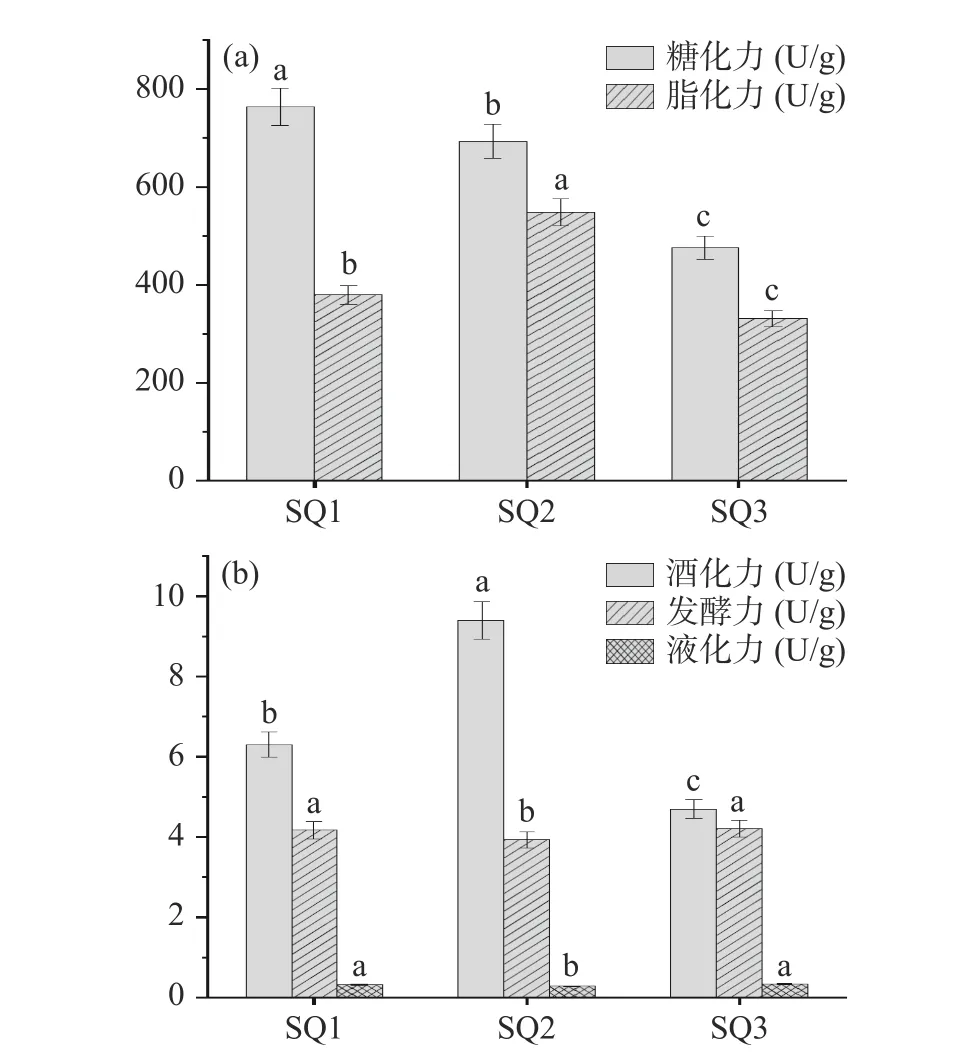
图2 红曲的发酵特性指标分析Fig.2 Analysis of fermentation characteristics indexes of Hong Qu
由图2 可知,红曲的糖化力在476~764 U/g 之间,酯化力在331~548 U/g 之间,发酵力在3.93~4.21 U/g之间,液化力在0.28~0.34 U/g 之间,酒化力在4.7~9.4 U/g 之间。方差分析结果显示,3 份样品的发酵特性间亦存在显著差异(P<0.05)。在轻工行业标准QB/T 5188-2017《酿造红曲》中,红曲的糖化力需要大于等于1000 U/g[16]。由此可见,纳入本研究的红曲其糖化力、液化力和发酵力指标均偏低。通过对制曲过程中微生物群落演替及其生化指标的变化,张娇娇等[28]发现在96 h 发酵时间内,红曲的糖化力随着制曲时间的延长而不断增加,细菌丰度和多样性不断降低,而真菌丰度和多样性不断增加,然而其最终糖化力为542.61 U/g,亦没有达到标准要求。因此,糖化力不达标或许是与菌群变化亦或是发酵时间较短等因素相关。结合图1 和图2 来看,3 份样品在理化指标和发酵特性之间均存在显著性差异(P<0.05),这说明其品质相对不稳定。通过对发酵特性进行评价,梁璋成等[29]亦发现不同企业和批次生产的红曲米品质存在较大的差异,并导致了后续黄酒产品质量可控性较差,而出现这种情况的原因主要在于红曲缺乏完善的质量标准体系。综上,在后续研究中尽可能多的增加采样地点和采样量,实现红曲理化指标和发酵特性的全面解析,对红曲质量标准体系和监管体系的完善具有积极促进作用。
2.3 基于门和属水平红曲细菌类群解析
通过对红曲细菌16S rRNA V3~V4区进行测序共得到了174896 条序列,所有序列均通过了质量控制,样品SQ1~SQ3 中分别含有59019 条、54526 条和61351 条有效序列,所有有效序列按照97%相似度划分共得到2538 个OTU,平均每个样品中含有1747 个OTU。经过同源性比对,这些OTU 分别隶属于6 个门、10 个纲、19 个目、41 个科和77 个属。本研究基于门和属水平对红曲的细菌多样性进行了解析,并将相对含量>1.0%的门和属定义为优势门和优势属,如图3 所示。
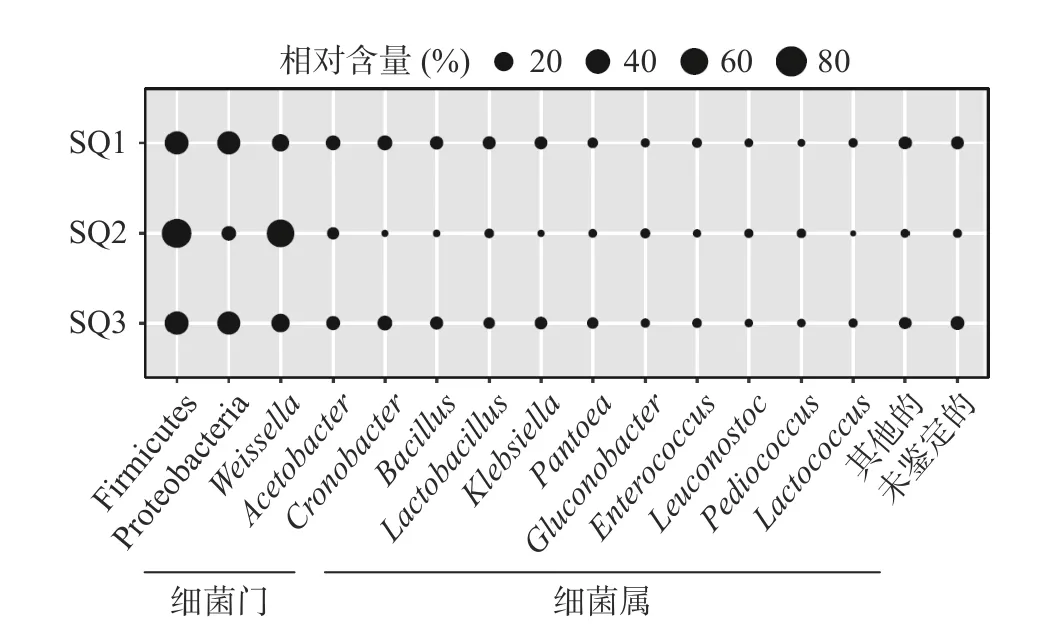
图3 红曲中优势细菌门和属相对含量分析Fig.3 Analysis of the relative content of dominant bacterial phyla and genera in Hong Qu
由图3 可知,Firmicutes 和Proteobacteria 为红曲中的优势细菌门,其平均相对含量分别为62.00%和36.66%,然而其在3 份样品中的比例存在一定的差异,其中SQ1 和SQ3 中Firmicutes 和Proteobacteria的比例接近1:1,而SQ2 中两者的比例接近7:1。由此可见,和理化与发酵特性指标一样,3 个样品的细菌类群亦存在较大差异。制曲温度和水分含量被认为与酒曲中微生物群落形成具有密切联系[30]。与大曲培菌时因堆积排列而受到的发酵热和空间异质性不同[31],红曲是将拌好曲的红曲米平铺在室内进行自然培菌,受热较为均匀,因而不同样品细菌类群结构间的差异更可能是由水分分布不均所引起的。由图3可知,红曲中的优势细菌属共有12 个,分别为隶属于Firmicutes 的Weissella(魏斯氏菌属,41.93%)、Acetobacter(醋酸杆菌属,9.99%)、Bacillus(芽孢杆菌属,5.94%)、Lactobacillus(5.29%)、Enterococcus(肠球菌属,1.99%)、Leuconostoc(明串珠球菌属,1.40%)、Pediococcus(片球菌属,1.30%)和Lactococcus(乳球菌属,1.27%);隶属于Proteobacteria 的Cronobacter(克罗诺杆菌属,8.76%)、Klebsiella(克雷伯氏菌属,5.21%)、Pantoea(泛菌属,3.28%)和Gluconobacter(葡糖杆菌属,2.06%)。由此可见,Weissella、Acetobacter和Cronobacter为红曲中的主要细菌类群。此外,这些优势细菌属中属于乳酸菌类群的有Weissella、Lactobacillus、Enterococcus、Leuconostoc、Pediococcu和Lactococcus,累计相对含量为47.22%。此外,Acetobacter的含量也占到近10%。由此可见,富含乳酸菌和醋酸菌或许是导致纳入本研究红曲酸度较高的主要原因,然而较高的酸度可能会抑制部分耐酸性较弱的霉菌和酵母菌生长繁殖,在一定程度上对红曲糖化力产生了不利影响。
2.4 基于门和属水平红曲真菌类群解析
本研究进一步从门和属水平解析了红曲的真菌多样性。通过对真菌ITS 2 区测序共得到了301978条有效序列,样品SQ1~SQ3 中分别含有100274 条、99144 条和102560 条序列,按照97%相似度划分共得到了694 个OTU,平均每个样品含有488 个OTU。经同源性比对,这些OTU 分别隶属于3 个门、6 个纲、9 个目、20 个科和28 个属,其中的优势真菌门和真菌属如图4 所示。

图4 红曲中优势真菌门和属相对含量分析Fig.4 Analysis of the relative content of dominant fungal phyla and genera in Hong Qu
由图4 可知,Ascomycota(子囊菌门,99.52%)为红曲中唯一优势真菌门,在所有样品中含量均达99.0%以上。红曲中的优势真菌属共有6 个,分别为隶属于Ascomycota 的Pichia(55.83%)、Monascus(红曲霉菌属,21.24%)、Dipodascus(双足囊菌属,6.55%)、Cyberlindnera(拟威尔嗜杀酵母属,6.09%)、Xeromyces(耐干霉菌属,3.71%)和Candida(假丝酵母属,1.75%)。由此可见,Pichia和Monascus为三个样品中主要的真菌类群。
通过解析福建地区红曲真菌类群,李路等[32]亦发现黑曲霉(Aspergillus niger)和紫红曲霉(Monascus purpureus)为其优势真菌类群,但其中并不蕴含Pichia。此外,对福建省5 个不同地区红曲微生物类群和发酵特性进行研究,Huang 等[33]发现Aspergillus和Monascus为其中优势真菌属,亦未发现Pichia,且Monascus与糖化力之间呈显著正相关关系。此外,相较于正常红曲样品,糖化力不达标的红曲样品其真菌丰度和多样性要明显偏低。有研究表明,霉菌是酿酒过程中的糖化动力[34],而且根霉、米曲霉和红曲霉是常用的糖化剂。因而,霉菌含量偏低而Pichia含量偏高亦或是真菌丰度和多样性较低可能导致是纳入本研究红曲糖化力达不到轻工行业标准QB/T 5188-2017《酿造红曲》要求的主要原因。此外,在发酵前接种了红曲母,曲母中主要蕴含着曲霉菌类群,经过发酵后其含量却未占据主导地位,因而过高含量的Pichia存在可能预示着红曲在制作过程存在一定的污染。红曲的制作环境并非是在受控的无菌条件下进行,微生物接种物、加工技术和生产环境以及气候条件均会影响红曲的微生物类群及其多样性[35],因而在后续生产中加强工作菌种的管理、注意生产环境卫生状况的改善以及适当增加红曲霉的接种量对这一问题的解决可能具有积极意义。
2.5 红曲发酵特性与微生物类群的关联性分析
红曲发酵特性与微生物类群的关联性分析,结果如图5 所示。

图5 优势菌群与红曲发酵特性指标之间的相关性分析Fig.5 Correlation analysis between dominant flora and fermentation characteristics indexes of Hong Qu
由图5 可知,Weissella与酒化力之间呈现显著正相关关系(P<0.05),而Cronobacter、Bacillus、Klebsiella、Enterococcus和Lactococcus与酒化力之间均呈现显著负相关关系(P<0.05)。此外,Dipodascus与糖化力之间呈显著负相关关系(P<0.05)。由此可见,优势细菌对红曲生化性能的影响主要体现在酒化力上,而真菌主要对糖化力产生影响。
2.6 红曲中乳酸菌和芽孢杆菌的分离鉴定
上述研究结果表明,纳入本研究的各样品品质间差异较大,且糖化力偏低,因而对其中的微生物进行初步分离鉴定为解决以上问题提供菌株支持具有一定的积极意义。目前,研究人员对酒曲中功能菌株进行研究时发现,除了霉菌等真菌类群能起到糖化作用外,部分芽孢杆菌亦具有良好的糖化能力,其亦可作为功能菌株被富集添加到酒曲中的应用中[36]。此外,红曲中的乳酸菌能对其他菌群产生积极影响,并提高红曲黄酒品质[9]。因而,本研究采用纯培养技术对红曲中的芽孢杆菌和乳酸菌进行了分离鉴定,其系统发育树如图6 所示。
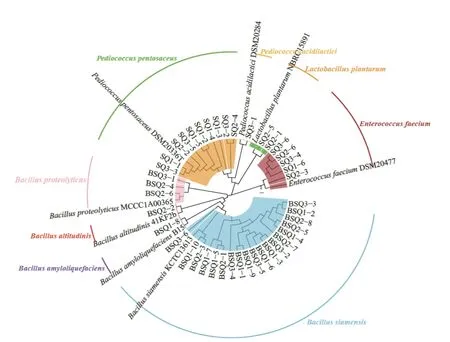
图6 红曲中芽孢杆菌和乳酸菌分离株的系统发育树Fig.6 Phylogenetic tree of Bacillus and lactic acid bacteria isolates from Hong Qu
由图6 可知,有24 株分离株被鉴定为芽孢杆菌,分别为B. siamensis(暹罗芽孢杆菌,19 株)、B. amyloliquefaciens(解淀粉芽孢杆菌,1 株)、B. altitudinis(高地芽孢杆菌,1 株)和B. proteolyticus(解蛋白芽孢杆菌,3 株),有18 株分离株被鉴定为乳酸菌,主要为隶属于Pediococcus的P. acidilactici(乳酸片球菌,1 株)和P. pentosaceus(戊糖片球菌,10 株),隶属于Enterococcus的E. faecium(屎肠球菌,5 株),隶属于Lactiplantibacillus的L. plantarum(植物乳杆菌,2 株)。由图6 亦可知,B. siamensis占芽孢杆菌分离株的79.17%,P. pentosaceus占乳酸菌分离株的55.55%,且两者在3 个样品中均可分离得到。由此可见,纳入本研究的红曲其芽孢杆菌和乳酸菌类群主要由B. siamensis和P. pentosaceus构成。
3 结论
本研究对产自山东某地的红曲理化指标和发酵特性进行了评价,对其微生物类群进行了解析,同时对蕴含的芽孢杆菌和乳酸菌进行了分离鉴定。结果发现,纳入本研究的红曲其糖化力、液化力和发酵力不足均偏低,且不同样品的理化指标和发酵特性之间存在显著性差异。红曲中的优势细菌为Weissella和Acetobacter等,优势真菌为Pichia和Monascus等,芽孢杆菌和乳酸菌类群主要由B. siamensis和P.pentosaceus构成。然而,不同样品在细菌类群结构上亦存在较大差异,且霉菌含量偏低。由此可见,该批次生产的红曲在理化特性与微生物群落结构等方面均有明显的不稳定性。因而,在后续生产过程中要加强管理生产环境卫生或是采用纯种发酵技术以提高产品稳定性。
