中华鳖生殖细胞对性腺分化的影响
2023-09-09王金霓王子嘉楼灵媛庄天依钱国英葛楚天
王金霓 吴 俣 王子嘉 黄 安 楼灵媛 庄天依 孙 伟 钱国英 郭 银 * 葛楚天 *
(1. 浙江万里学院动物性别与发育重点研究所, 宁波 315500; 2. 浙江万里学院生物与环境学院, 宁波 315500;3. 上海海洋大学水产与生命学院, 上海 201306)
生殖细胞负责将父母的遗传信息传递给下一代, 在有性繁殖的生物中必不可少。胚胎中的原始生殖细胞(Primordial germ cell, PGC)在性腺以外的地方产生, 经历增殖、迁移、最终定植于生殖嵴上,在性腺发育的过程中, 雌性性腺中的生殖细胞会大量增殖, 而雄性性腺中的生殖细胞进入了有丝分裂静止期[1]。
性腺主要由生殖细胞和体细胞组成, 其性别决定是个复杂的过程。在环境依赖型性别决定(Environmental-dependent sex determination, ESD)物种中, 性别决定受环境条件影响; 在基因型性别决定中(Genetic sex determination, GSD)物种中, 性别由受精时基因差异决定[2]。哺乳类、鱼类、鸟类、两栖类和爬行类动物在性别决定后, 雌性性腺皮质区高度发育, 髓质区退化最终发育为卵巢; 雄性性腺皮质区退化, 髓质区发育最终发育为精巢。生殖细胞一般分布于雌性性腺的皮质区, 周围由颗粒细胞环绕; 分布于雄性性腺的髓质区, 周围由支持细胞环绕。生殖细胞周围的体细胞能够影响其分化和发育, 生殖细胞对于体细胞的作用以及对性别分化的影响因物种而异。在鱼类中, 青鳉和斑马鱼在消除生殖细胞后, 后代出现全雄的现象[3,4]。在小鼠中, 将胚胎期的生殖细胞消除后, 未发生性别逆转的现象[5]。在鸡中消除原始生殖细胞后, 体细胞在没有生殖细胞存在的情况下进行正常的性分化[6]。在西班牙勒突螈中, 生殖细胞完全消除后, 性腺性别并未发生逆转的现象[7]。爬行动物在脊椎动物进化中处于承前启后的关键地位, 其生殖细胞对于性别的影响尚未明晰。目前仅在温度依赖型性别决定(Temperature-dependent sex determination, TSD)物种红耳龟中发现消除生殖细胞后, 其性腺形态没有明显改变, 但是未对其性别进行鉴别。
中华鳖存在微小性染色体(Z/W), 属于GSD物种[8], 是我国名特优水产养殖品种。中华鳖存在典型的雌雄性别二态性: 雄鳖比雌鳖的生长速度快,个体大, 裙边宽厚, 营养价值和价格更高, 因此开发全雄苗种是提升中华鳖现代产业发展的重要方面。目前, 中华鳖的性别决定机制尚未明确, 生殖细胞对于中华鳖性腺分化的影响研究未见报道。本研究通过白消安消除了中华鳖的生殖细胞, 利用组织学观察、蛋白荧光免疫染色及基因的荧光定量分析鉴定了生殖细胞消除后其性腺性别。
1 材料与方法
1.1 中华鳖胚胎孵化
本实验所需的中华鳖受精卵均采自绍兴大畈水产专业合作社。中华鳖受精卵的采集时间严格控制在中华鳖产卵后12h内, 孵化方式采用全裸无接触式。将采集的中华鳖受精卵放置于孵化盘的定位孔中, 动物极裸露于空气中, 孵化箱的温度保持在29.5—30℃, 湿度保持在80%—85%。中华鳖的采集时期按照中华鳖胚胎发育时期[9]进行。
1.2 白消安处理
将白消安(Sigma, 美国)溶解于DMSO中, 浓度分别为4、20和50 mg/kg。中华鳖胚胎发育至14期时, 将其分为4组, 对照组(DMSO)、白消安4 mg/kg组(4Bu)、白消安20 mg/kg组(20Bu)、白消安50 mg/kg组(50Bu), 每组400枚约为5 g重量的中华鳖受精卵,往中华鳖受精卵中注射5 μL的各个浓度的白消安以及DMSO。ZW(注射DMSO的ZW胚胎)、ZW+4Bu(注射4 mg/kg白消安的ZW胚胎)、ZW+20Bu(注射20 mg/kg白消安的ZW胚胎)、ZW+50Bu(注射50 mg/kg白消安的ZW胚胎); ZZ(注射DMSO的ZZ胚胎)、ZZ+4Bu(注射4 mg/kg的白消安的ZZ胚胎)、ZZ+20Bu(注射20 mg/kg白消安的ZZ胚胎)、ZZ+50Bu(注射50 mg/kg白消安的ZZ胚胎), 以上是处理后的各个组别。在处理完成后, 置于相同环境下继续孵化。
1.3 样品收集
中华鳖胚胎孵化至18期、21期和25期时, 收集各处理组胚胎的中肾性腺复合物(Gonad and mesonephros complex, GMC)于4%PFA中, 固定24h后用PBS清洗10min, 50%乙醇浸泡2h, 最后置于70%乙醇, 4℃保存。收集21期性腺于TRIzol (Thermo Fisher Scientific, 美国)中, -80℃保存。
1.4 石蜡包埋切片和苏木素&伊红染色
70%乙醇保存的GMC样品依次经过乙醇浓度由低至高梯度脱水, 二甲苯透明, 石蜡包埋。连续切片厚度为6 μm, 收集石蜡切片在65℃烘箱中烘干, 经过二甲苯脱蜡, 乙醇浓度由高至低梯度复水,苏木素&伊红(碧云天, 中国)染色, 最后用普通光学显微镜(Nikon, 日本)观察, 拍照。
1.5 免疫荧光染色
石蜡切片经过二甲苯脱蜡、复水后, 置于柠檬酸钠中, 96℃水浴, 抗原修复20min, 冷却后用封闭液(10%驴血清, 3%牛血清白蛋白, 0.3% Triton X-100)孵育1h, 加入一抗, 兔抗VASA(1﹕250, Abcam,英国), 鼠抗β-catenin(1﹕500, Sigma, 美国), 兔抗SOX9(1﹕1000, Millipore, 美国), 羊抗(FOXL2, 1﹕300, Abcam, 英国), 鼠抗DMRT1(1﹕50, Millipore, 美国), 鼠抗CYP19A1(1﹕50, 杭州华安生物技术有限公司, 中国), 兔抗PCNA(1﹕400, Cell Signaling Technology,美国), 4℃过夜; 第2天用PBST清洗3次, 每次15min,避光加入二抗, Alexa Fluor 594驴抗兔IgG(1﹕500,Invitrogen, 美国), Alexa Fluor 594驴抗鼠IgG(1﹕500,Invitrogen, 美国), Alexa Fluor 488驴抗羊IgG(1﹕500,Invitrogen, 美国), Alexa Fluor 488驴抗鼠IgG(1﹕500,Invitrogen, 美国)和DAPI(1﹕500, Sigma, 美国), 37℃孵育2h, 后用PBST清洗3次, 每次15min, PBS: 甘油(1﹕3)封片, 最后用激光共聚焦显微镜(Zeiss, 德国)观察, 拍照。
1.6 RNA提取和实时荧光定量PCR
按照TRIzol试剂盒(Thermo Fisher Scientific, 美国)方法提取RNA。按照反转录试剂盒(Thermo Fisher Scientific, 美国)步骤合成cDNA。实时荧光定量PCR使用的引物列于表1。以GAPDH为内参, 使用比较阈值循环(Ct)方法[10]计算样品中的相对mRNA水平。

表1 荧光定量PCR分析的基因及其引物序列Tab. 1 Genes and peimer sequence of Real-time PCR
1.7 数据分析
每个实验至少3个生物学重复。数据分析利用软件SPSS20.0的单因素方差分析(*P<0.05; **P<0.01;***P<0.001), 所有数据均表示为平均值±标准差。
2 结果
2.1 白消安处理后性腺内生殖细胞变化
为了有效地消除中华鳖的生殖细胞, 我们设置了4个浓度的白消安(0、4、20和50 mg/kg)。在中华鳖胚胎期14期注射白消安, 18期至21期统计的死亡率分别为: 7.87%、8.52%、9.89%和59.6%。进一步利用生殖细胞特异性抗体VASA蛋白进行免疫荧光染色, 结果显示: 在ZW中, 20Bu中VASA的荧光信号(红色)显著性地低于4Bu和DMSO(图1); 同样的, 在ZZ性腺中, 20Bu中VASA的荧光信号(红色)显著性地低于4Bu和DMSO(图1)。因此本研究采用20 mg/kg白消安作为消减中华鳖生殖细胞的最终浓度。
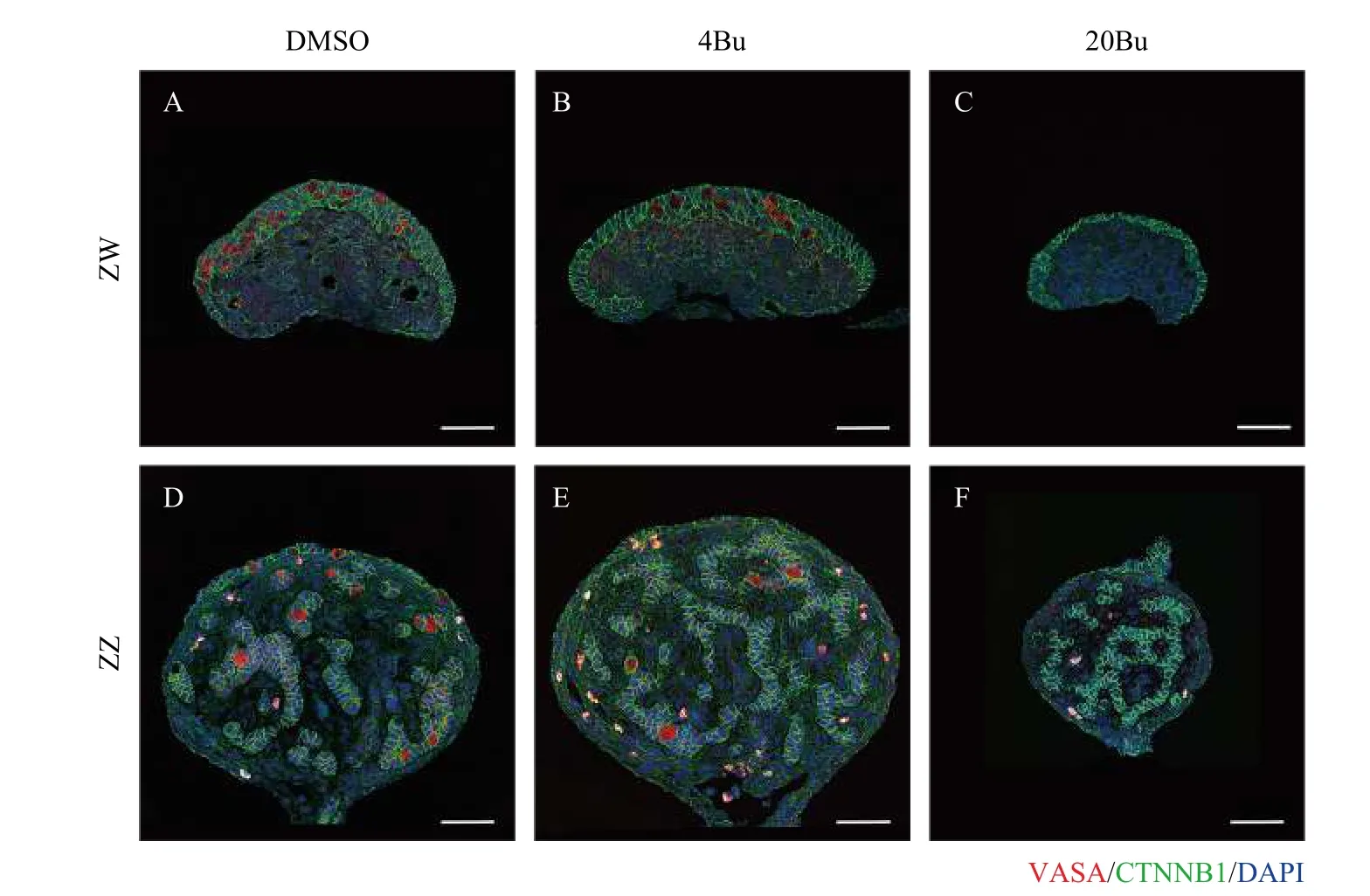
图1 白消安处理后性腺内部的VASA染色情况Fig. 1 Immunofluorescence of VASA in internal gonad after busulfan-treatment
为了进一步明确ZW或ZZ性腺中生殖细胞消除情况, 我们分别对发育至21期的胚胎性腺进行横向石蜡切片并对生殖细胞进行免疫荧光显色, 随后随机选取4张切片进行生殖细胞数量分析。结果显示, 在ZW性腺中, 皮质区有大量的VASA红色信号(图2A), ZW+20Bu中未见到VASA蛋白荧光信号(图2B), 生殖细胞数量统计不到; 在ZZ性腺中, 髓质区的性索中有大量的VASA红色信号(图2C), ZZ+20Bu中仅统计到1个VASA蛋白荧光信号(图2D)。4张切片统计的生殖细胞数量显示: 在20 mg/kg白消安处理后, ZW、ZZ中的平均生殖细胞数量不足1个(图2E)。荧光定量PCR结果显示: 20 mg/kg白消安处理后, ZW和ZZ性腺中生殖细胞特异性基因Ddx4(图2F)和Dazl(图2G)的mRNA表达量急剧降低。以上结果表明, 在中华鳖胚胎期20 mg/kg的白消安注射能够有效地消除ZZ和ZW性腺中的生殖细胞。
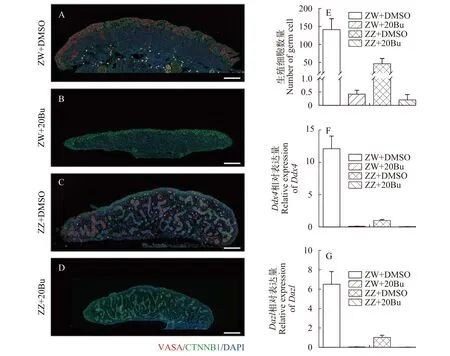
图2 白消安处理后, 性腺生殖细胞数量变化以及生殖细胞特异性基因表达的变化Fig. 2 The change of the number of germ cells and germ cell-specific genes expression after busulfan-treatment
2.2 生殖细胞消除后对性别分化的影响
通过组织形态学分析来研究生殖细胞消除对中华鳖性别分化的影响。组织形态学观察发现:ZZ+20Bu的性腺粗且短(图3B), ZZ的形态也是粗且短(图3A); ZW+20Bu的性腺长且扁平(图3D), ZW的性腺也呈现长且扁平的状态(图3C), 说明性腺外部在形态上没有逆转的变化。同时, 组织切片的苏木素&伊红染色显示, ZZ的性腺成椭圆状, 髓质区的性索中存在生殖细胞, 支持细胞围绕着生殖细胞生长(图3E), ZZ+20Bu性腺形态呈现椭圆状, 性腺髓质区的性索中不存在生殖细胞(图3F), 整体形态呈现雄性状态; ZW性腺形态成伞状, 皮质区分布着大量的生殖细胞, 皮质区较厚(图3G), ZW+20Bu性腺呈现伞状, 皮质区的大量生殖细胞丢失, 皮质区变薄(图3H), 整体形态呈现雌性状态。我们进一步分析了性别特异性蛋白FOXL2、DMRT1的表达变化, 免疫荧光染色结果显示, 在18期(图4A)、21期(图4E)和25期(图4I)的ZW中, FOXL2信号集中在髓质区大量表达, 在18期(图4B)、21期(图4F)和25期(图4J)的ZW+20Bu中, FOXL2信号也集中在髓质区表达, 且未见DMRT1蛋白的荧光信号; 在18期(图4C)、21期(图4G)和25期(图4K)的ZZ中, DMRT1信号集中在性索上的支持细胞中表达, 在18期(图4D)、21期(图4H)和25期(图4L)的ZZ+20Bu中,DMRT1信号集中在性索支持细胞上, 与ZZ的蛋白表达位置没有区别, 且未见FOXL2的信号。同时我们还进行了性别特异性基因Foxl2和Dmrt1的荧光定量分析, 荧光定量分析结果显示, 在ZW中,Foxl2基因高表达,Dmrt1基因表达量较低, ZW+20Bu中Foxl2基因的表达量上升,Dmrt1的表达量未发生变化。在ZZ中,Dmrt1基因高表达,Foxl2基因表达量较低, ZZ+20Bu中Dmrt1基因表达量有上升趋势, 但不具有显著性,Foxl2表达量升高, 但远远低于ZW(图5B和5D)。以上结果表明在生殖细胞减少后,中华鳖胚胎性腺的性别分化没有发生逆转。
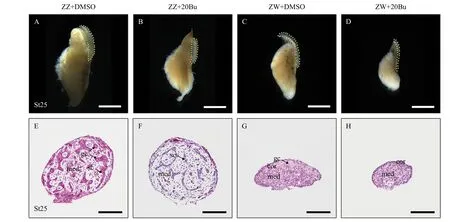
图3 生殖细胞消除后的组织形态学观察以及性腺组织结构的变化Fig. 3 Change of external and internal morphology of gonad after busulfan-treatment
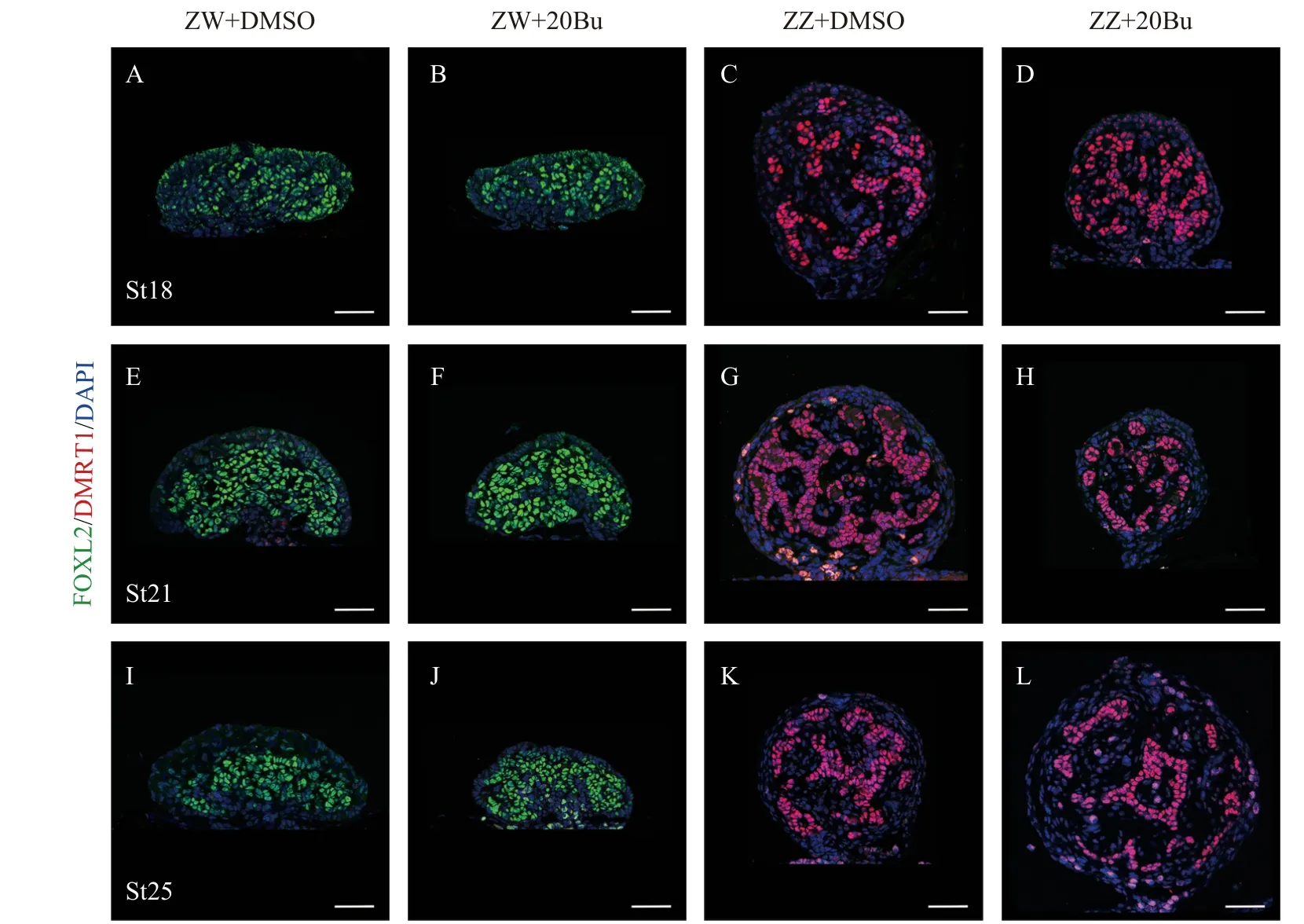
图4 生殖细胞消除后的性别特异性蛋白FOXL2和DMRT1的表达情况Fig. 4 The expression of sex-specific protein FOXL2 and DMRT1 after germ-cell-depletion
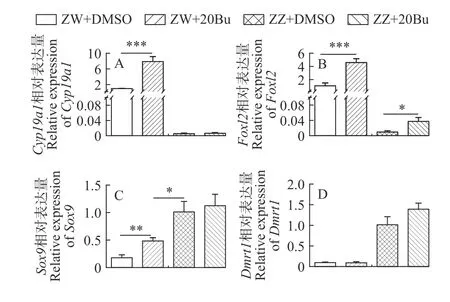
图5 生殖细胞消除后的性别特异性基因的表达变化Fig. 5 Changes of sex-specific genes expression after busulfantreatment
2.3 生殖细胞减少后对体细胞的影响
为了研究生殖细胞减少后对体细胞的影响, 通过体细胞特异性蛋白CYP19A1和SOX9的免疫荧光染色来说明生殖细胞减少后对体细胞的影响。免疫荧光染色结果显示, 在ZW中, 18期的CYP19A1的蛋白表达量不高(图6A), 同样在ZW+20Bu中, 18期的CYP19A1蛋白的表达量也很少(图6B); 另外ZW+20Bu的21期(图6F)、25期(图6J)的CYP19 A1蛋白表达区域和ZW的21期(图6E)、25期(图6I)的表达区域一致, 均集中在髓质区中大量表达; ZZ+20Bu的各个时期SOX9蛋白表达区域(图6D, 6H和6L)和ZZ(图6C, 6G和6K)中的表达区域一致, 均集中在髓质区支持细胞中表达。同时, 特异性基因Cyp19a1和Sox9荧光定量分析结果显示, 在ZW中,Cyp19a1基因大量表达,Sox9表达量较低, ZW+20Bu中的Cyp19a1表达量升高,Sox9的表达量升高但远远低于ZZ; ZZ+20Bu的Sox9大量表达,Cyp19a1表达量较低,Sox9表达量有上升趋势, 但不具有显著性,Cyp19a1的表达量没变化(图5A和5C)。以上结果表明, 生殖细胞减少后对体细胞未产生影响。
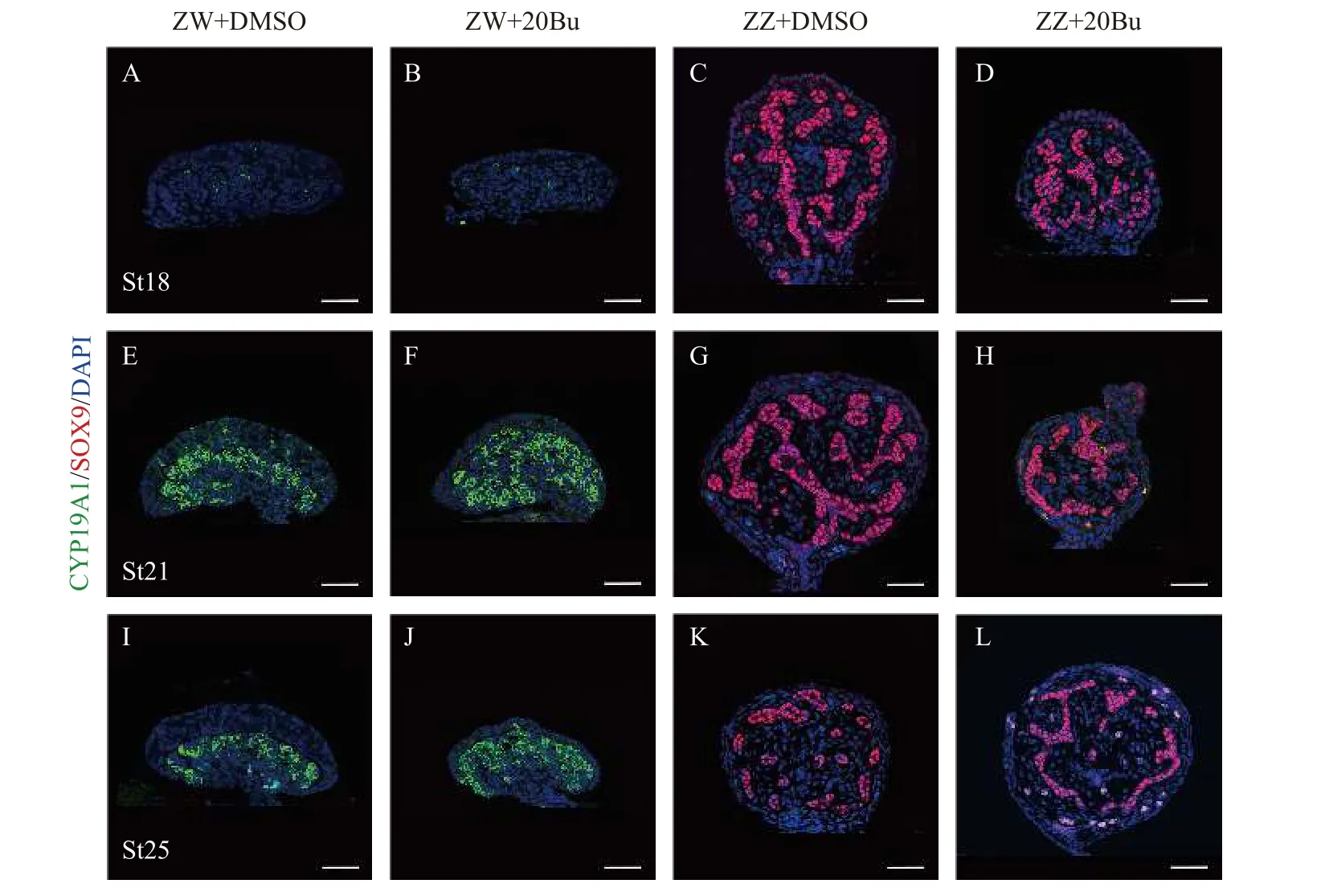
图6 生殖细胞消除后的体细胞中表达的蛋白CYP19A1和SOX9的表达情况Fig. 6 The expression of sex-specific protein CYP19A1 and SOX9 after germ-cell-depletion
3 讨论
本研究首次利用白消安处理胚胎期的中华鳖,有效地消除了中华鳖性腺中的生殖细胞, 获得了中华鳖生殖细胞消除模型。随后分析了生殖细胞消除后性别和体细胞变化, 发现消除中华鳖的生殖细胞后, 其性腺形态未发生明显改变, 利用性别特异性蛋白和标记基因分析显示其性别未发生明显改变。我们的研究表明: 消除中华鳖生殖细胞后对其性腺的形态及性别没有显著性影响, 同时也表明在爬行动物中, 生殖细胞在性别分化过程中没有决定性作用。
白消安作用于分裂期的细胞, 可使细胞内的蛋白质和核酸被烷基化[11], 其细胞毒性可造成生物的不育性[12], 被广泛应用于脊椎动物中生殖细胞的消除, 成体及胚胎期小鼠[13]、胚胎期鹅[14]、成体黄姑鱼[15]和胚胎期红耳龟[16]中都曾应用过。除此之外,消除生殖细胞可以通过敲低生殖细胞特异性基因,如通过敲低青鳉的Cxcr4基因得到了生殖细胞消除的青鳉个体[17]; 敲除斑马鱼的Dnd基因后, 其原始生殖细胞被消除[18]。
生殖细胞在脊椎动物性别分化中的作用因物种而异。斑马鱼的生殖细胞的数量与性别分化存在相关性, 所有早期斑马鱼幼体性腺中都会有一定数量的卵母细胞存在, 在后续的发育过程中, 雌性的卵母细胞正常发育, 在雄性中出现生殖细胞凋亡现象[19], 而在斑马鱼幼体发育的第一天将所有生殖细胞消除会导致全雄性发育[18]; 青鳉的生殖细胞在消除后, XX的雌性青鳉往雄性方向发展, 外形结构呈雄性, 支持细胞中同时表达Dmrt1和Foxl2[20]。而鸡和小鼠的生殖细胞在消除后, 雌雄性腺的组织学形态未发生改变, 性别没有发生逆转, 在爬行动物中, DiNapoli和Capel[16]仅对消除生殖细胞后的红耳龟性腺形态进行了观察, 而对生殖细胞在爬行动物性别分化中的作用未做深入研究。本研究在性腺形态、基因表达和蛋白表达上发现消除生殖细胞后中华鳖雌雄性别未发生变化; 在白消安处理导致生殖细胞减少后, ZW、ZZ性腺的形态学未发生变化, 性别特异性蛋白表达的区域未发生变化。此结果与在小鼠、鸡和西班牙勒突螈中一致。在XX小鼠中, 生殖细胞消除后颗粒细胞没有发生转分化的现象[13]。西班牙勒突螈的胚胎中, ZW性腺在白消安处理导致生殖细胞消除后保持明显的卵巢特征:明显的空腔及Cyp19a1高表达; 生殖细胞消除后ZZ性腺的Cyp19a1表达量仍旧是低表达, 说明生殖细胞的减少没有影响性腺分化[7]。在鸡中, 去除早期鸡胚中的新月区导致生殖细胞减少, 组织形态学观察发现处理组的睾丸及处理组卵巢的性腺形态发育均与对照组结果一致, 说明鸡中生殖细胞的减少没有导致性别的逆转[6]; 在红耳龟中, 胚胎期生殖细胞减少后, 卵巢皮质区高度发育, 髓质区退化, 而睾丸髓质区高度发育, 皮质区退化, 结果说明在红耳龟中生殖细胞的减少并未造成性别的逆转[16]。以上结果说明, 在性腺发育的过程中, 生殖细胞的消除不影响性腺的分化。然而, 有研究报道不同阶段的生殖细胞可以影响不同发育阶段的性别分化,在小鼠中, 当XY胚胎中存在减数分裂的生殖细胞时, 内皮细胞迁移和睾丸索的形成被破坏[13]; 在小鼠出生后卵母细胞因辐射而丢失后, 发现后续卵泡细胞在增殖和分化中向雄性支持细胞方向发展[13];当XX的体细胞和XY体细胞重组时发现睾丸索的结构正常生成, 但当XX的生殖细胞和XY的体细胞重组时发现睾丸索的结构被破坏[21], 这说明处于减数分裂时生殖细胞能够抑制睾丸通路进而促进卵巢的发育。在中华鳖中, 减数分裂标记基因Stra8在18期开始在雌性中高表达, 而此时胚胎也进入了性别分化阶段, 因此, 减数分裂后的生殖细胞是否在中华鳖甚至爬行动物的性别分化中发挥作用有待进一步阐明。所以本实验发现, 在中华鳖减数分裂前, 消除生殖细胞不会影响其性腺性别的分化。白消安的处理对中华鳖胚胎的整体发育的影响是非常值得关注的, 白消安的安全剂量因物种而异, 我们的实验也设计了几个不同浓度用来确定实验的最佳浓度。在20 mg/kg的浓度处理下, 出现了整体GMC大小处理组小于对照组的现象, 但整个形态没有发生变化。此结果与红耳龟和牙鲆中类似: 白消安处理胚胎期的红耳龟后, 处理组中的胚胎比对照组中的要小, 但处理组的四肢和内脏和对照组的未发现明显差异[16]; 成体牙鲆经过白消安处理后,睾丸和卵巢都缩小, 但整体的形态并没有发生改变[22]。这说明合适浓度的白消安并不会影响胚胎的整体发育, 也不会影响组织的形态发育。
在大鼠中, 白消安处理后生殖细胞数量减少,睾丸中的支持细胞、间质细胞数量减少, 支持细胞的直径变小, 但间质细胞的直径没变化, 睾丸的直径也未发生改变, 黄体生成素和促卵泡激素的水平升高, 睾酮的水平降低[23]。在红耳龟中, 白消安处理导致生殖细胞减少后, 雄性胚胎中支持细胞的数量变多, 雌性中的颗粒细胞的数量未发生明显变化[16]。在本研究中, 利用白消安消除中华鳖生殖细胞后,CYP19A1和SOX9在雌雄中的表达区域未发生改变。但Cyp19a1和Foxl2表达量在白消安处理后显著性升高。随后进行了增殖细胞核抗原(Proliferating cell nuclear antigen, PCNA)的染色, 在25期时,ZW+20Bu中的髓质区的CYP19A1和PCNA信号集中在一个细胞内表达(图7B), 这结果和ZW中的一致(图7A), 另外还进行了FOXL2和CYP19A1的共定位染色, 免疫荧光染色显示: 在25期时, FOXL2和CYP19A1的蛋白在ZW和ZW+20Bu中都定位在了同一细胞中(图7C和图7D)。此结果说明在性腺中, 体细胞并没有发生异常的增殖。因此, 我们认为Foxl2和Cyp19a1表达量升高是由于生殖细胞数量的减少导致皮质区和髓质区区域的细胞比例发生较大的变化引起的。
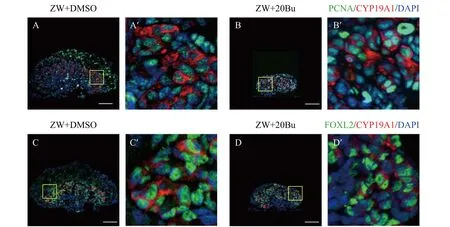
图7 生殖细胞消除后PCNA和CYP19A1共染观察细胞增殖的变化以及FOXL2和CYP19A1的蛋白表达共定位情况Fig. 7 Immunofluorescence of PCNA and CYP19A1 to observe the change of proliferation after germ-cell-depletion and immunofluorescence of FOXL2 and CYP19A1 to observe the expression distribution
生殖细胞消除的模型主要应用于生殖细胞的移植。在小鼠中, 生殖细胞消除模型主要应用于精原干细胞的移植使精子重生[24]; 在鱼类中, 消除受体的内源性生殖细胞可以显著提高外源生殖细胞的移植效率, 更高效率地达到“胚胎移植”的目的[15]。对于中华鳖的生殖细胞消除模型建立, 后续可以实现移植体外成熟的生殖细胞来实现“转基因中华鳖”。在本实验中, 应用白消安处理中华鳖成功地获得了中华鳖生殖细胞消除的模型, 得出了胚胎期中华鳖减数分裂前的生殖细胞消除不会影响性腺性别分化的结论。
