牦牛肉肌原纤维蛋白在不同pH值条件下的分子结构变化
2023-09-09屈莎胡婷唐善虎李思宁郝刚
屈莎,胡婷,唐善虎,李思宁,郝刚
(西南民族大学食品科学与技术学院,四川成都 610000)
蛋白质氧化被认为是食品变质的原因之一,它对食品质量的影响包括嫩度降低、变色和风味劣变,普遍存在于肉及肉制品加工与储藏过程中。蛋白氧化不仅会导致蛋白分子间和分子内的共价交联,还会引起蛋白主链断裂和氨基酸残基侧链基团的修饰,进而引起蛋白质功能性质如凝胶特性、界面性质及保水性发生改变[1]。肉及肉制品中的蛋白质氧化反应主要由活性促氧化物质(如活性氧物质、活性氮物质、脂类次级氧化产物及内源性氧化酶等)直接或间接地诱导发生。从而导致蛋白质结构性质的改变,包括通过非共价和共价分子间相互作用的断裂、交联聚集。活性氧(ROS)倾向于攻击蛋白质,以促进功能和巯基的丧失。氧化蛋白的其他变化包括羰基衍生物的形成、蛋白质的去折叠、表面疏水性的增加和构象的变化。在ROS中,羟基自由基分子量小,易于扩散,氧化能力强,是引起肌肉中脂肪和蛋白氧化的主要发起者,它是在过氧化氢、还原过渡金属和细胞还原剂存在下通过羟自由基(Fenton)反应形成的[2]。
pH值不仅是影响肌原纤维蛋白(MP)萃取效率的因素,也是引起蛋白构象改变的主要条件之一。pH值可以通过改变氨基酸侧链电荷的数量及分布,改变蛋白质分子间的相互作用及蛋白质分子的折叠状态,从而引起蛋白质空间结构的改变,最终影响着蛋白质的各种功能性质[3]。
牦牛分布在中国青藏高原海拔3 000 m以上地区,被誉为“高原之舟”,具有高蛋白、低脂肪、丰富的氨基酸等优点,但在其加工储藏运输过程中受环境影响易发生蛋白氧化。pH值是影响蛋白品质变化最为重要的因素之一,但目前研究多是pH值对大豆分离蛋白[4]、乳清蛋白[5]、羔羊[6]、猪肉[7]等特性的研究,对于牦牛肉的研究甚少,因此本研究在之前研究的基础上模拟酸性、中性、碱性条件下,建立了羟基自由基氧化体系(Fenton体系),从分子结构方面探究在不同pH值下不同H2O2浓度对牦牛肉MP理化特性的影响,充分挖掘蛋白氧化机理及本质,以期为深入研究肉及肉制品中蛋白质氧化的相关性提供理论基础。
1 材料与方法
1.1 材料与试剂
牦牛肉购于四川省阿坝州,宰杀后冷却排酸,快速冷冻后低温运回实验室-20 ℃保存。
EGTA(乙二醇双(2-氨基乙基酸)四乙酸)、NaH2PO4·H2O、2,4-二硝基苯肼(DNPH)、Na2HPO4·12H2O、抗坏血酸、EDTA(乙二胺四乙酸)、三氯乙酸,成都科隆化学品有限公司;盐酸胍、Tris,德国BioFroxx公司;5,5’-二硫代双(2-硝基苯甲酸)(DTNB),上海源叶生物;2,4,6-三硝基苯磺酸(TNBS),成都化夏化学;所有试剂都为分析纯。
1.2 仪器与设备
5804R冷冻离心机,德国Eppendorf公司;T-25高速匀浆机,德国IKA公司;UV1810S紫外分光光度计,上海佑科仪器仪表有限公司;F-4700型荧光分光光度计,日本那珂事务所;ASD Field Spec Pro FR傅里叶变换红外色谱,美国Boulder公司。
1.3 方法
1.3.1 肌原纤维蛋白(MP)的提取
参考Park等[8]的方法从牦牛背最长肌中分离提取肌原纤维蛋白,最终得到的沉淀MP于4 ℃冰箱中保存,48 h内使用。蛋白质质量浓度用双缩脲法进行测定,牛血清白蛋白为标准蛋白(y=0.048 1x+0.001 2,R2=0.999 7)。
1.3.2 肌原纤维蛋白氧化模型构建
参考Xiong等[9]的方法略作修改,将肌原纤维蛋白质用15 mmol/L PIPES(0.6 mol/L NaCl,pH值6.0)溶解后质量浓度为10 mg/mL的MP分散于Fenton氧化体系(0.01 mmol/L FeCl3,0.1 mmol/L抗坏血酸,5、10、15、20、40、60 mmol/L H2O2)中,用NaOH和HCl调节所需pH值(5.0、6.0、7.0、8.0),于4 ℃下氧化24 h,以1 mmol/L EDTA(最终浓度)终止氧化。对照组用去离子水代替H2O2。氧化结束后确定MP的pH值为5.0、6.0、7.0、8.0。
1.3.3 羰基的测定
羰基含量的测定参照Oliver等[10]的方法,使用2,4-二硝基苯肼(DNPH)反应方法进行测定。羰基含量表示为nmol/mg pro。
式中:
C——羰基含量,nmol/mg pro;
A1——样品吸光值;
c——MP质量浓度,mg/mL;
D——比色光径,cm;
n——稀释倍数。
1.3.4 巯基的测定
总巯基和游离巯基参考Ellman[11]的方法,采用DTNB法进行测定。巯基含量(nmol/mg pro)使用摩尔吸光系数13 600 L/(mol·cm)计算。
式中:
S——巯基含量,nmol/mg pro;
A2——样品吸光度;
c——MP质量浓度,mg/mL;
n——稀释倍数。
1.3.5 游离氨基测定
参考吴伟[12]的方法,略作修改。将一定量的肌原纤维蛋白样液分散于含1%(m/V)SDS,0.1 mol/L pH值9.3的四氢硼酸钠缓冲液中,搅拌1 h后8 000g离心20 min,取2 mL上清液与100 μL 0.03 mol/L TNBS混匀后在37 ℃保温1 h,反应结束后加入0.5 mol/L HCl调节pH值至4.0,在335 nm波长下测定其吸光度值,代入甘氨酸标准曲线(y=0.009 5x-0.001 2,R2=0.999 2),求其游离氨基。
1.3.6 溶解度的测定
参考Peyrano等[13]的方法,将1 mg/mL的MP样液离心(4 ℃,5 000g,10 min),用双缩脲法测定其上清液的蛋白浓度。溶解度表示以离心前后蛋白质质量浓度的比值来表示。
1.3.7 表面疏水性的测定
表面疏水性测定参考简华君[14]的方法,用1-苯氨基萘-8-磺酸(ANS)作为荧光探针对表面疏水性进行测定的,在激发波长374 nm,发射波长484 nm条件下测定荧光强度。后以相对荧光强度为纵坐标,蛋白浓度为横坐标作图,初始斜率即为肌原纤维蛋白质溶液的表面疏水指数。
1.3.8 内源荧光测定
参考Jiang等[15]的方法适当修改测定蛋白内源荧光光谱。用与蛋白pH值相对应的磷酸盐缓冲液(20 mmol/L,pH值5.0、6.0、7.0、8.0)调节肌原纤维蛋白浓度至0.5 mg/mL,在激发波长295 nm条件下,测定色氨酸在300~400 nm间的荧光光谱。
1.3.9 傅里叶红外光谱测定
参考Kang等[16]的方法,略作修改。将氧化后的蛋白真空冷冻干燥机中冷冻干燥后,用傅立叶红外光谱仪测定。结果用Peak fit 4.0软件分析1 600~1 700 cm-1的图谱。
1.3.10 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)
参考Xiong等[17]的方法,略作修改。将蛋白质量浓度调至1.0 mg/mL,与5×上样缓冲液混合(蛋白:上样缓冲液=4:1,V/V),水浴5 min冷却至室温,离心(10 000g,10 min),取上清液用于电泳分析。样品上样体积10 μL,分离胶浓度12%,浓缩胶浓度5%,电极缓冲液为Tris-甘氨酸缓冲液(0.05 mol/L Tris,0.384 mol/L甘氨酸,0.1% SDS(V/V,pH值8.3)。电泳结束后用考马斯亮蓝R-250染色,用洗脱液(10%乙醇,10%冰醋酸,V/V)进行脱色。
1.3.11 数据分析
数据处理和差异显著性分析分别采用Excel进行数据分析,SPSS软件中的Duncan比较进行显著性水平分析,绘图采用Origin软件进行,所有实验均进行三次平行。
2 结果与分析
2.1 蛋白氧化对牦牛肉MP羰基含量的影响
如图1所示,随着MP中H2O2浓度的升高,羰基含量增加,与对照组相比,羰基含量增加显著(P<0.05),但10~15 mmol/L、15~20 mmol/L、40~60 mmol/L之间羰基含量不显著(P>0.05),蛋白氧化产生的羰基可与其他蛋白分子的氨基(赖氨酸残基的ε-氨基)发生席夫碱反应使蛋白间产生共价交联,因此蛋白氧化过程中羰基在不断产生的同时也在一定程度上消耗[18]。pH值对H2O2浓度为5 mmol/L的MP羰基含量无显著影响(P>0.05),随着H2O2浓度的加深,pH值7.0、8.0时(远离肌原纤维蛋白等电点(pI,5.0~5.5)[19])羰基含量上升速率明显低于pH值5.0、6.0(pI附近)的羰基增速,尤其是pH值6.0,说明在同等氧化条件下,等电点附近的MP更易受羟自由基(·OH)攻击导致蛋白主肽链断裂。
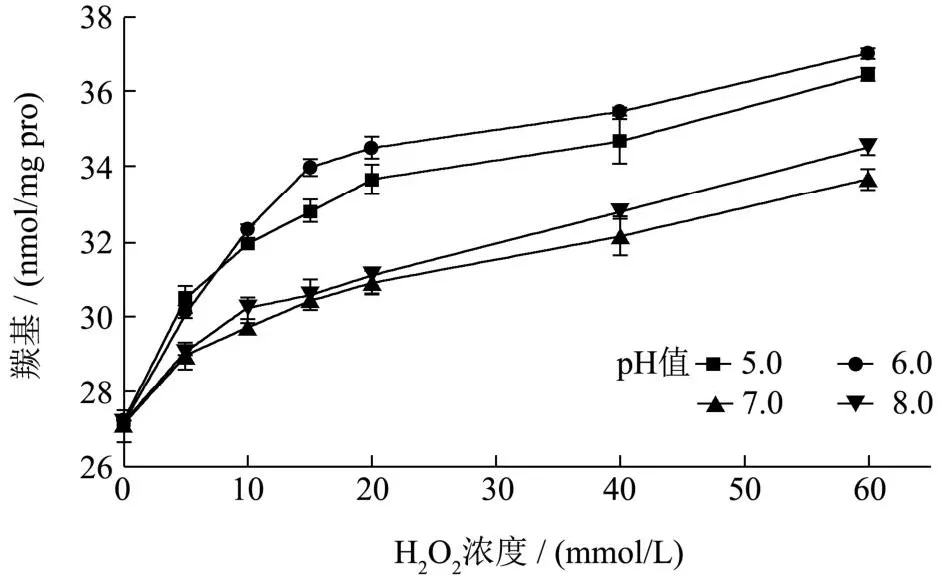
图1 不同pH值(5.0、6.0、7.0、8.0)下不同H202浓度对MP羰基含量的影响Fig.1 Effect of different H2O2 concentration on carbonyl of MP at different pH values (5.0, 6.0, 7.0, 8.0)
2.2 蛋白氧化对牦牛肉MP巯基的影响
半胱氨酸的巯基是对氧化最敏感的蛋白侧链基团之一,是MP中一个关键的活性官能团,微环境的变化诱导蛋白质结构的展开可以暴露半胱氨酸残基,最终导致二硫键的形成进一步导致蛋白分子聚集,因此巯基是除羰基外另一个衡量蛋白氧化的重要指标[20]。如图2所示,随着蛋白氧化程度的加深,总巯基含量降低显著(P<0.05),同时,随着H2O2浓度的增加,游离巯基显著降低(P<0.05)。氧化后,总巯基和游离巯基显著低于对照组,表明牦牛肉MP巯基对羟基自由基敏感。巯基氧化可分为可逆状态(二硫键结合和次磺酸)和不可逆状态(亚硫酸盐和磺酸)[12],在同等氧化条件下,pH值为7.0、8.0时(远离pI),MP总巯基下降的绝对值大于游离巯基下降的绝对值,表明蛋白氧化使得MP二硫键含量下降,即MP巯基被氧化成不可逆状态,形成了含硫化合物。而pH值为5.0、6.0时(pI附近),MP游离巯基下降的绝对值大于总巯基下降的绝对值,表明蛋白氧化使得MP二硫键含量上升,说明游离巯基氧化成二硫键的量大于二硫键转化成不可逆氧化状态的量。在酸性条件下巯基下降速率大于在碱性条件下,这表明酸处理的蛋白更容易通过硫醇-二硫化物交换反应在分子间形成新的二硫键[21]。
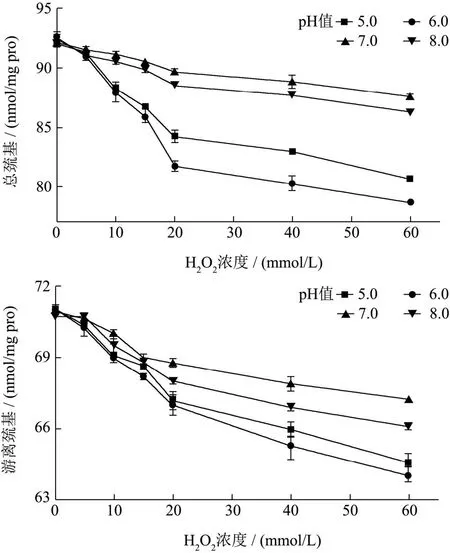
图2 不同pH值下不同H2O2浓度对MP于巯基含量的影响Fig.2 Effect of different H2O2 degree on MP sulfhydryl under different pH values
2.3 蛋白氧化对牦牛肉MP游离氨基的影响
游离氨基是用来反映蛋白氧化程度的常用指标。如图3所示随着H2O2浓度的增加,游离氨基含量显著降低(P<0.05),当MP中H2O2浓度达到60 mmol/L时,游离氨基大约是对照组的一半。蛋白氧化产生的羰基会与蛋白质的氨基反应形成席夫碱,导致蛋白分子中游离氨基下降;肉制品中脂肪氧化产物烯醛类物质可以与半胱氨酸、赖氨酸残基、组氨酸发生迈克尔加成反应,导致蛋白中游离氨基的下降;当氧化引起蛋白共价交联形成聚集体时,由于氨基包裹在聚集体内部而未被试剂检测到,这也会造成游离氨基量的下降[22]。随着氧化条件的加强,pH值7.0、8.0时(远离pI)游离氨基下降速率明显低于pH值5.0、6.0时(pI附近),pH值为6.0时MP氧化程度最深,这一结果与羰基结果相吻合。
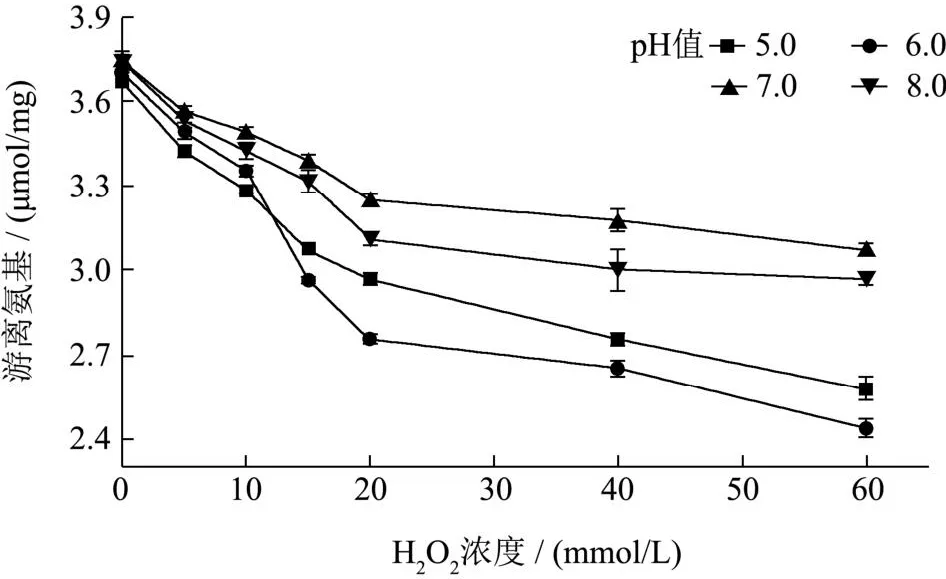
图3 不同pH值下不同H202浓度对MP游离氨基的影响Fig.3 Effects of different H2O2 levels on MP free amino groups at different pH values
2.4 蛋白氧化对牦牛肉MP溶解度的影响
蛋白溶解度主要受蛋白质分子间相互作用(如疏水相互作用、二硫键等)与蛋白质-水相互作用(如离子-偶极、偶极-偶极等)两方面作用力的影响[23]。蛋白质-水相互作用增强则蛋白溶解度上升,蛋白质-蛋白质相互作用增强则蛋白溶解度下降。不同pH值、不同H2O2浓度下MP溶解度变化如图4所示。相同H2O2浓度下随着pH值的增加蛋白溶解度显著增加(P<0.05)。MP在pI(5.3左右)附近所带的电荷最少,蛋白质之间缺乏静电排斥,分子间作用由于疏水相互作用而得到增强,导致蛋白聚集或沉淀。随着pH值远离pI,MP所带负电荷增加,静电斥力分子间相互作用力减弱,使得蛋白质-水相互作用逐渐增强,导致蛋白溶解度升高。在同一pH值下,随着蛋白氧化浓度的增加,MP溶解度与对照组相比溶显著减低(P<0.05)。这主要是由于蛋白氧化引起共价交联,形成不溶性聚集体,而且随H2O2浓度不断上升不溶性聚集体越多,引起蛋白溶解度进一步下降[22]。

图4 不同pH值下不同H202浓度对MP溶解度的影响Fig.4 Effect of different H2O2 levels on MP solubility at different pH values
2.5 蛋白氧化对牦牛肉MP表面疏水性的影响
表面疏水性是评估蛋白质化学和物理状态变化的一个指标[24]。荧光探针1-苯氨基萘-8-磺酸(ANS)处于水相环境时几乎不发射荧光,当处于疏水环境中时,ANS荧光强度大大增强,因此ANS探针的荧光强度变化可反应其所处微环境的疏水性改变。ANS倾向与蛋白疏水区域结合,采用ANS可测定蛋白表面疏水性变化。由图5可知,当pH值一定时,随着H2O2浓度的增加,与对照组相比疏水性显著升高(P<0.05),H2O2浓度越大,蛋白表面疏水性越大。这是因为蛋白氧化导致蛋白构象发生改变,蛋白质去折叠,大量疏水基团暴露。另外,氧化过程中球蛋白表面氨基酸残基被氧化修饰引起的疏水性变化较为复杂,Met的疏水性侧链转化为亲水基团;Lys的ε-氨基氧化成电中性的羰基衍生物,降低了正电荷性,导致亲水性下降;而Lys、Cys及His能与肉品中脂类的氧化产物α,β-不饱和醛发生迈克尔加成,在蛋白侧链上接上长链烷烃,从而使疏水性增加[25]。pH值5.0时的疏水性显著高于其他组(P<0.05),在等电点附近时,MP表面电荷减少,分子间斥力降低,蛋白彼此形成疏水性聚集体,随着pH值增加逐渐远离pI,分子间排斥力增强,靠疏水相互作用驱动的蛋白质聚集行为削弱,疏水性降低[24]。

图5 不同pH值下不同H202浓度对MP表面疏水性的影响Fig.5 Effect of different H2O2 degrees on the hydrophobicity of MP surfaces at different pH values

图6 不同pH值下不同H2O2浓度对MP内源荧光的影响Fig.6 Effect of different H2O2 levels on endogenous fluorescence of MP at different pH values
2.6 蛋白氧化对牦牛肉MP内源荧光的影响
色氨酸内源荧光可以反应MP色氨酸所处微环境和氧化状态的变化[26],进而能够表征蛋白氧化对MP高级结构的影响。在各pH值组中,随着H2O2浓度的增加各样品的λmax蓝移,且与对照组相比,λmax蓝移显著(P<0.05),且荧光强度(FI)持续下降,各处理组间差异显著(P<0.05),λmax从最初的342左右蓝移至339左右,FI下降了1.3倍,色氨酸是蛋白质氨基酸中单电子氧化势能最低的氨基酸,对·OH较为敏感,很容易被氧化成色氨酸自由基,与分子氧结合后形成色氨酸过氧化自由基,最终形成犬尿氨酸,引起内源荧光强度下降。λmax与色氨酸所处微环境有关,当色氨酸残基由水相环境转移到疏水环境时,其荧光光谱会蓝移,当色氨酸残基由疏水环境转移到水相环境时,荧光光谱会红移。Trp荧光光谱的蓝移表明,由于氧化引起蛋白质聚集,MP中最先暴露的色氨酸残基嵌入到了氧化MP聚集体的内部[25]。pH值为5.0时的λmax显著高于其它pH值组(P<0.05),即随着pH值的增加,λmax蓝移,这一结果是由于当pH值在pI附近时,易发生蛋白氧化,发生去折叠现象,三级结构展开引起疏水基团暴露[27],疏水性增强,这与之前疏水性研究一致。而pH值在7.0和8.0时TrpFI显著高于pH值为5.0时,这可能是因为大多数具有酸性或碱性官能团的芳香化合物的荧光与溶液的pH值有关。不同的pH值、化合物的不同状态、化合物分子和离子的不同电子构型,使得荧光强度就有了一定差异[28]。
2.7 蛋白氧化对牦牛肉MP二级结构的影响
蛋白质氧化引起的主肽链断裂和共价交联都会伴随着内部结构的改变,其中蛋白质二级结构的改变是最为重要的指标之一,可利用红外光谱(FT-IR)进行测量。在酰胺I区(1 600~1 700 cm-1)可以反映蛋白二级结构的变化。肽链中N-H基团的平面弯曲和C-O基团的伸缩振动会影响这一区域,此外,肽键中C-N的伸缩振动也能改变这一区域[29]。牦牛肉MP的α-螺旋、β-折叠、β-转角以及无规则卷曲变化如图7所示,不同pH值条件下,随着H2O2浓度的增加,无规则卷曲显著增加(P<0.05),即二级结构总比例显著下降。其中β-折叠显著增加(P<0.05),α-螺旋和β-转角显著减少(P<0.05),蛋白二级结构由有序变为无序,朝着不稳定的方向转变。而与pH值7.0相比,pH值5.0和6.0处理的肌原纤维蛋白质具有较高的β-折叠结构和较低的α-螺旋。

图7 不同pH值下不同H2O2浓度对MP二级结构的影响Fig.7 Effect of different H2O2 degree on MP secondary structure at different pH values
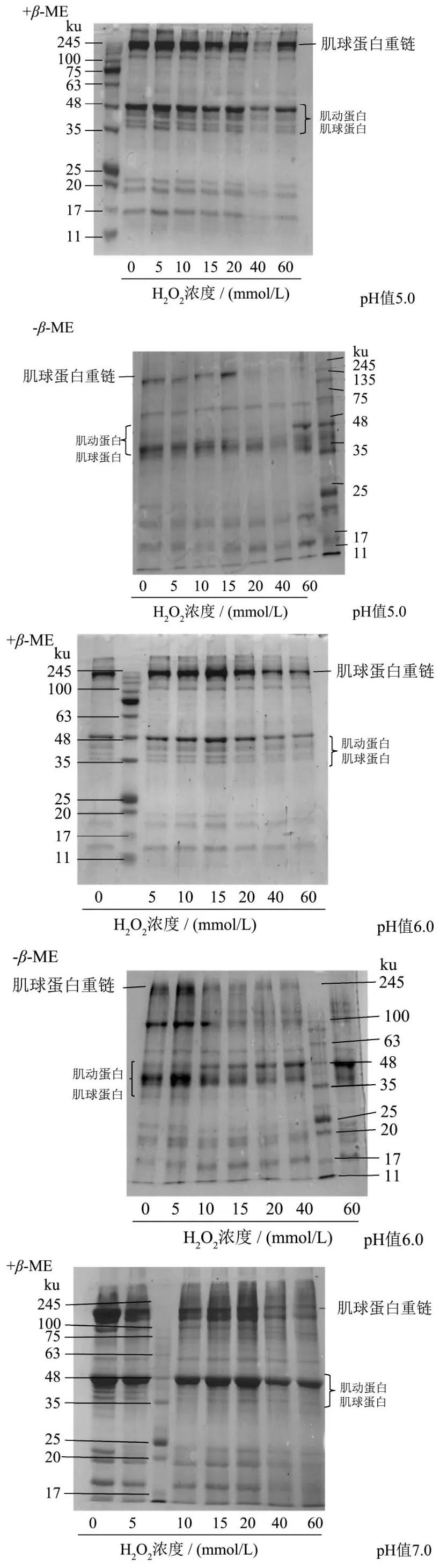
2.8 MP SDS-PAGE分析
蛋白主肽链的氧化会引起肽链断裂,蛋白分子量减少,同时蛋白质侧链基团如半胱氨酸巯基氧化形成二硫键、酪氨酸氧化形成二聚酪氨酸,使得蛋白质分子间发生交联聚集[30],此外蛋白氧化产生的羰基衍生物可与其他蛋白的氨基通过席夫碱反应形成交联聚集,SDS-PAGE电泳可以分析氧化后MP的聚集情况。β巯基乙醇(β-ME)作为一种强还原剂,可还原二硫键[31]。由图8可知,当pH值为5.0时,H2O2浓度>20 mmol/L时,未加β-ME的肌球蛋白重链(MHC)条带几乎消失,随H2O2浓度深入蛋白交联聚集程度逐渐加强,而加入β-ME的MHC还有清晰可见的条带,但比低浓度组(<20 mmol/L)颜色浅,可见MP在低浓度氧化时的交联主要依靠二硫键,而在较高浓度氧化时,其他的共价交联占有相当比例。pH值为6.0时,未加β-ME的MHC条带随着H2O2浓度增加(>5 mmol/L)颜色变浅,60 mmol/L时条带几乎消失;而加入β-ME的条带与pH值为5.0时的情况类似,H2O2>5 mmol/L时,蛋白已经发生聚集,且以二硫键交联为主,高浓度时其他的共价交联形式增多。pH值7.0时,未加β-ME的MHC条带要在60 mmol/L时才开始变浅,此前蛋白氧化交联程度较低,较少形成二硫键。pH值8.0时,无论是否加入β-ME,MHC条带与对照组相比差别不明显。因此在氧化过程中,MP在酸性条件下更易发生交联聚集,在低氧化环境中,二硫键是导致蛋白发生交联的主要作用力,H2O2浓度增加也会导致其他的共价交联,这也证明了半胱氨酸的巯基相对于其他蛋白质侧链基团要对氧化更敏感。
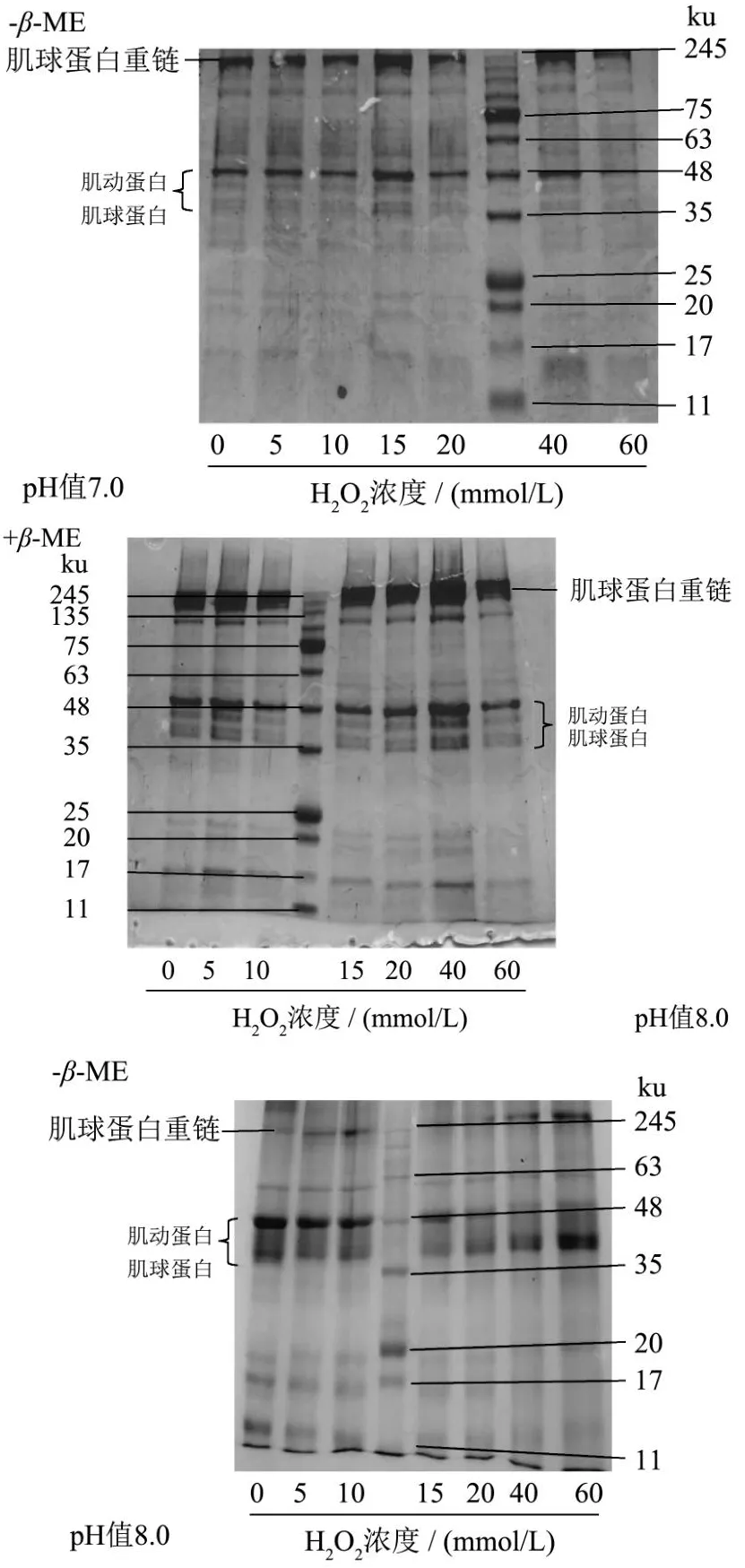
图8 在不同pH值下不同H2O2浓度的电泳图Fig.8 Electrophoresis diagram of different H2O2 levels at different pH values
3 结论
本研究讨论了不同pH值下不同H2O2浓度对牦牛肉MP在分子水平上的影响。在一定pH值条件下随着H2O2浓度的增加羰基、表面疏水性显著增加(P<0.05),总巯基、游离巯基、游离氨基、溶解度、内源荧光强度显著下降(P<0.05),λmax蓝移,二级结构总比例显著下降(P<0.05),其中,β-折叠显著增加(P<0.05),α-螺旋和β-转角显著减少(P<0.05),蛋白分子间发生交联聚合;在一定氧化条件下,等电点附近,肌原纤维蛋白的氧化程度更高,这是由于等电点附近,静电荷少,蛋白之间静电斥力小,蛋白与水之间相互作用力低,MP更易受到羟自由基的攻击。随着pH值偏离等电点,表面疏水性显著降低(P<0.05),溶解度显著增加(P<0.05),λmax蓝移,FI显著增加(P<0.05),β-折叠结构降低,α-螺旋结构增加,pH值在6.0时,蛋白生成的聚集体稳定性较好。MP的氧化伴随着二级结构转变、骨架断裂和交联聚集,二硫和非二硫共价键都贡献了蛋白的交联,而MP的分子结构的改变进一步影响了其功能,包括溶解性、凝胶性和乳化性等的变化。
