葛根素治疗阿尔茨海默病作用机制的网络药理学及分子对接研究
2023-09-08巴宗韬高外毛热爱拉阿合力江
巴宗韬,高外毛,热爱拉·阿合力江,徐 颖,王 健
1.上海中医药大学康复医学院(上海 201203);2.上海中医药大学中西医结合学院(上海 201203)
阿尔茨海默病(Alzheimer's disease,AD)是一种神经退行性疾病,其特征是有β-淀粉样蛋白(Aβ)沉积形成老年斑和tau 蛋白过度磷酸化导致神经纤维缠结[1]。AD 病因迄今不明,一般被认为是起因复杂的异质性疾病,可能是由多种因素同时参与致病,如遗传因素、氧化应激与炎症反应、神经递质功能紊乱和环境因素等。AD 多发于老年人,由于全球人口老龄化的加剧,AD 患者与日俱增。但目前,临床上尚无有效阻止AD 发生或能逆转其进展的治疗药物,急需寻找实质性改变AD 患者临床进程的靶标。
比较公认的AD 发病机制指出,Aβ 生成和清除的稳态被打破是神经元变性和痴呆发生的原始诱因,其可诱导tau 蛋白过度磷酸化、炎症反应、神经元凋亡等一系列病理过程。早老素1和2条件性双基因敲除(PS cDKO)的成年小鼠前脑中出现了神经元和突触丢失、星形胶质细胞增生和tau 的过度磷酸化,这与AD 的神经病理学很相似,因此被选用为研究AD 病理和药理学机制的动物模型[2]。
葛根素(puerarin,Pue)是从葛根中提取的主要生物活性成分,已广泛用于心脑血管疾病、糖尿病及糖尿病并发症、骨坏死、帕金森病、AD、子宫内膜异位症、癌症的治疗。Pue 拥有广泛的药理特性,如血管舒张、心脏保护、神经保护、抗氧化、抗癌、抗炎、减轻疼痛、促进骨骼形成、抑制酒精摄入和减弱胰岛素抵抗等,因此具有广泛的药用价值。
课题组的前期研究[3]表明,Pue 能够通过调控PS cDKO 小鼠的突触功能来改善AD 样的病理表现,但是并没有深入开展进一步的机制研究。网络药理学一直被用作中医药药理基础与作用机制研究的热门工具,并广泛应用于中药活性成分筛选、药物重定位、中药配伍机制探索及中医药多成分、多靶点、多通路的作用机制阐释等。为此,本研究基于网络药理学和分子对接筛选了Pue 治疗AD 的关键分子、核心靶点和所涉及的重点信号通路,同时采用动物实验验证,以期对已有的成果进行补充,并为Pue 的临床应用和开发提供新的思路。
1 研究思路
通过中药系统药理学数据库与分析平台(TCMSP,https://old.tcmsp-e.com/tcmsp.php)、集成药效团匹配平台(PharmMapper,http://lilab-ecust.cn/pharmmapper/index.html)等获取Pue 的作用靶点,利用人类基因综合数据库(GeneCards,https://www.genecards.org)获取AD 相关靶点;药物与疾病靶点映射后获取交集靶点,应用蛋白互作网络分析数据库(String,https://cn.string-db.org)构建蛋白质相互作用网络图,并筛选出核心靶点进行分子对接;通过生物信息数据库(DAVID,https://david.ncifcrf.gov)对核心靶点进行基因本体论(GO)功能富集分析,在京都基因和基因组百科全书数据库(KEGG,https://www.genome.jp/kegg/)进行信号通路分析,最后进行动物实验验证结果。见图1。

图1 葛根素治疗阿尔茨海默病的网络药理学研究思路
2 方法
2.1 Pue 靶点预测 采用TCMSP 以及PharmMapper 等数据库以“puerarin”为检索词,通过TCMSP 数据库下载Pue 的2D 结构及靶点;并在PharmMapper 数据库中使用上述mol2 格式文件导出该数据库收录的Pue 潜在的靶点。将上述靶点在整合蛋白质数据库(Uniprot,https://www.uniprot.org)中转换为对应的基因靶点并去重,对获得的靶基因进行规范和验证。
2.2 AD相关疾病靶点获取 在GeneCards数据库中以“Alzheimer's disease”为关键词检索与AD 相关的疾病靶点,然后利用Uniprot 数据库对靶基因进行验证和补充。根据相关性分数(Relevance score)值筛选后,将上述药物-疾病靶基因上传至Venny 2.1.0 平台进行映射,得到交集靶点。
2.3 蛋白质-蛋白质相互作用网络(PPI)的构建 将Pue 的预测靶点与AD 相关靶点的交集导入String 数据库,物种限定为人(Homo sapiens),设置置信度>0.5,隐藏离散蛋白节点,构建Pue-AD 疾病靶点PPI 并导出。使用Cytoscape 3.9.1软件对PPI网络进行分析和优化处理,利用Network Analyzer 分析其Degree 等网络拓扑特征值。以超过度中心性的中位数作为筛选标准,选取核心靶点。
2.4 GO 富集分析和KEGG 信号通路分析 将Pue 干预AD 的核心靶点通过进一步的基因注释和通路分析,确定其代表的功能。将核心靶点导入DAVID数据库与KEGG数据库,限定物种为人,设定阈值P<0.05,然后进行基因功能和通路富集分析,并依据P-vaule 值排序,对分析结果进行可视化处理。
2.5 分子对接验证 选取PPI 网络图中Degree 值排名前6 的靶点与Pue 进行分子对接。从SWISS-MODEL(https://swissmodel.expasy.org)数据库中获取PPI 网络中度值前6 的靶标蛋白的PDB ID,依次输入PDB 蛋白质结构数据库(RCSB PDB,https://www.rcsb.org),在数据库获取对应蛋白结构的PDB 格式文件。在Pymol 软件中对Pue 的mol2 格式文件进行预处理并转换为PDB格式,再将Pue PDB 格式文件与所有蛋白PDB 格式文件在AutoDockTools 1.5.7 软件中进行去水、加氢和电荷平衡等预处理,并获取Pue与所有蛋白结构的口袋位置参数,然后导出为PDBQT 格式文件。应用Vina 软件进行分子对接得到分子结合效能(affinity)。应用Pymol软件对结果进行可视化处理。
2.6 动物实验验证
2.6.1 动物 SPF 小鼠40 只,体质量为(25±3)g,雌雄各半,由华东师范大学脑功能基因组学研究所赠送。对于PS cDKO小鼠的繁殖和鉴定方法同前期研究[4],其中携带转基因Cre,PS1和PS2的基因型为fPS1/fPS1、PS2-/-的小鼠作为PS cDKO 小鼠,不携带Cre基因且PS1和PS2的基因型为PS1+/+、PS2+/+的小鼠作为WT 小鼠。所有小鼠均饲养在上海中医药大学实验动物中心SPF级动物房,饲养温度为(22±2)℃,明暗交替周期为12 h,自由饮水与摄食。动物生产合格证号:SCXK(沪)2017-0011。动物使用许可证号:SYXK(沪)2020-0009。与实验动物相关的实验操作遵守伦理规定,经过上海中医药大学实验动物管理和使用委员会批准(伦理批准号:PZSHUTCM221017015)。
2.6.2 药物 Pue,上海同田生物技术股份有限公司(批号:1601262);二甲基亚砜(DMSO),美国Sigma-Aldrich 公司(批号:D2650);兔抗裂解的半胱氨酸蛋白酶-3(Cleaved Caspase-3),美国CST 公司(批号:9661S);兔抗细胞外调节蛋白激酶[p44/42 MAPK(Erk1/2)],美国CST 公司(批号:4695S);兔抗磷酸化细胞外调节蛋白激酶[p-p44/42 MAPK(Erk1/2)],美国CST 公司(批号:4370S)。
2.6.3 主要仪器及软件 多功能酶标仪,美国BioTek公司(型号:Synergy2);电泳仪,美国Bio-Rad 公司(型号:PowerPacTMHC);全自动凝胶成像仪,上海天能公司(型号:Tanon-4200SF);VisuTrack 啮齿类动物行为分析软件,上海欣软公司(型号:XR-VT);ImageJ 软件,美国National Institutes of Health 公司。
2.6.4 分组与干预 将5 月龄的PS cDKO 小鼠随机分为模型组(PS cDKO)和模型+Pue 组(cDKO+Pue);将同窝野生型小鼠随机分为野生型组(WT)和野生型+Pue组(WT+Pue)。每组10 只。WT+Pue 组和cDKO+Pue 组的小鼠给予Pue(100 mg/kg)的腹腔注射治疗,WT 组和cDKO 组的小鼠给予相同溶媒0.02%DMSO 注射,共治疗30 d,然后进行行为学测试,测试结束后取材进行分子生物学检测。第31 天进行行为学测试,行为学测试期间继续如前给予Pue治疗。
2.6.5 检测指标与方法
2.6.5.1 Y迷宫实验 Y迷宫实验是利用啮齿动物对新异环境的探索天性,测定动物的空间识别记忆能力。Y迷宫实验具体操作参照前期研究[3],Y 迷宫用于测试动物的辨别记忆、参考记忆、工作记忆,由3个完全相同的臂(30 cm×6 cm×15 cm)组成,各个臂之间夹角是120°。小鼠始终从同一臂出发,将另一臂定义为新异臂后将其封闭,使小鼠自由探索8 min。1 h 后将新异臂打开,使小鼠探索整个迷宫8 min。计算得到小鼠在新异臂停留的时间比和进入新异臂的次数。两次实验之间清理迷宫,使用75%乙醇驱除小鼠残留气味。
2.6.5.2 Western blot 实验 小鼠麻醉后在冰上取海马放于液氮中冷冻,实验时用预冷的组织裂解缓冲液以及1 mmol/L 苯甲烷磺酰氟、蛋白酶和磷酸酶抑制剂裂解所需组织。在4 ℃、15 000 r/min的条件下离心30 min获得裂解液,提取核蛋白并定量。每样取40 μg 用10%和12%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)作用,然后转移到硝化纤维素膜上。将在4 ℃与一抗Cleaved Caspase-3(1∶1 000)、兔抗p44/42 MAPK(Erk1/2)(1∶1 000)、兔抗p-p44/42 MAPK(Erk1/2)(1∶2 000)孵育一夜的硝化纤维素膜与酶标二抗(1∶3 000)在室温下孵育1 h,并使用发光底物进行孵育。用全自动凝胶成像仪扫描条带,用ImageJ 软件对蛋白条带强度进行定量。相对蛋白水平归一化为β-肌动蛋白水平。
2.7 统计学方法 用SPSS Statistics 24.0 软件进行数据分析,组间数据比较采用单因素方差分析(单因素ANOVA)。计量资料采用±s表示,以P<0.05 为差异有统计学意义。
3 结果
3.1 预测Pue靶点 通过TCMSP、PharmMapper数据库检索以及查阅文献补充,最终共得到预测靶点340个。
3.2 AD相关靶点筛选 从相关数据库获得AD相关靶点11 120 个。根据经验设定相关性分数大于中位数的相关靶点为AD 的潜在靶点,则通过GeneCards 所得AD靶点相关性分数最大值为158.657 44,最小值为0.105 21,中位数为2.502 06,得到靶点5 560 个;再取中位数筛选两次后得到最大值为158.657 44,最小值为5.885 89,中位数为12.110 79。故设定相关性分数>12.110 79 的靶点为AD 的潜在靶点。最终得到1 130 个靶点。在Venny 2.1.0 平台将预测的药物成分靶点与AD 靶点取交集,得到交集靶点118 个,并绘制韦恩(Venn)图。见图2。

图2 葛根素治疗阿尔茨海默病靶点的韦恩图
3.3 构建PPI 将“3.2”中所获得的118 个靶点利用String 数据库分析,构建PPI 模型。见图3。将String 数据库结果导入Cytoscape 3.9.1软件中对PPI网络进行分析和可视化处理,节点颜色及大小的变化与度中心性呈正相关,因此可直观获得Pue 治疗AD 的核心靶点。PPI网络具有比预期更多的边缘,表明这些蛋白质至少部分地作为一个群体进行生物学连接,整个网络高度互动。结果显示,Pue 治疗AD 的效应机制可能与丝氨酸/苏氨酸蛋白激酶1(AKT1)、半胱氨酸蛋白酶(CASP3)、白蛋白(ALB)、表皮生长因子受体(EGFR)、肿瘤坏死因子(TNF)、血管内皮生长因子A(VEGFA)等蛋白相关。

图3 葛根素治疗阿尔茨海默病的靶点
3.4 GO 富集分析和KEGG 信号通路分析 对Pue 干预AD 的核心靶点通过DAVID 数据库进行GO 富集分析,共得到GO 条目148 个(P<0.05)。其中生物过程(BP)条目100 个,细胞组成(CC)条目23 个,分子功能(MF)条目25个,见图4。其中BP条目主要涉及Erk1和Erk2 级联的正调节(positive regulation of Erk1 and Erk2 cascade)、丝裂原活化蛋白激酶(MAPK)级联的正调节(positive regulation of MAPK cascade)、蛋白质磷酸化的正调节(positive regulation of protein phosphorylation)、蛋白质自磷酸化(protein autophosphorylation)等;CC 条目主要涉及谷氨酸能突触(glutamatergic synapse)、突触后膜(postsynapse)、神经元细胞体(neuronal cell body)等;MF 条目主要涉及相同蛋白结合(identical protein binding)、酶结合(enzyme binding)、蛋白激酶结合(protein kinase binding)、蛋白磷酸酶结合(protein phosphatase binding)、蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性(protein serine/threonine/tyrosine kinase activity)等。

图4 基因本体论数据库(GO)富集结果
再对核心靶点进行KEGG 通路富集分析,得到11条信号通路(P<0.05),分别为白介素-17(IL-17)信号通路、血管内皮生长因子(VEGF)信号通路、丝裂原活化蛋白激酶(MAPK)信号通路、磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/AKT)信号通路、AD 信号通路、核因子-κB(NF-κB)信号通路、环磷酸腺苷(cAMP)信号通路、激酶Janus 和转录因子STAT(JAK-STAT)信号通路等,见图5。将上述靶点输入KEGG 数据库做通路图富集,选择代表性的通路图进行展示,见图5。上述表明Pue 通过调控多条信号通路来干预AD的发展。

图5 京都基因和基因组百科全书数据库(KEGG)通路筛选
3.5 分子对接分析 本研究分子对接结果显示见表1。结果进行可视化展示,见图6。表明Pue 可通过与其相应的靶点受体结合而影响其功能,在AD 治疗中发挥重要作用。

表1 分子对接结果

图6 分子对接结果可视化展示
3.6 Y 迷宫实验结果 结果表明,与WT 小鼠比较,PS cDKO 小鼠在新臂的停留时间和探索新臂的次数均降低(P<0.05),表明PS cDKO 小鼠的空间识别记忆能力受损;经过Pue治疗后,这些情况发生了逆转(P<0.05),表明Pue可以改善PS cDKO小鼠的空间识别记忆障碍。见图7。
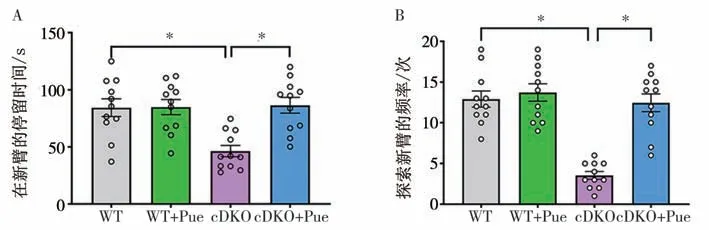
图7 Pue对小鼠的空间识别记忆障碍的影响
3.7 Western blot实验结果 与WT 组比较,cDKO 组小鼠前额皮质p-Erk1/2 蛋白水平升高(P<0.05);与cDKO组比较,cDKO+Pue 组小鼠前额皮质p-Erk1/2 蛋白水平降低(P<0.05)。与WT 组比较,cDKO 组小鼠前额皮质Cleaved Caspase-3 蛋白水平升高(P<0.05);与cDKO 组比较,cDKO+Pue 组小鼠前额皮质Cleaved Caspase-3 蛋白水平降低(P<0.05)。见图8。

图8 各组前额皮质p-Erk1/2、Erk1/2、Cleaved Caspase-3蛋白表达情况
4 讨论
近年来研究[5]显示天然化合物尤其是中药及其产物可以通过作用于多种机制来抑制AD 的发生和发展,在药物开发困境尚未突破的今天,中药因为其多靶点治疗效应,已经成为AD 药物开发的潜在对象。葛根为豆科植物葛的块根,于春、秋两季采挖,洗净后去除外皮,切片干燥后使用。《神农本草经》言其能平消渴,除大热,止呕吐,通诸痹,起阴气,解诸毒。Pue 是从葛根中分离的异黄酮类衍生物。药物代谢动力学显示,作用于体内后Pue 主要分布于心脏、肺、脾、胃、乳房、肝、肾及血浆、睾丸、肌肉、胫骨和股骨,并可透过血脑屏障进入脑内[6]。Pue 可以减轻蛛网膜下腔出血小鼠的神经功能缺损,有效减轻脑水肿,保护血脑屏障;并可能是通过B淋巴细胞瘤-2(Bcl-2)/Bcl-2相关蛋白质(Bax)/Cleaved Caspase-3 和去乙酰化酶3(Sirt3)/超氧化物歧化酶2(SOD2)凋亡途径减轻蛛网膜下腔出血小鼠的神经功能缺损。[7]Pue 还在一定程度上恢复了AD 模型小鼠海马和大脑皮质内脑源性神经营养因子、tau 蛋白磷酸化、丙二醛、乙酰胆碱酯酶、糖原合成酶激酶-3β 的水平,以及SOD 的活性,表明Pue 可能对Aβ 诱导的认知损伤具有保护作用[8]。Pue 为葛根的特有异黄酮,研究[9]显示口服高剂量Pue 在大鼠体内吸收较好,且安全性良好。Pue在AD中发挥神经保护作用的研究[10]主要涉及PI3K/AKT、c-Jun氨基末端激酶(JNK)、Caspase-3、糖原合成酶激酶-3β(GSK-3β)等信号通路,可通过抑制氧化应激、凋亡、Aβ 产生和沉积,降低tau 蛋白过度磷酸化,调控铁代谢、抑制脂质过氧化、抗炎和改善突触可塑性,以及可能抑制铁死亡等机制,在AD 中具有独特的药理作用。我们所做的网络药理学研究与上述众多实验性结果高度重合,并提供了更多尚未被验证的可能通路与机制。
图5B 中红色椭圆形区域内为Pue 治疗AD 的核心靶点,选取其中一条Ca2+-Erk1/2-CASP3-cell death 通路进行验证,而CASP3 已在分子对接中得到验证。Western blot 结果显示,Pue 抑制了PS cDKO 小鼠Erk1/2的磷酸化水平和Cleaved Caspase-3 的表达水平。研究[11]表明,细胞间Ca2+水平升高会诱导内质网应激,并构成显著的促凋亡信号。此外,Ca2+也是细胞凋亡和自噬的刺激因子[12-13]。Rosen 等[14]发现,Ca2+的内流或存储释放激活了PC12细胞和初级皮质神经元中的Ras蛋白。接下来Ca2+/钙调蛋白依赖的Ras 蛋白特异性鸟嘌呤核苷酸释放因子 1(Ras-GRF1)的发现直接证实了Ca2+调节Ras 活性[15],而在Erk 通路中,Ras 作为上游激活蛋白,Raf 作为MAPK 之一,MAPK/Erk 激酶(MEK)作为丝裂原活化蛋白激酶-激酶(MAPKK),形成Ras-Raf-MEK-Erk通路[16]。Erk1/2属于MAPK家族,在信号级联中发挥作用,并将细胞外信号传递到细胞内靶点。Erk级联是高度调控的级联,负责基本的细胞过程,包括细胞增殖和分化。这些调节因素影响双特异性磷酸酶[17]、支架蛋白[18]、信号持续时间和强度[19]以及级联成分的动态亚细胞定位[20]。Erk 通路上游蛋白和激酶的过度激活已被证明可诱导各种疾病,包括癌症、炎症、发育障碍和神经障碍[21]。正常情况下,磷酸化的Erk1/2在脑内主要分布于神经纤维,可能参与调节神经元突起的发生,延长和稳定突触的形成[22]。在病理情况下,Erk1/2信号通路广泛参与脑血管病、脑损伤、AD等多种神经系统疾病的发生及发展过程。Erk1/2 信号通路的持续性激活会启动凋亡级联反应,激活下游的Caspase-3,最终导致神经元凋亡。Caspase-3是一切细胞凋亡信号传导的共同通路,能够接受上游信号,自身被激活后作用于特异性底物使细胞凋亡,在凋亡级联反应中起关键作用。据估计,神经系统发育过程中产生的原始细胞群有一半通过细胞凋亡的方式被清除,如此便可以优化突触连接[23]。在发育中的神经系统中,凋亡在神经管形成的早期被观察到,并在涉及神经元、胶质细胞和神经祖细胞的神经网络的最终分化过程中持续存在。Kuida 等[24]通过基因工程的方法生成了Caspase-3缺陷小鼠,该小鼠Caspase-3 的缺陷导致了其神经系统凋亡的重要缺陷,在胚胎发育期间或在1 至3 周龄期间就因为脑细胞数量增多引起的脑畸变而死亡。此实验证明了Caspase-3依赖性细胞凋亡在神经系统发育中起重要作用。研究[25]表明,早老素(PS1 和PS2 与早发性家族性AD 有关)在细胞凋亡过程中被Caspase-3 裂解,Caspase-3 也能在体外裂解纯化的PS。Louneva 等[26]发现在对照组和AD病例中,Caspase-3在突触后选择性富集。此外,与同年龄的对照组相比,AD 患者突触内pro Caspase-3 和激活的Caspase-3 表达水平显著增加,表明活跃的Caspase-3可能导致进行性突触变性并最终导致突触丧失,这是AD认知能力下降的最佳病理关联[27]。
本研究显示,运用网络药理学的手段对Pue 治疗AD 的潜在靶点与分子机制进行预测,能够让实验者在实验设计中把握主要方向,缩小研究目标,其重要作用不言而喻,在整个实验研究中的优先级更在预实验之前。同时本研究也提示Pue 治疗AD 具有多通路、多靶点同时作用的特点,预测到的分子机制也为后续开展Pue的基础药理学研究提供了方向。
