藤仓赤霉菌中蟾毒灵7β-羟化酶的发现与功能鉴定
2023-09-08钟雪庆赵群飞
钟雪庆,赵群飞
上海中医药大学创新中药研究院手性药物研究中心(上海 201203)
蟾酥是蟾蜍科动物中华大蟾蜍(Bufobufo gargarizansCantor)或黑眶蟾蜍(BufomelanostictusSchneider)耳后腺和皮肤腺体的干燥分泌物[1],属于我国传统名贵中药材。其性温、味甘辛、有毒,有解毒止痛、开窍醒神的功效,主治痈疽疔疮、瘰疬、咽喉肿痛、痧胀腹痛等[2]。现代药理学研究发现,蟾酥具有强心[3-4]、抗肿瘤[5-6]、抗炎镇痛[7-8]等多种药理活性。
蟾蜍内酯类化合物是蟾酥的独特功效组分[9],其共同的结构特征在于甾体母核C17 位置连有一个高度氧化的六元二烯内酯环侧链,属于强心甾类化合物,具有强心、抗肿瘤、抗炎、局部麻醉等生理活性[10]。但蟾蜍内酯类化合物往往毒性较大且水溶性差,从而限制了其在临床上的应用[11]。对蟾蜍内酯类化合物进行结构修饰,获得低毒性、高水溶性且具有良好药理活性的结构衍生物是实现蟾酥功效组分可持续利用的重要手段,其中甾体骨架上的羟化修饰是提高其水溶性并对其进行进一步结构改造的关键。甾体骨架惰性碳-氢键的立体选择性氧化一直以来是化学合成的重大挑战,因此采用生物催化实现蟾蜍内酯类化合物的羟化修饰成为近年来的研究热点。但目前该类化合物的生物催化依赖于筛选合适的微生物进行生物转化[12-18],还缺少能催化羟化反应的酶的报道。微生物转化往往特异性差、产物复杂,后续分离纯化困难且难以进行优化改造。因此,挖掘和表征能催化蟾蜍内酯类化合物特异性羟化反应的酶具有重要的意义。
本研究以已知的真菌甾体羟化酶为探针,通过同源序列比对,尝试从已知具有甾体羟化功能的藤仓赤霉菌(Fusariumfujikuroi)[19]中挖掘能催化蟾蜍内酯类化合物特异性羟化反应的酶,以促进蟾酥功效组分蟾蜍内酯类化合物的开发应用。
1 材料
1.1 主要仪器 高温灭菌锅,普和希株式会社(型号:MLS-3751L-PC);隔水式恒温培养箱,上海博迅医疗生物仪器股份有限公司(型号:GSP-9080MBE);超微量紫外分光光度计,美国赛默飞世尔科技(中国)有限公司(型号:NanoDrop One 840-317400);台式常温离心机,德国艾本德公司(型号:Eppendorf Centrifuge 5245);高速冷冻离心机,德国艾本德公司(型号:Eppendorf Centrifuge 5910R);DNA 电泳仪,北京六一生物科技有限公司(型号:JY300C);蛋白电泳仪,美国BIO-RAD 公司(型号:165-8001);电转仪,美国BIO-RAD 公司(型号:PowerPac Basic 164-5050);凝胶成像仪,上海勤翔科学仪器有限公司(型号:GenoSens 1850);大容量振荡培养箱,上海西雷生物科技有限公司(型号:YR101);高通量组织研磨仪,上海万柏生物科技有限公司(型号:Wonbio-48r);聚合酶链式反应(PCR)扩增仪,美国赛默飞世尔科技(中国)有限公司(型号:ProFlexTMBase);化学发光成像系统,上海勤翔科学仪器有限公司(型号:ChemiScope6100);反相液相色谱仪,日本岛津企业管理(中国)有限公司(型号:SIL-20ACHT UFLC);反相制备液相色谱仪,美国安捷伦科技(中国)有限公司(型号:Agilent 1260 Infinity Ⅱ PrepLC System);科思美析Cholester 色谱柱,日本 Nacalai Tesque 公司(型号:05977-51)。
1.2 药物与试剂 蟾毒灵、蟾毒它灵对照品,成都德思特生物技术有限公司(批号:DC0022、DC0079);DNA 分子量标准Marker,上海生工生物技术有限公司(批号:B500351-0500);TureColor 双色预染蛋白 Marker,上海生工生物技术有限公司(批号:C610011-0001);胰蛋白胨、酵母提取物,美国赛默飞世尔科技(英国)公司(批号:LP0042B、LP0021B);博莱霉素(Zeocin)、无氨基酵母氮源(YNB),北京索莱宝科技有限公司(批号:Z8020、Y8040);裂解液(用于PCR) ,艾科瑞生物科技有限公司(批号:AG12306);非连接酶依赖型的多片段一步法克隆试剂盒,南京诺唯赞生物科技有限公司(批号:C113-01);高纯度耐热DNA 聚合酶,南京诺唯赞生物科技有限公司(批号:P111-01);超保真DNA 聚合酶,南京诺唯赞生物科技有限公司(批号:P505-d1);限制性内切酶BamH Ⅰ、Spe Ⅰ、Kpn Ⅰ、Xho Ⅰ,美国New England Biolab 公司(批号:R0136V、R3133V、R3142S、R0146S);质粒小提试剂盒,美国OMEGA Bio-Tek 公司(批号:D2500-02);DNA 切胶回收试剂盒,美国OMEGA Bio-Tek 公司(批号:D6943-02);高效液相色谱(HPLC)用乙腈,美国J.T.Baker 公司(批号:B9017-03);小鼠抗多聚组氨酸标签(His-Tag)抗体(一抗),爱博泰克(ABclonal)生物科技有限公司(批号:AE003);辣根过氧化酶(HRP)标记的山羊抗小鼠IgG (H+L)抗体(二抗),ABclonal 生物科技有限公司(批号:AS003);超敏ECL 发光液试剂盒,上海勤翔科学仪器有限公司(批号:1810212);常用国产化学试剂氯化钠(NaCl)、氯化钾(KCl),上海泰坦科技股份有限公司(批号:01226205、01111284);常用生化试剂琼脂粉、葡萄糖,上海生工生物技术有限公司(批号:A505255-0250、A610219-0500)。
1.3 菌株和质粒 毕赤酵母菌株KM71H,上海泽叶生物科技公司(批号:ZY62227GC);酵母表达载体(pPICZA)质粒,金斯瑞生物科技股份有限公司合成。
1.4 培养基
(1)溶菌肉汤(LB)培养基。液体培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,去离子水(ddH2O)定容至1 L,121 ℃灭菌20 min。固体培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,琼脂20 g,ddH2O定容至1 L,121 ℃灭菌20 min。
优化肉汤(SOB)培养基:胰蛋白胨20 g,酵母提取物5 g,NaCl 0.5 g,KCl 0.186 g,ddH2O 定容至1 L,121 ℃,灭菌20 min。
(2)酵母浸出粉胨葡萄糖(YPD)培养基。液体培养基:酵母提取物1.0 g,胰蛋白胨2.0 g,ddH2O 90 mL,20%葡萄糖溶液10 mL,115 ℃灭菌30 min。固体培养基:酵母提取物1.0 g,胰蛋白胨2.0 g,琼脂2 g,20%葡萄糖溶液10 mL,ddH2O 90 mL,121 ℃灭菌20 min。20%葡萄糖溶液:100 g 葡萄糖用ddH2O定容至500 mL,115 ℃灭菌15 min。
(3)最小甘油培养基(MGYH):1.34% (W/V) 酵母氮源,1% (V/V) 甘油,4×10-5% (W/V) 生物素,ddH2O 定容至1 L。
(4)最小甲醇组氨酸培养基(MMH):1.34% (W/V)酵母氮源,0.5% (V/V) 甲醇,4×10-5%(W/V) 生物素,ddH2O定容至1 L。
1.5 引物 PCR 所需的核苷酸引物由上海生工生物技术有限公司合成。AOX-duet-F1、AOX-duet-R1、AOXduet-F2、AOX-duet-R2 用于构建含有两套AOX1 启动子/终止子表达盒的共表达载体pPICZA-duet ;FF294-F、FF294-R 用于从毕赤酵母菌重组菌株中克隆验证甾体7β-羟化酶基因FF294是否整合到酵母染色体上;CPRlun-F、CPRlun-R 用于从毕赤酵母菌重组菌株中克隆验证细胞色素P450 还原酶基因CPRlun是否整合到酵母染色体上。见表1。

表1 引物序列表
2 方法
2.1 毕赤酵母蛋白表达质粒的构建
2.1.1 毕赤酵母蛋白共表达载体pPICZA-duet 的构建
以酵母表达载体pPICZA 为模板,分别以AOX-duet-F1/R1 和AOX-duet-F2/R2 为引物,通过Phanta®Max Super-Fidelity DNA 聚合酶克隆出DNA片段1和DNA片段2。用限制性内切酶BamH Ⅰ酶切载体pPICZA,通过使用切胶回收试剂盒回收PCR 扩增的片段及酶切片段。
将回收的DNA片段和酶切片段采用非连接酶依赖型的多片段一步法克隆试剂盒进行重组。取10 μL 重组产物加入到100 μL 的大肠杆菌DH5α 感受态细胞中进行化学转化,按常规质粒提取方法提取质粒。由上海生工生物技术有限公司对重组质粒进行测序,确定序列正确后得到共表达载体pPICZA-duet。
2.1.2 重组表达载体pPICZA-duet-FF294-CPRlun的构建 由金斯瑞生物科技股份有限公司合成经毕赤酵母偏好性密码子优化的FF294基因以及细胞色素P450酶还原酶基因CPRlun(GenBank 编号:QEG13902.1)。将CPRlun基因插入至pPICZA-duet 的限制性内切酶BamHⅠ/Spe Ⅰ之间获得重组质粒pPICZA-duet-CPRlun,再将FF294基因插入至pPICZA-duet-CPRlun的限制性内切酶Kpn Ⅰ/Xho Ⅰ之间,获得同时携带CPRlun和FF294的重组质粒pPICZA-duet-FF294-CPRlun。
2.2 甾体羟化酶FF294酵母工程菌的构建 按常规方法制备毕赤酵母感受态细胞,取40 μL 重组质粒pPICZA-duet-FF294-CPRlun,加至240 μL 新鲜毕赤酵母KM71H 感受态细胞中;电转仪电转(2 kV、5 ms),电击后加入1 mL 预冷的1 mol/L 的山梨醇;30 ℃、100 r/min孵育1.5~2 h;室温,2 000 r/min,离心5 min,弃上清,重悬于1 mol/L 的山梨醇,涂布于YPD 平板(含100 μg/mL的博来霉素),30 ℃静置培养3~5 d,长出菌落。挑选8~10 个酵母工程菌单克隆于3 mL 的YPD 液体培养基中(含100 μg/mL 的博来霉素,置于30 ℃、260 r/min 振荡培养箱中培养24 h。将YPD 培养物转接至5 mL 的MGYH中,置于30 ℃、260 r/min振荡培养箱中培养24 h;MGYH 培养物4 ℃、2 000 r/min 离心5 min,收集菌体,5 mL MMH(含甲醇0.5%)重悬,置于30 ℃、260 r/min 振荡培养箱中培养3 d,每隔24 h加0.5%甲醇溶液。
(1)验证目的基因是否整合到酵母细胞染色体。取20 μL上述培养了3 d的菌液于1.5 mL的EP管中,加入100 μL 的裂解液和1 μL 的蛋白酶 K,60 ℃条件下反应5 min,随后在98 ℃条件下反应2 min,放在冰上备用。取1~4 μL 上清液为模板,以FF294-F/R 和CPRlun-F/R为引物进行PCR 扩增,PCR 产物进行琼脂糖凝胶电泳检测,验证目标基因FF294和CPRlun是否整合到酵母染色体上。
(2)通过蛋白免疫印迹法(Western blot)的方法验证目标蛋白是否表达及筛选高表达阳性克隆。取1 mL上述诱导培养了3 d 的菌液离心收集菌体,液氮速冻,研磨仪破碎菌体(60 Hz、1 min ,2 次)后加入1 mL 的裂解液溶解制备样品,10 000 r/min,离心5 min,取上清,进行聚丙烯酰胺凝胶(SDS-PAGE)蛋白电泳。采用湿法转膜300 mA恒流条件下转膜2 h,取下含有蛋白条带的硝酸纤维素膜,磷酸盐缓冲液(PBST)清洗后用5%的脱脂奶粉封闭2 h;小鼠来源的抗His-Tag 的一抗孵育1 h;PBST 清洗后加入HRP 标记的二抗,室温下孵育0.5 h;PBST buffer 清洗后,采用超敏ECL 发光液试剂盒显色1~2 min,化学发光成像仪检测。
2.3FF294酵母工程菌对蟾蜍内酯类化合物的转化
将毕赤酵母工程菌KM71H-FF294接种于5 mL 的YPD 液体培养基中(含100 mg/L 的博来霉素)中,置于30 ℃、260 r/min 振荡培养箱中,培养24 h得到种子培养液;将0.5 mL种子培养液转接至5 mL的MGYH中,置于30 ℃、260 r/min 振荡培养箱中,培养24 h 后收集菌体。用5 mL的MMH重悬菌体,加入25 μL溶于甲醇的蟾蜍内酯类化合物(喂养终浓度为100 mg/L),置于30 ℃、260 r/min 振荡培养箱中转化3 d,每隔24 h补加0.5%甲醇。取500 μL 菌液用等体积乙酸乙酯萃取两次,氮吹仪吹干后用500 μL甲醇复溶,进行HPLC-MS检测。
液相分析条件:0~3 min,30% B;20~25 min,100%B;26 ~30 min,30% B(流动相A:水+0.1%甲酸溶液;流动相B:乙腈+0.1% 甲酸溶液)。色谱柱采用COSMOSIL Cholester-column (4.6 mm I.D.×250 mm);柱温40 ℃;流速:1.0 mL/min;检测波长:254 nm。
2.4 蟾蜍二烯酸内酯类化合物转化产物的分离纯化和结构鉴定 接种毕赤酵母工程菌KM71H-FF294于10 mL的YPD液体培养基中(含100 mg/L的博来霉素),置于30 ℃、260 r/min 振荡培养箱中,培养24 h,转接至1 L的MGYH中,置于30 ℃、260 r/min振荡培养箱中,培养24 h 后收集菌体。用1 L 的MMH(不加甲醇)重悬菌体,加入蟾蜍二烯酸内酯类化合物(溶于1%的甲醇溶液中,喂养终浓度100 mg/L),置于30 ℃、260 r/min 振荡培养箱中,转化3 d,每隔24 h 补加0.5%甲醇溶液。用等量的乙酸乙酯萃取两次,旋干后得到粗品,通过制备级反相HPLC对转化产物进行分离纯化,纯化后的化合物用40%~70%的乙腈溶解至饱和状态,置于4 ℃冰箱挥发结晶,通过核磁共振(NMR)分析检测和X 射线单晶衍射鉴定其结构。
3 结果
3.1 藤仓赤霉菌中甾体羟化酶FF294 的发现 藤仓赤霉菌能转化甾体化合物形成多种羟化产物[19],但其中起催化作用的甾体羟化酶还未被鉴定。我们以已知新月弯孢霉(C.lunatus)来源的C14α-甾体羟化酶基因P450lun(GenBank 基因编号:QEG13904.1)为探针,通过生物大分子序列比对(Blast)法,于藤仓赤霉菌的基因组(GenBank 编号:FMSL01000003.1)中挖掘到一个可能编码甾体羟化酶的同源基因(命名为FF294,GenBank 编号:SCV33294.1)。FF294 与P450lun的Identities/ Positives为 44%/61%。
3.2 甾体羟化酶FF294 毕赤酵母异源表达工程菌株的构建结果
3.2.1 毕赤酵母异源表达质粒的构建结果 真菌来源的细胞色素P450 酶通常需要细胞色素P450 还原酶(CPR)为其提供电子以完成羟化反应。因此,我们在常规毕赤酵母表达载体pPICZA 基础上,构建了含两个AOX1启动子/AOX1终止子表达盒、适用于两个基因共表达的毕赤酵母表达载体pPICZA-duet,质粒图谱如图1A 所示。将FF294基因以及CPRlun基因插入pPICZA-duet,获得重组质粒pPICZA-duet-FF294-CPRlun,质粒图谱如图1B所示。

图1 毕赤酵母共表达载体pPICZA-duet(A)和重组质粒pPICZA-duet-FF294-CPRlun(B)的质粒图谱
3.2.2 毕赤酵母高效异源表达工程菌株的构建和筛选结果 将质粒pPICZA-duet-FF294-CPRlun电转化到毕赤酵母 KM71H 中,得到重组菌株KM71H-FF294。利用引物FF294-F/R 和CPRlun-F/R 进行PCR 扩增实验,确定了目的基因FF294和CPRlun成功地整合到酵母细胞染色体上(图2A)。通过抗His-Tag 抗体进行Western blot 实验,确定了甾体羟化酶FF294 和P450 还原酶CPRlun能够在酵母细胞中高表达,选择5 号阳性克隆进行后续实验(图2B)。

图2 阳性毕赤酵母工程菌株的筛选
3.3FF294重组酵母工程菌转化蟾蜍内酯类化合物
为了鉴定藤仓赤霉菌来源甾体羟化酶FF294 的功能,我们以蟾蜍内酯类化合物蟾毒它灵、蟾毒灵为底物(图3A),研究毕赤酵母重组菌株KM71H-FF294的羟化活性。在终浓度为100 mg/L、生物转化72 h 后,以HPLC-MS 法检测代谢产物,结果显示FF294 转化蟾毒它灵没有产生明显的产物(图3B),而转化蟾毒灵时产生了预期分子量的羟化产物化合物1 (图3C,图4)。

图3 FF294重组酵母工程菌转化蟾蜍内酯类化合物产物的高效液相色谱-质谱检测结果

图4 蟾毒灵和FF294重组酵母工程菌转化蟾毒灵产物的质谱检测结果
3.4 蟾毒灵转化产物的结构鉴定 为了进一步确定FF294 的功能,我们对蟾毒灵转化产物化合物1 进行了分离及结构鉴定。通过2.4 中的步骤得到转化产物粗品。通过半制备级反相HPLC 对转化产物进行分离纯化、X-射线单晶衍射和核磁共振(NMR)检测,确定了化合物1 的结构为7β-羟基蟾毒灵。晶体结构和数据见图5、表2;NMR 碳氢图谱和数据见图6、图7。
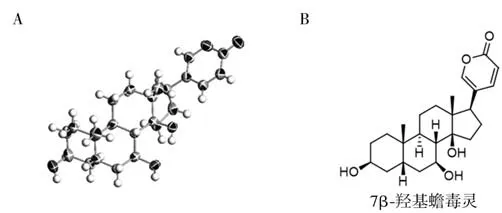
图5 化合物1的晶体结构及结构式

图6 化合物1的核磁碳谱图

图7 化合物1的核磁氢谱图

表2 分离到的化合物1的X-射线晶体结构数据
化合物1 的核磁数据:1H NMR (600 MHz,DMSOd6):δ 7.95 (dd,J= 9.7,2.5 Hz,1H),7.59-7.39(m,1H),6.28(d,J= 9.6 Hz,1H),5.57(d,J= 4.6 Hz,1H),5.54 (s,1H),4.21 (d,J= 3.0 Hz,1H),3.85(s,1H),3.83-3.74 (m,1H),2.50-2.44 (m,1H),2.16-2.05 (m,2H),1.83-1.74 (m,2H),1.74-1.63 (m,3H),1.62-1.52 (m,2H),1.48-1.37 (m,3H),1.37-1.28 (m,6H),1.16-1.08 (m,1H),0.89 (s,3H),0.62(s,3H);13C NMR (151 MHz,DMSO-d6):δ 17.29,21.69,24.12,27.80,28.95,29.70,33.74,34.64,35.27,36.98,37.19,40.53,46.50,47.99,50.56,64.82,69.72,84.98,114.76,123.12,148.04,149.66,161.85。
4 讨论
蟾蜍内酯类化合物是名贵中药材蟾酥的独特功效成分,具有很好的药理活性和应用前景。近年来,由于蟾酥药用资源需求量与日俱增,直接从动物中分离提取资源受限,而且该类化合物通常毒性较大且水溶性差,限制了其进一步的开发和应用。采用化学合成的手段对甾体母核的不活泼碳-氢键进行高立体选择性氧化修饰面临巨大的挑战,因此,蟾蜍内酯类化合物的生物转化成为了研究热点。但目前蟾蜍内酯类化合物的羟化主要是通过微生物转化来实现,虽有较多对蟾蜍内酯类化合物进行微生物转化羟化的案例[12-18],但至今还没有对此类化合物进行特异性羟化修饰的羟化酶被克隆鉴定。
本课题从真菌藤仓赤霉菌中发现的蟾毒灵7β-羟化酶FF294,据课题组所知,是目前文献报道的首个蟾蜍内酯羟化酶。该酶的发现和研究,将促进更多蟾蜍内酯羟化酶的挖掘和表征,从而有助于更多含多重手性中心、高氧化态的蟾蜍内酯类化合物的绿色、高效、精准合成,进而有利于推进蟾酥功效组分的可持续开发利用。
