Eg5 小分子抑制剂SB-743921通过c-Myc/SP1/CDK1 通路抑制去势抵抗性前列腺癌细胞恶性增殖的研究
2023-09-05徐礼臻朱再生周鹏飞刘全启徐旻胡亮
徐礼臻 朱再生 周鹏飞 刘全启 徐旻 胡亮
近年来前列腺癌的发病率逐渐上升且患者趋于年轻化[1-2]。研究表明,前列腺癌是一种异质性疾病,相同病理类型的前列腺癌表现形式差异很大[3-4]。对于细胞生长缓慢且长期局限于前列腺内的患者,可采取积极观察等应对措施;对于侵袭性前列腺癌患者,多采取积极手术等治疗方式,一般行前列腺切除术、睾丸切除术或全雄激素剥夺治疗[5]。但是,转移性前列腺癌接受手术去势或雄激素剥夺治疗后,经过一段时间后大多发展为去势抵抗性前列腺癌(castrationresistant prostate cancer,CRPC)。CRPC 是前列腺癌晚期的一种表现形式,易发生转移,且致死率极高,目前尚无确切的治疗方式[6]。因此,探讨前列腺癌发展为CRPC 的分子机制是突破CRPC 治疗瓶颈的有效手段。驱动蛋白5(kinesin-5,Eg5)在细胞纺锤体有丝分裂过程中起着重要作用。研究发现,Eg5 参与调节细胞周期、细胞凋亡、肿瘤侵袭转移及DNA 损伤响应等多种生物学功能[7],与胰腺癌、肝癌、前列腺癌等多种恶性肿瘤的发生、发展密切相关[8]。Eg5 在恶性肿瘤细胞中异常表达会导致转录因子c-Myc 表达上调;而c-Myc 过表达与前列腺癌去势抵抗有关。作为c-Myc 的下游靶点SP1,与共济失调毛细血管扩张突变基因转录调控密切相关,参与调节DNA 双链损伤修复、细胞周期、肿瘤转移等[9]。作为重要的有丝分裂作用因子,笔者推测Eg5 可能是CRPC 的有效靶点。但Eg5 调节前列腺癌细胞产生去势抵抗的机制研究鲜有报道。因此,本研究观测了Eg5 小分子抑制剂SB-743921 对CRPC 细胞株DU145 增殖、凋亡、细胞周期及迁移的影响,并初步探讨相应的分子机制,现将结果报道如下。
1 材料和方法
1.1 主要药物与试剂 Eg5 小分子抑制剂SB-743921(批号:HY-12069)购自美国Med Chem Express 公司。Eg5 抗体(批号:14404S)、c-Myc 抗体(批号:18583S)、SP1 抗体(批号:9389S)、波形蛋白(Vimentin)抗体(批号:5741S)、E-钙黏蛋白(E-cadherin)抗体(批号:14472S)、β-肌动蛋白(β-actin)(批号:4970S)、鼠二抗(批号:14709S)、兔二抗(批号:14708S)均购自美国Cell Signaling Technology 公司,周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)1 抗体(批号:ab201008)购自美国Abcam 公司,MTT 试剂盒(批号:C0009)、Annexin V-FITC 典化丙啶(PI)凋亡检测试剂盒(批号:C1062M)均购自上海碧云天生物技术公司,MEM 培养基(批号:KGM41500N-500)购自江苏凯基生物技术股份有限公司,RIPA 裂解液(批号:SY021-100)购自南京三翊生物科技有限公司,反转录试剂盒(批号:R323)、qRT-PCR 试剂盒(批号:Q311)均购自南京诺唯赞生物科技有限公司,慢病毒NC 小干扰RNA(small interfering RNA,siRNA)(批号:PLV-10)、Eg5 siRNA(批号:AM4639)均购自上海吉凯基因医学科技股份有限公司。
1.2 细胞培养与分组 人CRPC 细胞株DU145 购自上海生命科学院细胞资源中心。将DU145 细胞置于含10%FBS、100 mg/L 链霉素、100 U/L 青霉素的MEM 培养基中培养。取对数生长期的DU145 细胞,设置对照组、NC siRNA 组、Eg5 siRNA 组、SB-743921(4 nmol/L)组、SB-743921(8 nmol/L)组,每组3 个重复孔。待细胞贴壁后,NC siRNA 组、Eg5 siRNA 组分别用NC siRNA、Eg5 siRNA 转染细胞;SB-743921(4 nmol/L)组、SB-743921(8 nmol/L)组分别用4 、8 nmol/L 的SB-743921处理细胞48 h[预实验提示SB-743921 对DU145 细胞处理72 h 的半数抑制浓度为(8.83±0.67)nmol/L,故本实验以4、8 nmol/L 浓度进行以下实验]。
1.3 细胞增殖能力检测 采用MTT 法。取5 组DU145 细胞,以4×104个/mL 的浓度接种于96 孔板;每孔加入MTT 继续培养4 h,弃上清液;每孔加入150 μL二甲基亚砜震荡30 s,使用美国Biotek 公司Cytation 5酶标仪测定570 nm 波长处的吸光度值。细胞生长抑制率=1-实验组吸光度值/空白对照组吸光度值×100%。
1.4 细胞凋亡能力检测 采用流式细胞术。收集5 组DU145 细胞,以1×106个/mL 的浓度接种于6 孔板,PBS洗涤2 次;在室温、避光下Annexin V-FITC 染色5 min,PI 染色5 min。使用德国美天旎生物技术公司MACSQuant 流式细胞仪检测细胞凋亡情况,利用FlowJo 7.6软件分析并计算细胞凋亡率。细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.5 细胞周期检测 采用PI 单染实验。收集5 组DU145 细胞,以1×106个/mL 的浓度接种于6 孔板,PBS 洗涤2 次;将各组细胞固定于70%乙醇,再加入含有RNA 酶RNAase A 的PI 染液,在室温下孵育细胞30 min;用PBS 除去多余PI 染液,使用美国BD 公司FACSCantoⅡ流式细胞仪测定细胞周期分布情况,利用ModFit LT3.3 软件分析并计算G2/M 期百分比。
1.6 细胞迁移能力检测 采用划痕实验。取5 组DU145 细胞,以2×105个/mL 的浓度接种于6 孔板,待细胞贴壁后用移液器吸头制造划痕,继续培养。于0、48 h 使用倒置显微镜观察划痕情况并拍照,使用Image J 软件分析并计算细胞迁移率。细胞迁移率=0 h划痕宽度-培养48 h 后划痕宽度)/0 h 划痕宽度×100%。
1.7 c-Myc、SP1、CDK1、E-cadherin、Vimentin mRNA 表达水平检测 采用qRT-PCR 法。取5 组DU145 细胞,以1×106个/mL 的浓度接种于60 mm3的培养皿,培养48 h 后提取总RNA;使用NanoDrop-100 微量核酸蛋白测定仪测定对应RNA 的浓度和纯度;利用反转录试剂盒反转录1 μmol/L RNA 得到cDNA,使用qRT-PCR 试剂盒进行反应。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参,使用2-ΔΔCt法计算目的基因mRNA 表达水平。各基因引物列见表1。

表1 引物序列
1.8 c-Myc、SP1、CDK1、E-cadherin、Vimentin 蛋白表达水平检测 采用Western blot 法。取5 组DU145 细胞,以1×106个/mL 的浓度接种于100 mm3的培养皿,培养48 h 后提取总蛋白;使用RIPA 裂解液在冰上裂解40 min,离心收集上清蛋白;用美国Bio-rad 公司蛋白电泳仪系统进行SDS-PAGE 凝胶电泳并分离目标蛋白,利用湿法电转至聚偏二氟乙烯膜。膜上的蛋白用5%(w/v)脱脂奶粉室温封闭1 h,加入一抗4 ℃孵育8 h,加入二抗室温孵育1.5 h。使用增强化学发光液显色,利用美国Bio-rad 公司Gel DocTMXR+凝胶成像系统检测条带灰度值,并用Image J 软件处理数据,计算目的蛋白表达水平。
1.9 统计学处理 采用SPSS 26.0 统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用Dunnett-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 SB-743921 对DU145 细胞增殖的影响 5 组细胞生长抑制率比较,差异有统计学意义(P<0.05);其中Eg5 siRNA 组、SB-743921(4 nmol/L)组、SB-743921(8 nmol/L)组生长抑制率分别为(33.35±3.12)%、(34.23±2.38)%、(36.32±2.67)%,均高于对照组的(2.32±0.23)%,差异均有统计学意义(均P<0.05)。
2.2 SB-743921对DU145细胞凋亡的影响 5组细胞凋亡率比较,差异有统计学意义(P<0.05);其中Eg5 siRNA组、SB-743921(4 nmol/L)组、SB-743921(8 nmol/L)组细胞凋亡率分别为(24.22±2.13)%、(18.79±1.33)%、(31.35±3.11)%,均高于对照组的(7.37±0.88)%,差异均有统计学意义(均P<0.05),见图1。
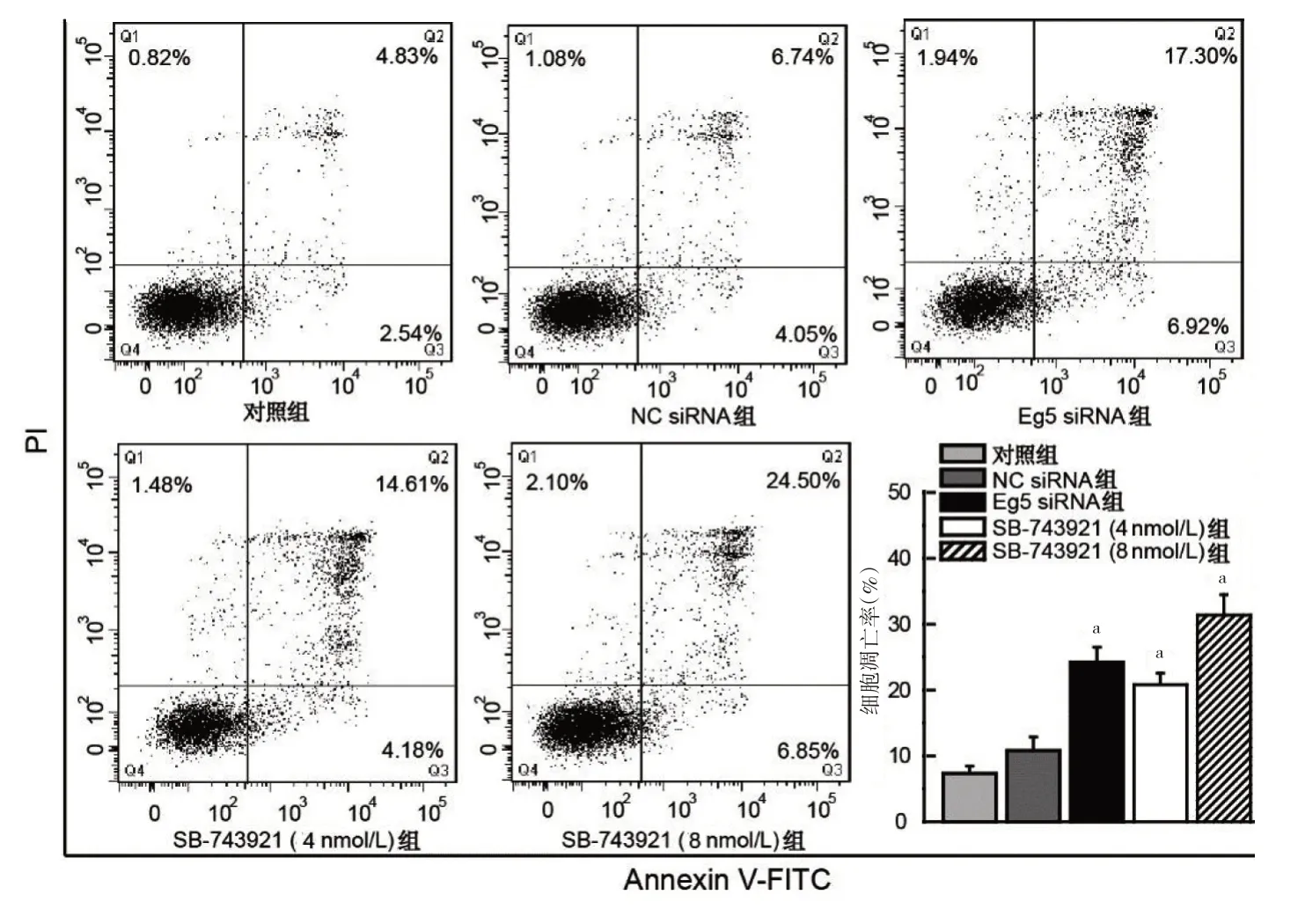
图1 SB-743921 对DU145 细胞凋亡的影响
2.3 SB-743921 对DU145 细胞周期的影响 5 组细胞G2/M 期百分比比较,差异有统计学意义(P<0.05);其中Eg5 siRNA 组、SB-743921(4 nmol/L)组、SB-743921(8 nmol/L)组G2/M 期百分比分别为(13.29±1.23)%、(11.46±2.31)%、(15.61±2.47)%,均高于对照组的(1.79±0.43)%,差异均有统计学意义(均P<0.05),见图2。
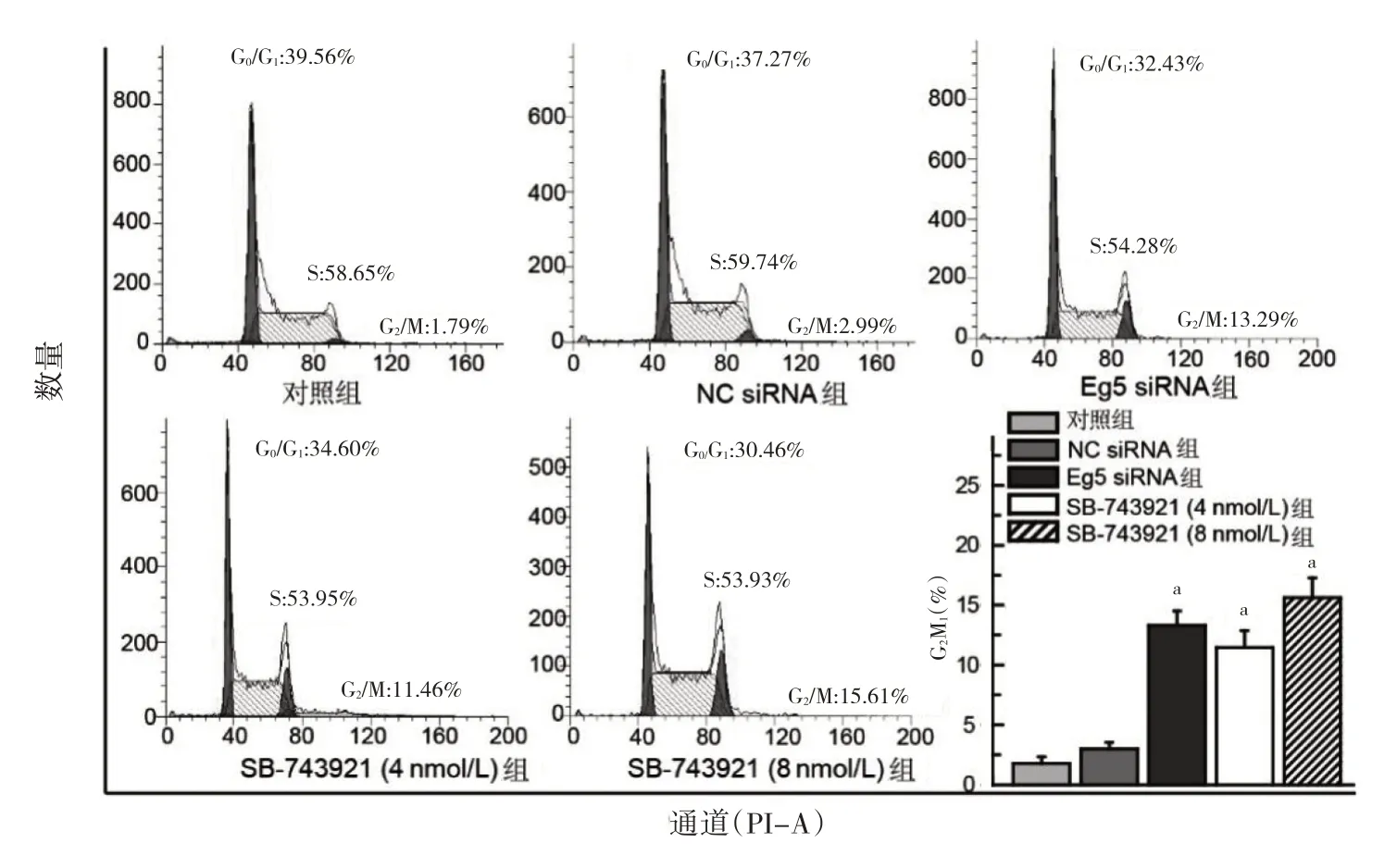
图2 SB-743921 对细胞周期的影响
2.4 SB-743921 对DU145 细胞迁移的影响 5 组细胞迁移率比较,差异有统计学意义(P<0.05);其中Eg5 siRNA 组、SB-743921(4 nmol/L)组、SB-743921(8 nmol/L)组细胞迁移率分别为(2.35±0.52)%、(6.50±1.56)%、(5.40±1.30)%,均明显低于对照组的(25.32±5.80)%,差异均有统计学意义(均P<0.05),见图3。
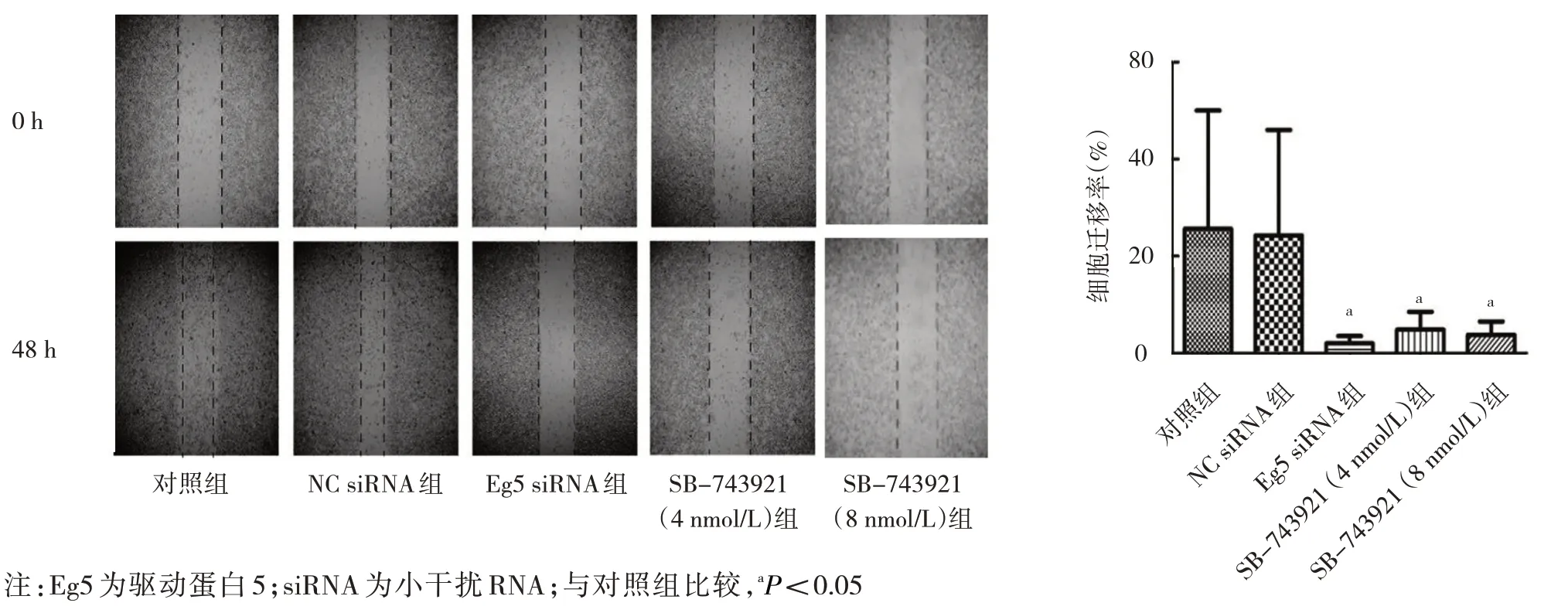
图3 SB-743921 对DU145 细胞迁移的影响
2.5 SB-743921 对c-Myc、SP1、CDK1、E-cadherin、Vimentin mRNA 表达水平的影响 5 组细胞c-Myc、SP1、CDK1、E-cadherin、Vimentin mRNA 表达水平比较,差异均有统计学意义(均P<0.05);其中Eg5 siRNA 组、SB-743921(4 nmol/L)组、SB-743921(8 nmol/L)组c-Myc、SP1、CDK1、Vimentin mRNA 表达水平均明显低于对照组,E-cadherin mRNA 表达水平均明显高于对照组,差异均有统计学意义(均P<0.05),见表2。

表2 SB-743921对c-Myc、SP1、CDK1、E-cadherin、Vimentin mRNA表达水平的影响
2.6 SB-743921 对c-Myc、SP1、CDK1、E-cadherin、Vimentin 蛋白表达水平的影响 5 组细胞c-Myc、SP1、CDK1、E-cadherin、Vimentin 蛋白表达水平比较,差异均有统计学意义;其中Eg5 siRNA 组、SB-743921(4 nmol/L)组、SB-743921(8 nmol/L)组c-Myc、SP1、CDK1、Vimentin 蛋白表达水平均明显低于对照组,E-cadherin 蛋白表达水平均明显高于对照组,差异均有统计学意义(均P<0.05);SB-743921(8 nmol/L)组CDK1、Vimentin 蛋白表达水平均明显低于Eg5 siRNA组,差异均有统计学意义(均P<0.05),见图4和表3。
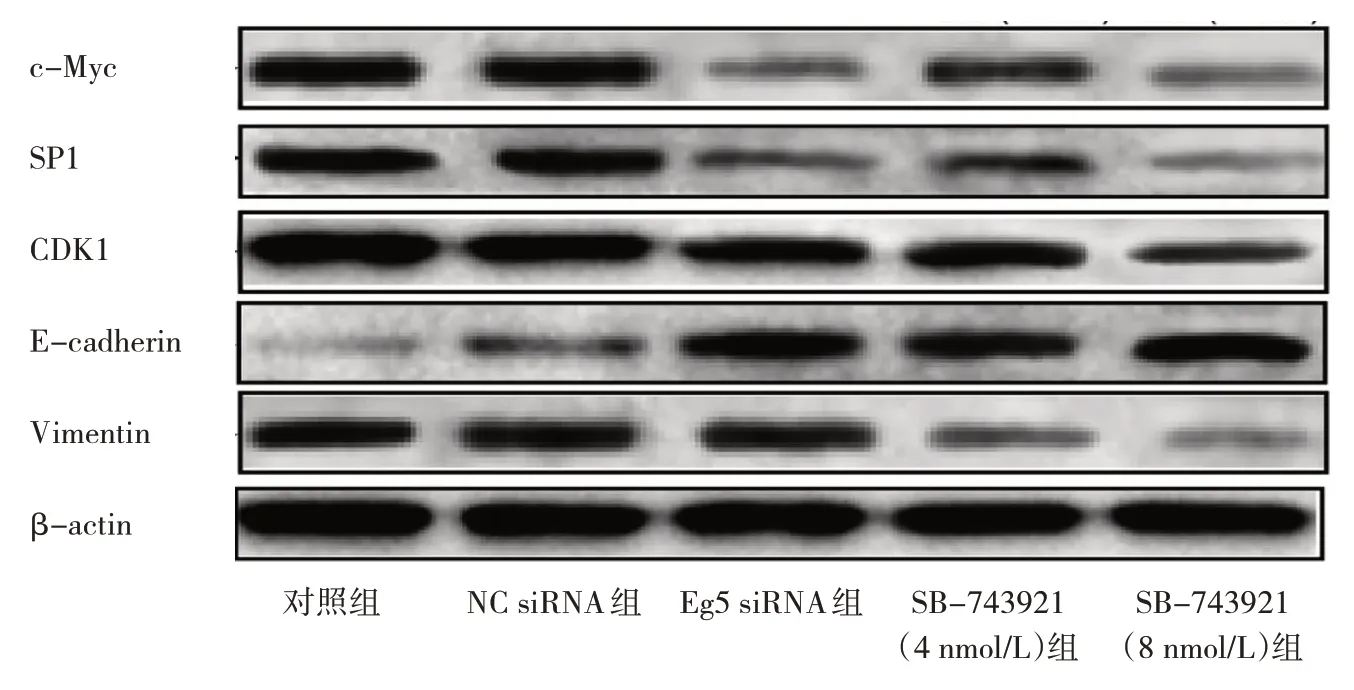
图4 5 组DU145 细胞c-Myc、SP1、CDK1、E-cadherin、Vimentin 蛋白表达的电泳图

表3 SB-743921对c-Myc、SP1、CDK1、E-cadherin、Vimentin蛋白表达水平的影响
3 讨论
前列腺癌是男性泌尿系统常见的肿瘤。在前列腺癌发生、发展过程中,细胞有丝分裂异常发挥着重要作用。研究表明,Eg5 异常表达会引起细胞有丝分裂异常和细胞异常增殖,是一个有效的靶点[10]。但它与很多参与调节有丝分裂的因子不同,Eg5 在正常组织细胞中的表达水平极低,但在恶性肿瘤细胞内的表达水平异常升高[11]。研究发现,Eg5 在正常细胞及恶性肿瘤细胞内的差异表达可导致靶向Eg5 疗法的不良反应相对较少,是一个很好的抗有丝分裂基因[12]。CRPC 细胞内存在着Eg5 过表达和活化[13],因此探讨Eg5 对CRPC 细胞株DU145 细胞恶性增殖、侵袭及转移的调节作用具有重要意义。本研究评价了Eg5 小分子抑制剂SB-743921 对DU145 细胞增殖、凋亡、细胞周期及迁移的影响,同时初步探讨了相关分子机制。
本研究发现,靶向沉默Eg5 表达可明显抑制DU145 细胞恶性增殖,诱导细胞凋亡,并将细胞周期阻滞在G2/M 期,减弱肿瘤细胞迁移能力;Eg5 小分子抑制剂SB-743921 可以抑制DU145 细胞恶性增殖和迁移。研究表明,Eg5 表达和功能的抑制可引起转录因子SP1、CDK1 表达水平降低[14-15]。SP1 是c-Myc 的下游靶基因,与肿瘤的恶性增殖、侵袭和转移密切相关[16]。SP1 表达水平降低可导致肿瘤细胞增殖及转移能力减弱。CDK1 是细胞有丝分裂的重要调节因子,其表达水平降低会导致细胞周期阻滞在G2/M 期,继而导致细胞因无法进行有丝分裂而凋亡[17]。本研究进一步探讨相关分子机制发现,靶向沉默Eg5 表达可下调c-Myc、SP1、CDK1、Vimentin mRNA 及蛋白表达水平,上调E-cadherin mRNA 及蛋白表达水平;而Eg5 小分子抑制剂SB-743921 可进一步下调CDK1、Vimentin 蛋白表达水平。
综上所述,Eg5 小分子抑制剂SB-743921 通过c-Myc/SP1/CDK1 信号通路阻断CRPC 细胞的恶性增殖和迁移,诱导细胞凋亡并将细胞周期阻滞在G2/M 期;提示SB-743921 具有治疗CRPC 的潜在价值。
