泛素特异性蛋白酶4对透明细胞肾细胞癌细胞增殖能力的影响
2023-09-05郑巳年崔晓波陈嘉瑜颜华卿陈力李如兵
郑巳年 崔晓波 陈嘉瑜 颜华卿 陈力 李如兵
肾细胞癌是一种常见的泌尿系统恶性肿瘤,其发病率占成人恶性肿瘤的2%~3%,但致死率极高[1]。中国肿瘤登记年报资料显示,2015 年我国新发肾细胞癌66.8 万例,死亡23.4 万例,发病高峰年龄50~60 岁[2]。透明细胞肾细胞癌(kidney renal clear cell carcinoma,KIRC)是肾细胞癌最常见的亚型,死亡率最高[3]。尽管局限性KIRC(T1~T2期)患者经手术切除治疗后5 年生存率约为93%,但是约60%的患者初次诊断即为转移性KIRC 或在病程中发生肿瘤复发及转移,而转移性KIRC 患者的5 年生存率仅为12%[4]。因此,探索KIRC发生、发展的分子机制,有助于确定新的治疗靶点,以延长患者的生存期。近年来研究发现,泛素-蛋白酶体途径在恶性肿瘤的形成过程中起重要作用[5]。泛素化-去泛素化稳态是导致KIRC 发生、发展的重要因素[6]。去泛素化酶从靶蛋白中去除泛素化修饰,从而调节包括细胞周期进程、信号转导、转录调节和细胞凋亡在内的许多生物学过程[7]。泛素特异性蛋白酶是去泛素化酶的主要亚类,而人类泛素特异性蛋白酶4(ubiquitin specific protease 4,USP4)基因是泛素特异性蛋白酶家族成员之一,它位于染色体带3p21.3 上,由22 个外显子组成[8]。研究表明,USP4 可以通过去泛素化修饰重要蛋白质来调节各种信号通路,在肿瘤、免疫和RNA 剪接等方面均有不同程度的影响[9]。然而,目前尚无研究证实USP4 是否通过去泛素化修饰功能来参与KIRC 发生、进展的调控。基于此,本研究利用癌症基因组图谱(the cancer genome atlas,TCGA)数据库和基因表达综合(gene expression omnibus,GEO)数据库中KIRC 患者的基因表达和临床数据进行分析,探讨USP4 对KIRC 细胞增殖能力的影响,以期为KIRC的临床诊治提供新的思路。
1 材料和方法
1.1 材料 人KIRC 细胞系Caki-1、OSRC-2 均购自中国科学院上海细胞库。FBS、RPMI 1640 培养基购自美国Gibco 公司;过表达USP4 的质粒、敲低USP4 的质粒、对照质粒均购自苏州吉玛公司;Lipofectamine 2000 试剂购自美国Invitrogen 公司;PBS、RIPA 裂解液、BCA 蛋白定量试剂盒、硝酸纤维素膜、脱脂奶粉、辣根过氧化无梅标记羊抗人的IgG、电化学发光显影液、细胞计数试剂盒8(cell counting kit-8,CCK-8)试剂盒、β-肌动蛋白抗体、结晶紫均购自中国上海碧云天生物技术有限公司。
1.2 方法
1.2.1 生物信息学分析 (1)利用TIMER 2.0 数据库(http://timer.cistrome.org/)的Gene DE 模块分析TCGA 数据库关于USP4 在KIRC、肾乳头状细胞癌(kidney renal papillary cell carcinoma,KIRP)、肾嫌色细胞癌(kidney chromophobe,KICH)和癌旁正常肾脏组织之间的差异表达。(2)从TCGA 数据库(https://portal.gdc.cancer.gov)下载并提取TCGA-KIRC 项目STAR 流程的TPM 格式数据,获得的数据中包含613 例原发性KIRC 组织和72 例正常肾脏组织,并以USP4 mRNA 表达水平的中位数(4.77 log2TPM)为界,分为高表达组和低表达组。(3)利用GEO 数据库(https://www.ncbi.nlm.nih.gov/geo)下载包含KIRC 组织及癌旁正常肾脏组织的数据集GSE53757,其中包含72 例KIRC 患者完整的临床资料。(4)利用Ualcan 数据库(https://ualean.path.uab.edu/analysis.html)提供的基因表达和生存曲线的图表,分析不同临床病理特征患者KIRC 组织中USP4 表达的差异。(5)从HPA 数据库(https://www.proteinatlas.org/)获取KIRC 组织及正常癌旁组织中USP4 蛋白的免疫组化染色数据。
1.2.2 细胞培养与转染 Caki-1、OSCR-2 细胞置于含10%FBS 的RPMI 1640 培养基中培养。所有细胞在37 ℃、5% CO2的培养箱中生长,取对数生长期的Caki-1、OSCR-2 细胞,以3×104个/孔的密度均匀接种至24孔板;待细胞生长融合度为60%~70%时,按照Lipofectamine 2000 说明书步骤将目的质粒、对照质粒转染细胞;转染培养48 h 后收集细胞进行以下实验研究。
1.2.3 Caki-1、OSCR-2 细胞中USP4 蛋白表达水平检测 采用Western blot 法。收集转染的Caki-1、OSCR-2 细胞,用PBS 溶液进行稀释,置于冰上预冷10 s;加入RIPA 裂解液后提取总蛋白,利用BCA 蛋白定量试剂盒检测蛋白浓度。将处理后的蛋白样品进行聚丙烯酰胺凝胶电泳并电转至聚偏二氟乙烯膜上,5%脱脂奶粉37 ℃封闭2 h;经一抗1∶1 000 稀释后4 ℃孵育过夜,加入TBST 洗膜3 min×5 次;然后用辣根过氧化物酶二抗1∶3 000 稀释后37 ℃孵育1 h,最后在凝胶成像系统内成像得到蛋白条带,根据条带灰度值计算目的蛋白的表达水平。
1.2.4 Caki-1、OSCR-2 细胞增殖能力检测 (1)CCK-8 法:将各组细胞以2 000 个/孔的密度接种于96 孔板,分别于培养0、24、48、72 h 时加入100 μL 10%CCK-8试剂,温育3 h 后,使用酶联仪测定450 nm 波长处的吸光度(optical density,OD)值,并以0 h 时OD 值为参照,其余时间点OD 值均与0 h 时OD 值相除得到增殖指数。(2)平板克隆实验:细胞转染24 h 后,消化、收集细胞并将细胞铺至6 孔板,每孔加入约800 个细胞、4 mL完全培养基,在显微镜下观察呈单细胞悬液状态。置于37 ℃、5% CO2培养箱中培养2 周,每隔24 h 观察细胞状态;当出现克隆时即弃去培养基,使用PBS 洗涤细胞3 次,4%多聚甲醛固定20 min,0.25%结晶紫染色20 min,干燥后在光镜下观察并统计克隆数,然后计算克隆指数。克隆指数为实验组克隆数目与对照组克隆数目的比值。
1.2.5 统计学处理 采用SPSS 25.0 统计软件。符合正态分布的计量资料组间比较采用两独立样本t检验;不符合正态分布的计量资料组间比较采用Wilcoxon 秩和检验;计数资料组间比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 USP4 在KIRC 组织中的表达 利用TIMER 2.0 数据库分析显示,USP4 在肾细胞癌各亚型(KICH、KIRC、KIRP)组织中的mRNA 表达水平均明显低于癌旁正常肾脏组织;其中KIRC 组织中的USP4 mRNA 表达水平差异最为显著,差异均有统计学意义(均P<0.05),见图1A。利用GEO 数据库、TCGA-KIRC 数据库分析显示,USP4 在KIRC 组织中的mRNA 表达水平均明显低于癌旁正常肾脏组织(均P<0.05),见图1B、C。利用HPA 数据库中的免疫组化染色结果证实,USP4 在KIRC 组织中的蛋白表达水平明显低于癌旁正常肾脏组织(P<0.05),且USP4 蛋白主要定位于细胞质或细胞膜,见图1D。
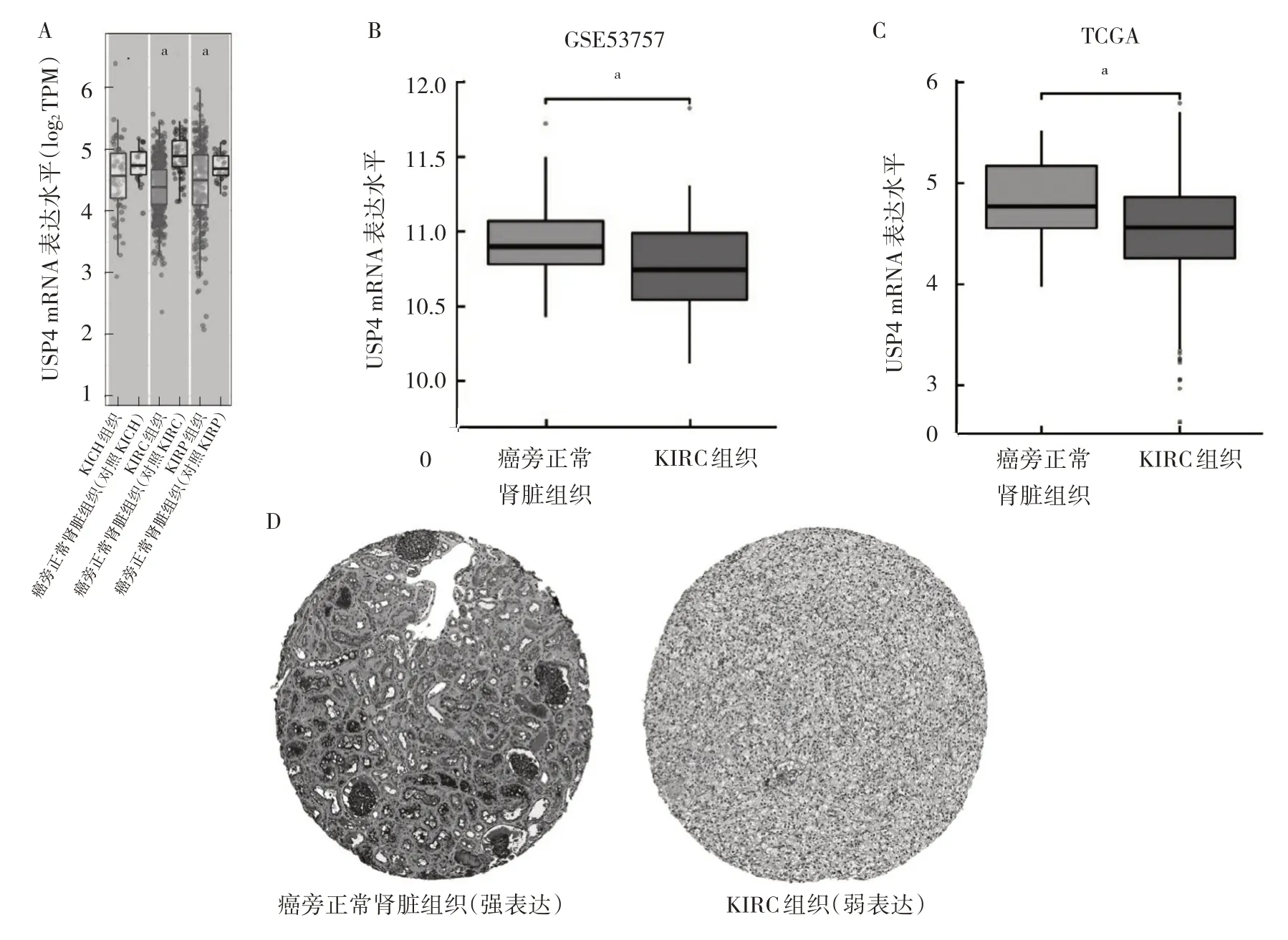
图1 生物信息学分析USP4 在KIRC 组织中的表达(A:TIMER 2.0 数据库提供的KICH、KIRC、KIRP 组织和癌旁正常肾脏组织中USP4 mRNA 表达水平比较,aP<0.01;B:GEO 数据库提供的GSE53757 数据集中KIRC 组织和癌旁正常肾脏组织中USP4 mRNA 表达水平比较,aP<0.01;C:TCGA 数据库提供的KIRC 组织和癌旁正常肾脏组织中USP4 mRNA 表达水平比较,aP<0.01;D:HPA 数据库提供的癌旁正常肾脏组织和KIRC 组织中USP4 蛋白表达的比较,免疫组化染色,×40)
2.2 KIRC 组织中USP4 mRNA 表达水平与患者临床特征的关系 KIRC 组织中USP4 mRNA 表达水平与患者T 分期、病理分期、组织学分级、总生存率、疾病特异性生存率、无进展生存率均有关(均P<0.05);与性别、年龄、N 分期、M 分期均无关(均P>0.05),见表1。

表1 KIRC组织中USP4 mRNA表达水平与患者临床特征的关系[例(%)]
2.3 过表达USP4 对Caki-1、OSRC-2 细胞增殖能力的影响 USP4 蛋白在Caki-1、OSRC-2 细胞中显著过表达,见图2A、C。过表达USP4 会明显降低Caki-1、OSRC-2 细胞增殖指数(均P<0.05),见图2B、D;同时也会明显降低Caki-1、OSRC-2 细胞克隆指数(均P<0.05),见图2E、F。

图2 过表达USP4 对Caki-1、OSRC-2 细胞增殖能力的影响(A:Caki-1 细胞中USP4 表达的电泳图;B:过表达USP4 对Caki-1 细胞增殖指数的影响,aP<0.05;C:OSRC-2 细胞中USP4 表达的电泳图;D:过表达USP4 对OSRC-2 细胞增殖指数的影响,aP<0.05;E:过表达USP4 对Caki-1 细胞克隆指数的影响,aP<0.05;F:过表达USP4 对OSRC-2 细胞克隆指数的影响,aP<0.05)
2.4 敲低USP4 对Caki-1 细胞增殖能力的影响 敲低USP4 会明显提高Caki-1 细胞克隆指数(均P<0.05),见图3。
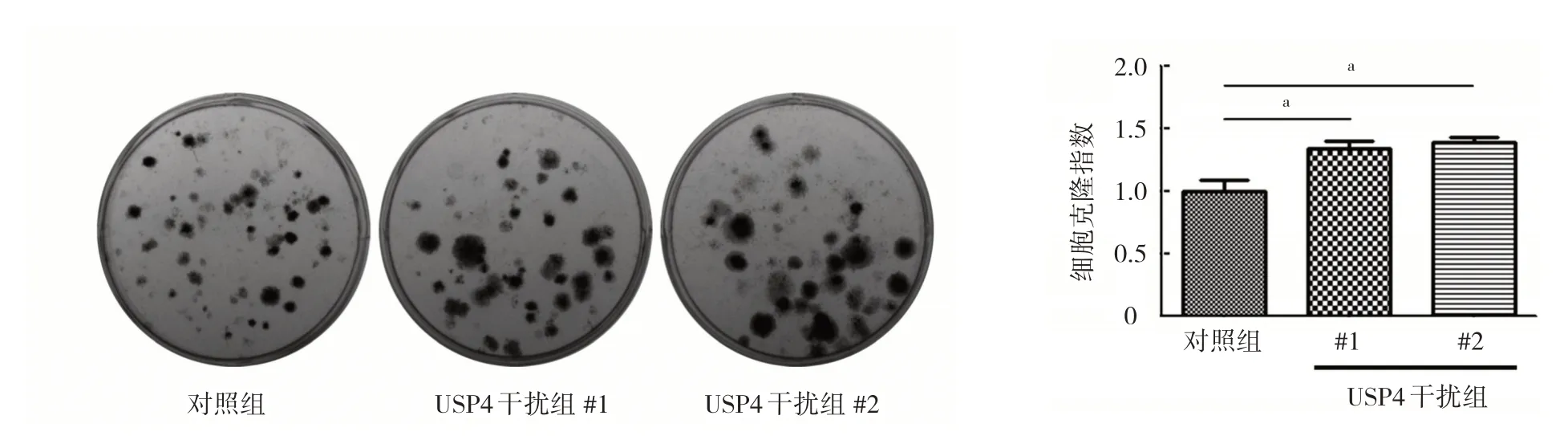
图3 敲低USP4 对Caki-1 细胞增殖能力的影响
3 讨论
对于KIRC,目前最有效的方法是早期发现并实施手术治疗,但是约60%患者初次诊断即为转移性KIRC或在病程中发生肿瘤复发及转移,而肿瘤转移是KIRC患者死亡的主要原因[4]。因此,探索KIRC 探索新的治疗靶点对于精准靶向治疗意义重大。去泛素化酶是蛋白质泛素化逆转过程的蛋白酶,而USP4 作为泛素特异性蛋白酶家族成员之一,在多种肿瘤发生、发展过程中发挥肿瘤抑制作用。在食管癌中,USP4 高表达与患者预后改善有关[10]。与癌旁正常组织相比,USP4在肺腺癌、肺鳞癌细胞中的表达明显降低;同时发现USP4 参与NF-κB 信号通路的调控,而USP4 的稳定敲低可增强炎症反应,并促进肺癌细胞的增殖、迁移和侵袭[11-12]。
本研究利用生物信息学工具分析显示,USP4 在KIRC 组织中的mRNA 及蛋白表达水平均明显低于癌旁正常肾脏组织;且KIRC 组织中USP4 mRNA 表达水平与患者T 分期、病理分期、组织学分级、总生存率、疾病特异性生存率、无进展生存率均有关,与性别、年龄、N 分期、M 分期均无关。可见,USP4 高表达患者能取得更好的生存获益。因此,笔者推测USP4 可能是预测KIRC 发生、发展的生物标志物。为了验证这一猜想,本研究利用细胞模型作了初步探索,结果显示USP4 蛋白在Caki-1、OSRC-2 细胞中显著过表达,而过表达USP4 会明显降低Caki-1、OSRC-2 细胞增殖能力和克隆形成能力,敲低USP4 会明显提高Caki-1 细胞克隆形成能力。笔者推测去泛素化酶抑癌作用相关的机制可能与其底物蛋白功能有关,由于底物分子调节多种肿瘤相关信号通路,包括p53、NF-κB、Wnt、转化生长因子-β、组蛋白表观遗传修饰等[13],但需要进一步研究明确。
综上所述,本研究初步证实USP4 在KIRC 细胞中可能发挥抑癌作用,为KIRC 的临床诊治治提供新的治疗靶点。
