小骨窗开颅血肿清除术与神经内镜下经外侧裂入路血肿清除术治疗高血压脑出血疗效对比
2023-09-03刘泓渊
夏 芹 覃 凡 刘泓渊 钟 棋
电子科技大学医学院附属绵阳医院·绵阳市中心医院,四川 绵阳 621000
高血压脑出血(hypertensive intracerebral hemorrhage,HICH)是一种多发于老年群体的非外伤性脑实质出血性疾病,多由机体血压持续异常升高造成小动脉硬化所引起的血管破裂,血肿灶位置常见于基底节区,病情危急,进展迅速,致残、致死率高[1-2]。外科手术是治疗HICH 最常用方式,小骨窗开颅血肿清除术对基底节区域责任血肿块的清除效率较高,术式具备轻度微创化、操作便捷等特点,但本术式仍存在术野相对狭窄等问题,针对颅脑深部血肿块处理难度较大,且止血相对困难,术后并发症较多,临床应用受到一定限制[3]。神经内镜下经外侧裂入路血肿清除术治疗HICH患者具有创伤性小、术后恢复迅速等优势,能精准定位于血肿灶,达到彻底清除血肿块的目的,从而有效解除颅脑局部占位效应,提升手术治疗效果[4-5]。但目前关于小骨窗开颅血肿清除术与神经内镜下经外侧裂入路血肿清除术治疗HICH 的血肿清除效果和术后再出血风险等报道尚存在差异。本文进一步探讨以上两种术式的疗效及安全性。
1 资料与方法
1.1 临床资料回顾性分析2020-01—2023-01 绵阳市中心医院收治的107例HICH患者的临床资料,采取小骨窗开颅血肿清除术的48例患者纳入小骨窗组,男/女为26/22,年龄(61.89±12.81)岁,高血压病程(11.36±2.09)a,血肿量(56.02±3.36)mL,术前格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分(8.22±2.09)分;选择神经内镜下经外侧裂入路血肿清除术的59 例患者纳入神经内镜组,男/女为35/24,年龄(62.56±12.15)岁,高血压病程(11.25±2.15)a,血肿量(55.85±3.52)mL,术前GCS评分(8.56±2.15)分。2组患者基线资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入及排除标准纳入标准:(1)根据《中国脑出血诊治指南(2019)》对HICH 的判定标准,经头部CT或MRI显示责任病灶位于基底节区出血,出血量30~70 mL;(2)入院时GCS 量表评估4~12 分;(3)年龄35~85 岁,高血压病程1.56~24.12 a;(4)符合对应手术适应证者;术前签署手术治疗风险知情同意书者;(5)临床资料完整。排除标准:(1)责任病灶位置较深,如脑干出血或单纯丘脑出血者;(2)入院时处于昏迷状态;(3)因颅脑外伤、颅内动静脉畸形出血、颅内动脉瘤、瘤卒中、血液系统疾病等疾病所致脑出血者;(4)因使用抗凝药物导致脑出血者;(5)合并呼吸衰竭、心力衰竭者;(6)伴中枢循环衰竭者;(7)脓毒症者;(8)因心脏、肝脏、肾脏等重要脏器出现器质性病变者;(9)精神系统疾病者;(10)意识不清楚,难以配合手术治疗者。
1.3 方法所有入组患者均在入院后接受密切的生命体征监测,做好术前准备工作,及时给予氧气支持和补液,纠正患者的水电解失衡、酸碱失衡。进入手术室后,均接受气管插管全身麻醉。
1.3.1 小骨窗组基于小骨窗开颅术治疗:采取头颅CT明确基底节区血肿灶后,手术入路选择侧裂、岛叶皮层入路,或选择Kocher 点颞中回、颞上回入路,在显微镜术野下,明确血肿的最大层面以及最接近脑表位置作为核心,开放皮层,牵拉,使用电钻开孔,借助咬骨钳或铣刀开一3~5 cm的骨窗,以“十”字型切开硬脑膜,使用18号穿刺针开始穿刺引流,吸附血肿块5~10 mL,以达到减压效果,再使用双极电刀切开大脑皮质并造瘘。操作过程中时刻注意避开功能区域和序贯,切勿将大脑皮质切开过大,切开范围不能侵犯脑沟,待血肿灶充分显露后及时做血肿块清除处理,再使用双极电凝镊针对性进行止血处理,并采取无菌生理盐水反复冲洗血肿腔,直至无任何活动性出血迹象后,则常规止血、纱布覆盖术区,将引流管留置其中,逐层关闭缝合术区。
1.3.2 神经内镜组给予神经内镜微创手术治疗:应用RUO33000 型神经内镜系统(德国鲁道夫公司生产)及配套手术器械。术前由头颅CT显示的血肿腔长轴最长层面作为标记,选择经侧裂入路进入血肿腔内,采取直切法,直切口长度4 cm,电钻钻孔,借助咬骨钳或铣刀扩大骨窗直径约2 cm,后悬吊处理,以“十”字型切开硬脑膜,连接内镜导引器和导航手术器械适配器,并进行手术导航系统引导,选择朝着血肿腔长轴方向开始做穿刺处理,待导引器顶端直达血肿腔1/3处后,将内镜导引器内的管芯以及导航手术器械适配器进行拔除,并采取蛇形牵开器进行固定,置入神经内镜,再逐渐朝外退出引导器,借助神经内镜的术野下进行血肿块清除,针对性电凝止血,直至无任何出血迹象后,则常规止血、纱布覆盖术区,将引流管留置其中,逐层关闭缝合术区。
1.4 观察指标
1.4.1 手术一般情况:观察并记录2组患者受试病例的手术时间、术中出血量、脑脊液恢复时间及置管时间。
1.4.2 血肿清除率:观察并记录2组患者受试病例的血肿清除率。血肿清除率计算公式为:血肿清除率=(术前血肿量—术后血肿量)/术前血肿量×100%。
1.4.3 预后情况:应用格拉斯哥预后评分(Glasgow outcome scale,GOS)[6]对2组患者的预后情况进行客观量化评估,该量表共分为5个等级,5级:受测对象恢复正常,虽有轻度缺陷,但能够正常生活,记5分;4级:伴有轻度残疾,但能够独立生活,在保护下工作,记4 分;3 级:重度残疾,有清醒意识,日常生活无法自理,需他人照护,记3分;2级:植物生存状态,仅有最小反应,如睡眠或清醒周期时眼睛能睁开,记2分;1级:死亡,记1分。记录2组患者术前及术后7 d的GOS评分变化。
1.4.4 神经功能缺损情况:采取神经功能缺损量表评分(neural function defect score,NFDS)[7]对2 组患者的神经功能缺损程度进行评估,总分值0~45 分,其中0~15 分判定为轻度神经功能缺损,16~30 分判定为中度,31~45 分判定为重度。记录2 组患者术前及术后7 d后的NFDS量表分值变化。
1.4.5 血清生化指标:采集2组患者受试病例的空腹外周静脉血5 mL,采集时间选择在术前及术后7 d的清晨,转速3 000 r/min、离心半径10 cm离心10 min,取出血清样本,冷藏于—80 ℃冰柜中备检。选用酶联免疫吸附法测定血清炎症因子[白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)]水平和神经功能指标[神经元特异性烯醇化酶(neuron specific enolasc,NSE)、S100蛋白]含量变化。
1.4.6 术后并发症:记录2组患者受试病例术后并发症发生情况,如颅内感染、肺部感染、颅内再出血等并发症。
1.5 统计学方法所有数据均导入SPSS 20.0软件进行统计学分析,符合正态分布和方差齐性的计量资料以均数±标准差(±s)进行描述,采用独立t检验或配对t检验;计数资料、等级资料采取构成比(%)描述,计数资料行卡方检验,等级资料采用Wilcoxon秩和检验法。统计检验采用双侧检验,检验水准:α=0.05。
2 结果
2.1 2组患者手术一般情况及血肿清除率对比相比小骨窗组,神经内镜组的手术时间、脑脊液恢复时间及置管时间均显著缩短(均P<0.001),术中出血量显著减少(P<0.001),血肿清除率显著降低(P<0.001)。见表1。
表1 2组患者手术一般情况及血肿清除率对比 (±s)Table 1 Comparison of surgical general situation and hematoma clearance rate between the two groups of patients (±s)

表1 2组患者手术一般情况及血肿清除率对比 (±s)Table 1 Comparison of surgical general situation and hematoma clearance rate between the two groups of patients (±s)
组别神经内镜组小骨窗组χ2/t值P值n 59 48手术时间/h 1.65±0.59 4.25±1.25 14.165<0.001术中出血量/mL 42.66±8.25 352.15±103.12 22.988<0.001脑脊液恢复时间/d 8.36±1.25 13.56±2.02 16.312<0.001置管时间/d 2.06±0.56 4.56±0.89 17.704<0.001血肿清除率/%91.25±7.15 78.56±12.15 6.722<0.001
2.2 2 组患者术前及术后7 d 的GOS 评分及NFDS评分对比术后7 d,2 组患者GOS 评分相比术前均显著性提高(P<0.05),NFDS评分相比术前均显著降低(P<0.05),神经内镜组术后7 d评分与小骨窗组比较差异有统计学意义(P<0.001)。见表2。
表2 2组患者术前及术后7 d的GOS评分及NFDS评分对比 (分,±s)Table 2 Comparison of GOS score and NFDS score before surgery and at 7 days after surgery between the two groups of patients (scores, ±s)
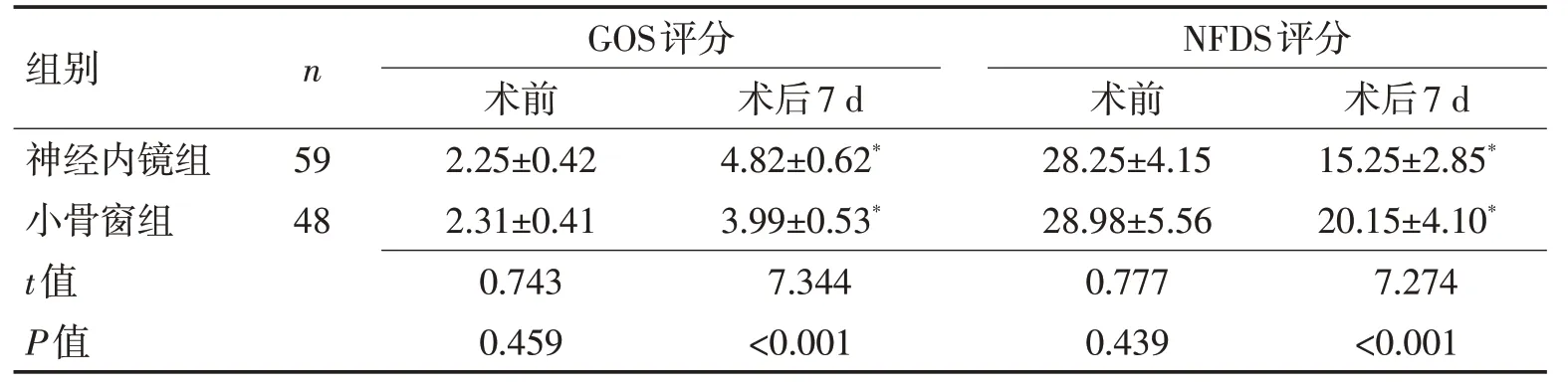
表2 2组患者术前及术后7 d的GOS评分及NFDS评分对比 (分,±s)Table 2 Comparison of GOS score and NFDS score before surgery and at 7 days after surgery between the two groups of patients (scores, ±s)
注:与术前对比,*P<0.05
组别神经内镜组小骨窗组t值P值n 术后7 d 15.25±2.85*20.15±4.10*7.274<0.001 59 48 GOS评分术前2.25±0.42 2.31±0.41 0.743 0.459术后7 d 4.82±0.62*3.99±0.53*7.344<0.001 NFDS评分术前28.25±4.15 28.98±5.56 0.777 0.439
2.3 2 组患者术前及术后7 d 的炎症因子指标和神经功能指标水平对比术后7 d,2组患者血清IL-6、TNF-α水平相比术前均显著升高(P<0.05),但神经内镜组显著低于小骨窗组(P<0.001),2 组患者血清NSE、S100 蛋白含量相比术前均显著降低(P<0.05),神经内镜组显著低于小骨窗组(P<0.001)。见表3。
表3 2组患者术前及术后7 d的炎症因子指标和神经功能指标水平对比 (±s)Table 3 Comparison of inflammatory factors and neurological function indicators before surgery and at 7 days after surgery between the two groups of patients (±s)
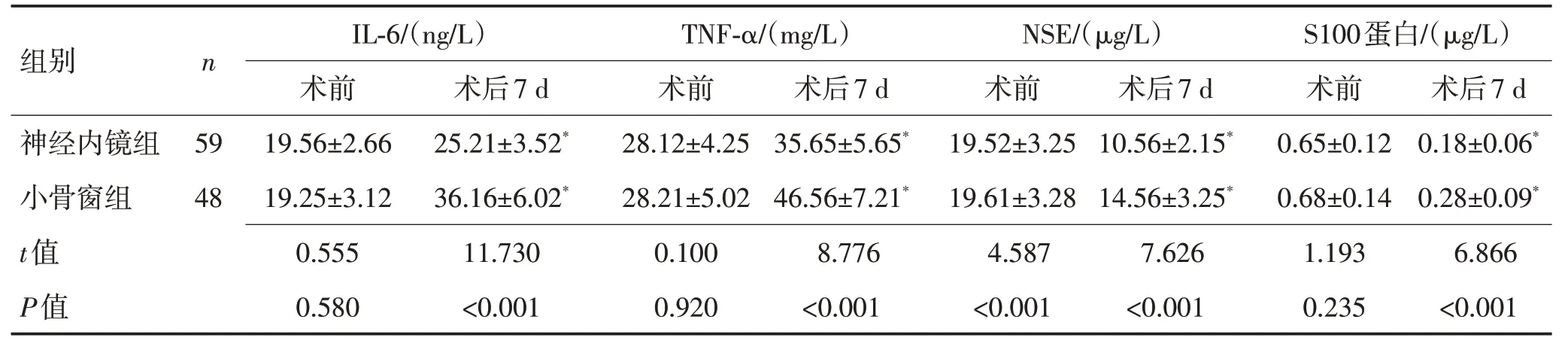
表3 2组患者术前及术后7 d的炎症因子指标和神经功能指标水平对比 (±s)Table 3 Comparison of inflammatory factors and neurological function indicators before surgery and at 7 days after surgery between the two groups of patients (±s)
注:与术前对比,*P<0.05
组别n神经内镜组小骨窗组t值P值59 48 IL-6/(ng/L)术前19.56±2.66 19.25±3.12 0.555 0.580术后7 d 25.21±3.52*36.16±6.02*11.730<0.001 TNF-α/(mg/L)术前28.12±4.25 28.21±5.02 0.100 0.920术后7 d 35.65±5.65*46.56±7.21*8.776<0.001 NSE/(μg/L)术前19.52±3.25 19.61±3.28 4.587<0.001术后7 d 10.56±2.15*14.56±3.25*7.626<0.001 S100蛋白/(μg/L)术前0.65±0.12 0.68±0.14 1.193 0.235术后7 d 0.18±0.06*0.28±0.09*6.866<0.001
2.4 2 组患者术后并发症发生情况对比神经内镜组术后并发症发生率相比小骨窗组显著下降(P<0.038)。见表4。
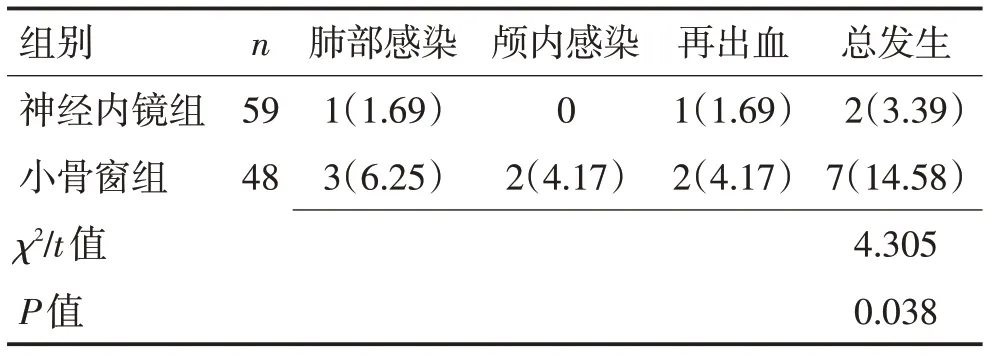
表4 2组患者术后并发症发生情况对比 [n(%)]Table 4 Comparison of occurrence of postoperative complications between the two groups of patients [n(%)]
2.5 典型病例术前、术后分析观察组典型病例:男,57 岁,血肿位于左侧基底节、丘脑区出血并破入脑室(图1A白色箭头所示),脑中线结构偏左0.4 cm,少量蛛网膜下腔出血约60 mL,左侧额叶片状低密度影,考虑为脑软化灶可能;采取小骨窗开颅血肿清除术+神经减压术+脑室外引流术治疗后(图1B)。对照组典型病例:男,54岁,右侧基底节并破入脑室(图1C 白色箭头所示),左侧额叶片状低密度影,少量蛛网膜下腔出血约40 mL(图1D)。
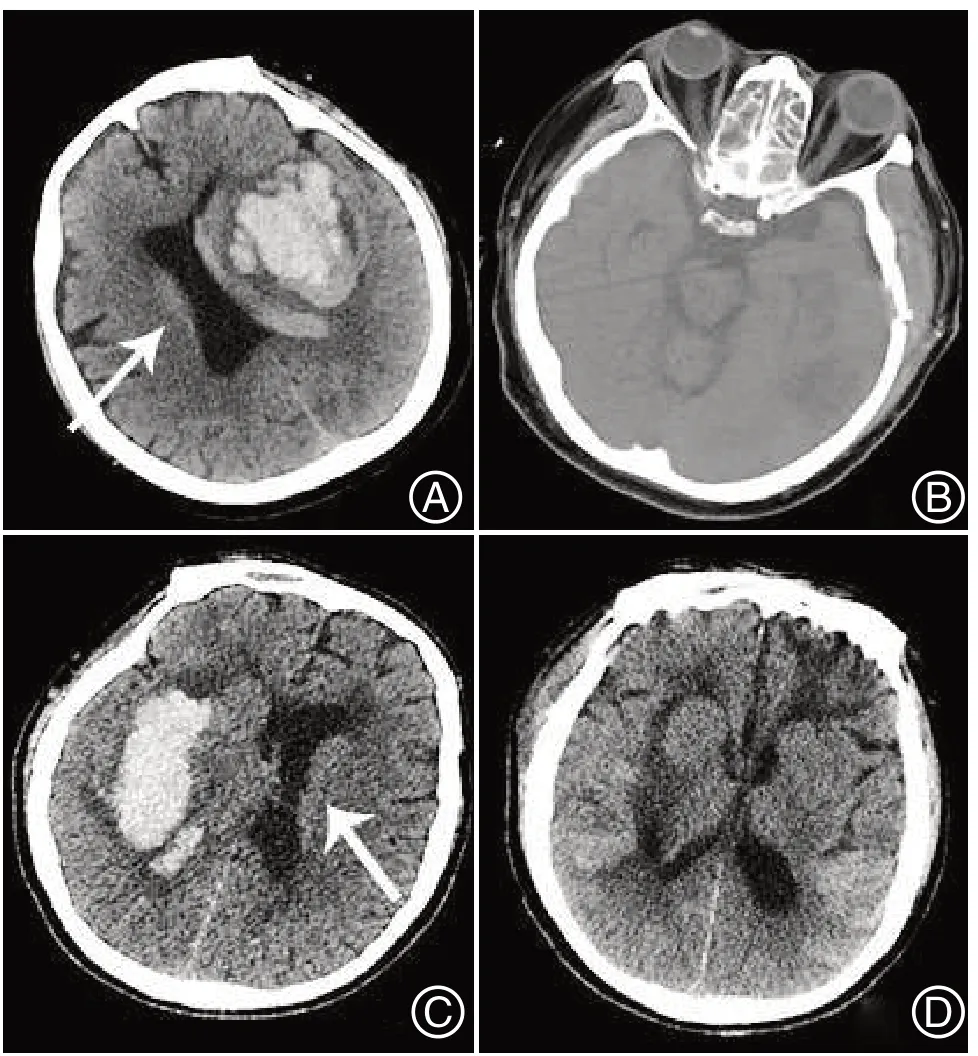
图1 小骨窗开颅血肿清除术和神经内镜下经外侧裂入路血肿清除术的术前后对比Figure 1 Preoperative and postoperative comparisons of small bone window craniotomy hematoma removal and neuroendoscopic hematoma removal via lateral fissure approach
3 讨论
小骨窗开颅血肿清除术具有微创理念,减轻对脑组织和重要神经与血管的损伤,止血便捷,避免因血肿块引流造成术野直观操作,能更彻底引流血肿块,从而提升血肿块清除效果[8]。神经内镜血肿清除术对颅脑组织的损伤程度相对较少,且手术时间较短,患者术后恢复更快,而经神经内镜外侧裂入路治疗不仅能兼顾大骨瓣的减压,还能借助神经内镜提供的术野更细微地观察血肿附近细小血管,及时止血,缩短手术时间,提高手术质量[9]。本研究发现,相较于小骨窗开颅血肿清除术,经神经内镜外侧裂入路治疗的手术时间、脑脊液恢复时间及置管时间均明显缩短,术中出血量明显减少,血肿清除率明显提高,术后7 d的GOS评分明显提高,NFDS评分明显降低。分析其原因,小骨窗开颅血肿清除术由于术野相对狭窄、光源不足等问题,对血肿块定位的精确性较低,影响手术操作效率,延长手术时间,且难以彻底清除颅内较深部位责任灶,从而导致血肿彻底清除效果不佳[10];此外,由于本术式常需牵拉脆弱的脑组织、重要血管与神经,极易造成二次脑神经功能损伤,影响患者预后。选择外侧裂入路能通过切开岛叶皮质后直达血肿块腔内,手术路径最短,不仅能彻底清除血肿块,保护周围小穿支血管,且易发现出血点,降低颅内再出血风险,同时相对优势侧出血,能有效保护语言功能;在神经内镜引导下能有效拓宽术野,避免传统人工微创手术通道的手术耗时较长,进而利于发现血肿块附近细小血管和细微出血点,可充分止血,减少术中出血量,提升清除血肿块效率,缩短手术时间,更利于患者术后脑脊液恢复和能更快地撤除引流管,提升整体血肿块清除效果,从而解除局部脑组织占位效应,改善患者预后和神经功能缺损情况。
既往文献表明,由于颅脑外科手术由于过度暴露或牵拉等侵入性操作,极易引起机体局部或全身炎症反应,导致外周血肿炎症因子如IL-6、TNF-α等异常表达,会进一步加重脑组织神经功能缺损,且血清IL-6、TNF-α表达水平越高,提示脑组织受损程度越严重[11-13]。此外,颅内血肿块扩散造成的局部占位效应,也是造成神经功能缺损的重要原因之一[14]。NSE 是一种酸性蛋白酶,仅存在于神经细胞和神经内分泌细胞,机体处于健康状态时候,其在血循环中的表达含量极低,一旦脑组织供氧不足,血脑屏障被破坏,可造成NSE异常生产和释放,在一定程度上能反映神经功能缺损情况[15-16]。S100B蛋白是反映血-脑脊液屏障被破坏程度的典型生化标志物,当脑组织受损时,其表达浓度大幅度提升,且S100B蛋白表达水平越高,提示患者神经功能缺损程度越严重[17-19]。本研究显示,神经内镜组受试患者的血清IL-6、TNF-α水平虽较术前提升,但升高幅度低于小骨窗组,而血清NSE、S100蛋白含量则明显低于术前和小骨窗组,提示相比于小骨窗开颅血肿清除术治疗,HICH 患者采用神经内镜外侧裂入路血肿清除术治疗后的炎症反应更轻,且能明显改善患者的神经功能缺损情况,利于病情恢复。对比2组患者术式安全性发现,神经内镜外侧裂入路血肿清除术的术后并发症总发生率仅为3.39%,远低于小骨窗开颅血肿清除术的14.58%,安全性良好,与肖豆等[20]报道相符。
本文采取神经内镜外侧裂入路血肿清除术治疗的优势:(1)能多角度处理血肿块,直观深部血肿块,彻底清除死角残留血肿;(2)利用透明硬通道壁管辅助神经内镜能直观观测管侧血肿块,及时发现并处理对微小出血点,更精准定位血肿块和观察血肿块与脑组织的分界线,避免损伤脑组织中重要血管和神经;(3)严密闭合内镜引导器管壁、管芯,能减少反复多次前缘切割和穿刺,可视化定位血肿块,一次性穿刺成功,提高手术操作效率,同时一次性建立通道,能减少对脑组织不必要的牵扯、牵拉。此外,本术式仍需注意以下几点事项:(1)此入路方式仅适用于位于内囊膝部、前肢与尾状核头或、体部、豆状核前中部的血肿块,针对以上部位后部的血肿块,则建议采取颞上沟-脑岛入路。(2)神经内镜技术操作空间存在一定限制,加上本术式对血肿块定位精确性的要求更高,对医师个人操作技术和经验要求偏高。
相比于小骨窗开颅血肿清除术治疗,采取神经内镜外侧裂入路血肿清除术治疗HICH 患者能明显提升手术治疗效果,不仅能改善患者的预后和神经功能缺损情况,还能减轻机体炎症反应,降低神经功能指标水平,进一步保护脑组织神经功能,术后并发症更少,临床应用价值明确。
