抗NMDAR 脑炎的脑脊液Aβ和tau 蛋白生物标志物与疾病严重程度及预后的关系
2023-09-03宋雅君邵颖哲贾延劼
宋雅君 龚 哲 杜 娟 邵颖哲 贾延劼
郑州大学第一附属医院,河南 郑州 450052
抗-N-甲基-D-天冬氨酸受体(anti-N-methyl-D-aspartate receptor,NMDAR)脑炎是自身免疫性脑炎(autoimmune encephalitis,AE)最常见的亚型,具有广泛的临床谱系[1]。其诊断高度依赖抗NMDAR 抗体的检出,且血清和脑脊液中的抗体滴度可能是唯一公认的抗NMDAR脑炎疾病活性指标[1-2]。但一些研究提出怀疑,认为一些寿命较长、免疫治疗难以攻击的浆细胞可能在各种器官中存活,并导致抗体保持在一定水平,这体现在临床康复多年后患者血清和脑脊液仍有抗体持续存在[3-4]。鉴于这种可能的局限性,仍需额外的生物标志物评估抗NMDAR 脑炎的严重程度或预后。
阿尔茨海默病(Alzheimer’s disease,AD)的特征包括细胞外斑块和细胞内神经纤维缠结(neurofibrillary tangles,NFTs),分别由β淀粉样蛋白(amyloid beta,Aβ)沉积和tau 蛋白磷酸化(p-tau)引起[5]。与健康对照组相比,AD 患者的Aβ水平下降,tau 水平升高[6]。越来越多的证据支持神经炎症是AD的神经病理特征之一[7-8]。病毒、细菌甚至真菌抗原已被发现与Aβ的病理沉积有关[9-11]。炎症期间淀粉样蛋白负担的逐渐增加及其抗感染特性的观察支持了Aβ可能在大脑的整体防线中发挥重要作用的观点[12-13]。然而,自身免疫性脑炎的病理过程是否涉及Aβ或tau蛋白的改变,目前尚未报道。另外在认知障碍人群中淀粉样斑块沉积与认知密切相关[14],而抗NMDAR脑炎患者伴认知功能减退是否与Aβ或tau蛋白有关尚未报道。
本文通过检测NMDAR脑炎患者脑脊液中Aβ1-42、Aβ1-40、t-tau 和p-tau 蛋白的水平,并与非炎症性神经疾病进行比较,且分析评估了脑脊液Aβ和tau在NMDAR脑炎患者中的临床价值。
1 方法与对象
1.1 研究对象纳入2019-07—2022-06 郑州大学第一附属医院神经内科收治的34例抗NMDAR脑炎患者和13例非炎症性神经疾病患者进行回顾性队列研究。本研究经郑州大学第一附属医院伦理委员会批准,所有患者或授权委托人签署知情同意书。
抗NMDAR 脑炎组纳入标准:(1)年龄≥18 岁;(2)符合2016 年Frances 修订的抗NMDAR 脑炎诊断标准[15],且脑脊液中检测出NMDAR 抗体阳性,明确诊断为抗NMDAR脑炎;(3)发病后在本院首次确诊,就诊前未接受任何免疫调节治疗。排除标准:(1)3个月内有过感染性脑炎或其他感染性疾病病史;(2)脑脊液采样时正在或曾经接受免疫治疗;(3)存在其他影响mRS评分的疾病;(4)数据不完整者。对照组纳入标准:(1)年龄≥18岁;(2)同期在我院住院行腰穿检查的其他非炎症性神经系统疾病患者,包括头晕、头痛和躯体化障碍;(3)脑脊液化验常规生化细胞学均无异常。
1.2 研究方法
1.2.1 临床资料的收集:详细收集所有患者的病史(高血压、糖尿病、冠心病、脑卒中或其他并发症)、人口学特征、入院时改良Rankin 量表(modified Rankin Scale,mRS)评分、入院时的临床症状(发热、头痛、意识障碍、认知障碍、精神行为异常、癫痫、睡眠障碍等)、入院时的实验室检查结果(CSF和血液数据、致病抗体和病原体)以及发病3 个月后的结局(mRS 评分)。所有患者均于入院后第2 天早晨采集空腹血,并在治疗开始前收集CSF。所有方法均按照相关规定进行,所有参与者在入组前均签署书面知情文件。
1.2.2 脑脊液收集:标准腰椎穿刺后,收集20 mL脑脊液。取15 mL 脑脊液进行常规、生化、细胞学、NGS、脑脊液培养、电泳或抗体检测。剩余的脑脊液样品立即在4 ℃下,4 000 g 离心10 min。上清液转移到聚丙烯管中,—80 ℃保存,直到进行测定。所有程序均在60 min内完成。
1.2.3 脑炎神经功能评分:由两名经验丰富的神经内科医生根据入院时mRS 评分独立评估抗NMDAR脑炎的严重程度,mRS评分≤2表示疾病严重程度较轻,mRS评分≥3表示疾病严重程度较重。根据出院3 个月时随访进行mRS 评分评估抗NMDAR 脑炎的预后。mRS评分≤2表示临床预后良好,mRS评分≥3表示预后较差[16]。
1.2.4 实验室检查:所有采集的血液或脑脊液样本均在郑州大学第一附属医院生物化学实验室或神经内科实验室进行分析。血液样本用于检查血常规、凝血功能、白蛋白和炎症指标水平。对于脑脊液的常规检测,通过仪器分析对体液细胞进行计数和分类。同时,采用离心沉淀玻片法进行人工镜检、分类和复检。抗NMDAR 脑炎患者的血清和脑脊液样本在神经内科实验室用转染细胞为标准基质的方法来确定抗体滴度。CSF 二代测序由北京基因组研究所高通量分析检测。脑脊液Aβ1-42、Aβ1-40、t-tau 和p-tau蛋白水平由先声诊断公司采用酶联免疫吸附法分析检测。
1.3 统计学分析采用SPSS 21.0 版进行统计分析。对本研究数据进行正态性检验,正态分布数据以均数±标准差(±s)表示,采用独立样本t检验。非正态分布数据以中位数(四分位范围)表示,并使用Mann-Whitney U 检验进行比较。分类数据以例数(%)表示,使用卡方检验或Fisher 精确检验进行比较。根据需要,使用Spearman 的等级分析或Pearson的相关分析来评估数据之间的相关性。受试者工作特征(receiver operating characteristics,ROC)曲线下的面积用于量化生物标志物对给定诊断的诊断性能。结果预测的截止值根据灵敏度和特异性的最高总和选择。P<0.05为差异有统计学意义。
2 结果
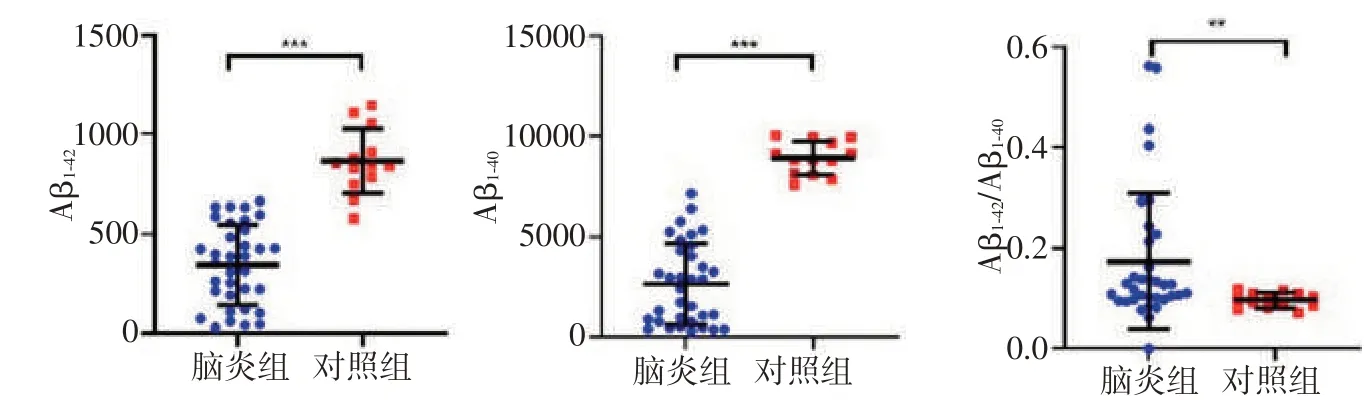
2.1 脑炎组、对照组的一般资料及实验室检查如表1 所示,抗NMDAR 脑炎组与对照组的既往患病情况无统计学差异(P>0.05)。与对照组相比,抗NMDAR组患者出现明显发热、意识障碍、癫痫、认知障碍、精神行为异常、脑脊液细胞数和蛋白升高(P<0.05)。抗NMDAR组脑脊液Aβ1-42、Aβ1-40明显低于对照组,差异有统计学意义(P<0.001);在脑脊液t-tau和p-tau的含量上抗NMDAR脑炎组与对照组比较差异无统计学意义(P>0.05),见图1。

图1 抗NMDAR脑炎组和对照组Aβ1-42、Aβ1-40、Aβ1-42/Aβ 1-40、t-tau 和p-tau 差异性比较Figure 1 Comparison of differences between the anti-NMDAR encephalitis group and the control group Aβ1-42,Aβ1-40,Aβ1-42/Aβ1-40,t-tau and p-tau

表1 抗NMDAR脑炎组和对照组一般资料、实验室检查比较Table 1 Comparison of general data and laboratory tests between the anti-NMDAR encephalitis group and control group
2.2 抗NMDAR 脑炎患者脑脊液中Aβ1-42与临床参数的相关性分析抗NMDAR脑炎患者的脑脊液Aβ1-42与其他实验室指标相关性分析结果提示,脑脊液Aβ1-42与入院mRS 评分(r=—0.887,P<0.001)和出院3个月mRS 评分(r=—0.871,P<0.001)高度相关;与中性粒绝对值(r=—0.433,P=0.011)、球蛋白(r=—0.436,P=0.010)、NLR(r= —0.548,P<0.001)、MoCA 评分(r=0.433,P=0.031)中度相关;与淋巴细胞(r=0.384,P=0.025)、肌酐(r=0.367,P=0.033)、尿酸(r=0.344,P=0.047)、脑脊液氯化物(r=—0.354,P=0.040)低度相关。见表2。
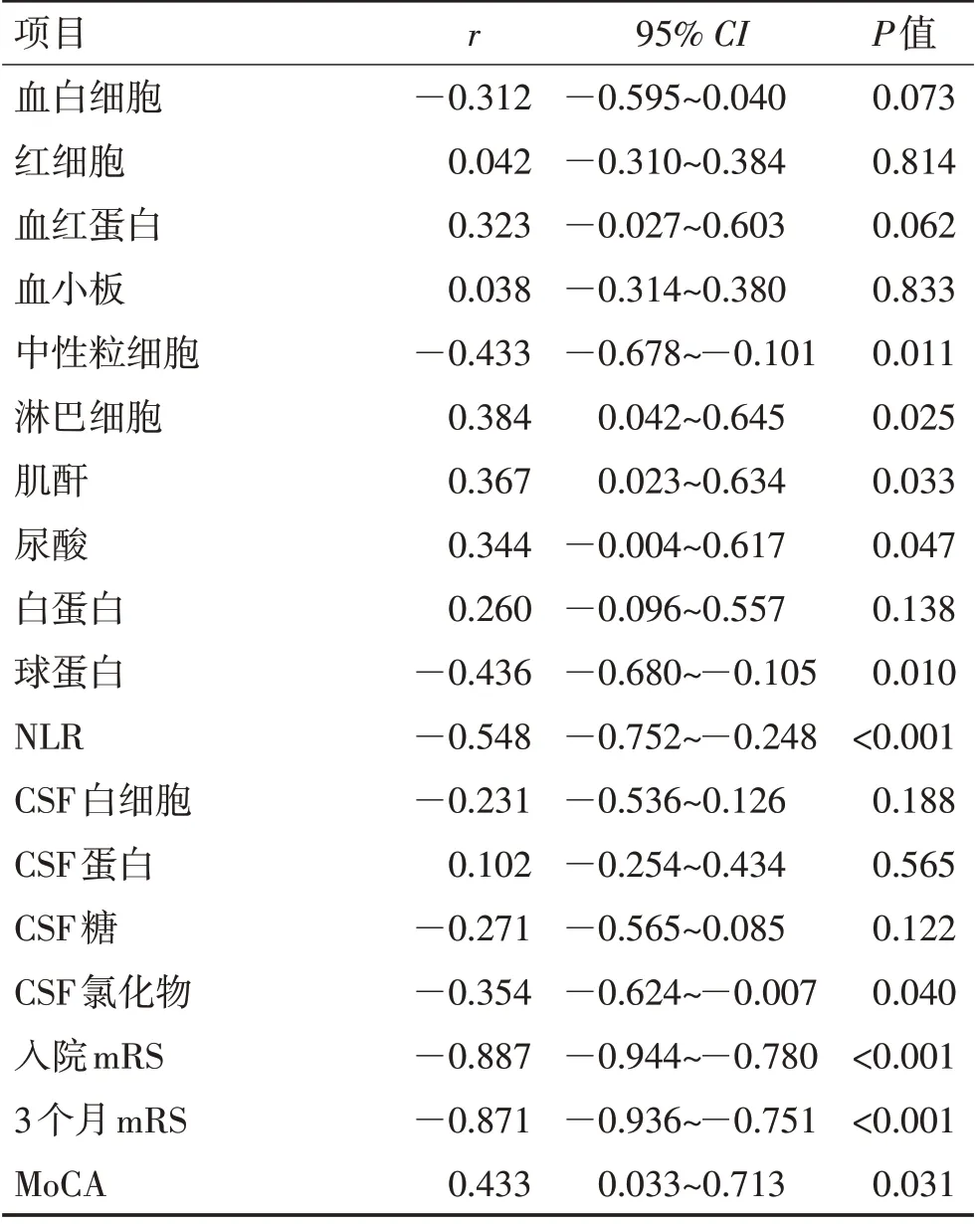
表2 抗NMDAR脑炎患者脑脊液中Aβ1-42与临床参数的相关性分析Table 2 Correlation analysis of Aβ1-42 in cerebrospinal fluid and clinical parameters in patients with anti-NMDAR encephalitis
2.3 不同严重程度组抗NMDAR 脑炎的差异性分析和危险因素如表3所示,将疾病严重程度较轻组和较重组的血及脑脊液实验室检查指标进行描述统计加差异性分析,2 组在中性粒细胞绝对值(P=0.038)、尿酸(P=0.005)、NLR(P=0.021)、A β1-42(P<0.001)、Aβ1-40(P<0.001)、t-tau(P=0.048)上差异有统计学意义。较轻组的中性粒细胞绝对值、NLR、t-tau低于较重组,尿酸、Aβ1-42、Aβ1-40高于较重组。将差异有统计学意义的指标进行单因素Logistic回归分析,抗NMDAR 脑炎疾病严重程度与Aβ1-42(OR=0.976,95% CI:0.958~0.996,P=0.017)、Aβ1-40(OR=0.999,95% CI:0.999~1,P=0.003)、NLR(OR=1.417,95%CI:1.025~1.961,P=0.003)显著相关(表4)。考虑不同因素间的相互影响及部分指标之间的共线性,筛选后进行多因素Logistic 回归分析,发现Aβ1-42(OR=0.979,95% CI:0.962~0.997,P=0.023)是抗NMDAR脑炎疾病严重程度的独立危险因素(表5)。
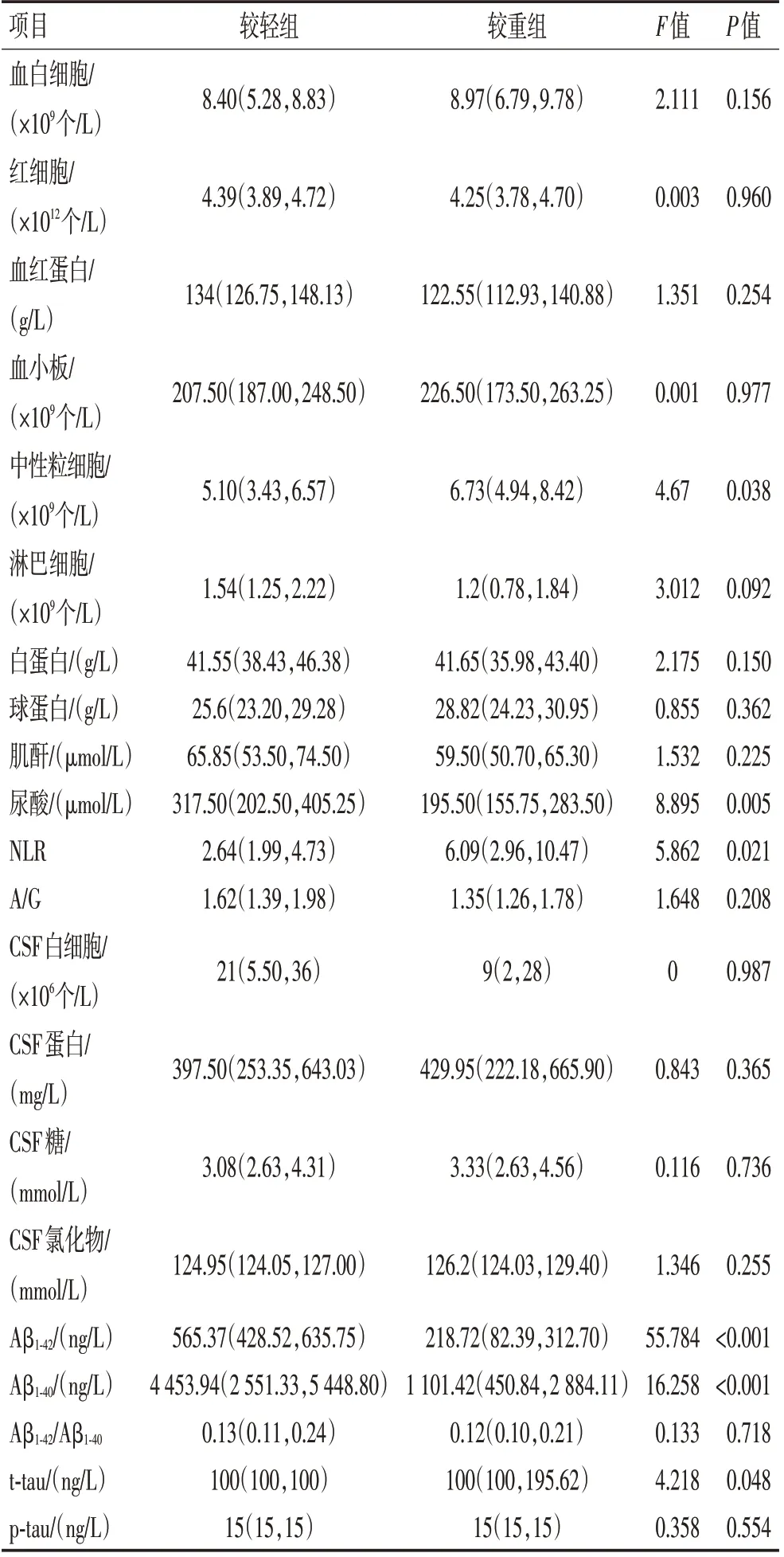
表3 不同严重程度组抗NMDAR脑炎的差异性分析Table 3 Differential analysis of anti-NMDAR encephalitis in different severity groups
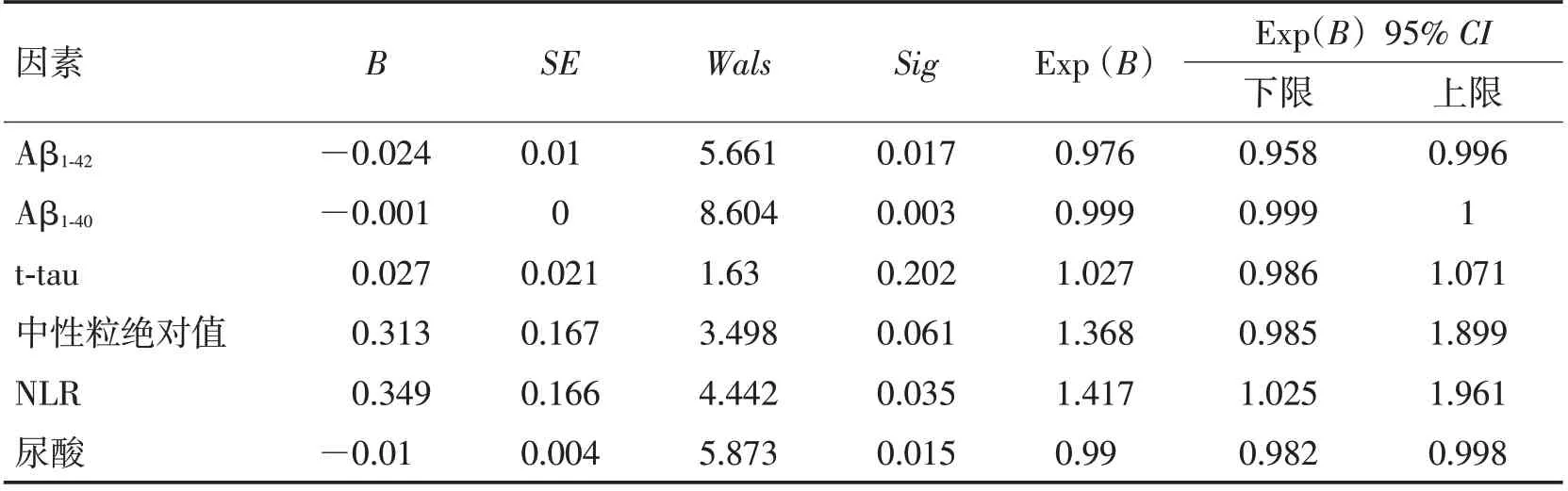
表4 不同严重程度组抗NMDAR脑炎的单因素回归分析Table 4 Univariate regression analysis of anti-NMDAR encephalitis in different severity groups

表5 不同严重程度组抗NMDAR脑炎的多因素回归分析Table 5 Multivariate regression analysis of anti-NMDAR encephalitis in different severity groups
2.4 不同预后组抗NMDAR脑炎的差异性分析和危险因素如表6 所示,将预后情况较好组和较差组的血及脑脊液化验指标进行描述统计加差异性分析,2 组在尿酸(P=0.011)、A/G(P=0.026)、A β1-42(P<0.001)、Aβ1-40(P=0.006)上有统计学差异。较好组的尿酸、A/G、Aβ1-42、Aβ1-40高于较差组。将差异有统计学意义的指标进行单因素Logistic回归分析,抗NMDAR 脑炎预后情况与A β1-42(OR=0.999,95% CI:0.984~0.996,P=0.002)、A β1-40(OR=0.999,95% CI:0.999~1,P=0.014)、A/G(OR=0.081,95% CI:0.007~0.886,P=0.039)、尿酸(OR=0.99,95%CI:0.981~0.999,P=0.023)显著相关(表7)。考虑不同因素间的相互影响及部分指标之间的共线性,筛选后进行多因素Logistic回归分析,发现Aβ1-42(OR=0.992,95% CI:0.986~0.999,P=0.020)是抗NMDAR 脑炎预后情况的独立危险因素(表8)。

表6 不同预后组抗NMDAR脑炎的差异性分析Table 6 Differential analysis of anti-NMDAR encephalitis in different prognostic groups
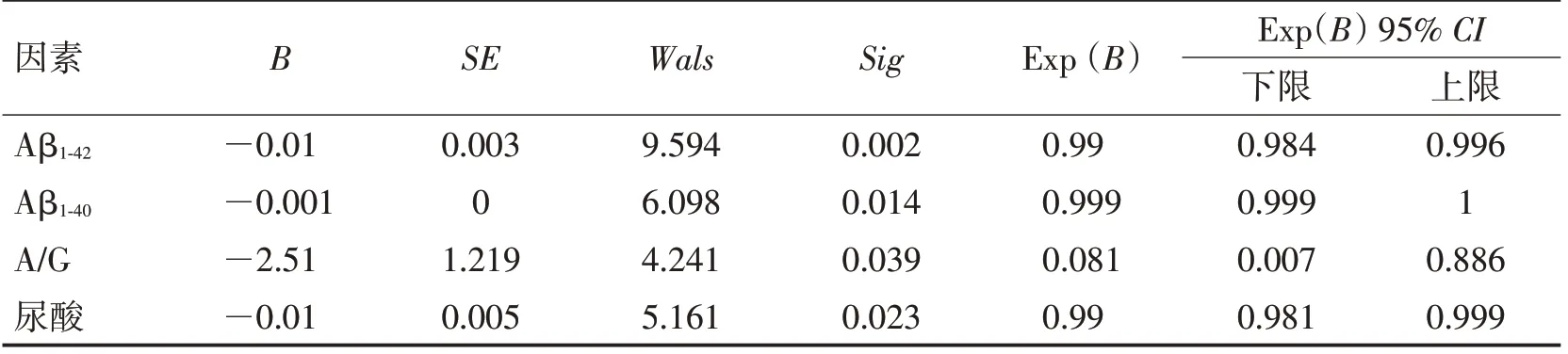
表7 不同预后情况组抗NMDAR脑炎的单因素回归分析Table 7 Univariate regression analysis of anti-NMDAR encephalitis in different prognostic groups
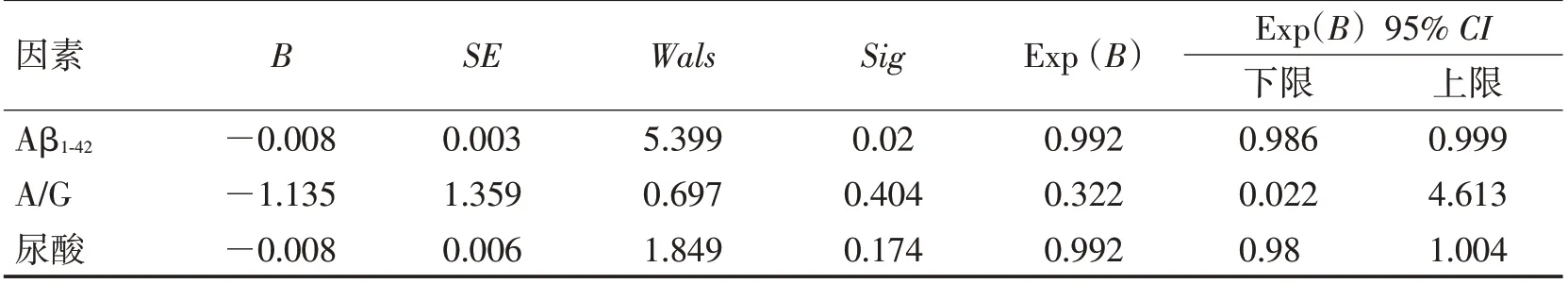
表8 不同预后情况组抗NMDAR脑炎的多因素回归分析Table 8 Multivariate regression analysis of anti-NMDAR encephalitis in different prognostic groups
2.5 抗NMDAR 脑炎患者脑脊液Aβ对疾病严重程度及预后的预测能力如图2 所示,脑脊液Aβ1-42对抗NMDAR 脑炎入院时疾病严重程度预测的曲线下面积为0.967 9,95%置信区间为0.918 3~1.000,截断值370.9,敏感度0.85,特异度1,P<0.000 1;对出院后3个月预后的预测的曲线下面积为0.871 4,95%置信区间为0.754 6~0.988 3,截断值370.9,敏感度0.857 1,特异度0.75,P=0.000 3。

图2 抗NMDAR脑炎患者脑脊液Aβ1-42的ROC曲线Figure 2 ROC curve of cerebrospinal fluid Aβ1-42 in patients with anti-NMDAR encephalitis
3 讨论
Aβ是AD的标志性蛋白之一,其生成和清除失衡导致AD 患者神经系统细胞外淀粉样斑块的病理改变,这涉及的β-淀粉样蛋白瀑布学说一直是AD发病机制的主流。脑脊液中的Aβ1-42被认为有更强的聚集倾向,从而形成淀粉样斑块并具有神经毒性[17]。然而除了淀粉样斑块沉积外,神经炎症也是AD的神经病理学特征之一[18]。有流行病学调查了8 000 多名被诊断患单纯疱疹病毒的患者与2.5万名未患单纯疱疹病毒感染诊断的对照组相比,患疱疹后被诊断为AD的概率提高了2.5倍,而且对比在积极接受过疱疹治疗的患者中,这种概率的增加几乎不见了[19]。病毒、支原体、细菌甚至真菌抗原已被发现与病理性Aβ沉积有关[10,20-23]。研究人员由此提出AD 的炎症假说,认为病原体造成的免疫系统持续性神经炎症导致形成淀粉样斑块的沉积[24]。脑脊液中可溶性Aβ的减少由淀粉样斑块中的Aβ沉积引起[25]。神经元损伤和随后的认知功能障碍主要由沉积的低聚物Aβ而不是成熟的原纤维造成支持了这一观点[26]。Aβ抗感染特性的提出也为此提供了支持[27-29]。
研究显示,细菌性脑膜炎患者脑脊液中的Aβ1-42和Aβ1-40含量,发现细菌性脑膜炎患者脑脊液中的Aβ1-42与对照组相比显著减少(P<0.05)[30],这可能与Aβ的抗菌活性有关,即Aβ在免疫反应中有一定保护性作用。研究发现在年轻的5XFAD转基因AD小鼠模型(表达人Aβ的转基因小鼠,10 周之前脑内无Aβ沉积)中,非致命的HSV1 感染可能有助于加速斑块生成的开始,且5xFAD小鼠在注入致命剂量的HSV1后比对照组小鼠活得更久,而斑块在其大脑中出现的时间缩短2 d[31]。此外,在无菌条件下,3D 神经细胞培养模型通常到培养第6周才会产生可观察到的Aβ沉积物[32],而3 周的培养细胞在感染病毒后48 h 内就观察到广泛的Aβ阳性沉积[31]。上述研究认为Aβ有抗菌肽(AMP)的生物活性,在人体中起保护和损害双重作用[33],而Aβ通过凝聚微生物,在入侵病原体周围形成复合物发挥抗菌活性,因此在脑脊液中不再测量[28]。本实验中抗NMDAR 脑炎患者脑脊液Aβ1-42较对照组明显降低,但目前无实验表明自身免疫性脑炎与Aβ的关系。有研究显示在多发性硬化患者中,患者脑脊液Aβ1-42低于正常对照组且差异有统计学意义[30]。根据上述Aβ的抗菌保护假说,Aβ可能像抗菌肽一样有凝聚微病原体的抗菌保护作用,任何入侵大脑的感染因子都可能具有这种触发作用,同时Aβ沉积可能是一种对感染的保护性免疫反应[19,33-37]。推测NMDAR作为一种神经细胞膜表面受体在神经炎症中同样受Aβ抗菌肽生物活性的作用,与感染相似,Aβ在其周围形成复合物发挥抗炎作用,导致脑脊液中可被检测到的Aβ减少。这些还需实验来证明。既往研究显示Aβ水平随年龄的增长逐渐下降的,因此本研究中抗NMDAR脑炎组较对照组较小的年龄差异不影响抗NMDAR 脑炎患者脑脊液Aβ降低的结论。
认知功能正常、轻度认知障碍、AD患者的淀粉样斑块沉积与认知密切相关[14,38]。研究发现,Aβ1-42在轻度认知障碍和AD患者中与延迟记忆和图像回忆正相关,即脑脊液中Aβ1-42含量越低,延迟记忆和图像回忆能力越差[39]。在帕金森病中,脑脊液Aβ1-42下降与认知功能下降和帕金森病痴呆相关,可以预测帕金森病未来认知障碍和痴呆风险[40]。另外研究显示在脑卒中患者中,卒中后3个月血浆Aβ1-42水平下降有助于预测1 a 后的卒中后认知障碍的发生[41]。本研究中抗NMDAR 脑炎脑脊液中Aβ1-42与认知水平中度正相关。参考痴呆中Aβ的作用机制,低聚物Aβ导致神经元损伤和认知功能障碍[26],推测抗NMDAR脑炎脑脊液中Aβ1-42与认知水平相关原因可能是NMDAR导致的神经系统炎症引起异常的Aβ沉积,增强小胶质细胞的激活和tau蛋白的病理改变,引发下游神经退行性过程,而这些过程反过来又对认知产生直接影响,决定痴呆的发展[39,42]。
本研究中,抗NMDAR 脑炎患者脑脊液中Aβ1-42与NLR 呈负相关,而NLR 在抗NMDAR 脑炎疾病严重程度较轻组比较重组低且差异有统计学意义。NLR被认为是一种反应全身炎症状态的潜在生物标志物,与多发性硬化、视神经脊髓炎谱系疾病等疾病活动有关[43]。另有研究发现NLR与抗NMDAR脑炎的疾病严重程度有关[44-45],对疾病有一定预测价值[46]。在Aβ的抗菌保护假说背景下,可能高水平的炎症反应引起Aβ1-42更多地形成低聚物Aβ及淀粉样斑块,导致神经元损伤,而在脑脊液中体现可被监测到的Aβ1-42含量降低,因此Aβ1-42与NLR呈负相关。
NMDAR脑炎患者脑脊液中Aβ1-42与尿酸呈正相关。单因素Logistic回归分析中尿酸在抗NMDAR脑炎疾病严重程度较轻组比较重组低,预后情况较好组比预后情况较差组低,且差异均有统计学意义。尿酸是嘌呤代谢途径的天然产物,能够抑制炎症级联,降低血脑屏障通透性,减少中枢神经组织损伤和神经元死亡[47]。研究显示抗NMDAR 脑炎患者尿酸较正常对照组患者显著降低且与疾病严重程度相关[48],与本研究结果一致。抗NMDAR脑炎中低水平的尿酸,可能影响了机体对炎症的抑制,从而促进Aβ1-42的聚集作用,使可被检测到的Aβ1-42含量下降,因此与疾病严重程度和预后情况有关。
为进一步了解Aβ1-42是否对抗NMDAR脑炎患者的疾病严重程度和预后有预测价值,本研究进行不同疾病严重程度组和不同预后情况的单因素Logistic回归分析,发现Aβ1-42、Aβ1-40、NLR和尿酸与疾病严重程度显著相关,Aβ1-42、Aβ1-40、A/G 和尿酸与预后情况显著相关。进行多因素Logistic回归分析,得出Aβ1-42可能是抗NMDAR 脑炎疾病严重程度组和预后情况的独立危险因素。ROC 曲线下面积分别为0.967 9和0.871 4。因此,抗NMDAR 脑炎患者脑脊液中,Aβ1-42含量在预测疾病严重程度组和预后情况上是一项有价值的指标。临床工作中,脑脊液Aβ1-42水平对抗NMDAR脑炎患者积极治疗有一定指导意义。
本研究中抗NMDAR脑炎患者脑脊液Aβ水平明显降低,且与认知水平相关,推测Aβ在中枢神经系统中可能有炎症保护功能,起减小或局限化炎症反应的作用,一定程度上能保护神经功能,减轻疾病炎症程度。但由于本研究样本量相对较小且是单中心、回顾性研究,结论中脑脊液Aβ1-42可能是抗NMDAR 脑炎患者疾病严重程度组和预后情况的独立危险因素,还需前瞻性、多中心的大型队列研究进一步证实,具体作用机制也需进一步研究。
