黄瓜CsGDSL脂解酶基因的克隆与表达分析
2023-09-02高璐瑶曹嘉健王春华杜亚琳
高璐瑶,曹嘉健,王春华,武 涛,杜亚琳
(1.湖南农业大学 园艺学院,湖南 长沙 410128;2.园艺作物种质创作与新品种育种工程研究中心,湖南 长沙 410128;3.农业农村部园艺作物(蔬菜、茶叶等)基因资源评价利用重点实验室,湖南 长沙 410128)
黄瓜(CucumissativusL.)是我国重要的蔬菜作物之一,其口味清爽、品种多样,深受广大消费者喜爱[1-3]。GDSL(GDSL lipase,Gly-Asp-Ser-Leu)基因参与表皮角质的聚合过程,影响脂质、次级代谢产物和细胞壁生物合成等主要过程[4-5]。明确黄瓜中CsGDSL的表达模式,有助于进一步探究CsGDSL影响黄瓜角质层发育的作用机制,为黄瓜表皮光泽的研究奠定基础。表皮光泽是蔬菜作物重要的商品性状之一,光泽性较强的蔬菜在市场上更具有竞争力[6-7]。表皮光泽作为外观性状,必然与植物表皮组分差异有着一定的联系[8]。
植物表皮主要成分为角质层,是植物表皮外的一层疏水保护层,形成于陆生植物表皮细胞壁外表面的脂质保水层[9-10]。其通常由角质和蜡质组成,而蜡质则又分为内层蜡质与外层蜡质,外层蜡质通常称为蜡粉;角质是角质层的主要结构成分,其主要组分是聚酯[11-14]。这三者均对植物表皮的形态特征有所影响[15-17]。GDSL脂肪酶属于α/β水解酶折叠蛋白超家族,其二级结构一般由多个α-螺旋、β-折叠组成,在调节植物生长发育、抗逆性和组织器官的形态建成等众多方面发挥着关键的作用[18-20]。目前,Uttam等[21]发现,在具有光泽的高粱突变体的叶和秆表面上表皮蜡积累发生变化,对其遗传图谱进行分析,发现注释为GDSL的基因座最可能与表皮蜡沉积相关的基因。Girard等[22]研究表明,当对番茄SlGDSL1基因进行RNAi干扰时,部分转基因植株番茄果实由于角质层沉积发生缺陷,角质层厚度变薄,番茄果皮光泽性变强。Petit等[23]发现在番茄果皮光泽性强的突变体中,其蜡质、角质的含量和构成物以及角质层厚度等方面都有一定变化,对其中的角质缺陷突变体进行遗传作图发现,存在一个具有剪接突变的GDSL2基因。以光泽性不同的2份辣椒为材料进行转录组测序分析,结果表明,GDSL基因在提高角质含量中起着重要作用[24]。
虽然前人已在番茄中初步研究了GDSL基因对于植物角质层及果实表皮光泽的影响,但在黄瓜中关于GDSL基因的克隆与表达模式分析的研究尚未报道。本研究参考葫芦科基因组数据库,对CsGDSL基因进行克隆。通过蛋白序列比对以及进化树构建,分析黄瓜CsGDSL脂解酶基因的保守性,并通过qRT-PCR技术明确了该基因在黄瓜不同组织部位中的表达差异。
1 材料和方法
1.1 试验材料
本试验研究材料为黄瓜种质创新与遗传改良团队实验室繁育的高代自交系华南型黄瓜649,于2021年6月种植于湖南农业大学耘园基地大棚中(长沙)。取茎、卷须、根、生长点、开花当天的雄花与雌花以及0,3 d的子房。所有材料取后立即置于液氮中,保存在-80 ℃的超低温冰箱中备用。
本研究所有克隆引物由软件 Primer Premier 5.0设计,北京擎科生物科技有限公司合成并测序(表1)。
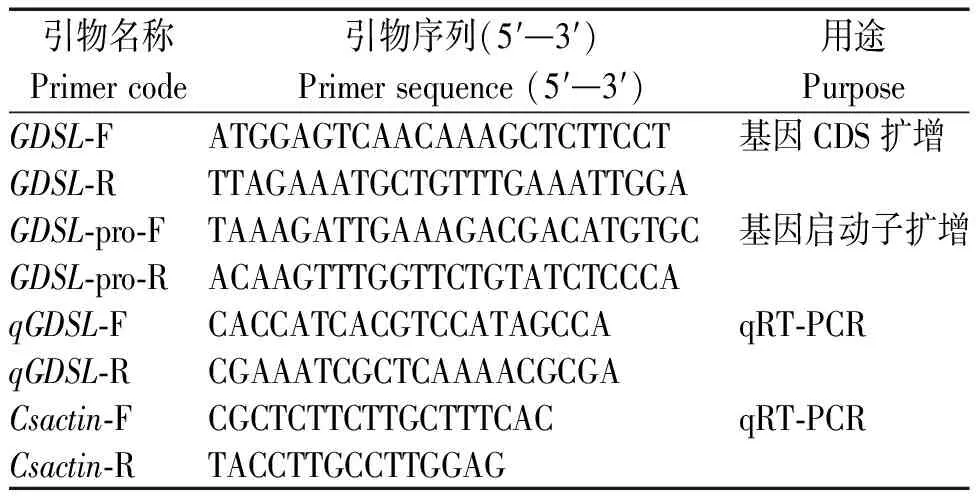
表1 引物信息
1.2 总RNA的提取与cDNA第一链的合成
TRIzol法(全式金,北京)提取茎、卷须、根、生长点、开花当天的雄花、雌花以及0,3 d的子房的总RNA,试验步骤参照说明书。以总RNA为模板,反转录合成cDNA第1链(诺唯赞,南京),置于-20 ℃备用。反转录程序如下,第1步:Oligo(dT)23VN(50 μmol/L)1 μL,Total RNA 10 pg~5 μg,RNase-free ddH2O补至12 μL;将反应液于65 ℃加热5 min,迅速置于冰上骤冷,并在冰上静置2 min;第2步:取4×gDNA wiper Mix 4 μL加于上述反应液中,用移液器轻轻吹打混匀。42 ℃ 2 min;第3步:反应液中加入10 × RT Mix 2 μL,HiScript II Enzyme Mix 2 μL,50 ℃ 45 min,85 ℃ 2 min,-20 ℃保存。
1.3 黄瓜CsGDSL基因的克隆与序列分析
以反转录得到的cDNA为模板,参照黄瓜基因组数据库(http://cucurbitgenomics.org/organism/20)检索出的CsGDSL基因序列设计基因特异性引物,利用高保真酶进行PCR扩增(诺唯赞,南京),以克隆目的基因。反应体系如下:2 × Phanta Max Buffer 25 μL,dNTP Mix(10 mmol/L)1 μL,Phanta Max Super-Fidelity DNA Polymerase 1 μL,GDSL-F 1 μL,GDSL-R 1 μL,cDNA 1 μL,ddH2O补至50 μL,反应程序:95 ℃ 3 min;95 ℃ 15 s,55 ℃ 15 s,72 ℃ 1 min,35次循环;75 ℃ 5 min;4 ℃保存。PCR产物经1%琼脂糖凝胶电泳分析,并回收目的条带,连接T载体(擎科,北京),转化大肠杆菌,选取阳性克隆测序。
1.4 CsGDSL基因的生物信息学分析
利用 NCBI (https://www.ncbi.nlm.nih.gov/)分析CsGDSL基因结构。通过Expasy Protparam(http://web.expasy.org/trans-late/)分析CsGDSL理化性质,如相对分子质量、等电点等。使用SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测该基因二级结构,PHYRE2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)预测该基因三级结构。根据CsGDSL的氨基酸序列,在NCBI数据库中通过Blast程序搜索得到与CsGDSL蛋白同源性高的植物蛋白序列,使用MEGA 6软件绘制系统发育树。
1.5 黄瓜CsGDSL脂解酶基因在黄瓜不同部位中表达量的分析
取茎、卷须、根、生长点、开花当天的雄花、雌花以及0,3 d的子房的总RNA进行qRT-PCR,以明确CsGDSL在黄瓜不同组织部位中的表达情况。内参选用黄瓜actin基因,所用引物序列见表1。qRT-PCR反应体系如下:Hieff®miRNA Universal qPCR SYBR Master Mix 10 μL,Forward Primer(10 μmol/L)0.4 μL,Reverse Primer(10 μmol/L)0.4 μL,cDNA 2 μL,ddH2O补至20 μL(翌圣,上海)。利用iCycler iQTM 5 real-time PCR 检测系统(Bio-Rad,Hercules,CA,美国)进行qRT-PCR,反应程序:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 30 s,40次循环,每个反应3次生物学重复,3次技术重复。使用 2-ΔΔCt算法分析CsGDSL在不同组织部位中相对定量 mRNA水平。
1.6 CsGDSL启动子功能分析
通过黄瓜基因组数据库获得CsGDSL启动子序列,并利用启动子分析网站PLANTCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对黄瓜CsGDSL启动子转录调控元件进行分析。
2 结果与分析
2.1 黄瓜CsGDSL基因的克隆与序列分析
以黄瓜cDNA为模板进行PCR扩增,获得CsGDSL(Gene ID:XM_004143264.3)CDS长度为1 059 bp,且与葫芦科数据库中一致,表明该基因克隆成功(图1)。CsGDSL编码352个氨基酸,推测蛋白分子量为39.04 ku,理论等电点为8.55,亲水性为-0.138(该值为负则代表亲水性,为正则代表疏水性)。对其二级结构、三级结构进行预测,表明CsGDSL编码蛋白序列中包含无规卷曲45.45%,α-螺旋33.24%,延伸连13.35%以及β-转角7.95%(图2)。
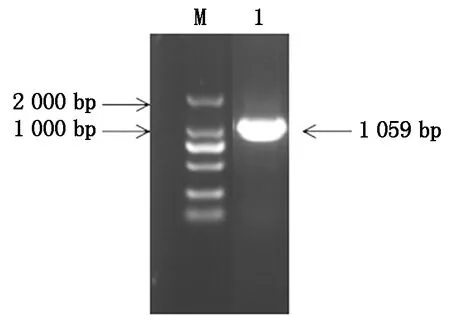
M.DM2000 DNA Marker;1.目的片段。
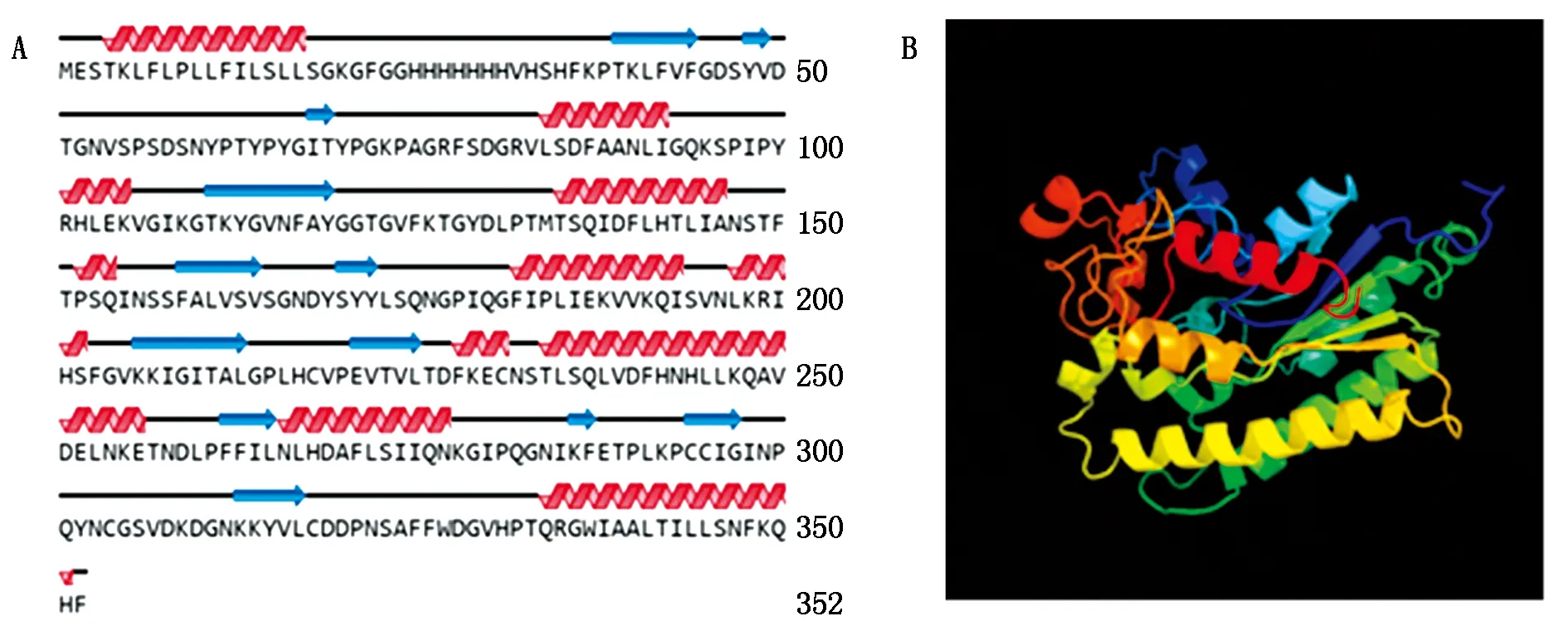
A.CsGDSL二级结构预测:卷曲;B.CsGDSL三级结构预测。
2.2 黄瓜CsGDSL基因的生物信息学分析
CsGDSL编码的蛋白经protein Blast黄瓜中GDSL蛋白与甜瓜(XP 008462554.1)、冬瓜(XP 03883064.1)、南瓜(XP_023544735.1、KAG7034511.1、XP_022925945.1、XP_022979129.1)等变种同源性超过88%(图3-A),表明该基因在进化过程中较为保守,均包含GDSL脂解酶保守结构。通过NCBI数据库Blast检索CsGDSL在不同作物中的同源蛋白,从检索结果中选取不同作物中的10个同源性较高的蛋白序列:甜瓜(Cucumismelo)、冬瓜(Benincasahispida)、灰籽南瓜(Cucurbitaargyrosperma)、中国南瓜(Cucurbitamoschata)、美洲南瓜(Cucurbitapepo)、印度南瓜(Cucurbitamaxima)、美洲栎(Quercuslobata)、葡萄(Vitisvinifera)。利用MEGA 6.0软件构建系统发育树。结果表明,黄瓜CsGDSL与甜瓜CmGDSL蛋白关系最为紧密(图3-B)。

A.CsGDSL氨基酸序列同源比对;红框中为保守结构域;B.CsGDSL进化发育树分析。
2.3 黄瓜CsGDSL组织表达特异性分析
取茎、卷须、根、生长点开花当天的雄花、雌花以及0,3 d的子房的总RNA进行qRT-PCR分析,以明确CsGDSL在黄瓜不同组织部位中的表达情况。试验结果表明,CsGDSL在黄瓜各组织部为中均有表达,CsGDSL在开花当天的雄花中表达量最高,雌花次之,0 d的子房中表达量最低。同时,CsGDSL在开花3 d后子房中的表达量显著高于开花当天的子房,该结果表明CsGDSL在黄瓜生长发育过程中起着重要作用(图4)。
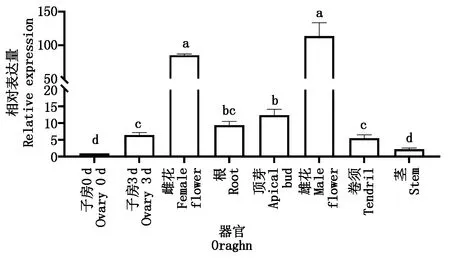
不同小写字母表示处理时间之间在0.05水平存在显著差异。
2.4 CsGDSL在不同黄瓜品种中保守性分析
选取6种光泽性不同的黄瓜,分别对CsGDSL基因CDS进行克隆,对其序列进行分析表明,在不同品种中,CsGDSL基因序列并未发生变化,表明在不同光泽性的品种中该基因功能高度保守(图5)。
黄瓜表皮光泽并不受CsGDSL基因编码区所影响,推测光泽性可能由CsGDSL基因启动子调控。
2.5 CsGDSL启动子元件分析
为进一步明确CsGDSL基因功能,以黄瓜649 DNA为模板进行PCR扩增,获得CsGDSL启动子长度为1 975 bp(图6)。对其进行分析表明,该基因启动子中鉴定出29个元件(表2)。其中包括,ARE、MBS及TC-rich repeats等与厌氧、干旱、防御和胁迫等逆境相关的响应元件;ABRE参与脱落酸反应的激素相关元件;Box4、CAG-motif、G-Box、GT1-motif、TCT-motif等与光反应相关的元件。基于此预测结果,推测CsGDSL与逆境胁迫、激素及光等具有响应。

图 5 6个品种中CsGDSL核苷酸序列分析
M.DM 2000 DNA Marker;1.目的片段。
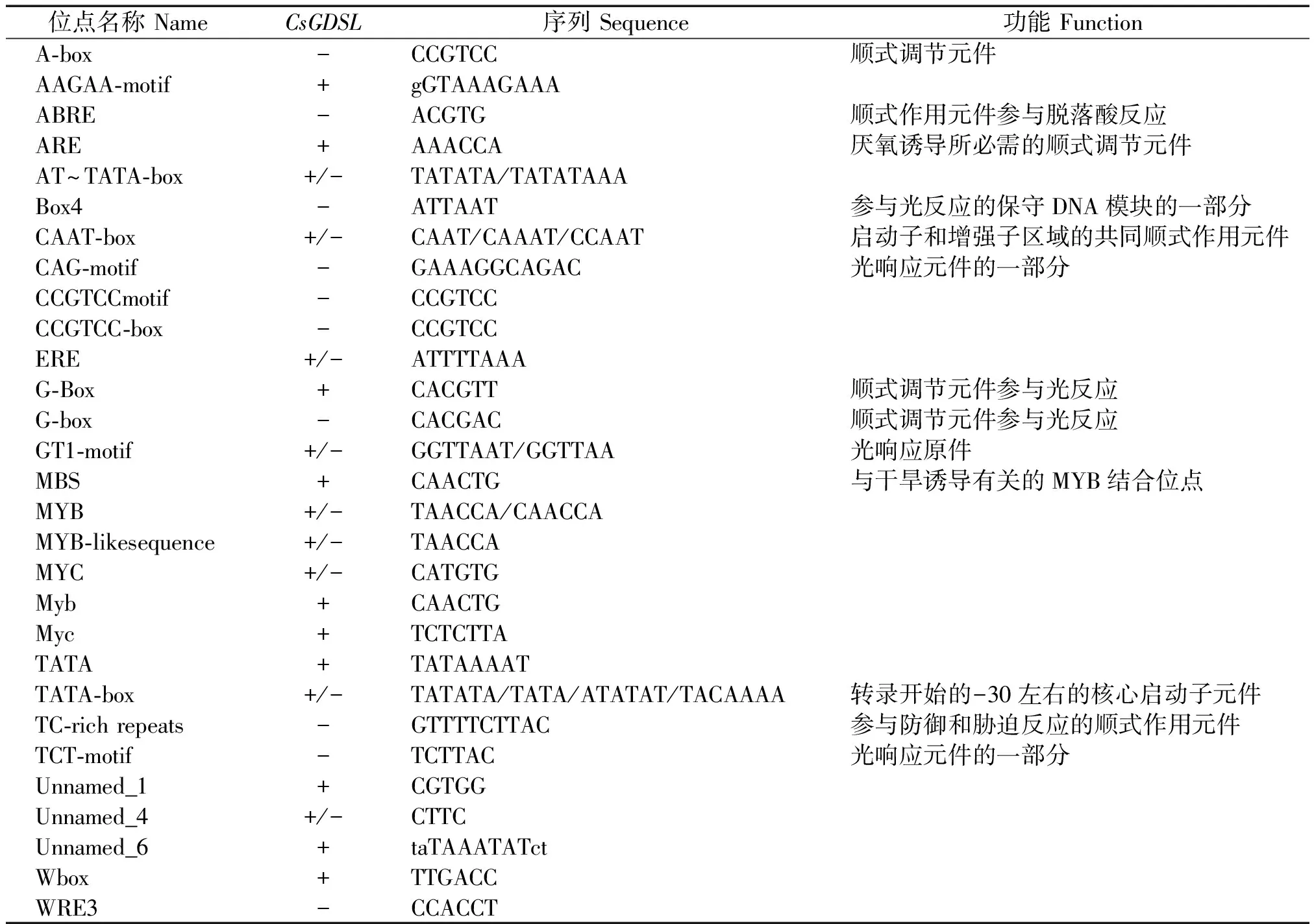
表2 CsGDSL启动子调控元件分析
3 结论与讨论
GDSL基因不仅能够影响植物表皮角质层的结构,还有研究表明,GDSL对于植物育性也有着一定的影响[25-26]。玉米细胞核雄性不育基因ZmMs30(MALESTERILITY30)编码GDSL脂解酶,当ZmMs30功能丧失,导致花药角质层缺陷、花粉外壁的不规则甚至完全雄性不育[27];玉米ZmIPE2(IRREGULARPOLLENEXINE2)基因同样编码GDSL脂解酶,IPE2功能障碍导致绒毡层和中层延迟变性,导致花药表皮和花粉外壁形成缺陷,完全雄性不育,同时脂肪代谢发生很大变化,脂质成分C16/C18脂肪酸及其衍生物的含量在ipe2发育的花药中显著降低[28]。因而,GDSL基因在花药及花粉发育中具有一定功能。本研究中CsGDSL在黄瓜开花当天的雄花、雌花中的表达量显著高于茎、子房、根、卷须、子房等其他部位,可能是由于在这一发育时期,基因主要作用于花器官的发育。并且,CsGDSL基因在花后3 d的子房表达含量高于开花当天,推测可能随着黄瓜果实的发育成熟,CsGDSL基因表达量逐步上调,进而参与黄瓜果实角质层的形成过程。
角质层因作为植物的疏水屏障,在植物抗逆性上也起着一定的作用。本研究中,对黄瓜CsGDSL启动子功能进行了初步预测,其具有与厌氧、干旱、防御和胁迫等逆境相关的响应元件。目前,已有研究表明,角质层发育对厌氧、干旱等胁迫起着显著作用,在大豆中GDSL 型酯酶/脂肪酶蛋白GmGELP28(GDSL-type esterase/lipase proteins 28) 对干旱、盐分和ABA处理的明显,转基因拟南芥和大豆植株表现出耐旱耐盐表型[29];水杨酸、乙烯和茉莉酸甲酯处理诱导辣椒叶中GDSL型脂解酶CaGLIP1(GDSL-type lipase)基因表达,并且在种子萌发和植物生长过程中,CaGLIP1转基因植物表现出耐旱性[30],但CsGDSL是否通过影响角质层的发育,进而影响黄瓜抗逆性还有待进一步研究。
综上所述,本研究参考黄瓜基因组数据库,通过基因克隆、生物信息学分析及qRT-PCR技术,获得了CsGDSL基因,明确了CsGDSL在黄瓜各组织部位中表达模式,为研究CsGDSL对于黄瓜果皮角质层发育及光泽性的影响奠定了基础。
